Los antecedentes del cultivo celular se remontan al año 1885, cuando Rous observó que las células embrionarias de pollo aisladas podían ser mantenidas vivas en una solución salina. Posteriormente, en 1910, Carrel demostró que distintas células y tejidos podían crecer durante períodos largos de tiempo en medios de cultivo, siempre que éstos se cambiaran con frecuencia para poder así nutrir a las células de una forma regular1. Desde entonces una serie de autores contribuyeron al desarrollo del cultivo de tejidos y, probablemente, un paso importante fue dado por Eagle en 1955 cuando observando que las células en cultivo tenían una serie de necesidades nutricionales mínimas o esenciales, hizo uso de estos conocimientos realizando una serie de experimentos en donde células animales podían proliferar en un sistema de cultivo compuesto por una mezcla química de vitaminas, coenzimas y aminoácidos, suplementado con suero animal.
Actualmente se realizan cultivos en los que las células se obtienen disociando enzimáticamente los tejidos originales que las contienen. Esta técnica permite a los investigadores realizar cultivos puros de tipos celulares determinados encaminados a multitud de usos. La finalidad principal de este tipo de técnicas ha sido la investigación básica, aunque recientemente se ha comprobado su utilidad terapéutica, tanto en lo que respecta a las sustancias producidas por las propias células durante el cultivo, como por la aplicación directa de dichas células en la regeneración de diversos tipos de tejidos.
A lo largo de este artículo veremos como se realizan los cultivos primarios de condrocitos extraídos directamente de cartílago articular humano y como su aplicación, mediante la técnica denominada implante de condrocitos autólogos (ICA), es un recurso de actualidad en el tratamiento de lesiones condrales, como demuestran los estudios clínicos que más delante expondremos.
OBTENCIÓN DE CONDROCITOS
El paso previo y fundamental de cualquier cultivo de células a partir de tejidos complejos es, por supuesto, la obtención de las células de dicho tejido para su posterior expansión o mantenimiento in vitro. El principal obstáculo a sortear en el manejo de esta técnica consiste en extraer las células del tejido sin dañarlas y en separar el tipo celular en cuestión de otros tipos celulares presentes en dicho tejido.
De forma natural el cartílago articular consta de una matriz en la que se hallan incluidos los condrocitos. Esta matriz está fundamentalmente constituida por diversos tipos de colágeno entre los cuales predomina el colágeno tipo II, aunque también coexisten con él, en menor proporción, otros tipos como los colágenos VI, IX y XI, constituyendo la suma de colágenos aproximadamente el 65-80% del peso de la matriz. Otros componentes presentes son los proteoglicanos, como el agrecano, versicano, biglicano y decorina. Aparte de determinados tipos de proteínas, en el cartílago también encontramos glicosaminoglicanos, como el condroitín-sulfato, dermatán-sulfato y keratán-sulfato.
El proceso de cultivo de condrocitos autólogos comienza cuando en el laboratorio de cultivo, en este caso el Instituto de Ortopedia y Banco de Tejidos Musculoesqueléticos de Santiago de Compostela, se recibe una biopsia de cartílago de un paciente. El transporte de esta biopsia se realiza normalmente en tampón fosfato salino (PBS) o medio esencial mínimo de Dulbecco (DMEM) suplementados con antibióticos que previenen el crecimiento bacteriano durante el transporte.
Como ya apuntábamos previamente, uno de los obstáculos a superar para llevar a cabo un cultivo in vitro de condrocitos a partir de una biopsia de cartílago, es la liberación de éstos de la densa matriz que los envuelve, evitando que el tratamiento resulte en la destrucción o pérdida de funcionalidad de estas células. Este problema se resuelve tratando el cartílago articular con enzimas capaces de disgregar la matriz cartilaginosa. Estas enzimas, denominadas colagenasas, se obtienen a partir de diversas cepas de Clostridium sp., bacterias que producen estos fermentos de forma natural. De esta manera, el cartílago obtenido asépticamente y transportado hasta el laboratorio en un medio adecuado es tratado con colagenasa para liberar los condrocitos.
Una digestión enzimática eficaz del cartílago requiere que la mayor superficie posible del tejido sea expuesta a las enzimas, para ello debe disociarse mecánicamente el tejido. Esto se consigue troceándolo en pequeños cubos de aproximadamente 1-3 mm3, siempre dentro de un ambiente estéril y evitando en todo momento que la muestra se deseque.
Por fortuna el tejido condral está compuesto únicamente por condrocitos, por lo que no contiene ningún tipo de células que debamos eliminar; sin embargo, en las superficies del cartílago y en la placa subcondral se hallan presentes cantidades apreciables de fibroblastos que contaminarían el cultivo final, de forma que una vez troceado el cartílago debe procederse con una digestión capaz de eliminar estas células. Como es bien conocido la tripsina es capaz de digerir las uniones de las células al substrato, razón por la cual los fragmentos de cartílago son tratados durante 30 minutos a 37 °C en una disolución de tripsina al 0,25%. Una vez realizada esta digestión, los fragmentos de cartílago quedan liberados de los fibroblastos que pudieran estar adheridos a ellos y un simple lavado basta para eliminarlos.
Una vez eliminados los fibroblastos contaminantes se procede a la digestión de la matriz condral. Para ello son varias las opciones que se pueden elegir. Normalmente escogeremos una concentración de colagenasa de acuerdo con su actividad. En la bibliografía especializada podremos encontrar diversos métodos que incluyen concentraciones de esta enzima que van del 0,1 al 0,3% p/v. El segundo parámetro a tener en cuenta durante la digestión es la protección de las células contra la propia acción de la colagenasa. Puesto que las digestiones de la matriz se realizan sobre períodos de tiempo que oscilan, dependiendo de la actividad de la enzima, entre las 15 y las 24 h, la exposición continuada de los condrocitos a la acción proteolítica de la enzima podría acabar por destruir estas células. La presencia de suero fetal de ternera (FCS) durante la digestión ha mostrado, tradicionalmente, una gran eficacia en la protección de los condrocitos contra la acción digestiva de las colagenasas, por lo cual es incluido de forma rutinaria en este procedimiento; sin embargo ciertos tipos de colagenasa son fuertemente inhibidas por este compuesto, por lo que deberá escogerse una enzima capaz de soportar la presencia de FCS manteniendo una actividad digestiva lo suficientemente fuerte como para disgregar con efectividad la matriz cartilaginosa en un plazo de tiempo razonable.
De esta forma, el medio de digestión suele estar compuesto por DMEM con la cantidad adecuada de colagenasa y FCS, además de una concentración de antibióticos (principalmente bacteriostáticos y fungicidas) capaz de prevenir el crecimiento de microorganismos durante el proceso digestivo. La cantidad de medio de digestión debe ser proporcional a la cantidad de cartílago a disgregar, y debe ser calculada teniendo en cuenta la actividad de la enzima en presencia del FCS.
La digestión con colagenasa se realiza a 37 °C y puede ir reforzada con diversos tipos de agitación. Los sistemas disponibles son múltiples y de su eficacia depende en gran medida el resultado de la digestión, siendo éste un punto de crucial importancia. Una agitación insuficiente conduce a una pobre digestión del tejido, mientras que la agitación excesiva resulta en la muerte de los condrocitos por una exposición elevada a la acción de la enzima proteolítica. La elección del tipo de agitación es pues fundamental y depende en primera instancia de la consistencia y composición inicial del cartílago a digerir, por lo que, junto con el tipo de colagenasa, concentración de FCS, etc. es un parámetro que debe ser establecido empíricamente para cada caso en particular.
Los sistemas de digestión-agitación varían desde el uso de pequeños tubos en los que se digieren una cantidad aproximada de 100 mg de cartílago mediante suave agitación horizontal continua, hasta el uso de pequeños matraces con pastillas magnéticas de agitación intermitente controlada por ordenador, en los que se pueden realizar la digestión de cantidades considerables de cartílago. La digestión debe realizarse a una temperatura de 37 °C y puede mantenerse en una atmósfera de humedad y concentración de CO2 controlada.
Una vez conseguida la digestión de la muestra de cartílago, los fragmentos no digeridos son eliminados pasando la mezcla a través de un filtro de nylon de 70 mm y las células resultantes de esta filtración son precipitadas por centrifugación y lavadas varias veces con medio de cultivo o PBS para eliminar todo resto de colagenasa. El resultado de esta operación es idealmente una suspensión de condrocitos en medio de cultivo. La cantidad de condrocitos obtenidos, así como su viabilidad, deberán ser evaluadas antes de proceder a su siembra y crecimiento in vitro. La densidad de siembra, bien sea en matrices tridimensionales o en monocapa, es de crucial importancia en el mantenimiento de las cualidades fenotípicas de estas células, como pronto veremos.
MÉTODOS DE CULTIVO
El cultivo in vitro de células de cartílago puede conducir, dependiendo de las condiciones del mismo, hacia un proceso denominado desdiferenciación. Este curioso fenómeno conduce a los condrocitos hacia un tipo celular de fenotipo fibroblástico, diferente de los condrocitos que inicialmente se han aislado del cartílago tanto en su morfología como en la expresión de determinados genes, afectando esta transformación de forma sustancial a la expresión del colágeno II. Así pues, la desdiferenciación es un proceso indeseable, aunque no por ello irreversible. Se ha demostrado que la devolución de los condrocitos a un ambiente condrotrópico (fundamentalmente su situación en matrices tridimensionales) puede conducir a la rediferenciación de estas células, con la recuperación de la expresión génica característica de ellas y la vuelta a un fenotipo típicamente condral2.
Las causas de la desdiferenciación de los condrocitos son su trasplante de un medio condrotrópico en el que están sometidos a una serie de factores de crecimiento cuya función todavía estamos comenzando a comprender3-5 y la carencia in vitro de la matriz tridimensional que ellos mismo secretan. La ausencia de estos elementos conduce a una adaptación al nuevo medio que produce esta transformación. De esta forma, la desdiferenciación es evitable por varios sistemas diferentes o con la combinación de varios de éstos. El primero y más empleado es su cultivo a alta densidad (unas 2 x 105 células por cm2); el segundo es incluir los condrocitos en matrices tridimensionales que simulen, de alguna forma, el ambiente primordial del que han sido extraídos, y el tercer método paliativo es el tratamiento de las células con mezclas de factores de crecimiento que retrasan el proceso de desdiferenciación.
Debido a este problema, la finalidad del cultivo y la forma de mantenimiento de los condrocitos in vitro debe ser fijada, por razones obvias, antes de realizar el cultivo. Si las células se mantienen a elevada densidad, el fenotipo se mantiene bien, pero su proliferación es escasa debido a la inhibición por contacto característica de las células no tumorales de mamíferos. Si se mantienen en un ambiente condrotrópico (matrices tridimensionales) la proliferación es asimismo lenta, aunque se mantiene notablemente la capacidad de producción de matriz extracelular normal. Los factores de crecimiento ayudan en ambos casos, como ya queda dicho, al mantenimiento de las propiedades condrales de estas células.
Para el caso que nos ocupa, es decir, el tratamiento de lesiones condrales mediante implantes de condrocitos autólogos cultivados in vitro, está claro que nuestro principal afán no es el estudio de los condrocitos ni de su función en sí misma, sino la expansión del número de células iniciales a un número muy superior, lo más rápidamente posible. Debemos entonces asegurar un método de cultivo con un adecuado equilibrio entre la rápida proliferación de los condrocitos y su desdiferenciación. Ambos objetivos pueden parecer en cierto modo opuestos, pues lo que induce a la proliferación (baja densidad de siembra, cultivos en monocapa), conduce inevitablemente a la desdiferenciación. ¿Cómo salvar pues este obstáculo si nuestro fin es el uso de cultivos de condrocitos con finalidad terapéutica? La respuesta no es sencilla y se basa fundamentalmente en dos aspectos. El primero es elegir una densidad de siembra que permita una rápida proliferación y que asegure la capacidad de rediferenciación de los condrocitos una vez devueltos a su ambiente original. El segundo es poner a punto un método de cultivo que permita comprobar la capacidad de rediferenciación de los condrocitos obtenidos.
CULTIVOS EN MONOCAPA
El método de elección para la rápida expansión de los condrocitos in vitro es su cultivo en monocapas. La densidad de siembra debe ser calculada teniendo en cuenta que cuanto menor sea ésta, mayor será la tasa de desdiferenciación y también observando que cuanto mayor es el número de pases de tripsinización-siembra mayor será aquélla también, puesto que la tripsinización de las células produce una inevitable destrucción del glicocálix celular, fundamental para el mantenimiento de sus cualidades fenotípicas. Así pues, de antemano fijaremos el número de células que queremos alcanzar y se realizará un cálculo en el que el número de células del que incialmente partimos y el número de pases a que serán sometidas debe ser equilibrado con la tasa de desdiferenciación tal que permita a las células recuperar su fenotipo.
El cultivo de condrocitos en monocapas se realiza sembrando las células en placas o frascos apropiados a tal efecto. El medio empleado usualmente es DMEM suplementado con un 10% de FCS conteniendo la cantidad adecuada de antibióticos. Los cultivos se mantienen en una atmósfera controlada con un 5% de CO2 y una humedad relativa del 100%. Cuando las monocapas de células alcanzan el 80-90% de confluencia, son lavadas con PBS y tratadas con tripsina, usando para ello una solución de esta enzima al 0,25% en PBS. Después de recibir este tratamiento durante 5 minutos a 37 °C, las células se despegan de la superficie a la que se encontraban adheridas, facilitando su resuspensión en medio de cultivo fresco y posterior fragmentación en subcultivos a menor densidad, lo que permite a los condrocitos seguir proliferando hasta haber obtenido el número adecuado para realizar su implante.
CULTIVOS EN MATRICES TRIDIMENSIONALES
Esta forma de cultivo se emplea con dos fines que ya hemos esbozado arriba. Primero, en la investigación de la fisiología de los condrocitos, pues este tipo de cultivo reproduce la situación natural de estas células in vivo, al disponerse éstas rodeadas por una matriz consistente, aunque esta imitación esté condicionada, por supuesto, por ciertas limitaciones como la falta de esfuerzos mecánicos, la diferente consistencia de la matriz respecto al cartílago normal, la ausencia de los factores de crecimiento presentes in vivo, etc., que, por otra parte, se pueden solucionar empleando diversos métodos.
La segunda utilidad de los cultivos en matrices tridimensionales es facilitar a las células cultivadas en monocapa un ambiente apropiado para su rediferenciación, lo que les permite reexpresar marcadores típicos de condrocitos normales como más adelante veremos. Existen tres matrices ampliamente empleadas: las de colágeno, las de agarosa y las de alginato. Las primeras tienen la ventaja de que se asemejan más al entorno natural de los propios condroci tos, aunque la dificultad en su obtención y mantenimiento del pH del medio de cultivo han llevado a los investigadores a intentar su sustitución por otro tipo de matrices de más fácil manejo, como la agarosa y el alginato. Ambas materias son de origen vegetal, compuestas por polisacáridos extraídos de algas marinas y son capaces de formar un gel, de forma que la agarosa resuspendida y disuelta en agua o medio de cultivo mediante calor, gelifica al enfriarse formando una matriz adecuada para el mantenimiento de células. La gelificación del alginato se consigue, por el contrario, por métodos puramente químicos. La adicción de iones divalentes a una solución de alginato en agua o medio de cultivo (que puede contener ya las células) hace gelificar la disolución, con lo que las células quedan inmediatamente incluidas en la matriz tridimensional como se aprecia en la Figura 1. Por la facilidad en el control de la gelificación hoy se prefieren las matrices de alginato a las de agarosa.
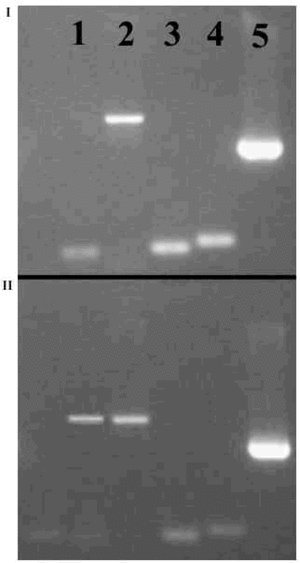
Figura 1. Condrocitos incluidos en alginato.
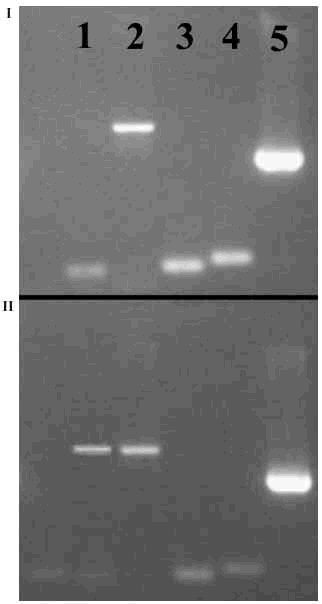
Como ya se ha dicho, la comprobación de la capacidad de rediferenciación de los condrocitos cultivados en monocapa es un parámetro fundamental en el cultivo de este tipo de células. Para asegurar esta capacidad, nosotros incluimos estas células en alginato2,6 y las mantenemos en estas condiciones durante un período de tiempo adecuado (2 semanas como mínimo), lo que permita su transformación en condrocitos normales con la recuperación de su expresión génica característica. El análisis de la expresión correcta de genes como el colágeno II y X (buenos indicadores de la tasa de desdiferenciación), agrecano, versicano, etc. se realiza fácil y rápidamente por RT-PCR. De esta forma, la disminución en la tasa de producción de mRNA codificador de colágeno X y el aumento en la cantidad del mRNA de colágeno II indican que la capacidad de rediferenciación de estas células se ha mantenido intacta (Fig. 2).
Figura 2. Expresión de los genes del colágeno II y X, agrecano y versicano en células en monocapa (I) y en las mismas células después de dos semanas incluidas en alginato (II).
Numerosos experimentos han demostrado que los tres tipos de matrices tridimensionales conducen en igual manera a la simulación de un ambiente en el que los condrocitos pueden rediferenciarse si el proceso de desdiferenciación no ha sido llevado hasta tal extremo que ésta se vea ya constitucionalmente impedida. Estudios en animales de experimentación han demostrado, asimismo, la utilidad de estas matrices como vehículos para el implante de condrocitos en lesiones condrales, con la posterior regeneración de un tejido cartilaginoso extremadamente similar al normal7.
TÉCNICA DE IMPLANTE DE CONDROCITOS AUTÓLOGOS. NUESTRA EXPERIENCIA
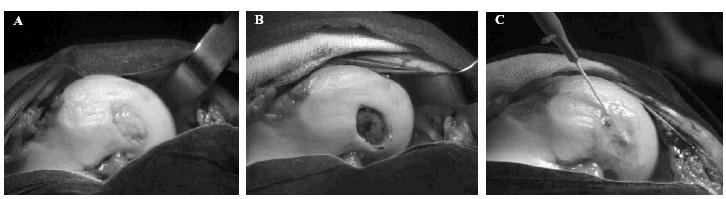
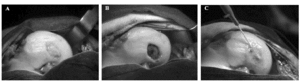
El paso que conecta el cultivo de condrocitos en laboratorio con su aplicación terapéutica es, por supuesto, su implante en pacientes con el objetivo de reparar una lesión condral. La técnica quirúrgica, aunque simple, es minuciosa. Brevemente, una vez expuesto el defecto, el cartílago enfermo es cuidadosamente eliminado, exponiendo la placa subcondral y procurando que los bordes del defecto estén compuestos únicamente de cartílago sano (Fig. 3A). Una vez practicada esta operación, se extrae un fragmento de periostio que se sutura cuidadosamente a los márgenes del defecto para construir un compartimento que reciba las células en suspensión (Fig. 3B). El éxito de la técnica depende, en último extremo, de la estanqueidad de este compartimento. Las células son depositadas en él mediante una cánula y el pequeño agujero por donde ésta se introdujo se sutura. Todo el borde de la sutura se sella con fibrina para asegurar la ausencia de fugas del compartimento, finalizado de esta forma la técnica quirúrgica (Fig. 3C).
Figura 3. Diferentes pasos en la técnica quirúrgica de implante de condrocitos autólogos (ICA). A: Defecto condral. B: Defecto preparado para sutura del periostio. C: Defecto con periostio suturado y cubierto de fibrina en el momento de introducción de las células.
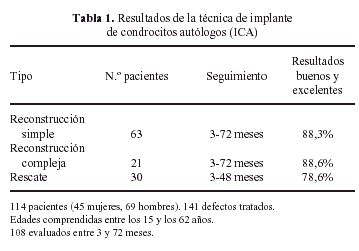
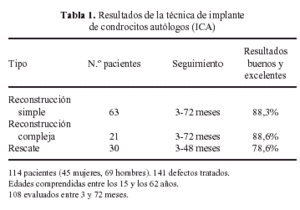
Nuestra propia experiencia en el cultivo de condrocitos en monocapas para su implante en humanos incluyen la realización de este tipo de implantes en 113 pacientes, con un total de 141 lesiones tratadas, como se muestra en la Tabla 1. En nuestro estudio clínico el promedio de resultados buenos y excelentes es de un 85%, demostrando la aplicabilidad de esta técnica en la reconstrucción de defectos condrales. De esta forma, debido a la frecuencia de este tipo de lesiones en personas jóvenes, la utilidad de esta técnica para impedir el desarrollo de artritis degenerativa en edades tempranas impulsa de forma extraordinaria el desarrollo de nuevas terapias basadas en la ingeniería tisular del cartílago, que dependen en última instancia del cultivo in vitro de condrocitos autólogos.
DESARROLLOS FUTUROS
El desarrollo de nuevas técnicas derivadas del cultivo de condrocitos autólogos está encaminada en nuestras instalaciones hacia la producción de fragmentos de cartílago neoformados in vitro. Esta atractiva perspectiva de futuro se basa en la producción, a partir de condrocitos obtenidos mediante cultivo en monocapa, de fragmentos de tejido cartilaginoso o precartilaginoso, de composición y propiedades mecánicas semejantes al cartílago articular normal. Estos fragmentos podrán ser fijados directamente al cartílago articular sano que rodea el defecto, simplificando de forma sustancial la actual técnica quirúrgica empleada durante los implantes de condrocitos autólogos.
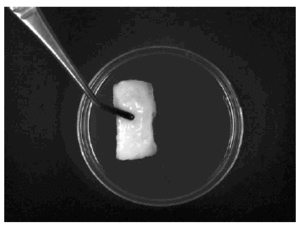
La producción in vitro de tejido condral es una labor de difícil consecución, tanto desde el punto de vista de la propia ingeniería, como desde el puramente fisiológico. Las cámaras de cultivo para su producción deben permitir a la vez el mantenimiento de elevadas cantidades de condrocitos en un reducido espacio físico y su adecuada nutrición. Por ello se emplean cámaras de cultivo cuidadosamente diseñadas a tal efecto8 en las que se pueden conseguir cartílagos como el que se muestra en la Figura 4.
Figura 4. Cartílago neoformado in vitro, DENOVOTM-T (Fotografía cedida por SULZERMEDICA).
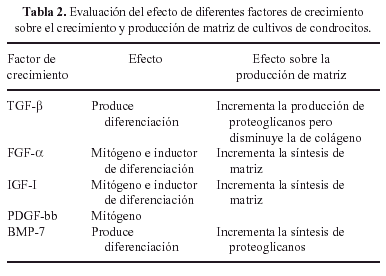
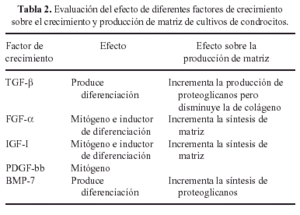
Por otra parte los condrocitos empleados para la producción de cartílago in vitro deben cumplir dos condiciones fundamentales: primero, deben poder regresar con facilidad a su fenotipo normal, por lo que el proceso de desdiferenciación que previamente hayan sufrido debe ser perfectamente reversible, así pues, el cultivo previo en monocapa será llevado a cabo con suma precaución en este sentido; posteriormente los condrocitos así obtenidos serán situados en un ambiente que permita su pronta rediferenciación. Para la neoformación de un cartílago in vitro debe cumplirse aún una segunda condición: durante el proceso de rediferenciación las células deben ser nutridas de tal forma que, una vez sembradas a alta densidad, permitan la secreción y formación de una matriz similar a aquella del cartílago articular tanto en su composición como en sus propiedades mecánicas. Esta nutrición incluye medios de cultivo especialmente diseñados que contienen, además, una mezcla de factores de crecimiento que estimulan la recuperación del fenotipo normal y la secreción de matriz por parte de los condrocitos. Podemos ver el efecto de algunos de estos factores de crecimiento en la Tabla 2. Cumpliendo estos requerimientos físicos y nutricionales se pueden obtener fragmentos de cartílago como el mostrado en la Figura 4.
Otras perspectivas de futuro en las que trabajamos son la obtención de condrocitos y tejido condral a partir de cultivos de células mesenquimales pluripotenciales obtenidas a partir de biopsias de médula ósea. Asimismo se trabaja en la transformación genética de las células cultivadas que facilite la neoformación de cartílago in vitro.
EL CULTIVO DE CONDROCITOS PARA IMPLANTE EN HUMANOS
El cultivo de condrocitos humanos con fines terapéuticos implica la adaptación del sistema de cultivo a la normativa vigente referente a la fabricación de especialidades farmacéuticas y más concretamente a aquella que rige la fabricación de medicamentos biológicos. Esta norma es la GMP (NCF en castellano, es decir Normas de Correcta Fabricación), incluida dentro de la normativa general ISO 9001 vigente en la Comunidad Económica Europea. Fundamentalmente, esta norma exige al productor que absolutamente todos los pasos seguidos en la fabricación de cualquier especialidad farmacéutica deben ser correctamente registrados. También todos los aparatos y medios implicados en la producción deben guardar registros de las operaciones realizadas y deben ser controlados y validados periódicamente.
A este respecto, haremos un breve repaso de la infraestructura de que dispone el Instituto de Ortopedia y Banco de Tejidos Musculoesqueléticos de Santiago de Compostela, donde se realizan cultivos de condrocitos para su implante en humanos, y veremos en qué medida la normativa actual afecta a la estructuración de las instalaciones, al entrenamiento y cualificación del personal y a la adecuación y validación de los aparatos incluidos en el proceso de producción de esta especialidad farmacéutica de origen biológico.
Entre la infraestructura necesaria para el cultivo de condrocitos encontramos como pieza fundamental las campanas de flujo laminar destinadas a asegurar que todas las operaciones se realicen bajo condiciones estrictamente estériles. Estas campanas deben estar situadas a su vez en salas que mantengan un flujo laminar constante de aire desde el techo. La norma de obligado cumplimiento que rige las salas donde se producen sustancias para inyección parenteral en humanos, norma de aplicación obligada al cultivo y envasado de condrocitos destinados a ICA, especifica que estas salas deben entrar dentro de la categoría denominada Clase 100 en la normativa americana, con lo cual el aire de la sala se puede considerar estéril, lo que permite manejar directamente en esa atmósfera sustancias destinadas a implantes humanos (huesos, células, inyectables, etc.). La esterilidad de la atmósfera de estas salas se consigue impulsando aire a través de filtros absolutos, es decir, que no permiten el paso de ninguna clase de microorganismo y recambiando el aire de las salas con una frecuencia superior a las 120 veces por hora. De esta forma, la situación de campanas de flujo laminar dentro de este tipo de salas asegura doblemente la esterilidad durante la fabricación del producto destinado al implante en humanos.
Otros equipos cruciales en el protocolo de cultivo de condrocitos, asimismo instalados en salas clase 100, son los incubadores de CO2. Estos equipos mantienen una atmósfera controlada con un 5% de CO2, que permite mantener constante el pH en los medios de cultivo, y una humedad del 100%, que impide la evaporación de los medios de cultivo. También son importantes los baños de agitación, así como las neveras para la congelación y mantenimiento a 4 °C de los productos empleados durante el cultivo celular (colagenasa, tripsina, medio de cultivos, sueros, etc.). Son asimismo fundamentales los sistemas de congelación controlada por ordenador, capaces de congelar las células cultivadas de la forma más adecuada posible al volumen y agente crioprotector empleado, y que generan el obligado registro de las temperaturas que los viales atravesaron durante su congelación. Las células así congeladas son almacenadas en contenedores de nitrógeno líquido especialmente controlados por la importancia de su contenido.
La normativa GMP europea establece también una serie de directrices que afectan al personal implicado en el proceso de cultivo (técnicos de mantenimiento de las instalaciones, técnicos de limpieza de las salas Clase 100, personal especializado en cultivo celular, etc.). Dicho personal debe ser específicamente cualificado y entrenado para cumplir su función específica dentro del proceso productivo, bien sea controlando la maquinaria que impulsa el aire de las salas Clase 100, bien sea realizando su limpieza y mantenimiento, o bien en la realización correcta del propio protocolo de cultivo. La normativa GMP requiere del productor el establecimiento de un riguroso control de calidad que asegure tanto la correcta fabricación del producto como su calidad final. En el caso de la producción de condrocitos autólogos para su uso en humanos, esto implica que todos los aparatos y materiales implicados en el cultivo de dichas células en salas Clase 100 deben ser exhaustivamente vigilados, para lo que deben someterse periódicamente a controles de contaminación microbiológica, tanto de superficies como del propio aire impulsado a través de los filtros en el caso de las campanas de flujo laminar y salas Clase 100. Al mismo tiempo, tanto los vestuarios de acceso a las Clases 100 como los trajes especiales que el personal usa en su interior, son analizados microbiológicamente de forma constante.
Asimismo, todos los aparatos implicados deben ser sometidos a un control de funcionamiento las 24 horas del día que debe quedar correctamente registrado. Cada cierto pe-
ríodo de tiempo todos los aparatos deben, y de hecho reciben un control de validación por parte de compañías autorizadas y externas a la empresa productora. En cuanto a los aparatos de importancia crucial en el proceso de cultivo celular, como son los incubadores de CO2 y los tanques de nitrógeno líquido para el almacenamiento de las células congeladas, están permanentemente conectados con los encargados de mantenimiento para que cualquier fallo en su funcionamiento sea inmediatamente solventado.
En cuanto a las sustancias químicas (enzimas, líquidos, medios de cultivo, etc.) la normativa establece que deben estar específicamente certificadas para su uso en humanos. A este respecto es interesante recalcar que en las instalaciones del Instituto de Ortopedia y Banco de Tejidos Musculoesqueléticos de Santiago de Compostela, donde se producen condrocitos para su implante en humanos, el suero empleado para el cultivo de estas células es del mismo paciente al cual pertenecen las células, lo que redunda en un incremento muy considerable en la seguridad del producto final, por los problemas que el empleo de FCS tiene en relación con la transmisión de enfermedades de origen priónico. De la misma forma, tanto la tripsina como la colagenasa empleadas en el cultivo de los condrocitos están autorizadas para su uso en humanos.
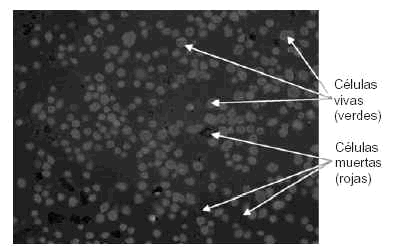
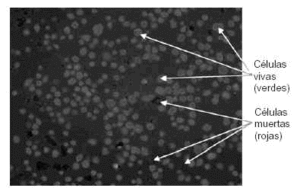
En las instalaciones del Instituto de Ortopedia, que cumplen estrictamente toda la normativa GMP que hemos expuesto, se ha establecido el obligatorio manual de calidad del producto que incluye el control riguroso de todo el proceso de cultivo y hace especial hincapié en el control automatizado del número de células y viabilidad de las mismas para cada cultivo de condrocitos (Fig. 5).
Figura 5. Control automatizado por ordenador de las viabilidad celular.
De igual manera, se realiza un control de la capacidad de rediferenciación de las células mediante su inclusión en matrices de alginato y análisis de la expresión de los genes del colágeno II y X como ya vimos (Figs. 1 y 2). También se controla el grado de hipertrofia de los condrocitos, proceso que normalmente acompaña al de desdiferenciación, durante su cultivo. Este control se realiza empleando un contador celular que indica la distribución de tamaño de las células que van a ser implantadas en el paciente.
Un manual de calidad de producción celular, como el establecido en este Instituto de Investigación y Producción, debe incluir un riguroso y exhaustivo control desde el momento en que se recibe la biopsia de cartílago del paciente, hasta que el producto final, los condrocitos expandidos in vitro, son enviados al cirujano correspondiente.