La imposibilidad del cartílago hialino para reparar sus propias lesiones hace que el tratamiento de las pérdidas focales de cartílago articular sea un tema de constante debate en nuestra especialidad y cuyo tratamiento no está resuelto por el momento. Clásicamente los cirujanos nos hemos tenido que conformar con las técnicas que estimulan la médula ósea y que sólo consiguen la formación de un tejido fibrocartilaginoso, de características mecánicas muy inferiores al cartílago hialino normal. Recientemente la revolucionaria aparición de las técnicas de trasplante de células cartilaginosas ha abierto una nueva y esperanzadora vía para reconstruir el cartílago hialino dañado, pero aún deben ser consideradas como técnicas experimentales en evolución, que tienen que demostrar su validez a largo plazo.
Los injertos osteocondrales no son nuevos en el tratamiento de las lesiones del cartílago, y hasta hace poco representaban la única forma de reparar con el mismo cartílago hialino el defecto provocado. El atractivo de esta técnica reside en la conservación de la unidad funcional cartílago hialino-hueso subcondral que garantiza un comportamiento biomecánico óptimo a la vez que asegura una buena consolidación del injerto al lecho receptor. Lexer en 19081 utilizó por primera vez un aloinjerto osteocondral. Otros autores han seguido este camino proponiendo los aloinjertos congelados para reparar defectos articulares2,3. Sin embargo, la dificultad para mantener el cartílago vivo tras la congelación, el riesgo de las reacciones autoinmunes, muy frecuentes cuando se utilizan injertos frescos4, y la preocupación acerca de la transmisión potencial de virus o priones, colocaron a los autoinjertos como mejores candidatos para esta técnica. Sin embargo la utilización de estos injertos viene limitada por su propia disponibilidad, la morbilidad asociada de la zona dadora y su incongruencia con la superficie a sustituir.
La introducción de la artroscopia generó un notable interés en este campo, dando lugar a numerosos trabajos e investigaciones en la última década. Las mínimas incisiones sumado a la posibilidad de tomar múltiples injertos de zonas no sometidas a cargas disminuyen notablemente la agresión quirúrgica. Como ventaja añadida cabe destacar la posibilidad de colocar los pequeños injertos de forma a recrear el radio de curvatura de la zona articular y manteniendo la congruencia entre las superficies articulares. Este procedimiento, publicado inicialmente por Matsusue5 en una lesión asociada a una rotura del ligamento cruzado anterior, fue perfeccionado tras la experimentación animal por Hangody6 y bautizado con el afortunado nombre de «mosaicoplastia». A pesar de su juventud y de no estar exenta de controversias, parece haber encontrado un lugar indiscutible en el tratamiento de determinadas lesiones focales.
INDICACIONES
Aunque inicialmente esta técnica fue diseñada para su utilización en los defectos focales tanto condrales como osteocondrales situados en las zonas de carga de los cóndilos femorales, los resultados alentadores obtenidos ampliaron sus indicaciones a otras superficies articulares como la bóveda astragalina, la tibia, el cóndilo humeral o incluso la cabeza del fémur. Dado que los resultados de esta técnica fuera de la articulación de la rodilla no han sido aún contrastados por el paso del tiempo, nos limitaremos a las indicaciones que presenta a nivel de la rodilla, sin olvidar que la lesión condral puede ser la consecuencia de otras patologías que también será necesario tratar para evitar el deterioro de la rodilla (alteraciones de ejes, laxitudes ligamentosas, etc.).
Las indicaciones de esta técnica (Tabla 1) son estrictas y sólo así se puede aspirar a lograr un buen resultado. La asociación a lesiones del ligamento cruzado anterior no es una contraindicación sino que esta técnica encuentra su mejor indicación en este tipo de lesiones postraumáticas de pequeño tamaño que acompañan a las roturas del LCA, permitiendo resolver por vía artroscópica y en un solo tiempo ambos problemas. Es recomendable que la mosaicoplastia se lleve a cabo sobre una rodilla estable y normoalineada para evitar tensiones al injerto que impidan su incorporación o incluso puedan llevar a la fractura del mismo. La mosaicoplastia de las lesiones rotulianas tiene un futuro mucho más incierto por la complejidad de la biomecánica femoropatelar en la que las desaxaciones ocultas del aparato extensor suelen condicionar pobres resultados. En la articulación de la rodilla esta técnica también se ha utilizado en alguna rara ocasión para rellenar lesiones tibiales, pero no parece ésta una buena indicación ya que sólo tendríamos un abordaje perpendicular a la parte más anterior de la tibia y ello a costa de una amplia incisión con un elevado índice de morbilidad.
Finalmente, el límite de la zona a tratar suele ser el caballo de batalla y no existe una cifra en la que los diferentes autores estén de acuerdo. Podríamos simplificar el problema asumiendo que las úlceras más pequeñas no tienen tendencia a progresar si su diámetro es inferior a 1 cm2 7. La realización de unas perforaciones sería suficiente para que se rellene de un fibrocartílago y los bordes de la úlcera servirían de protección frente a un posible deterioro futuro. Por encima de 3 cm2 la técnica artroscópica adquiere una gran dificultad y por encima de 4 cm2, la disponibilidad de tejido trasplantable en las zonas donantes parece agotada8 y habría que recurrir a los trasplantes de células cultivadas cuyos resultados iniciales en estos casos son muy atractivos.
DETALLES TÉCNICOS
Evaluación artroscópica
La técnica comienza por la realización de una artroscopia diagnóstica de la rodilla en la que se compruebe que la lesión cumple las características mencionadas y la integridad y extensión de la zona dadora. Para ello resulta imprescindible la medición del diámetro de la úlcera con alguno de los calibradores que los distintos instrumentales ponen a nuestra disposición. La lesión debe de desbridarse y es recomendable llegar hasta el hueso subcondral sangrante para provocar la aparición de una cicatriz fibrocartilaginosa entre los injertos. La obtención de los injertos y su implantación en la lesión por técnicas artroscópicas exigen un largo entrenamiento por parte del cirujano, por lo que no es infrecuente que no se pueda completar la cirugía por esta vía y tengamos que recurrir a la artrotomía, sobre todo cuando se trata de lesiones amplias.
Extracción de los injertos
Las zonas dadoras son el borde de la zona troclear de los cóndilos femorales o la región intercondílea, que son supuestamente zonas sin carga. Sin embargo algunos trabajos demuestran que estas zonas soportan unas presiones no despreciables, por lo que la extracción de cartílago quizás no sea inocua9. En un intento de buscar nuevas fuentes de cartílago hialino se ha propuesto experimentalmente la extracción de los cilindros de la articulación tibioperonea proximal, pero a nivel práctico nos parece muy agresivo al exigir una nueva incisión en una zona no exenta de riesgos10. La cánula de extracción deberá atacar la superficie articular de forma perpendicular para evitar biselar el cartílago hialino. La longitud del injerto oscila entre los 10 y los 20 mm según los instrumentales existentes en el mercado (Fig. 1), pero un cilindro de 10 mm puede ver comprometida su estabilidad tras ser implantado a presión. En los defectos que abarcan al hueso subcondral, la longitud de los injertos tendrá que ser mayor. Los diámetros varían desde 2,7 mm hasta 12 mm, teniendo que combinar las distintas medidas para conseguir un mejor relleno de la lesión, minimizando los intersticios. De forma ideal, se podría rellenar toda la superficie utilizando cilindros más grandes que se solaparan, pero la estabilidad de este montaje y su posible revascularización al no estar soportados por el hueso vivo del receptor plantea serias dudas. Recientemente han aparecido distintos trabajos que estudian los efectos del defecto producido en la vertiente femoral externa. En animales, Hurtig11 comprobó en ovejas que los defectos de 2,7 mm y 4,5 mm cicatrizaban con tejido fibrocartilaginoso y no apreciaba lesiones degenerativas en la femoropatelar, lo que no ocurría en aquellos de 6,5 mm. Ahmad12 tuvo la ocasión de estudiar in vivo la zona dadora en un paciente reintervenido encontrando un tejido fibroso denso de tipo cicatricial, con zonas de osificación y más rígido que el cartílago normal. Es necesario por lo tanto ser prudente con el número y tamaño de los injertos extraídos, sopesando las ventajas del trasplante frente a la morbilidad producida para no caer en la filosofía que reza el refrán popular de «desvestir a un santo para vestir a otro».
Figura 1. Aspecto de un cilindro autólogo tras su extracción con la trefina.
Inserción del injerto
Se deberá labrar el lecho que recibirá al injerto bien con una trefina o con una broca, pero siempre con meticulosidad para conseguir su encaje ajustado. El cilindro debe impactarse de forma que quede a nivel de la superficie que lo rodea. Si queda prominente, estará sometido a fuerzas de cizallamiento que pueden comprometer su incorporación (Fig. 2). Por el contrario, un injerto hundido carece de función y se recubre de tejido fibrocartilaginoso13. Los injertos pequeños tienen la ventaja de poder reproducir con más facilidad la curvatura del cóndilo, pero presentan un mayor riesgo de rotura durante su introducción y aumentan la duración de la intervención. Nosotros recomendamos diámetros entre 6 y 10 mm ya que son más robustos y dejan una superficie mayor de cartílago hialino y con menor número de intersticios que tendrán que rellenarse con fibrocartílago. Finalmente hay que señalar que cuando la zona que tiene que ser reconstruida está excavada, es necesario combinar distintas longitudes de injertos para reproducir una superficie convexa. La meticulosidad en la técnica y el preciso instrumental quirúrgico permiten un ajuste a presión de estos pequeños injertos que hace innecesaria su fijación con métodos adicionales (agujas, tornillos, etc.)
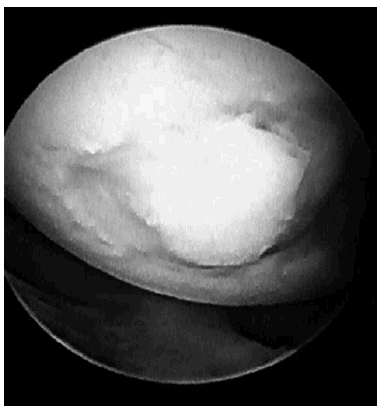
Figura 2. Aspecto artroscópico de un injerto demasiado prominente.
Postoperatorio
El paciente puede movilizar de forma asistida o pasiva desde el primer día, pero está terminantemente prohibido el apoyo del miembro durante al menos 5-6 semanas. La carga se hará de forma gradual hasta los 3 meses y las actividades de la vida diaria se suelen reanudar a la 8.a semana. La vuelta al deporte y a las actividades violentas sólo se hará después de un control RMN que confirme la completa consolidación de los injertos, existiendo una buena correlación entre la clínica y la RMN14 en el postoperatorio de estos enfermos.
RESULTADOS
Son escasos los trabajos existentes en la literatura a este respecto y, dada la relativa novedad de esta técnica, las series publicadas con seguimiento suficiente son inexistentes. Bobic, en 12 casos combinados con una reconstrucción del LCA encuentra en 10 de ellos resultados excelentes a los 2 años15. Hangody revisa 57 pacientes y el 91% obtuvieron un resultado bueno o excelente a más de 3 años16. En su publicación más reciente17 obtiene un 92% de buenos resultados en el tratamiento de las lesiones femorales, aunque el seguimiento de los pacientes es muy variado (entre 1 y 8 años). Realizó 68 artroscopias de control, y en 58 de ellas encontró unas superficies articulares macroscópicamente bien conservadas, con supervivencia del cartílago hialino implantado y un correcto relleno con fibrocartílago de las zonas donantes. Los resultados se mantienen en aquellos pacientes seguidos más de 3 años (3 y 6 años) y se mostraron superiores a los obtenidos con las técnicas que estimulan la médula ósea (perforaciones, abrasión o microfracturas). Merece la pena mencionar por su interés el trabajo de Barber18 en el que se estudian de forma longitudinal 10 pacientes a los que se sometió a una artroscopia de control entre los 2 y los 12 meses, tomando biopsias de la zona trasplantada en 7 de ellos. En todos los casos los injertos tenían un buen aspecto y las biopsias evidenciaban la vitalidad de los condrocitos y osteocitos trasplantados.
Experiencia propia
Poco después de haber tenido conocimiento de su existencia, comenzamos a utilizar esta técnica en 199719, y 2 años más tarde publicamos los resultados clínicos e incluso histológicos en algunos casos de nuestra serie20. Actualmente entre los dos hospitales hemos intervenido 51 casos, con una edad media de 32 años (rango 20-45). Los datos sobre sexo, tamaño y localización de la lesión figuran en la Tabla 2. Todas las lesiones eran de grado III en la clasificación de Outerbridge, y por lo tanto dejaban hueso subcondral expuesto. Se utilizaron dos tipos de instrumentales de características similares (Arthrex®, Mitek®). La mayoría de nuestras lesiones no superaban 1,5 cm2 (62%) y ello explica que en más de la mitad de los casos fuera suficiente un cilindro de 10 mm para su relleno. Sólo realizamos tres implantes en el 17,6% de los pacientes (Fig. 3) y pensamos que por encima de este número, la cirugía abierta simplifica el proceso y acorta el tiempo quirúrgico. La complicación postoperatoria más frecuente fue la aparición de un hemartros que se relaciona con el sangrado fundamentalmente a través de la zona dadora, y que requirieron su evacuación en el 5% de nuestros enfermos.
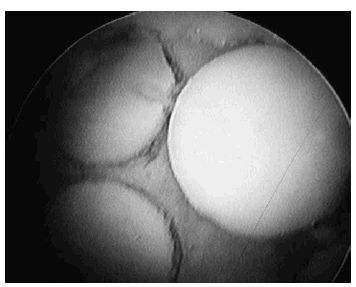
Figura 3. Imagen artroscópica de una mosaicoplastia tras la colocación de tres injertos de 8 mm.
Para la valoración clínica de los 41 casos que tenían más de 1 año de seguimiento, utilizamos la escala de Lysholm, viendo que ésta pasaba de una media de 72 puntos en el preoperatorio a 95 sobre 100 en el último control, siendo a mejoría estadísticamente significativa (p < 0,01). Tuvimos la ocasión de hacer una segunda artroscopia de control en 9 casos entre los 3 y los 9 meses postoperatorios y el aspecto de la lesión fue satisfactorio en 7, encontrándonos totalmente recubierta la zona con islotes de cartílago hialino y zonas de fibrocartílago que en ocasiones también recubrían parcialmente a los injertos, pudiendo separar esta lámina de tejido fibroso del cartílago hialino con el gancho sin dificultad. Esta lámina fibrosa forma parte del tejido cicatricial procedente del estímulo de la médula ósea y su aspecto laxo es debido a que en la mayoría de los casos la segunda artroscopia se realizó por debajo de los 6 meses postoperatorios. La maduración de este tejido con el tiempo proporciona un mejor aspecto artroscópico de la lesión. En 2 casos uno de los injertos se había desprendido, en el primero incluyendo todo el cilindro por un mal ajuste del mismo y en el segundo sólo la capa cartilaginosa y 2-3 milímetros de hueso, por una fractura quizás durante la fase de impactación. En ambos casos la zona de cartílago perdida se había rellenado de tejido fibrocartilaginoso y no juzgamos oportuno realizar ningún gesto quirúrgico complementario (Fig. 4). Ambos pacientes tuvieron una cotación de Lysholm por encima de los 90 puntos.
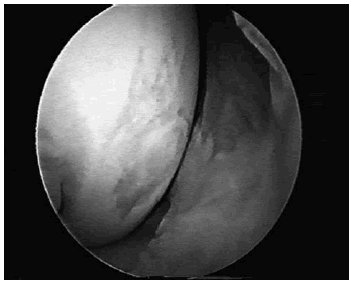
Figura 4. Aspecto de una lesión en la que se desprendió la capa de cartílago hialino. El nicho está recubierto totalmente por tejido fibrocartilaginoso en el control artroscópico a los 6 meses.
LIMITACIONES ACTUALES Y PERSPECTIVAS FUTURAS DE LA TÉCNICA
Las mayores limitaciones de esta técnica surgen de la disponibilidad de cartílago hialino para el trasplante y de las consecuencias de su extracción, que contraindica su uso en lesiones mayores de 3-4 cm. La utilización de aloinjertos criopreservados se presenta como una alternativa muy atractiva ya que proporcionaría una cantidad ilimitada de injertos, eliminaría la morbilidad de la zona dadora y permitiría utilizar un cartílago hialino «de carga» con una adaptación exacta a la forma articular a reparar. También permitiría la colocación de los injertos con la rotación adecuada para adaptarse a los patrones de orientación de las fibras colágenas que presentan los cóndilos femorales en su superficie. Sin embargo, es muy difícil preservar la viabilidad de la porción cartilaginosa tras la congelación de estos pequeños cilindros a pesar del uso de crioprotectores a distintas concentraciones, como se ha podido comprobar en un estudio experimental en corderos21. Por el momento sólo podrían tener utilidad para el «relleno» de las zonas dadoras, lo que podría disminuir el porcentaje de hemartros postoperatorios.
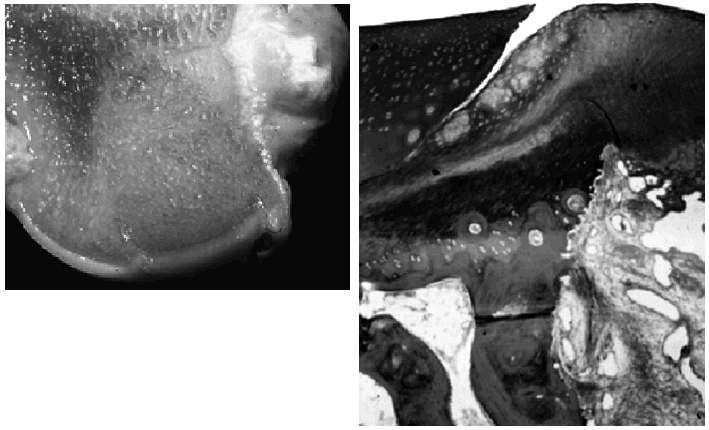
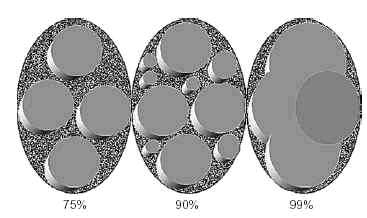
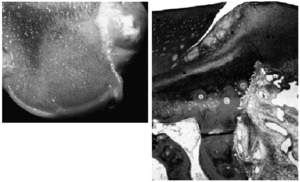
Por otro lado, a nivel histológico, el trasplante no tiene una incorporación perfecta. Existe una falta de unión entre el cartílago injertado y el que le rodea. Aunque esta falta de «cicatrización» del tejido cartilaginoso es un hecho conocido, se ha comprobado recientemente su constancia al utilizar esta técnica en animales21,22 (Fig. 5). Quizás en un futuro las técnicas de fusión tisular con láser, actualmente en vías de experimentación o a aplicación de factores de crecimiento pueda mejorar esta interfaz. También cabe señalar que con la mosaicoplastia no se reproduce un tejido uniforme sino un material «compuesto», al estar los espacios rellenos por fibrocartílago de peores cualidades para resistir cargas, y que esta extensión puede representar en ocasiones más de un tercio de la superficie trasplantada6 (Fig. 6).
Figura 5. A: Cóndilo femoral de un cordero en el que macroscópicamente se aprecia la perfecta incorporación del cilindro osteocondral. B: Microscópicamente se aprecia la falta de unión entre el cartílago hialino del injerto y la zona vecina (Cedidas por F. Forriol).
Figura 6. Esquema representando el porcentaje aproximado de superficie rellena por cartílago según las distintas técnicas: cilindros grandes, cilindros de distintos diámetros y cilindros superpuestos.
Finalmente, desde el punto de vista biomecánico, el cartílago que se trasplanta procede de zonas de «bajas solicitaciones» y por ello tiene un menor espesor. Lane22 al realizar pruebas de resistencia mecánica con indentadores encuentra que el cartílago trasplantado de la zona troclear es 6-7 veces más rígido que el del cóndilo femoral, lo cual podría bien explicarse por su menor espesor y también por la remodelación con aumento de densidad del hueso subcondral que para algunos autores es la causa inicial de la osteoartrosis23. La utilización de aloinjertos que provengan de la misma zona que los va a recibir podría paliar este problema. Hasta entonces es preferible extraer los injertos de los bordes de los cóndilos femorales. Quizás en el futuro, los trabajos en el área de los biomateriales permitirá junto a la ingeniería tisular, la producción de andamios habitados por condrocitos y así fabricar injertos osteocondrales ex vivo para su implantación artroscópica.