La grasa de las articulaciones sinoviales puede servir para el mantenimiento de la estructura articular. Nuestro objetivo es analizar la evolución de la degeneración articular en rodillas con y sin paquete adiposo.
Material y metodologíaEn 6 ovejas se efectuó la sección del ligamento cruzado anterior en ambas rodillas, para provocar una artrosis. En un grupo se preservó el paquete adiposo y en otro grupo se extirpó completamente. Realizamos un estudio histológico y de biología molecular analizando la expresión, en la membrana sinovial, el hueso subcondral, cartílago, grasa, menisco y líquido sinovial, de RUNX2, PTHrP, catepsina-K y MCP1.
ResultadosNo encontramos diferencias morfológicas. Encontramos aumento de la expresión de RUNX2 en membrana sinovial, PTHrP y Catepsina K en líquido sinovial en el grupo sin grasa y aumento de la expresión RUNX2 en el menisco y MCP1 en líquido sinovial en el grupo con grasa.
ConclusiónLa grasa infrapatelar participa en el proceso inflamatorio que acompaña en la artrosis, pues la resección de la grasa de Hoffa altera los marcadores proinflamatorios, mientras que el modelo con la grasa intacta incrementa el marcador proinflamatorio MCP1 en líquido sinovial.
The fat of the synovial joints can be used to maintain the joint structure. Our objective is to analyze the evolution of joint degeneration in knees with and without adipose pack.
Material and methodologyIn six sheep, the anterior cruciate ligament was sectioned in both knees, to cause osteoarthritis. In one group the fat pack was preserved and in another group it was completely removed. We performed a histological and molecular biology study analyzing the expression, in the synovial membrane, subchondral bone, cartilage, fat, meniscus, and synovial fluid, of RUNX2, PTHrP, cathepsin-K, and MCP1.
ResultsWe did not find morphological differences. We found increased expression of RUNX2 in synovial membrane, PTHrP and Cathepsin K in synovial fluid in the group without fat, and increased expression of RUNX2 in the meniscus and MCP1 in synovial fluid in the group with fat.
ConclusionInfrapatellar fat participates in the inflammatory process that accompanies osteoarthritis, since Hoffa fat pad resection alters pro-inflammatory markers, while the model with intact fat increases the pro-inflammatory marker MCP1 in synovial fluid.
La artrosis (OA) es una degeneración de la articulación sinovial, que afecta a más del 25% de la población mayor de 65 años1; se caracteriza por una degradación progresiva del cartílago, un crecimiento óseo anormal por la remodelación ósea subcondral, esclerosis con formación de osteofitos e inflamación sinovial, acompañado de dolor articular, todo lo cual puede conducir a una discapacidad funcional. Sin embargo, la clínica es variable y no siempre guarda relación con la imagen. Su etiología es multifactorial e incluye factores como las lesiones y cirugías articulares previas, los traumatismos, la obesidad, el envejecimiento, sin olvidar, la herencia genética. Es una enfermedad crónica que se caracteriza por dolor, inflamación y pérdida de cartílago y se produce por un desequilibrio entre los fenómenos de degradación y la reparación tisular cuando las solicitaciones mecánicas superan el nivel tolerado por los tejidos articulares2.
La inflamación sinovial conduce a la destrucción del cartílago, al dolor y a la incapacidad funcional3 y altera los condrocitos inhibiendo la remodelación de la matriz extracelular del cartílago4. Los factores inflamatorios, como IL-1β y TNF-α y otras citoquinas activan la NF-κB en las células sinoviales y en los condrocitos4. Las citoquinas inflamatorias como la interleucina-1 beta (IL-1 β) y el factor de necrosis tumoral alfa (TNF-α) estimulan la producción de metaloproteinasas de la matriz (MMP), enzimas que pueden degradar todos los componentes de la matriz extracelular. Las colagenasas, MMP-1 y MMP-13 incrementan el proceso de degradación del colágeno. La MMP-1 es producida principalmente por las células sinoviales de la membrana sinovial y la MMP-13 es un producto de los condrocitos5.
El paquete adiposo infrapatelar de Hoffa (IFP) es un tejido adiposo especializado que ejerce como amortiguador mecánico y guía al tendón rotuliano e incluso a la propia rótula durante los movimientos de flexo-extensión, pero en condiciones normales el IFP es una fuente de células mesenquimales y factores de crecimiento que mantienen y cuidan la integridad de los tejidos articulares6–8. Luego, cuando se inicia el proceso degenerativo, el IFP se altera y contribuye a la degradación articular. Para demostrar esta hipótesis, se provocó una artrosis en la rodilla de animales. A un grupo se resecó la grasa del IFP completamente mientras que al otro se dejó intacta.
Hemos estudiado moléculas como RUNX2, factor de transcripción clave asociado con la diferenciación de los osteoblastos que influye en los procesos de inflamación articular así como en el proceso de degeneración de la zona del cartílago articular9. Por su parte, la proteína relacionada con la PTH, PTHrP es un receptor que se eleva en los procesos inflamatorios de la artrosis10. La catepsina K es un biomarcador clínico de la actividad de la artrosis, pudiendo utilizarse como una herramienta de factor predictivo relevante en el desarrollo de esta patología11 y la MCP1, proteína quimiotáctica de monocitos, es una adipocina relacionada con la regulación de la migración e infiltración de los monocitos y participa como una citoquina proinflamatoria12.
Material y métodosModelo animalTodos los procedimientos se llevaron a cabo según la legislación vigente (RD 53/2013 del 1 de febrero) y europea (Directiva 2010/63/UE) y tras la aprobación del Comité Ético del centro.
Se emplearon ovejas (n=6), de raza Assaf, con una edad de 2 años y con un peso medio de 60±10 kg, procedentes de la granja de nuestro centro. Todos los animales fueron intervenidos de las dos rodillas y se incluyeron en dos grupos experimentales. En el grupo A, rodilla derecha, se efectuó la sección del ligamento cruzado anterior (LCA) y resecó toda la grasa del IFP. En el grupo B, rodilla izquierda, solo se realizó la sección del LCA. La sección del LCA es una metodología común para provocar la aparición de una artrosis en un plazo breve de tiempo.
Todos los animales fueron trasladados a las instalaciones de la unidad de hospitalización, una semana antes del procedimiento, para asegurar el periodo de cuarentena y su aclimatación al nuevo alojamiento. Durante este tiempo, se realizaron los exámenes clínicos y de laboratorio periódicos, con el fin de controlar enfermedades que impidiesen su inclusión en el estudio. Tras su llegada fueron pesados y posteriormente alojados en grupos de 2-3 animales, disminuyendo de esta forma el estrés. Su alimentación se basó en heno y concentrado de pienso con acceso libre al agua.
El día previo a la intervención, los animales fueron sometidos al rasurado de la zona quirúrgica, trasladados a una jaula individual, en ayunas de alimento sólido durante las 24 h. El acceso al agua de bebida fue ad libitum.
Procedimiento anestésicoComo medicación preanestésica, se utilizó una combinación de midazolam (Midazolam Normon®), a dosis de 0,25mg/kg, y metadona (Metasedin®), a dosis de 0,2mg/kg, administradas por vía intramuscular. Tras un periodo de espera de 10-15 min, en un ambiente tranquilo y sin estímulos y una vez comprobado el correcto estado de sedación, se trasladó a quirófano, donde recibió una preoxigenación mediante mascarilla con FiO2 de 0,5 y se realizó la venoclisis de la vena cefálica, con un catéter endovenoso de 16GA.
Una vez asegurada la permeabilidad de las vías endovenosas, se procedió a la inducción anestésica mediante propofol (Propofol Lipuro®), a dosis de 2-3mg/kg, por vía intravenosa lenta, controlando la relajación y desaparición de reflejos. A continuación, se realizó una intubación endotraqueal convencional, colocando al animal en decúbito supino.
El mantenimiento anestésico durante todo el procedimiento se realizó con sevofluorano (Sevoflo®), a dosis de 1-1,5 CAM. Como terapia analgésica intraoperatoria se empleó fentanilo (Fentanest®), administrando una dosis de carga de 5mg/kg, seguido por una perfusión continua a dosis de 6mg/kg/h, y administrando dosis de rescate en caso de ser necesario.
Se administró una dosis de amoxicilina-clavulánico (Synulox®), a dosis de 20mg/kg/24h, vía intramuscular, como antibioterapia profiláctica y como terapia analgésica y antiinflamatoria, 4mg/kg de carprofeno (Rimadyl®), por vía endovenosa.
Procedimiento quirúrgicoSe realizó una miniartrotomía bilateral, pararrotuliana lateral convencional, con incisión en la cápsula articular, luxación interna de la rótula, flexión de la articulación y sección del LCA y resección de la grasa del paquete adiposo de Hoffa, según el grupo de estudio. Una vez terminado el protocolo experimental, se cerró la articulación por planos con sutura reabsorbible.
Comprobado el correcto estado hemodinámico y respiratorio del animal fue trasladado a una sala aclimatada, realizando un seguimiento hasta su completa recuperación, momento en el que fue trasladado de nuevo a la unidad de hospitalización.
Cuidados postoperatoriosLa medicación postoperatoria consistió en la administración de carprofeno (Rimadyl®), 4mg/kg/24 horas, por vía subcutánea, durante cinco días, como terapia antiinflamatoria-analgésica y un antibiótico, amoxicilina-clavulánico (Synulox®), a dosis de 20mg/kg/24h vía intramuscular, durante 9 días. Además, durante las primeras 72 h, se administró como analgésico postoperatorio, buprenorfina (Buprex®) 0,01mg/kg, cada 8 h, por vía intramuscular.
Durante todo el periodo postoperatorio se comprobó la ausencia de signos de enfermedad, dolor o malestar, comprobando en todo momento la correcta ingesta de alimento y agua.
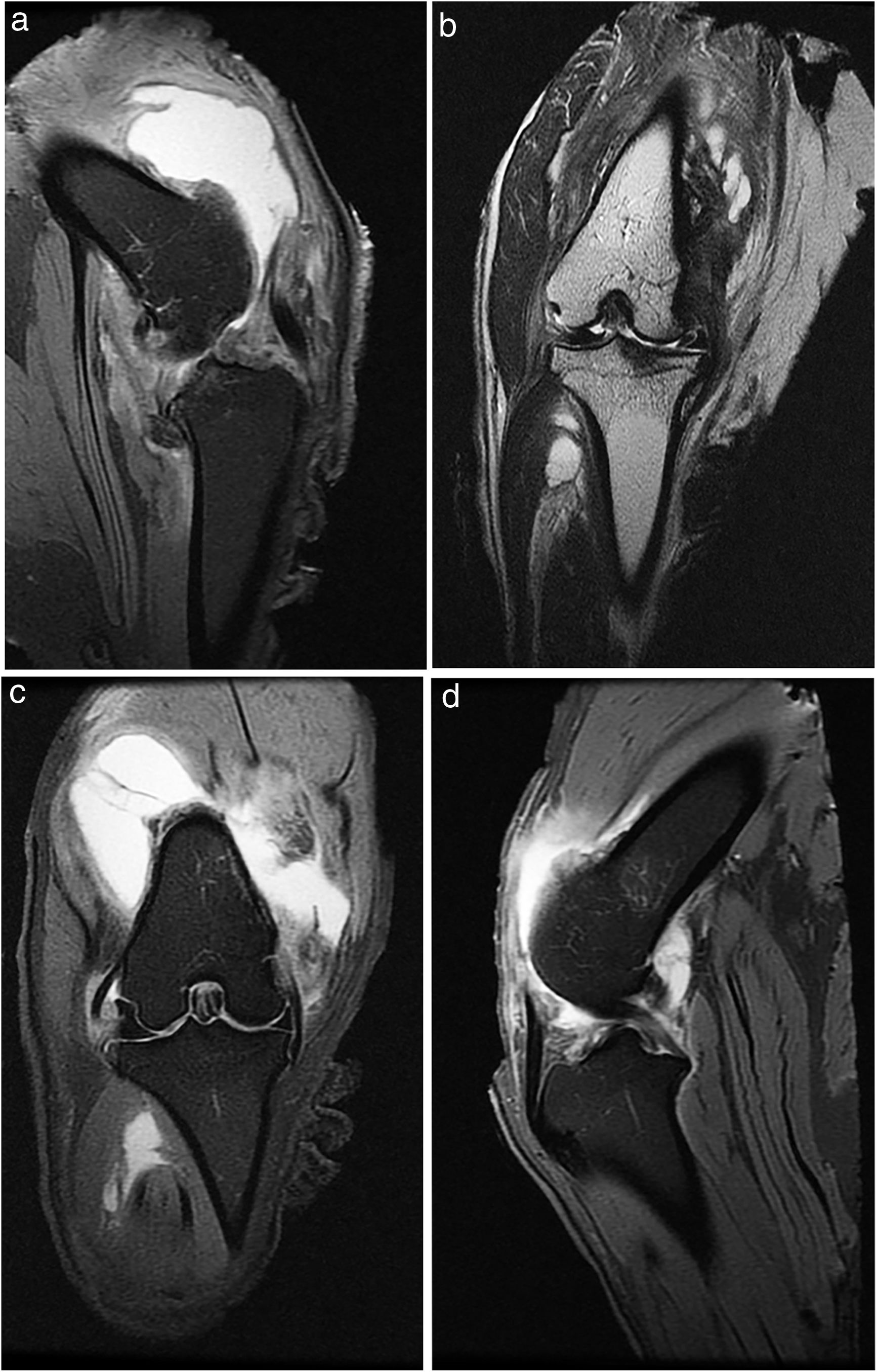
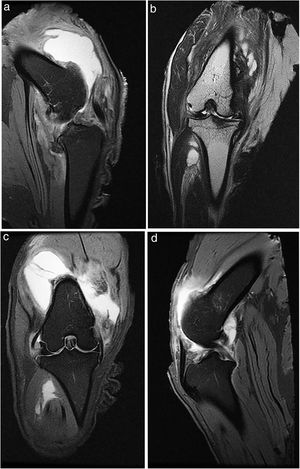
A todos los animales se realizó una radiografía antes de la eutanasia y una RM (fig. 1).
Procedimiento de eutanasiaPara el sacrificio de los animales se premedicó a los animales con una mezcla de midazolam (0,35mg/kg) y ketamina (5mf/kg), por vía intramuscular. Tras comprobar el correcto estado de sedación se procedió a la venoclisis de la vena yugular, inyectando por vía endovenosa propofol (4mg/kg), hasta conseguir una hipnosis completa del animal. A continuación, se administró la solución eutanásica pentobarbital sódico (Dolethal), a dosis de 133mg/kg PV (1ml/1,5kg), por vía endovenosa.
Tras comprobar la ausencia de actividad cardiorrespiratoria mediante auscultación y ECG, se trasladó al animal para la recogida de muestras.
Estudios realizadosTras el sacrificio del animal se extrajo completamente la rodilla que se cortó por la diáfisis femoral y tibial con sierra, se obtuvieron muestras para realizar los estudios de histología y biología molecular sobre membrana sinovial, hueso subcondral, cartílago articular, líquido sinovial y grasa periarticular (análisis genético por PCR de factores inflamatorios, metaloproteasas de matriz e inhibidores) y proteómica, Western blot: electroforesis, transferencia e inmunodetección. Se analizaron RUNX2, PTHrP, Catepsina K, Actina y MCP1.
Estudio histológicoLa fijación de las piezas se efectuó en formol, al 4%, tamponado con fosfatos, durante 24 h. Una vez fijadas, las piezas fueron decalcificadas en una solución de polivinilpirrolidona (PVP) y EDTA, durante al menos 2 meses y a 4°C.
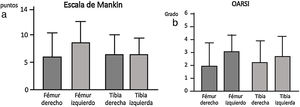
La deshidratación de las piezas se realizó mediante alcoholes de gradación creciente, se introdujeron en xileno, durante 4 h, y se incluyeron en parafina a una temperatura de 60°C. Finalmente, se realizaron cortes de 4μm de grosor y se tiñeron con tricrómico de Masson y safranina-O. Se realizó un análisis histológico según la Escala Mankin13 para valorar el estado del cartílago y hueso subcondral. La puntuación final fue el resultado de sumar los valores correspondientes a las alteraciones en: a) la estructura del cartílago, b) la celularidad, c) la tinción de la matriz y d) la integridad del «tidemark» o línea limitante basófila. Al cartílago normal le correspondieron 0 puntos, y a la afectación más grave del cartílago le corresponderían 14 puntos. La escala OARSI14 considera la situación global de la articulación siendo una valoración semicuantitativa encajando cada preparación en un grado considerando el estado de los diferentes tejidos articulares, el estado normal sería el grado 0 y el más alterado el grado 6. La evaluación histopatológica fue realizada por dos observadores independientes.
Expresión génica. Extracción de RNAEl RNA total de las muestras de menisco, membrana sinovial y grasa periarticular fue extraído utilizando Trizol Reagent (Ambion). Las muestras de menisco se disgregaron mecánicamente con bisturí para posteriormente, procesarlas con el TisueLayser con dos esferas, durante 20 min, a una intensidad de 50Hz.
En el caso de las muestras de membrana sinovial y las de grasa, se añadió 1ml de Trizol por cada 100mg de tejido, previa disgregación mecánica con bisturí. A cada muestra resultante, se agregó la quinta parte de cloroformo (Carlo Ebra Reagents). Para la precipitación de RNA, por cada ml de Trizol se añadió la mitad de isopropanol (Fisher Chemical). Para el lavado del precipitado se utilizó etanol. Previo a la retrotranscripción se realizó la cuantificación de las muestras obtenidas analizando su pureza con el NanoDrop 2000 (Spectrophotometer, Thermo Scientific), siempre utilizando DEPC (Treated water, Ambion).
Para analizar la expresión de nuestras proteínas empleamos el kit de cDNA (Applied Biosystems). De cada una de las muestras se realizó una dilución 1:100. Utilizamos la mezcla con 1μl de RNA por muestra. Por último, colocamos los tubos en la Mastercycler para la retrotranscripción.
PCRLas muestras obtenidas de cDNA se prepararon para la PCR. Se analizaron todas las muestras por triplicado. En la mezcla se añadió beta Actina Rv y Fw (Sigma Aldrich), RunX2 Rv y Fw (Sigma Aldrich), TB Green Premix (Takara) y DEPC. Las proporciones fueron las establecidas por el propio programa en dependencia de la concentración de cada muestra. Se programó el equipo para PCR (700HT Fast Real-Time PCR System, Applied Biosystems).
Western blotLas muestras de líquido sinovial fueron procesadas y analizadas mediante la técnica de Western blot. En un primer paso se liofilizaron las muestras para su optimización. Se colocaron las muestras en el liofilizador y se incubaron «over-night» (congelación al vacío). Transcurridas 12 h, se añadió Ripa Buffer (Sigma Aldrich), lo obtenido tras el proceso de liofilización era seco, se disolvió en Ripa buffer.
Para la cuantificación de las proteínas se realizaron diluciones seriadas, en una placa de 96 pocillos, para obtener una curva patrón con BSA, Comassie (Thermom Scientific) y agua destilada (miliQ), manteniendo en todos los pocillos el mismo volumen. La medición colorimétrica se llevó a cabo en el Varioskan (Thermo Fisher), se midió la absorbancia a 595mm. Para el gel separador se utilizó agua MQ (destilada), Resolvin gel Buffer pH 8,8 (Bio-Rad), Tris HCL Buffer pH 6,8 (Bio-Rad), SDS (Sigma Aldrich), TEMED (Bio-Rad), APS (Sigma Aldrich), Acrilamida (Bio-Rad). Se realizó una transferencia húmeda, a 100 voltios durante una hora (Bio-Rad). Al terminar la transferencia se obtuvieron las membranas, las cuales fueron sumergidas en leche al 5% con TBS al 1X para su bloqueo. Se dejó «over nigth» con el anticuerpo primario (MCP1 (Abcam), RUNX2 (Santa Cruz), Catepsina K (Abcam), PTHRP (Santa Cruz), Actina (Abcam)) a 4° C en agitación suave. Se añadieron los anticuerpos secundarios correspondientes (para MCP1: Rabbit (Abcam); para RUNX2: Rabbit (Abcam); para catepsina K: Rabbit (Abcam); para PTHRP: Rabbit (Abcam); para la actina: Rabbit (Abcam). Para el revelado, se utlizó ECL (Prime Western Blotting Detection Reagents de Amersham), en el Varioskan flash (Thermo Scientific) para su lectura por quimioluminiscencia.
Análisis estadísticoPara la comparación entre los distintos grupos se utilizó el test de la t de Student, para muestras independientes si la variable en estudio seguía una distribución normal, y el test de Kruskal-Wallis seguido de la U de Mann-Whitney si no la seguía. Todos los análisis estadísticos se realizaron con el programa SPSS 9.00 para Windows.
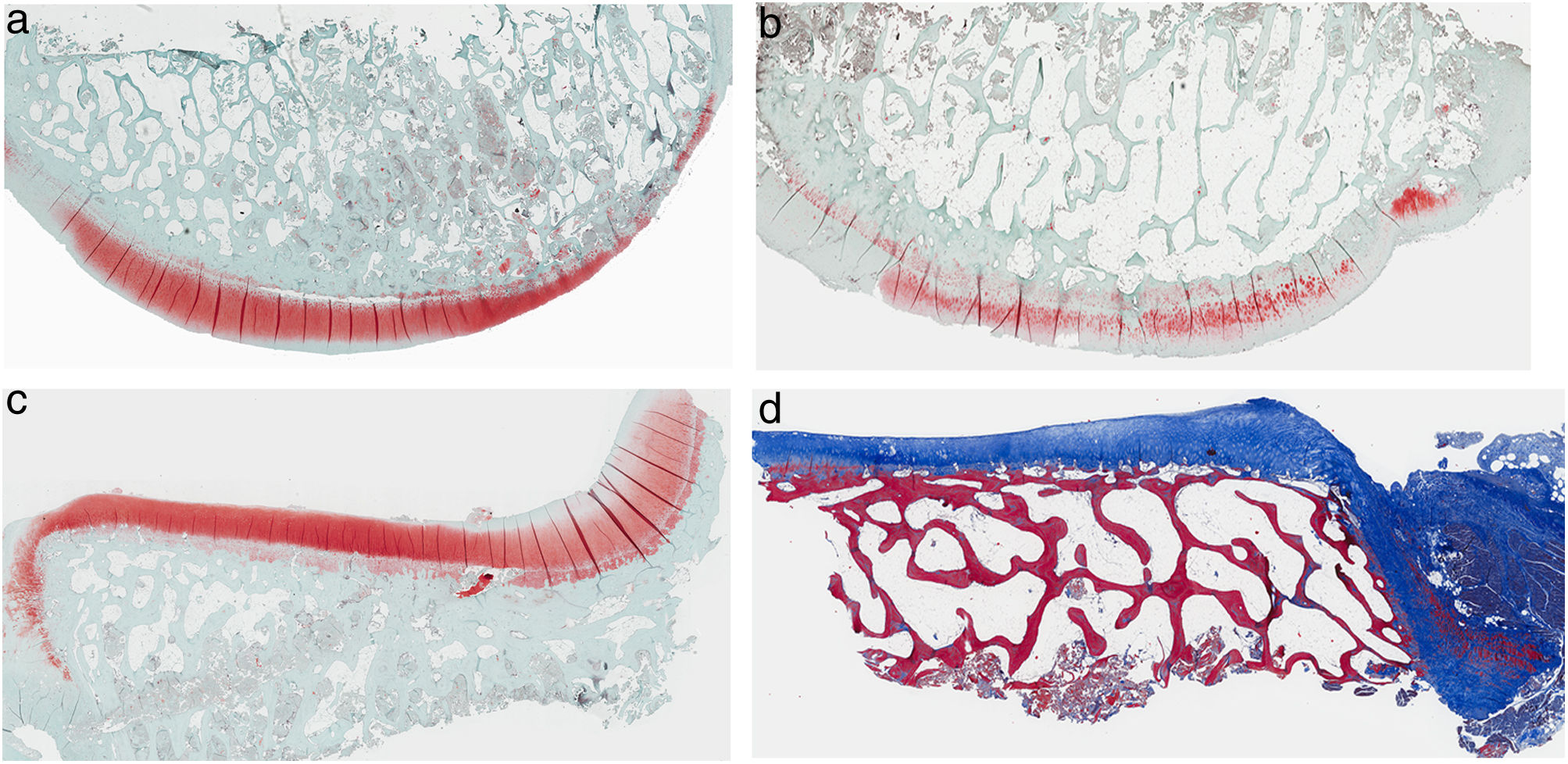
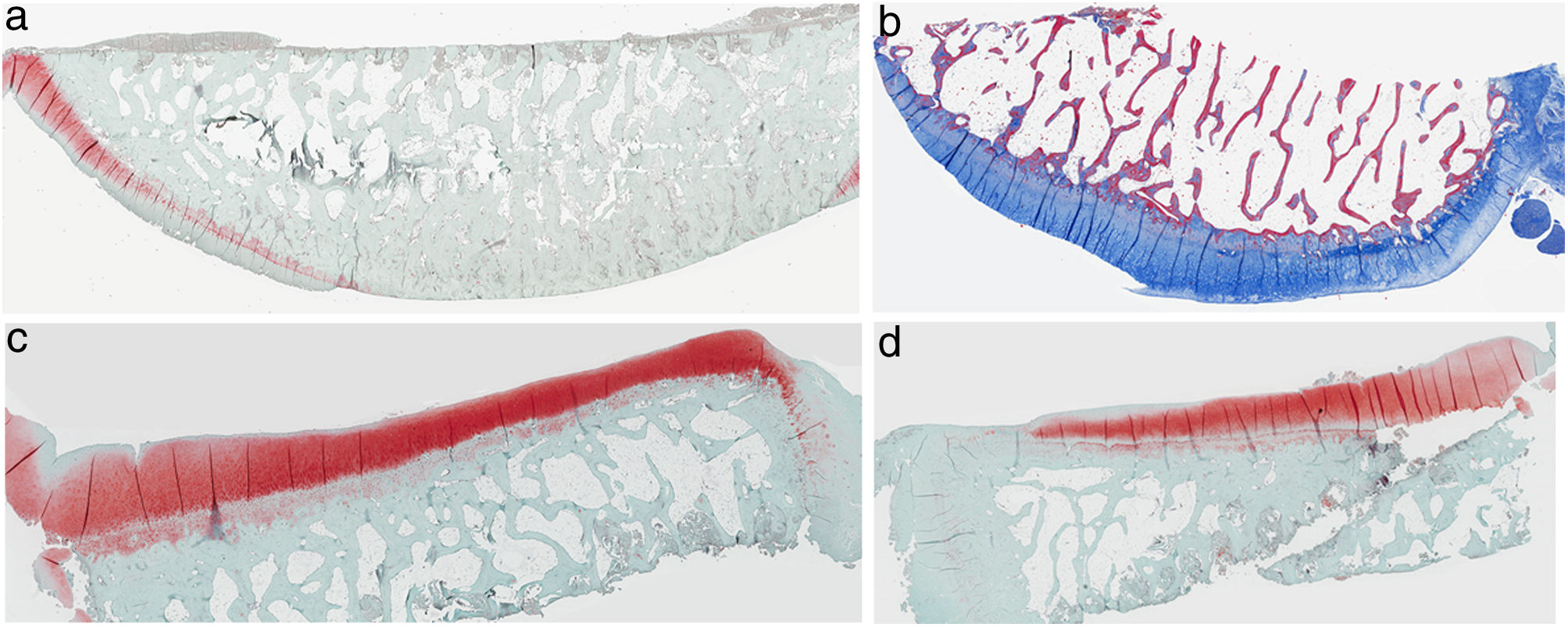
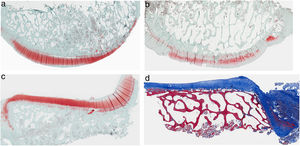
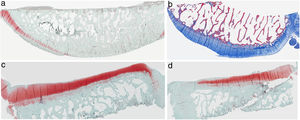
ResultadosHistologíaLas tinciones con tricrómico de Masson revelaron las diferencias entre ambos grupos. Las muestras de cartílago tibial no presentaron diferencias morfológicas evidentes. Las diferencias fueron evidentes en el cartílago femoral con una tendencia a mayor degradación en el modelo al que se le extirpó la grasa de Hoffa, concretamente presentaron una hipocelularidad más difusa y mayores irregularidades en la superficie articular. Las tinciones con safranina manifestaron mayor pérdida en el contenido de proteoglicanos en las rodillas sin IFP, presentando grandes zonas sin tinción (figs. 2 y 3).
Histología del grupo sin resección de la grasa de Hoffa, a) #1 cóndilo femoral con una estructura normal y mantenimiento de proteoglicanos; b) #5 cóndilo femoral con pérdida de la estructura tisular y disminución de proteoglicanos; c) #2 cóndilo tibial con estructura normal; d) #3 cóndilo tibial con grupos isogénicos, desestructuración del tejido cartilaginoso y disminución de proteoglicanos.
Histología del grupo con resección de la grasa de Hoffa, a) #1 cóndilo femoral con desaparición de cartílago articular; b) #2 cóndilo femoral con estructura normal e hipocelularidad y grupos isogénicos; c) #4 cóndilo tibial con desaparición de cartílago; d) #5 cóndilo tibial cartílago mantiene la estructura tisular y muestra ligera pérdida de proteoglicanos.
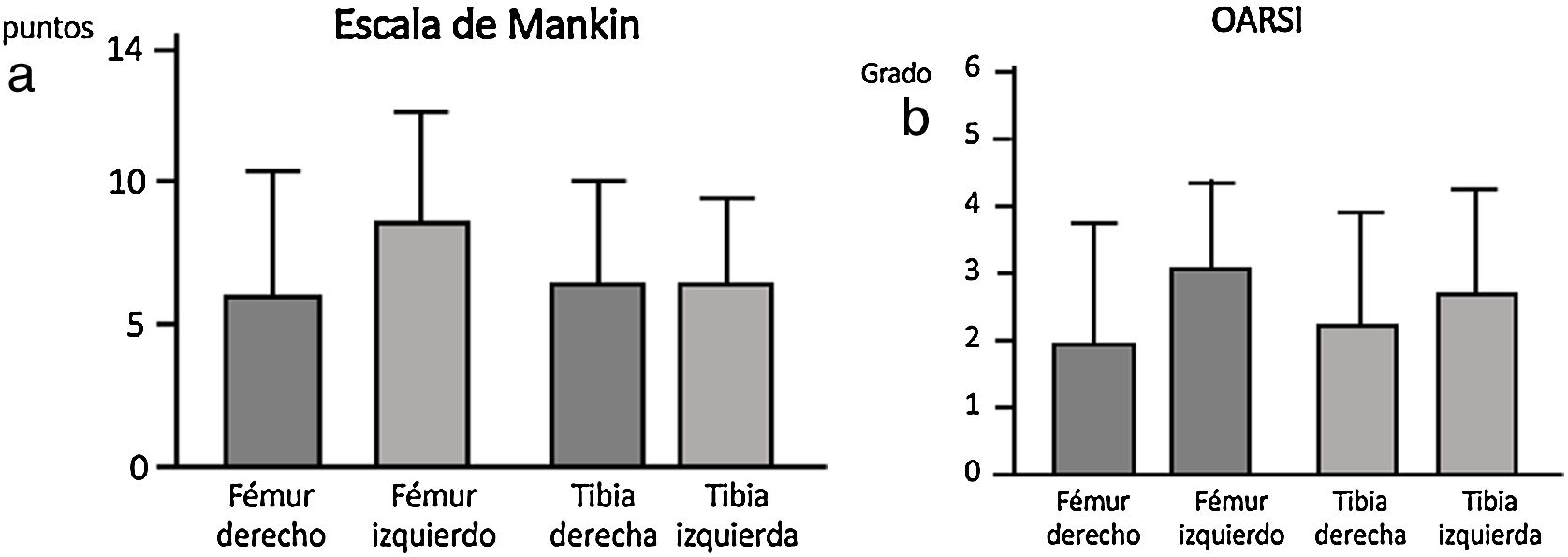
La escala Oarsi no presentó diferencias significativas entre los dos grupos siendo los valores obtenidos en la tibia muy similares en ambas rodillas. La escala de Mankin tampoco presentó diferencias entre ambos grupos; los valores obtenidos en la tibia resultaron similares en ambos lados, no obstante se observó una tendencia un mayor valor en la escala en el fémur izquierdo, grupo sin IFP (fig. 4).
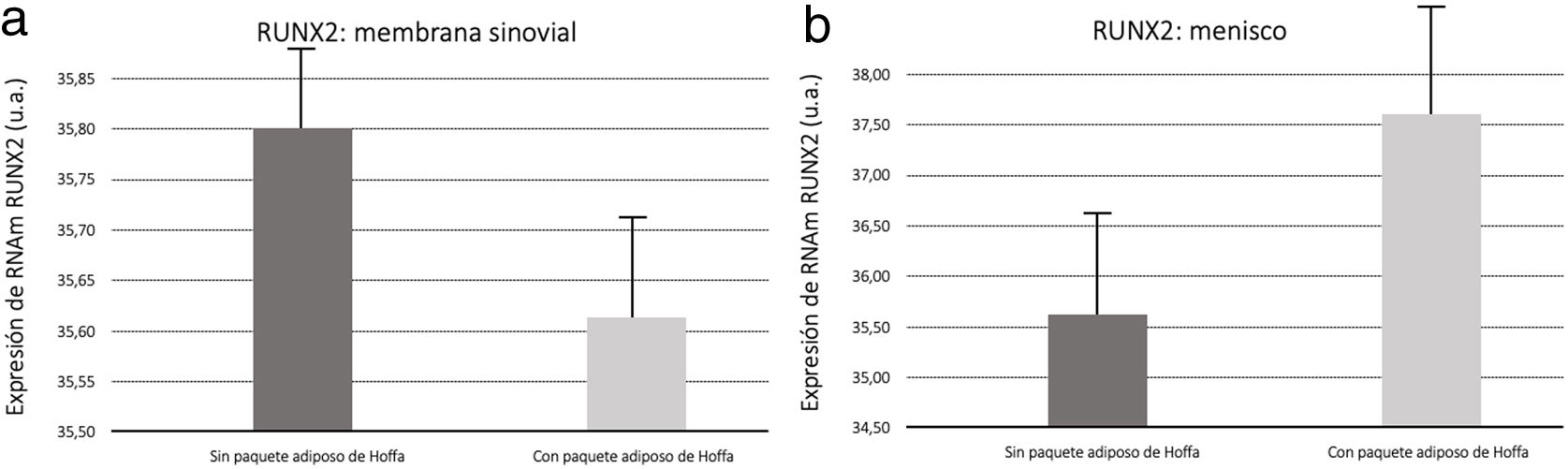
Biología molecularNuestros resultados mostraron (fig. 5) que la medición por PCR de RUNX2 aumentó su expresión en las membranas sinoviales del grupo con la grasa del IFP resecada. En cuanto a las muestras de menisco se vio un aumento en la expresión RUNX2 en el grupo con grasa (fig. 5).
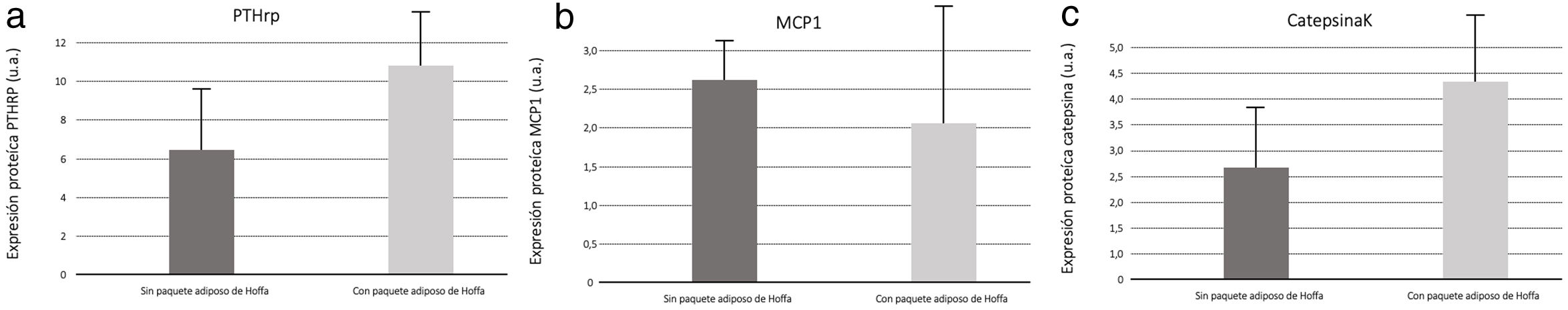
Con relación a la medición por Western blot de PTHrP en muestras de líquido sinovial, encontramos mayor secreción de PTHrP en líquido sinovial del grupo con IFP extirpado (fig. 6). La medición de MCP1, por Western blot, en las muestras de líquido sinovial se observó una mayor secreción de MCP1 en líquido sinovial en las muestras del grupo con IFP intacto (fig. 6). Así mismo, los resultados de la medición por Western blot de Catepsina K en muestras de líquido sinovial obtuvimos mayor secreción de catepsina K en líquido sinovial del grupo al que se extirpó el IFP (fig. 6).
DiscusiónSe ha planteado la relación de la artrosis con la obesidad y se piensa que el aumento de peso conlleva un mayor soporte de carga articular y con ello un mayor desgaste articular como consecuencia de la activación de procesos moleculares y de la función endocrina del tejido adiposo15,16. El tejido adiposo blanco produce sustancias semejantes, aunque no iguales, a las hormonas endocrinas, conocidas como adipocitoquinas que intervienen en la degradación del cartílago, la sinovial y el hueso17. Jedrzeczyk et al.18, demostraron un aumento de la cantidad de adipocitos e infiltración de linfocitos en el IFP en personas con un alto índice de masa corporal que también se ha asociado con una disminución del volumen de cartílago de la rodilla, con su grosor, el aumento de la superficie tibial y un mayor número de lesiones condrales19. Sabemos que la dieta y el ejercicio son efectivos para conseguir la pérdida de peso, reduciendo el dolor de rodilla, mejorando la función articular y disminuyendo los niveles en plasma de Il-620.
Se han planteado dos tipos de artrosis, una relacionada con la obesidad y el síndrome metabólico y otra como efecto de la actividad física y sobrecarga articular. La grasa en personas obesas contiene macrófagos activados que producen una inflamación sistémica de bajo grado y las citoquinas inflamatorias producidas por estos macrófagos y por las adipocinas producidas por los adipocitos podrían ser los iniciadores del proceso degenerativo17,21–23. Además, la obesidad afecta a la grasa articular ya que el tejido adiposo está menos oxigenado y la hipoxia estimula la propagación de las adipoquinas proinflamatorias24.
No todos los estudios demuestran que el IFP contribuya a crear un ambiente articular inflamatorio catabólico. El IFP extraído en la cirugía de las prótesis de rodilla muestra una disminución de la liberación de glicosaminoglicanos y menor expresión de MMPs25. Maculé et al.26, encontraron una fuerte infiltración de células inflamatorias en el 36% de las muestras del IFP obtenidos de pacientes sometidos a prótesis de rodilla por artrosis y la RM con contraste encontró una correlación positiva entre los cambios de perfusión en el IFP y la gravedad de la sintomatología artrósica27. Se ha publicado que las células inmunológicas pueden infiltrar el IFP como consecuencia de la artrosis, disparando la liberación de citoquinas proinflamatorias de los adipocitos21,28,29, con un efecto catabólico sobre el cartílago, iniciando un círculo vicioso21. Sin embargo, Wang et al.30, no encontraron relación del IFP con la artrosis o que los cambios de la grasa en RM sean consecuencia de la artrosis.
Para Cao9 la RUNX2 se incrementa en presencia de lesión o inflamación articular, influyendo en el proceso degeneración de toda la zona, sobre todo del cartílago. Nuestros resultados nos indican que existe un incremento de RUNX2 en las muestras de meniscos y membrana sinovial cuando se conservó la IFP. Esto apoya en ambos tejidos que la grasa del IFP está implicada en el proceso degenerativo.
El análisis de PTHRP presentó mayores cantidades de secreción en el líquido sinovial de los modelos sin IFP; ya que este receptor se eleva en los procesos inflamatorios artrósicos10; deducimos que el IFP participa directamente en el proceso inflamatorio.
Con relación al análisis de catepsina K en el líquido sinovial, debemos tener en cuenta que es una enzima implicada en el proceso de remodelado óseo, se utiliza como un biomarcador clínico de la actividad de la artrosis y su presencia indica una respuesta ante la actividad inflamatoria11. En nuestro estudio la proteína también se secreta en mayores cantidades en los animales sin IFP, lo que apoya la implicación de esta grasa de Hoffa en el proceso inflamatorio y degenerativo de la artrosis.
Los animales con la grasa intacta presentaron mayor cantidad de MCP1, es conocido que las adipoquinas son inductoras de MCP1, actuando en la regulación de la migración e infiltración de los monocitos20, participando, por lo tanto, como una citoquina proinflamatoria.
Como limitación del estudio cabe reseñar el pequeño número de animales y no haber analizado otras citoquinas o factores de crecimiento que permitan visualizar el comportamiento global de los mediadores de la grasa.
La conservación del paquete adiposo de Hoffa durante el proceso inicial de una artrosis no modifica los cambios estructurales degenerativas que se producen tras la sección del LCA. El IFP es una parte importante de la articulación de la rodilla y participa, como el resto de las estructuras, en la artrosis. Sin embargo, hemos observado que la grasa del IFP participa en el proceso inflamatorio y tiene una acción sobre la degeneración del cartílago. En procesos artrósicos avanzados la grasa del paquete infrapatelar es incapaz, por sí misma, de detener un proceso degenerativo ya establecido ni tampoco de revertir el proceso.
Los resultados moleculares indican la implicación de la grasa de Hoffa en el proceso inflamatorio y en la progresión de la degeneración de la zona articular, pues la resección de la grasa de Hoffa altera los valores de las moléculas inflamatorias analizadas, mientras que con la grasa intacta incrementa el marcador proinflamatorio MCP1 en líquido sinovial, lo cual sostiene que la grasa es parte activa del microambiente inflamatorio que acompaña en la progresión de la artrosis.
Nivel de evidenciaNivel de evidencia III.
FinanciaciónProyecto financiado por la Fundación SECOT, dentro de las becas para proyectos de investigación concedidas en 2018.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.