Los meniscos tienen una enorme facilidad para lesionarse y, curiosamente, muy poca para la reparación. Se han encontrado roturas meniscales en más del 65% de individuos asintomáticos que son evaluados con la resonancia magnética (RM)1, un índice muy similar al encontrado por Noble y Turner2, en cadáveres. Aroen et al3 en 1.005 artroscopias, en 993 pacientes, realizadas en tres centros hospitalarios durante 6 meses, determinaron que el 54% de los procedimientos fueron debidos a problemas meniscales, siendo el 49% de los casos por causas deportivas, de los cuales el 30% eran consecuencia del fútbol.
El menisco puede romperse por causas mecánicas, bioquímicas o por alteraciones del colágeno de tipo II. Las lesiones meniscales se describen y clasifican según su apariencia y localización anatómica. También se dividen en completas o incompletas, según ocupen todo el espesor del menisco o parte de él. La cirugía artroscópica, al igual que la artrotomía, permite una clasificación morfológica de las lesiones, longitudinales, radiales o en asa de cubo, y también roturas complejas. Se considera una lesión meniscal estable aquella cuya porción central no se desplaza más de 3 mm4.
En la clásica revisión de Smillie5, en 3.000 roturas meniscales, encontraron un 58% de roturas horizontales y el 42% restante fueron longitudinales. Poehling et al6, en 6.039 roturas meniscales demostraron que un 42% de las lesiones eran horizontales y un 56% verticales, de todas ellas un 21% fueron oblicuas. En el estudio de Dandy7, en 1.000 roturas meniscales sintomáticas, un 75% fueron verticales y un 23% horizontales y, por su parte, Metcalf y Barrett8 encontraron un 40% de lesiones verticales y un 60% horizontales, entre todas, un 45% fueron lesiones oblicuas. Estas variaciones dependen de factores como la edad media de los pacientes y el tipo de actividad. En la revisión de Drosos y Pozo9, en 392 pacientes entre 18 y 60 años, el menisco interno se lesionó más frecuentemente que el externo, tanto si la etiología era deportiva como si no, por las mayores solicitaciones que soportaba el compartimento interno de la articulación.
Eggli et al10, en 1995, señalaron que las roturas meniscales en pacientes con ligamento cruzado anterior (LCA) intacto eran de causa degenerativa. Además, las roturas meniscales, en muchas ocasiones, son parte de la historia natural de la lesión del LCA, como consecuencia de los cambios en la biomecánica articular que producen un aumento de las solicitaciones sobre el menisco11-14. Es cierto que el menisco no se comporta de igual modo si el LCA está intacto o roto. Hay publicaciones que muestran las diferencias. En 1992, Cannon y Vittori15 publicaron las intervenciones en 90 pacientes, viendo que el índice de reparaciones era del 93% en rodillas con el LCA intacto y del 34% cuando el LCA estaba roto. Por el contrario, Tenuta y Arciero16 vieron que el índice de éxitos fue del 57% en meniscos suturados aislados y del 90% cuando se asociaron con la reconstrucción del LCA.
La reparación meniscal de la zona avascular del menisco (más allá de su tercio externo periférico) es técnicamente posible, aunque los pobres resultados obtenidos en clínica lo desaconsejan. Sin embargo, la estimulación de la angiogénesis por medio del trefinado desde la zona vascular puede tener un efecto beneficioso y favorecer el proceso de cicatrización en dicha zona. El objetivo que nos marcamos a la hora de realizar este trabajo fue analizar el efecto del trefinado en el propio menisco y en las lesiones meniscales longitudinales en la zona avascular del menisco tras realizar una sutura doble.
MATERIAL Y MÉTODO
El trabajo contó con la aprobación de una Comisión Deontológica para la experimentación animal.
Como animales de experimentación se utilizaron 12 corderos (Ovis aries) de raza híbrida, de 4 meses de edad y un peso medio de 30-35 kg. El estudio se realizó en el menisco interno de la rodilla izquierda del animal.
Agrupación de animales
Los animales se dividieron en tres grupos, de 4 animales cada uno, según el tratamiento seguido para estimular la reparación meniscal:
Grupo I: control, inyectando suero fisiológico.
Grupo II: inyección de Matrigel® (300 μl, BD Biosciences®).
Grupo III: inyección de Healon® (850 μl de ácido hialurónico 10 mg/ml, Pharmacia & Upjohn).
Anestesia del cordero
Se utilizó anestesia general sin intubación endotraqueal. Para proceder a la administración de la medicación anestésica, se canuló la vena cefálica presente en la extremidad anterior derecha y se suministró también fluidoterapia de mantenimiento con suero glucosado al 5%.
La inducción anestésica se consiguió mediante la administración por vía intravenosa de tiobarbital® (Abbot) a una dosis de 12 mg/kg, atropina® (B. Braun) 0,5 mg/kg y fentanil® (Kern), a una dosis de 0,015 mg/kg. Con esta medicación se logró una depresión del estado de consciencia del animal junto con un buen efecto analgésico, sin afectar a la actividad respiratoria espontánea.
El despertado del animal se realizó de forma espontánea.
La pauta antibiótica utilizada fue de ketoprofeno 3 mg/kg por vía intramuscular (IM), cada 24 horas durante los 3 días posteriores a la intervención. Los animales deambularon libremente en su jaula y dispusieron de comida y agua ad libitum desde el primer día después de la intervención.
Técnica quirúrgica
La vía de abordaje elegida fue anteromedial, luxando externamente el aparato extensor. Se seccionó parcialmente el ligamento lateral interno, llegando al plano capsular que está íntimamente unido al ligamento.
Se practicó una lesión meniscal completa longitudinal, de 2,5 cm, en la zona avascular del cuerpo del menisco con una lanceta de 45°, revisando con unas pinzas que la lesión afectara a todo el espesor del menisco.
La sutura se efectuó con dos agujas rectas de dentro a fuera, atravesando la lesión y saliendo por el muro meniscal al exterior, con dos puntos de poligluconato Dexon® 3/0.
Aplicando una jeringuilla se introdujeron las sustancias correspondientes a los diferentes grupos, trefinando entre dos puntos de sutura. En el grupo control se realizó la misma técnica introduciendo suero fisiológico.
El cierre de la artrotomía interna se efectuó con puntos sueltos de Dexon®, suturando el ligamento lateral interno y cerrando la piel con seda.
Todas las lesiones del menisco fueron longitudinales y cubrieron todo el espesor del menisco, y el trefinado se efectuó perpendicular a la lesión. En algunos casos hubo que hacer dos intentos para llegar a atravesar la lesión meniscal e inyectar el producto correspondiente a cada grupo.
El BD Matrigel® es una matriz de membrana basal extraída de sarcoma de ratón Engelbreth-Holm-Swarm (EHS), rica en proteína de matriz extracelular. Su mayor componente es laminina, seguido de colágeno IV, proteoglicano heparán-sulfato, entactina y nidogén. Además contiene factor transformador de crecimiento beta (TGF-ß), factores de crecimiento fibroblástico y activadores del plasminógeno tisular. Es una sustancia líquida a bajas temperaturas, que gelifica rápidamente a temperatura ambiente. No puede utilizarse como uso diagnóstico o terapéutico, únicamente con fines de investigación. El Matrigel® se alicuotó en 300 μl bajo condiciones de esterilidad y se conservó a -20 º hasta su utilización.
Todos los animales fueron sacrificados a las 6 semanas, previamente se sedaron mediante la administración de una dosis im de ketamina (10 mg/kg) y xilacina (0,2 mg/kg). Seguidamente se les administró por vía endovenosa (vena safena) 1 g de tiobarbital® y 20 ml de cloruro potásico (KCl).
Estudios realizados
Histología
Después del sacrificio del animal se extrajo completamente la rodilla izquierda, se desarticuló y se extrajo el menisco interno.
Los meniscos fueron seccionados radialmente con un bisturí delimitando la zona de la lesión para su posterior estudio histológico.
La fijación de las piezas se efectuó en formol, al 4%, tamponado con fosfatos, durante 24 horas. La deshidratación de las piezas se realizó mediante alcoholes de gradación creciente (70%, 80%, 96% y 100%), cambiando dichos alcoholes cada 12 horas manteniéndose en agitación constante. Posteriormente se introdujeron en xileno durante 4 horas y se incluyeron en parafina a una temperatura de 60°. Finalmente se realizaron cortes de 4 μm de grosor en un microtomo convencional (Microm®. Modelo HM 340-E, Alemania) y se tiñeron con tricrómico de Masson y safranina-O.
Se llevó a cabo una valoración de la reparación fijándonos en:
1. Persistencia de espacio entre los dos labios de la lesión.
2. Acercamiento de grupos isogénicos a la lesión.
3. Invaginación de células desde la superficie articular meniscal superior e inferior.
4. Acercamiento de vasos desde la zona periférica hacia la lesión.
5. Invasión de infiltrado celular acompañando a la sutura.
6. Existencia de puentes tisulares de unión entre los bordes de la lesión.
RESULTADOS
Grupo I: control
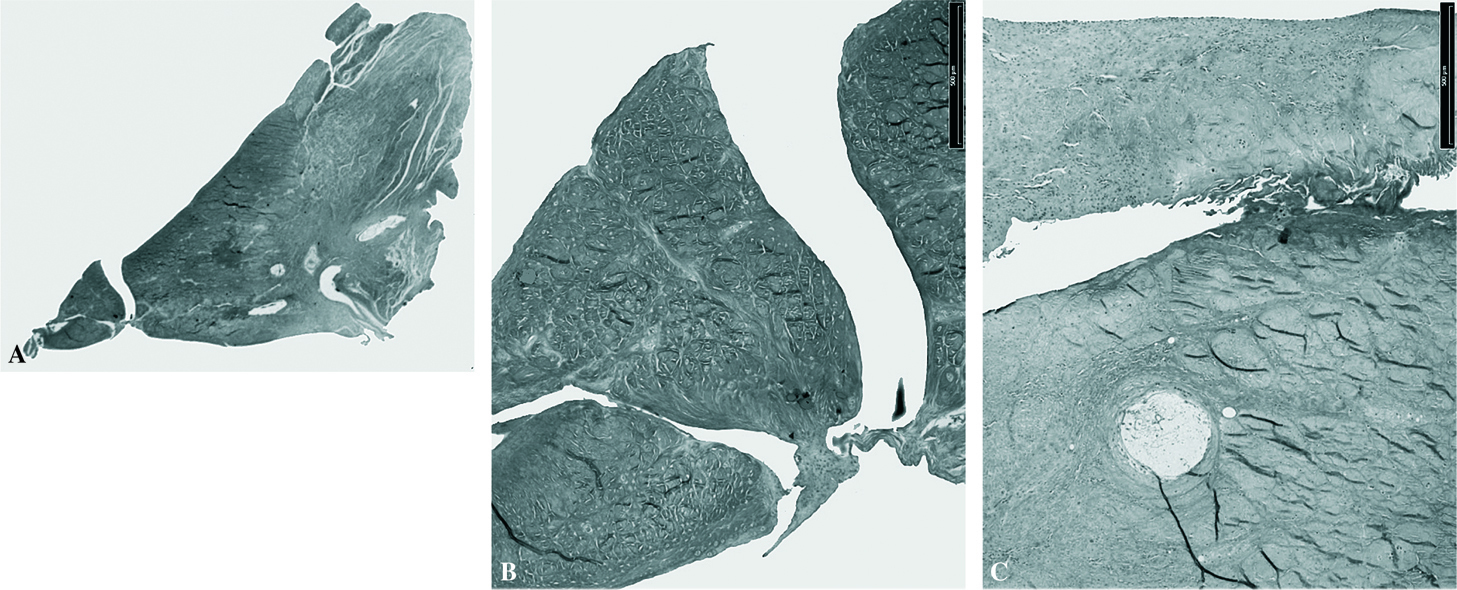
En este grupo no se apreció unión, los fragmentos permanecieron completamente separados sin signos de reparación meniscal. Se observó el canal por donde penetró la aguja, con pequeños infiltrados celulares alrededor del canal (fig. 1).
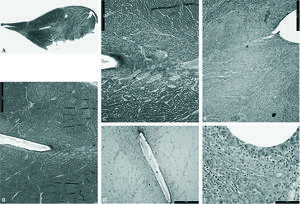
Figura 1.Grupo I: control. Imagen de lesión meniscal. A) Se aprecia el recorrido de la aguja de trefina, produciendo cavidades. El tejido salta de un fragmento a otro (tricrómico de Masson, x0,5). B) Detalle (tricrómico de Masson, x4). C) Desgarro del canal con fibras en su interior y orificio de la sutura con infiltrado celular (tricrómico de Masson, x10).
El canal de penetración de la aguja de trefina se iniciaba en la periferia del menisco. Se constituyó una cuña que penetraba desde la sinovial permitiendo la entrada de células en todo el recorrido del canal. Cuando nos acercamos al borde de la lesión las células desaparecían. En el borde de la lesión y en el canal de penetración de la aguja, aparecieron numerosos clones de condrocitos, teñidos con safranina-O.
Grupo II: inyección de Matrigel®
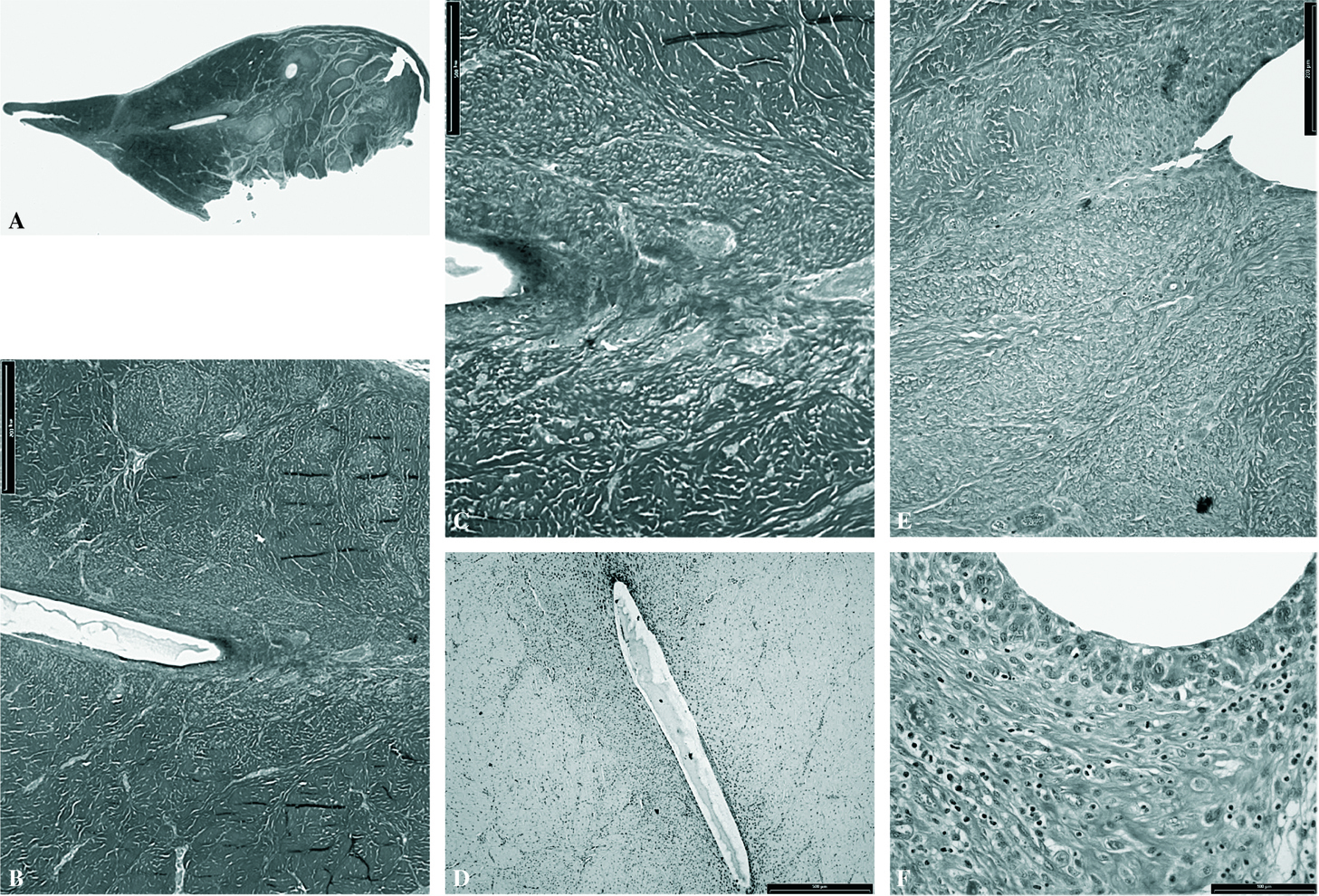
No se adivinaron signos de reparación meniscal. Se detectó el canal de penetración de la aguja con fibras de colágeno onduladas longitudinalmente alrededor del mismo y células en su interior formando cavidades con las propias células de la profundidad del menisco, en grandes celdas y con una estructura fibrosa más laxa. Con la tinción de safranina-O, se visualizaron las células que se disponían por fuera del trayecto de la trefina. Los fragmentos estaban muy desplazados. Se observó el canal producido por la trefina con estructura fibrosa laxa y fibras de colágeno onduladas que se disponían paralelas al canal (fig. 2).
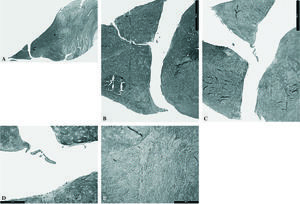
Figura 2.Grupo II: inyección de Matrigel®. Se evidencia el trayecto de la aguja con cavidades en su recorrido (A) (tricrómico de Masson, x0,5). B) Cavidad en el canal de trefinación con infiltrado celular (tricrómico de Masson, x10). C) Detalle (tricrómico de Masson, x20). D) (safranina-O, x10). E) Cavidad en el canal de trefinación (tricrómico de Masson, x20). F) Borde del orificio de sutura tapizado con células gigantes multinucleadas y penetración vascular (tricrómico de Masson, x40).
Se siguió muy bien el trayecto de la trefina. Comenzaba en la periferia capsular con una penetración de tejido fibroso con células proveniente de la cápsula, en cuña con su vértice ocupado por un orificio de la sutura.
Grupo III: inyección de ácido hialurónico
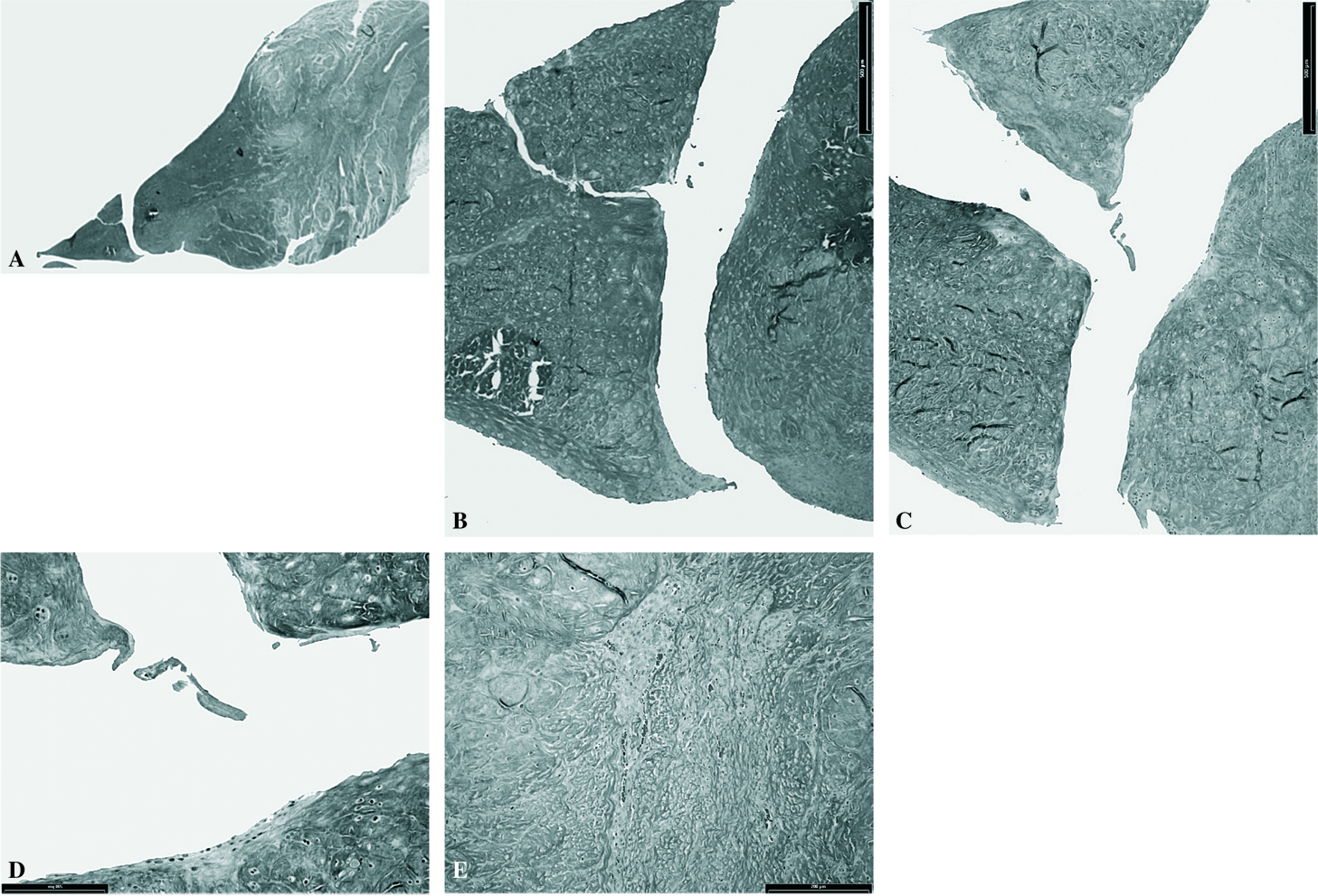
Tampoco se observó unión entre los fragmentos. En los canales de penetración de la aguja de trefina, en su porción más periférica, mostraron numerosas células hemáticas y sinoviales. Alrededor de los canales se apreció una desestructuración del colágeno mostrando claramente la ondulación de las fibras de colágeno (fig. 3).
Figura 3.Grupo III: inyección ácido hialurónico. A) Lesión sin signos de reparación (tricrómico de Masson, x0,5). B) Tricrómico de Masson, x4. C) Tricrómico de Masson, x4. D) Penetración vascular en el interior del menisco (tricrómico de Masson, x20). E) Penetración vascular en el interior del menisco (tricrómico de Masson, x20).
En todos los casos se apreció una cuña de penetración celular desde la periferia en cuyo vértice apareció un orificio correspondiente al canal de sutura. No hubo signos de invasión ni reparación, sin embargo, se pudo señalar como un proceso de invasión capsular.
En ninguno de los grupos estudiados encontramos uniones entre los fragmentos de los meniscos. La inyección de sustancias mostró cambios en el interior de la estructura meniscal.
Por otra parte, el trefinado permitió la entrada celular pero no consiguió adquirir una estructura meniscal. La zona estaba ocupada por un tejido fibroso con células sin presentar la imagen característica de las fibras de colágeno del menisco. La reparación se solía producir por la penetración de una cuña de tejido fibroso con vasos y células desde la periferia que desestructuraba al propio menisco.
La técnica del trefinado con inyección de diferentes sustancias no demostró ser una técnica efectiva. Estimulaba la formación fibrosa desde la cápsula con rica celularidad, dejaba los canales de trefina sin reconstruir y no conseguía la unión de los fragmentos.
No apreciamos estimulación con los diferentes grupos utilizados, pues todos los cambios se observaron en el fragmento grande, periférico, unido a la cápsula. En ningún caso observamos cambios interesantes en el fragmento libre que, por otra parte, siempre se soltaba al quitar la sutura para efectuar los cortes de las piezas.
DISCUSIÓN
La mayoría de las publicaciones sobre reparación meniscal dejan claro que las roturas longitudinales en la zona avascular, las más frecuentes, no son capaces de repararse y el menisco no alcanza sus condiciones biomecánicas normales. Hay evidencias, en estudios experimentales17-20, de que a los dos y tres meses la resistencia mecánica de una lesión meniscal no alcanza el 30% de la resistencia del tejido meniscal sano. No es de extrañar el dilema que plantea un deportista con una lesión meniscal aislada. El cirujano debe equilibrar, por un lado, el deseo del paciente de volver lo antes posible a su actividad y, por otro, debe prevenir la aparición de complicaciones y alteraciones degenerativas21, aunque según Papachristou et al22, la reparación meniscal en la zona avascular tiene muchas probabilidades de curar.
Para ampliar las indicaciones de reparación de las áreas avasculares se han desarrollado técnicas que pretenden llevar sangre desde la cápsula hasta el área avascular o reparar directamente la lesión.
Las roturas longitudinales, menores de 1 cm, pueden curar espontáneamente23. Por otro lado, cuando la rotura meniscal es parcial, es decir, no afecta a todo el espesor meniscal, debe valorarse la estabilidad de la misma y se les puede dejar sin tratamiento. Una rotura meniscal longitudinal puede ser reparada, especialmente en pacientes jóvenes y activos, asociada si fuera necesario con la reparación del cartílago articular y del LCA24.
El trefinado aporta riego sanguíneo a la lesión. Incluso los propios túneles que dejan el paso de los hilos de sutura sirven de punto de entrada a las células reparadoras17-20,25,26 pues la sinovial es una fuente de nutrición del metabolismo meniscal que responde a determinados estímulos externos. La sutura estabiliza los fragmentos y estimula la proliferación celular sin dar signos claros de cicatrización, aunque según Zhang et al25, trefinar y suturar promueve la curación en la zona avascular pues la sutura estabiliza una lesión, pero no es capaz de curar si no hay aporte sanguíneo.
Gershuni et al27 mostraron cicatrizaciones de lesiones longitudinales meniscales con la trefina y el aporte de tejido sinovial, en la zona avascular del menisco externo en perros, señalando que las células que participaban en la reparación meniscal procedían de las propias células meniscales, de las células endoteliales de los capilares y de la sinovial. También especularon que las células de la circulación general llegaban por los capilares de los conductos creados por la trefina o a través del colgajo sinovial. El problema que se plantea con esta técnica es la rotura de las fibras de colágeno que afecta a la capacidad funcional del menisco, por lo que su uso clínico no se ha extendido y se ha propuesto la práctica de canales de pequeño diámetro para disminuir este efecto adverso28.
La respuesta a la curación de una rotura meniscal depende de la localización de la lesión, la perfusión, el índice vascular y la inmovilización. Sin embargo, nos planteamos que una rotura longitudinal meniscal, cure o no, necesita de una fijación que elimine los síntomas clínicos y, como señalan Richards et al29, está sometida a compresión durante todo el arco de movimiento de la articulación de la rodilla. La rotación aumenta las solicitaciones sobre el menisco y, en concreto, la rotación interna aumenta dos veces la presión sobre el menisco lateral comparado con la posición neutra o con la rotación externa, desplazando y dañando los fragmentos meniscales. También pueden afectar la disminución de líquido sinovial y el descenso de la nutrición tisular, además de las solicitaciones sobre la articulación30. Según Stone31 la reparación meniscal sólo se obtiene en un 10% de todas las roturas meniscales revisadas por artroscopia.
Por esto, cualquier técnica de reparación meniscal debe aproximar los bordes de la rotura para proteger la reparación de las solicitaciones articulares que tienden a separarlos. En una reparación meniscal deben primar los mismos principios que para la de otro tejido orgánico: inmovilización, con una fijación adecuada, reposo y aporte de sustancias apropiadas que consigan la reparación.
La sinovial y la unión menisco capsular son, por otro lado, una porción rica en células mesenquimales capaces de migrar y rellenar, si se dan las condiciones oportunas, las roturas meniscales y, como señalan Kobayashi et al32, son muy adecuadas para realizar trasplante celular en zonas avasculares del menisco.
En nuestro estudio hemos observado la proliferación vascular en numerosas ocasiones, pero no se ha traducido en un tejido de unión entre los fragmentos ya que los vasos nunca se han visto llegar al borde de la lesión. Se han observado vasos que parecen desaparecer en el interior del menisco y continuar con un ensanchamiento por donde penetra el líquido sinovial, como si éste fuese un impedimento para su avance.
El trefinado puede aportar riego sanguíneo a la lesión, además de estimular la membrana sinovial. Ya se ha visto cómo los túneles creados por los hilos de sutura sirven de canal para la llegada de células competentes en el trabajo reparador.
En las roturas de la zona roja-blanca del menisco31 se recomienda perforar desde la zona periférica numerosas veces con una aguja, para facilitar la llegada de vasos, evitando la abrasión que desestructura el tejido meniscal. Los trabajos de Zhongnan et al26, en perros, mostraron que las lesiones trefinadas habían curado total o parcialmente, mientras que ninguna de las lesiones del grupo control mostró signos de reparación. En las lesiones del grupo control aparecían un número elevado de fibrocondrocitos a ambos lados de la herida, sin encontrar signos de cicatrización a las 24 semanas de la lesión. La longitud de la zona reparada era máxima a las 8 semanas, con una diferencia significativa entre la captación radioactiva de los fibrocondrocitos en el grupo trefinado respecto al control, lo que sugiere que la sinovial es una fuente de nutrición del metabolismo meniscal que responde a determinados estímulos externos.
La práctica de la trefina presenta un problema, la disrupción de la arquitectura de la estructura del colágeno, afectando la capacidad funcional del menisco, por lo que su uso clínico no se ha extendido. Actualmente, se ha iniciado la práctica de canales de pequeño diámetro para disminuir el efecto lesional de las trefinas33.
En la práctica se han comunicado buenos resultados trefinando en roturas meniscales incompletas sintomáticas34 para evitar los riesgos de la sutura y preservar el menisco. En un estudio experimental35,36 trefinaron 24 meniscos de perro, con sutura de una rotura longitudinal, rellenando el canal con una matriz polimérica porosa en la mitad de ellos y dejando libres los otros 12. Encontraron degeneración cartilaginosa en ambos grupos por lo que consideraron que no era una técnica superior a la meniscectomía parcial.
Nuestra experiencia nos demuestra que el efecto de la trefina es parcial, que destruye la estructura del menisco de forma irreversible y que, de nuevo, aunque los vasos penetren en el menisco no consiguen llegar a la lesión y mucho menos aportar sustancias reparadoras. En el menisco, la llegada de vasos no es sinónimo de reparación. Hemos observado cómo se forma una cuña de tejido celular en la zona de la trefina, destruyendo las fibras meniscales sin llegar nunca a la lesión. Pensamos que no es una técnica adecuada.
En conclusión, el trefinado no estimula la reparación meniscal y deja, en la mayoría de los casos, lesiones graves en la estructura del propio menisco. En ocasiones el paso de la trefina deja un canal con las fibras de colágeno rotas y en otras cavidades con una reacción fibrosa alrededor que pueden comprometer la función mecánica del propio menisco.
Conflicto de intereses. Los autores recibimos una beca de investigación de la Fundación Mapfre para la realización de parte del presente trabajo. No hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial.
Correspondencia:
F. Forriol.
Departamento de Cirugía Ortopédica y Traumatología. CUN.
Avda Pío XII, 36.
31008 Pamplona. Navarra.
Correo electrónico: fforriol@mac.com
Premio de Investigación Básica de la SECOT 2005.
Recibido: septiembre de 2005.
Aceptado: septiembre de 2005.