Efecto de la preparación femoral en los cambios remodelativos precoces tras prótesis total no cementada de cadera
Effect of femoral preparation on early remodeling changes after total uncemented hip arthroplasty
PANISELLO SEBASTIÁ, J. J.* ; MARTÍNEZ MARTÍN, A.**; DOMINGO CEBOLLADA, J.**; HERRERA RODRÍGUEZ, A.**; CANALES CORTÉS, V.**, y PEGUERO BONA, A.**
Servicios de Traumatología y Cirugía Ortopédica. * Hospital Comarcal de Alcañiz. Teruel. **Hospital Miguel Servet. Zaragoza.
Correspondencia:
Dr. J. J. PANISELLO SEBASTIÁ.
Gertrudis Gómez de Avellaneda, 57, portal 3, 1° O.
50015 Zaragoza.
Recibido: Junio de 1998.
Aceptado: Noviembre de 1998.
RESUMEN: Se ha realizado un estudio prospectivo en 32 pacientes afectos de coxartrosis en quienes se implantó una prótesis total no cementada (ABG) y en los que se determinó densitométricamente la variación de la masa ósea femoral causada por la agresión quirúrgica y su evolución en los primeros 60 días. Los resultados mostraron una pérdida global a los 15 días, tendencia a la recuperación a los 30, con estabilización de la reparación ósea hacia los 45 días excepto en las zonas más traumatizadas por el fresado y las raspas endomedulares. Las cifras obtenidas a los 60 días mostraron una recuperación ósea en las zonas metafisarias que recibían cargas y un descenso en las zonas 1, 4 y 7, coexistiendo una incipiente remodelación y una recuperación incompleta de la agresión quirúrgica.
PALABRAS CLAVE: Cadera. Densitometría. Remodelación ósea.
ABSTRACT: A prospective study was made in 32 patients with coxarthrosis who underwent total uncemented arthroplasty (ABG). The variation in femoral bone mass produced by surgery in the first 60 days was measured by densitometry. There was an overall loss of bone at 15 days, which tended to recover at 30 days. The bone repair stabilized at 45 days, except in the areas most affected by endomedullary reaming and rasping. The results obtained at 60 days showed bone recovery in metaphyseal weight-bearing areas and decreased bone mass in zones 1, 4 and 7. Incipient remodeling and incomplete recovery from surgical aggression coexisted.
KEY WORDS: Hip. Densitometry. Bone remodeling.
La remodelación ósea periprotésica es un fenómeno bien conocido desde que fue descrita por Charnley2 a principios de los años setenta a partir de observaciones radiográficas y posteriormente cuantificada mediante técnicas absorciométricas.1,6,7,11,13 Desde de los trabajos de McCarthy y cols.,12 Kilgus y cols.6 y Kiratli y cols.7 se constató un patrón de pérdida ósea de predominio proximal a distal que parecía producirse en los primeros 3 años tras la protetización, concluyéndose que el grado de pérdida ósea se relacionaba con el puenteo de fuerzas (stress shielding). Posteriormente otros autores valoraron el efecto de diferentes factores en la cuantía de la remodelación ósea; así, McGovern y Engh13 encontraron una mayor resorción con el uso de vástagos grandes, señalando que los cambios relacionados con la nueva situación biomecánica se desarrollaban de forma muy rápida, entre el tercer y sexto mes. Del mismo modo, los factores dependientes del paciente como la edad, peso, talla y tipo de coxopatía (si es coxartrosis o necrosis avascular) parecían no influir en la cuantía de los cambios,8,12-14,16,19,22 siendo el sexo el único factor que podría determinar un comportamiento remodelativo distinto.15
Recientemente se han presentado estudios que analizan los cambios precoces. Viladain y cols.23 apreciaron una pérdida temprana ya en el tercer mes; Reigstad y cols.17 encontraron una pérdida ósea ya en el cuarto mes, con una rápida progresión hasta el final del primer año, y en España, Vidal y cols.22 apreciaron una pérdida general de masa ósea (MO) a los 3 meses, atribuida a la agresión quirúrgica y a la descarga, con pérdidas posteriores al sexto mes.
Para determinar la influencia de la agresión quirúrgica (raspas y fresado endomedular) se estudió un grupo homogéneo de pacientes en quienes se implantó una prótesis total de cadera (PTC) no cementada y en quienes se analizó densitométricamente la remodelación ósea durante las primeras semanas.
Material y Método
Con objeto de valorar la pérdida ósea precoz causada por la preparación femoral se diseñó un estudio prospectivo controlado sobre una población de 32 pacientes afectos de coxartrosis en quienes se implantó una PTC no cementada tipo ABG (Howmédica). El vástago femoral es de diseño anatómico y fabricado con titanio. La fijación se restringe a metáfisis donde presenta un diseño en forma de escamas para aumentar la estabilidad del implante, con recubrimiento de hidroxiapatita a este nivel. La cola del vástago es delgada y corta, evitando el contacto con la diáfisis.
El implante se colocó siempre por vía posteroexterna, descrita por Köcher y Langenbeck, utilizando el tamaño que consiguiera un anclaje óptimo metafisario, sin buscar un relleno completo. La preparación femoral consistió en obtener un alojamiento metafisario del implante mediante raspas sucesivas hasta conseguir que éstas tuvieran una buena estabilidad primaria, siendo sustituidas entonces por el implante definitivo. Se realizó un sobrefresado diafisario a partir del trocánter menor de al menos 2 mm mayor que el grosor de la cola del implante. Todos los pacientes recibieron profilaxis antitrombótica con heparina de bajo peso molecular desde 12 horas antes de la intervención hasta 3 semanas después de reiniciar la marcha; y profilaxis antibiótica con cefalosporinas de la segunda generación desde el preoperatorio hasta 48 horas después de la intervención.
En todos los casos se trató de artroplastias unilaterales. Hubo 16 hombres y 16 mujeres. La edad media de la muestra en el momento de la intervención fue de 63,8 ± 3,11 años (mínimo: 61 y máximo: 66 años), siendo de 63,6 en varones y de 64,1 en mujeres.
Las determinaciones densitométricas se efectuaron en ambas caderas (enferma y sana como grupo control) en el preoperatorio y a los 2 meses, analizándose además la afecta a los 15, 30 y 45 días. Las zonas estudiadas fueron las siete áreas de Gruen y cols.3 El momento y la frecuencia de las mediciones se decidió con objeto de apreciar el efecto de la agresión quirúrgica inmediata y la capacidad de reparación ósea antes de la carga completa. Se buscó que los cambios observados no pudieran atribuirse a la remodelación ósea causada por la nueva situación biomecánica tras la protetización, que en otros estudios se considera a partir del terces mes.17,22,23
El densitómetro utilizado fue un Hologic QDR 1000 (Hologic Inc., Waltham, Massachusets),4,5 que dispone de una fuente giratoria de rayos X que genera dos rayos de energía eficaz de 70 y 140 keV.1 Las principales características operativas de este densitómetro son:1,5 error de precisión para el fémur: 1,52%;error de exactitud: 2%. Se consideró de capital importancia la colocación del paciente en la mesa del densitómetro para que todas las exploraciones midieran las mismas áreas de estudio, consiguiéndose mediante la adaptación de la extremidad a un dispositivo rígido equipado con cintas de velcro que fijaba el miembro en posición neutra.
El análisis estadístico se efectuó mediante el paquete informático SPSS. Para la comparación de porcentajes se utilizó la Chi cuadrado; para las medias, la «t» de Student-Fisher para datos libres o apareados según conviniera.
Resultados
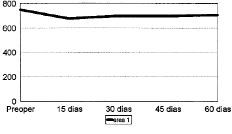
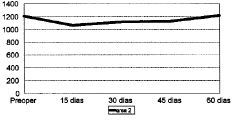
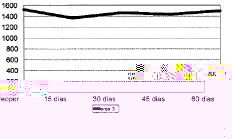
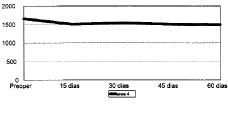
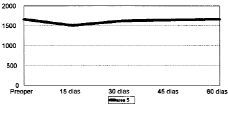
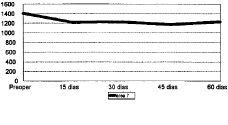
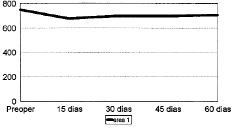
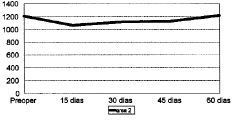
Las cifras de MO a lo largo del seguimiento se muestran en la Tabla 1 y en las figuras 1 a 7. No hubo diferencias significativas de MO en la cadera sana, tomada como control, considerándose que los factores generales que afectan a ambas (encamamiento durante la primera semana, medicación) no influyen significativamente en las variaciones observadas en los primeros 2 meses. En lo referente a la cadera intervenida, todas las áreas femorales experimentaron una caída de MO a los 15 días de la intervención, atribuible a la preparación con raspas y al fresado endomedular, que destruyen la circulación endostal. Esta pérdida osciló entre 5,9% de la zona 6 y 13,3% de la zona 7.
Tabla 1. Evolución de la masa ósea femoral en mg Ca/cm2 a lo largo de los primeros 60 días, mostrando en cada zona el porcentaje de variación, la media de variación y la desviación estándar. | |||||
| MO preop. | 15 días | 30 días | 45 días | 60 días | |
| Fémur 1 | 749 | ||||
| -- % variación | 8,9% | 6,6% | 6,8% | 6,1% | |
| -- Media variac. | 72,4 | 50,7 | 52,1 | 42,23 | |
| -- SE | 184,46 | 117,03 | 166,02 | 64,42 | |
| Fémur 2 | 1.209 | ||||
| -- % variación | 10,6%* | 7,1% | 6,6% | +0,5% | |
| -- Media variac. | 145,4 | 92,8 | 81,7 | 8,4 | |
| -- SE | 227,64 | 199,32 | 152,30 | 138,21 | |
| Fémur 3 | 1.520 | ||||
| -- % variación | 8,1%* | 3,9% | 5,5% | 1,4% | |
| -- Media variac. | 154,8 | 58,16 | 86,30 | 19,16 | |
| -- SE | 173,30 | 194,42 | 149,62 | 255,27 | |
| Fémur 4 | 1.643 | ||||
| -- % variación | 8,5%* | 9,2%* | 10,8%* | 10,2%* | |
| -- Media variac. | 140,3 | 101,2 | 139,21 | 148,83 | |
| -- SE | 232,87 | 199,4 | 141,33 | 126,57 | |
| Fémur 5 | 1.657 | ||||
| -- % variación | 9,3%* | 2,8% | 1,0% | 1,1% | |
| -- Media variac. | 155,0 | 42,5 | 13,95 | 14,83 | |
| -- SE | 170,83 | 183,13 | 117,22 | 121,83 | |
| Fémur 6 | 1.463 | ||||
| -- % variación | 5,9% | 6,8% | 4,8% | +4,0% | |
| -- Media variac. | 87,5 | 83,6 | 56,2 | 44,83 | |
| -- SE | 302,31 | 121,03 | 119,21 | 136,55 | |
| Fémur 7 | 1.403 | ||||
| -- % variación | 13,3%* | 16,1% | 20,9% | 16,2% | |
| -- Media variac. | 187,4 | 175,18 | 233,93 | 172,16 | |
| -- SE | 292,66 | 165,93 | 172,85 | 166,75 | |
| * p < 0,05. | |||||
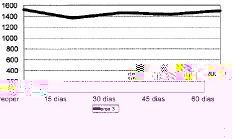
Figura 1. Evolución de la masa ósea en área 1 del fémur en mg Ca/cm2.
Figura 2. Evolución de la masa ósea en área 2 del fémur.
Figura 3. Evolución de la masa ósea en área 3 del fémur.
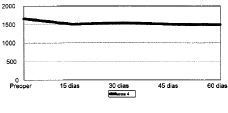
Figura 4. Evolución de la masa ósea en área 4 del fémur.
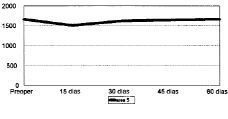
Figura 5. Evolución de la masa ósea en área 5 del fémur.
Figura 6. Evolución de la masa ósea en área 6 del fémur.
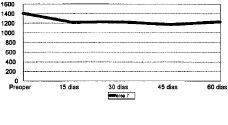
Figura 7. Evolución de la masa ósea en área 7 del fémur.
La determinación a los 30 días mostró el inicio de la recuperación de la MO endomedular, que se centró en las zonas laterales y distales, con un incremento entre el 3,5 a 6,5% respecto a la pérdida observada a los 15 días. Las zonas 6 y 7, más traumatizadas por el esfuerzo del cirujano por no colocar el implante en varo, presentaron aún ligeras pérdidas, de 0,9 y 2,8%, respectivamente.
Las cifras observadas a los 45 días mostraban una tendencia a estabilizarse la reparación ósea, oscilando entre un incremento del 2,1% y un descenso del 1,6% respecto a las cifras del mes. Tan solo la zona 7 seguía presentando pérdidas, con un nuevo descenso del 4,8% respecto a las cifras iniciales.
Al final del segundo mes se evidenció cierto incremento de las cifras de MO, traducción de la nueva situación biomecánica, con solicitaciones de carga cada vez mayores y capaces de estimular la neoformación ósea. Así se apreciaron incrementos entre el 2,1 a 8,8%, siendo las zonas que directamente recibían cargas (2, 3, 5 y 6) las que mayor aumento registraron frente a la determinación anterior. Excepto en las zonas 4 y 7, las cifras de MO en esta fase fueron semejantes a las existentes en el preoperatorio.
Discusión
Existe consenso en que los cambios remodelativos en el fémur tras implantar una PTC no cementada se inician en los primeros meses, con un gradiente de pérdida de predominio proximal, por puenteo de fuerzas a ese nivel. Frente a los trabajos clásicos6 que demuestran pérdidas del 20-25% en zona 6 y 34,8% en zona 7 en pacientes entre 1 a 7 años de evolución, o del 13 a 24% a los 2 años,7 los trabajos de Viladain y cols.23 ya encuentran una pérdida de 21,9% en la zona 7 a los 3 meses, o bien del 31,1% a los 6 meses en esa misma zona para Vidal y cols.22 Sin embargo, no queda claro el papel de la agresión quirúrgica en la cuantía de las pérdidas iniciales.
Se ha demostrado en el animal de experimentación que el fresado endomedular destruye las arterias nutricias y la superficie endostal de la diáfisis. Rhinelander y cols.18 demostraron que la arteria nutricia irriga los dos tercios internos de la cortical diafisaria en coincidencia con Willans y cols.,24 quienes atribuyen a esta circulación endostal el 62% del aporte sanguíneo de la cortical del hueso sano en perros. Previamente, en 1974, Trueta21 ya describió este fenómeno y sugirió un mecanismo de compensación mediante la inversión del flujo sanguíneo, que pasa a ser centrípeto, en un proceso de curación. Este mismo autor, en sus trabajos histológicos sobre el clavo endomedular de Kuntscher, ya observó que tras el fresado endomedular se produce una necrosis del hueso esponjoso y de un tercio interno de la cortical en las primeras 24 horas, que es máxima a partir de las 2 semanas, compensándose por una reacción perióstica que origina engrosamiento de la cortical.21 En el animal de experimentación se ha observado que la revascularización y reparación de un tercio interno dañado de la cortical se produce entre la octava y la duodécima semana; sin embargo, se cree que en el hombre ésta no es completa hasta la decimosexta.10
Por otro lado, la abrasión producida por la preparación femoral mediante raspas traumatiza la cara interna de la cortical de modo semejante al fresado. La zona del cálcar, sin ser zona de fresado, es presentada por Stiles y cols.19 como un área frecuentemente traumatizada al ser guía del fresado y de las raspas, lo que origina necrosis a ese nivel, sobre la que se desarrollarán los cambios adaptativos por puenteo de fuerzas. Este hecho ha sido ya observado por Kröger y cols.,9 quienes en su estudio sobre 34 implantes no cementados encuentran, en una única determinación a los 14 días de la protetización, una pérdida de MO en cálcar del 13,5 al 19,2%, con descenso también en zona 4. Estos autores atribuyen este descenso de MO al efecto del fresado y raspado femoral y resaltan su importancia en la apreciación de los cambios reales tras la protetización, que podrían ser sobreestimados si no se tiene en cuenta este hecho.
El estudio realizado viene a cuantificar el efecto que sobre la MO causa la preparación femoral, no únicamente en el postoperatorio inmediato, sino la capacidad de recuperación tras la agresión ósea y la carga de la extremidad. Permite evidenciar que el hueso sobre el que actuará la remodelación ósea no es exactamente el que presenta el fémur en el postoperatorio inmediato como proponen Kröger y cols.,9 sino que presenta modificaciones cuantitativas fruto de una reparación ósea semejante a las fracturas. De este modo, la necrosis causada es evidente al final de la segunda semana, en la que produce una pérdida de aproximadamente 10% en todas las áreas femorales. Hacia la cuarta-sexta semana parece estabilizarse el proceso reparador, que busca alcanzar cifras parecidas a las existentes antes de la intervención. Sin embargo, es a partir de la sexta semana cuando comienzan a manifestarse cambios en función de la nueva situación biomecánica, coincidiendo con el apoyo progresivo de la extremidad afecta, que en este estudio se autorizó a partir del décimo día.
La zona 1 del fémur, frecuentemente desfuncionalizada, presenta a los 60 días una pérdida del 6,1%, a partir de la cual se producirá un lento descenso por atrofia referido por numerosos autores.22,23 Las zonas 2, 3, 5 y 6 al ser asiento del apoyo metafisario de la prótesis reciben un estímulo fisiológico más adecuado para la neoformación ósea, apreciándose al final del segundo mes la práctica recuperación de la MO inicial. Cabrá esperar en el futuro una pérdida por remodelación. Las zonas 4 y 7 merecen una consideración especial. En la zona 4, generalmente más estrecha, el efecto del fresado endomedular es más agresivo en tanto que el diámetro de la fresa tiende a coincidir con el diámetro endomedular, causando una destrucción más radical de la vascularización, con la consiguiente necrosis del hueso esponjoso y parte de la cortical interna. Este hueso no muestra recuperación a los 2 meses de la intervención. Por otro lado, la zona 7 sufre una doble agresión. Al efecto del fresado endomedular y del paso de las raspas, que destruye la vascularización endostal y prácticamente depleciona de esponjosa el cálcar, hay que añadir la desperiostización que se produce en el momento de la osteotomía. En efecto, con el ánimo de mejorar la presentación del cuello para realizar la osteotomía el cirujano lo expone hasta prácticamente trocánter menor, provocando de este modo su denervación y devascularización. Esta doble agresión causa una mayor necrosis en la zona del cálcar, con una mayor pérdida inicial. Si a ello se añade el no ser una zona de transmisión de fuerzas en vástagos de apoyo metafisario o rectos se comprenderá que de una pérdida del 16% en la octava semana se pase a un descenso del orden del 25-30% al final del primer año15,23 al tratarse de una zona primero devascularizada y después desfuncionalizada.
Considerando el efecto de la agresión femoral y su influencia en el posterior remodelado cabría concluir: 1) parece deseable el uso del menor tamaño de implante que proporcione una correcta estabilidad primaria; 2) la preparación femoral debe buscar el apoyo estable del vástago sobre hueso esponjoso de calidad sin pretender directamente el apoyo sobre hueso cortical, y 3) la zona del cálcar debe preservarse primero de una desperiostización excesiva y segundo de una excesiva agresión con raspas, buscando conservar hueso esponjoso entre el implante y la cortical.
Bibliografía
1.Adami, S; Zamberlan, N; Gatti, D; Zansifi, C; Braga, V; Broggini, M, y Rossini, M: Computed radiographic absorptiometry and morphometry in the assessment of postmenopausal bone loss. Osteoporosis Int, 6: 8-13, 1996.
2.Charnely, J: Low friction arthroplasty of the hip: Theory and practice. Berlin. Springer-Verlag, 1979, 20-90.
3.Gruen, T; McNeice, G, y Amstutz, H: «Moldes of failure» of cemented stem-type femoral components. Clin Orthop, 141: 17-27, 1978.
4.Grupo de Trabajo en Osteoporosis: BMD en cuello femoral. Mujeres. En: Estudio de la densidad ósea en la población española. Madrid. Pharma Consult, 1992, 151.
5.Hologic QDR 1.000 X-Ray Densitomer: Operator''s manual and user''s guide. Massachusetts. Hologic Inc, 1990.
6.Kilgus, D; Shimaoka, E; Tipton, J, y Eberle, R: Dual energy X-ray absorptiometry measurement of bone mineral density around porous-coated cementless femoral implants. J Bone Joint Surg, 75B: 279-299, 1993.
7.Kiratli, B; Heiner, J; McBeath, A, y Wilson, M: Determination of bone density by dual X-ray absorptiometry in patients with uncemented tottal hip arthroplasty. J Orthop Res, 10: 221-227, 1992.
8.Kröger, H; Miettinen, H; Arnala, I; Koski, E; Rushton, N, y Suomalainen, O: Evaluation of periprosthetic bone using dual-energy X-ray absorptiometry: Precision of the method and effect of operation on bone mineral density. J Hand Surg, 11: 10, 1526-1530, 1996.
9.Laupacis, A; Bourne, R; Rorabeck, C; Feeny, D; Wong, C; Tugwell, P, y Leslie, K: The effect of elective total hip replacement on health-related quality of life. J Bone Joint Surg, 75A: 1619-1626, 1993.
10.López Blasco, J: Principios mecánicos y biológicos del enclavado endomedular. Zaragoza. XXVIII Curso AO Básico de Osteosíntesis, 1995.
11.Martini, F; Sell, S; Kremling, E, y Küsswetter, W: Determination of periprosthetic bone density with the DEXA method afeter implantation of custom-made uncemented femoral stems. Int Orthop, 20: 218-221, 1996.
12.McCarthy, K; Steinberg, G; Agren, M; Leahey, D; Wyman, E, y Baran, D: Quantifying bone loss from the proximal femur after total hip arthroplasty. J Bone Joint Surg, 73B: 774-778, 1991.
13.McGovern, T; Engh, C; Zettl-Schaffer, K, y Hooten, J: Cortical bone density of the proximal femur following cementless total hip arthroplasty. Clin Orthop, 306: 145-154, 1994.
14.McPearson, E; Dorr, L; Gruen, T, y Saberi, M: Hydroxyapatite-coated proximal ingrowth femoral stems. Clin Orthop, 315: 223-230, 1995.
15.Panisello Sebastiá, JJ; Herrera Rodríguez, A; Peguero Bona, A; Martínez Martín, A; Calvo Díaz, A, y Domingo Cebollada, J: El estado biológico del fémur como factor predictivo de la remodelación ósea. Estudio densitométrico. Rev Ortop Traumatol, 42: 125-130, 1998.
16.Prendergast, P, y Taylor, D: Design of intramedullary prostheses to prevent bone loss: Predictions based on damage stimulated remodelling. J Biomed Eng, 14: 499-506, 1992.
17.Reigstad, A; Rokkum, M; Bye, K, y Brandt, M: Femoral remodelling after arthroplasty of the hip. Acta Orthop Scand, 64: 411-416, 1993.
18.Rhinelander, F: Tibial blood supply in relation to fracture healing. Clin Orthop, 105: 34-81, 1974.
19.Stiles, R; Laverina, C; Resnick, D, y Covery, R: The calcar femoral. An anatomic, radiological, and surgical correlative study. Investigate Radiology, 25: 1311-1315, 1990.
20.Tonino, A; Romanini, L; Rossi, P; Borroni, M; Greco, F, y García Araújo, C: Hydroxyapatite-coated hip prostheses. Clin Orthop, 312: 211-225, 1995.
21.Trueta, J: Cortical circulation in long bones. J Bone Joint Surg, 61A: 1052-1059, 1974.
22.Vidal, C; Vaquero, J, y Gómez, L: Remodelación ósea del fémur tras prótesis total de cadera: Estudio densitométrico. Rev Ortop Traumatol, 39: 209-215, 1995.
23.Viladain, J: Densitometry in the analysis of femoral remodelling. En: Epinette, J, y Geesink, R (Eds): Hydroxyapatite Coated Hip and Knee Arthroplasty. Paris. Cahiers d''Enseignement de la SOFCOT, 1995, 131-135.
24.Willans, S: Modelling in the analysis of ion exchange between blood and bone. PhD thesis. Edinburgh, 1987.