Durante la artroplastia de rodilla se produce una pérdida sanguínea importante. El objetivo de nuestro estudio es valorar la eficacia y la seguridad de la administración tópica de 3 g de ácido tranexámico (TXA) en cuanto a la reducción de pérdidas sanguíneas en artroplastia de rodilla.
Material y métodoSe ha realizado un ensayo clínico aleatorizado, fase iii, doble ciego, controlado con placebo. Se incluyó a 150 pacientes en 2grupos paralelos de tratamiento (75 por brazo). La solución se administró de forma tópica intraarticular tras la cementación y previo al cierre capsular. Se realizaron determinaciones analíticas antes y después de la cirugía.
ResultadosLa pérdida total de sangre media para el grupo placebo fue de 831,5ml y 662,3ml para el grupo TXA con una diferencia entre ambos de 169,2ml, lo que supone un ahorro del 20,4%, siendo estadísticamente significativa (p<0,001). No se obtuvieron diferencias en el inicio de la deambulación, días de ingreso o escala visual analógica al mes de la cirugía. Se retiró a 10pacientes por infección del tracto urinario prequirúrgico, alergia a metales, fallo de selección, debilitamiento rotuliano, inestabilidad protésica, fractura tibial intraquirúrgica, cambio de indicación a prótesis unicompartimental y una pérdida de seguimiento. Hubo una única complicación no relacionada con el fármaco (globos vesicales de repetición).
ConclusiónLa administración de TXA de forma tópica tras la cementación de los componentes protésicos en artroplastia de rodilla en una única dosis demuestra que es segura y eficaz.
Knee arthroplasty is a major surgery with potential significant blood loss. Assess the efficacy and safety of topical administration of 3g of tranexamic acid (TXA) in terms of reducing blood loss in knee arthroplasty.
Material and methodA randomized, phase III, double-blind, placebo-controlled clinical trial has been conducted. We included 150 patients in 2parallel treatment groups (75 per arm). The solution was administered topically intra-articular after cementation and prior to capsular closure. Analytical determinations were made before and after surgery to quantify blood loss.
ResultsTotal blood loss for the placebo group was 831.5ml and 662.3ml for the TXA group. The difference between the 2groups was 169.2ml; which means a save of 20.4 per cent; this difference being statistically significant (P<.001). There were no differences in terms of the onset of ambulation, days of admission or Visual Analogue Scale at one month of surgery. Ten patients were rejected for presurgical urinary tract infection, metal allergy, selection failure, patellar weakening, prosthetic instability, intrasurgical tibial fracture, change of indication to unicompartimental prosthesis and a loss of follow-up. There was only one complication unrelated to the investigational drug (bladder balloon).
ConclusionThe administration of TXA topically after cementation of the prosthetic components in total knee arthroplasty in a single dose has demonstrated being safe and effective.
La cirugía de sustitución total de la rodilla es una intervención quirúrgica mayor asociada a múltiples complicaciones entre las que se encuentran la pérdida sanguínea y su consecuente necesidad de transfusión1-3. En los últimos años, la tendencia de los estudios publicados se centra en favorecer la rápida recuperación de los pacientes y en disminuir las complicaciones posquirúrgicas, concretamente las relacionadas con las transfusiones sanguíneas como son: el aumento de los costes, la contaminación bacteriana, la transmisión de infecciones virales y las reacciones transfusionales2.
Uno de los fármacos que suscita un interés reciente es el ácido tranexámico (TXA). Se trata de un agente antifibrinolítico de larga trayectoria utilizado en el control de sangrados activos y como medida profiláctica en especialidades como Otorrinolaringología y Ginecología4. En lo que respecta a la cirugía ortopédica, se encuentran estudios acerca del uso del TXA utilizado de forma intravenosa en los que se aprecia una disminución del sangrado posquirúrgico y la necesidad de transfusión. Sin embargo, ante los potenciales efectos adversos de la administración intravenosa, se valoró como alternativa el uso del TXA de forma tópica5. En los diferentes estudios publicados se ha visto que la administración tópica del TXA alcanza altas dosis de concentración a nivel de la articulación con baja distribución sistémica, disminuyendo efectos adversos e igualando resultados respecto al ahorro de pérdidas sanguíneas en comparación con la administración por vía intravenosa6-9.
No obstante, la mayoría de estos estudios son de carácter observacional o revisiones, no encontrándose en nuestro medio ningún estudio experimental basado en un ensayo clínico acerca de la administración tópica del TXA en la cirugía de sustitución total de rodilla.
El objetivo principal de nuestro estudio es comparar la eficacia y la seguridad del TXA tópico en términos de ahorro de pérdidas sanguíneas con respecto a placebo en pacientes diagnosticados de artrosis severa que habían sido tratados mediante cirugía protésica de rodilla.
Materiales y métodosSe realizó un ensayo clínico independiente, fase iii, aleatorizado, doble ciego, enmascarado y controlado con placebo de enero del 2018 a abril del 2019 en el Hospital Puerta del Mar, Cádiz. Este ensayo fue autorizado por la Agencia Española del Medicamento y Productos Sanitarios y por el Comité Ético Hospitalario. El tamaño muestral se calculó para un poder estadístico del 90%, beta 0,1 y alfa de 0,05, determinando que eran necesarios 66 pacientes por grupo de tratamiento y con una proporción de pérdidas esperada del 5%. Se determinó necesario el reclutamiento de 150 pacientes, asignando 75 pacientes a cada brazo de tratamiento, en 15 bloques de 10 pacientes. La asignación se hizo de forma aleatoria mediante la aplicación informática gratuita www.randomization.com. El enmascaramiento de la medicación a estudio fue realizado por el Servicio de Farmacia del hospital, donde se prepararon jeringas precargadas con solución transparente inolora de 30ml, ya fuera con la medicación a estudio (3 g de TXA) o placebo, con un etiquetado similar. De esta forma se mantiene el doble ciego tanto para el paciente como para el cirujano.
Los criterios de inclusión para participar en el estudio fueron: edad entre 18 y 80 años, con una escala visual analógica (EVA) igual o mayor que 7, con un grado Kellgren igual o mayor que ii y tener el consentimiento informado firmado. Los criterios de exclusión fueron: enfermedad cardiaca severa, enfermedad tromboembólica, hipersensibilidad previa a TXA, enfermedad sistémica grave, antecedentes de convulsiones, trastorno mental grave, toma de anticoagulantes, embarazo o lactancia.
La variable principal del estudio fue la pérdida total de sangre estimada (TBL) según la fórmula de Nadler et al.10. Se analizaron además variables sociodemográficas, antropométricas, necesidad de transfusión sanguínea, tiempo de deambulación y tiempo hasta el alta hospitalaria. Así como variables de seguridad: acontecimientos adversos de cualquier índole, tasa de infección, necesidad de evacuación de hematomas o dehiscencia de herida quirúrgica. El tiempo de seguimiento de los pacientes fue de un mes desde la intervención en todos los casos.
Para estimar la pérdida sanguínea en la cirugía se realizaron 2determinaciones analíticas: la primera una hora antes de la intervención y una segunda a las 24 h de la misma.
Todas las cirugías fueron realizadas por miembros de la Unidad de Rodilla de dicho hospital, utilizando el abordaje parapatelar interno. Se utilizaron 2modelos de prótesis: Sigma® de DePuy Synthes (DePuy-Synhes®, Johnson & Johnson®) y Triathlon® de Stryker (Stryker®). >Tras la colocación cementada de los componentes protésicos y previo al cierre capsular se siguió el siguiente protocolo para la medicación: colocación de la rodilla en extensión, se administra el contenido de las jeringas distribuyéndolo por toda la articulación. Posteriormente, se aproximan los bordes de la herida quirúrgica, se cubre con compresas y se realiza vendaje compresivo. Se retira el manguito de isquemia y se mantiene el vendaje 3min para que entre en acción la medicación. Transcurridos los mismos, se retira el vendaje compresivo y se aspira la solución acuosa. Finalmente, se realiza hemostasia local exhaustiva, cierre por planos y colocación de vendaje algodonado y elástico inguinopédico. En ningún caso se colocó drenaje.
Para la recogida de datos y su procesamiento se utilizó el programa SPSS v.21 para Macintosh (IBM Corp., Armonk, NY, EE. UU.). Se realizó un análisis por intención de tratar desde el momento de la aleatorización del paciente (tras la firma del consentimiento informado). Se valoró la normalidad de la distribución de todas las variables mediante los test de Kolmogorov-Smirnov y de Shapiro-Wilk. Para el análisis de las diferencias basales entre grupos en las variables cuantitativas se ha utilizado la prueba de la t de Student y la prueba de la chi al cuadrado para las variables cualitativas.
ResultadosDel total de 150 pacientes reclutados, 10 pacientes fueron retirados del ensayo por los siguientes motivos: 3eran mayores de 80 años en el momento de la cirugía, un paciente presentaba sintomatología de infección de tracto urinario, otros 2pacientes se excluyeron por motivos relacionados con la técnica quirúrgica (debilidad del tendón rotuliano y colocación de prótesis unicompartimental) y, por último, hubo pérdida de los resultados de la analítica posquirúrgica en otro de los pacientes. De esta forma quedaron distribuidos 69 pacientes en el grupo TXA y 71 en grupo placebo.
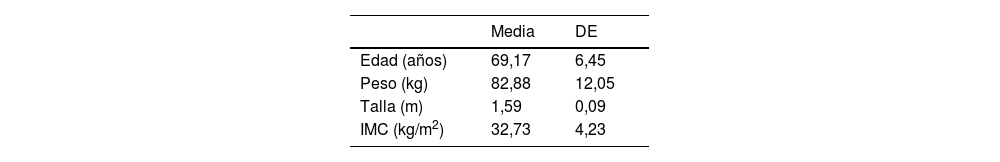
El análisis descriptivo demográfico de la muestra se resume en la tabla 1, siendo el porcentaje de hombres y mujeres del 29,3% (n=44) y el 70,7% (n=106), respectivamente, y siguiendo una distribución normal.
El tipo de prótesis utilizada fue Sigma® (Depuy-Synthes) para el 44,2% (n=65) y Triathlon® (Stryker) en el 55,8% (n=82) de los pacientes, mostrando la distribución similar en ambos grupos, 33 prótesis Sigma® y 40 Triathlon® para el grupo TXA y 32 prótesis Sigma® y 42 Triathlon® para grupo placebo. No se encontraron diferencias estadísticamente significativas (p valor=0,94) entre ambos grupos.
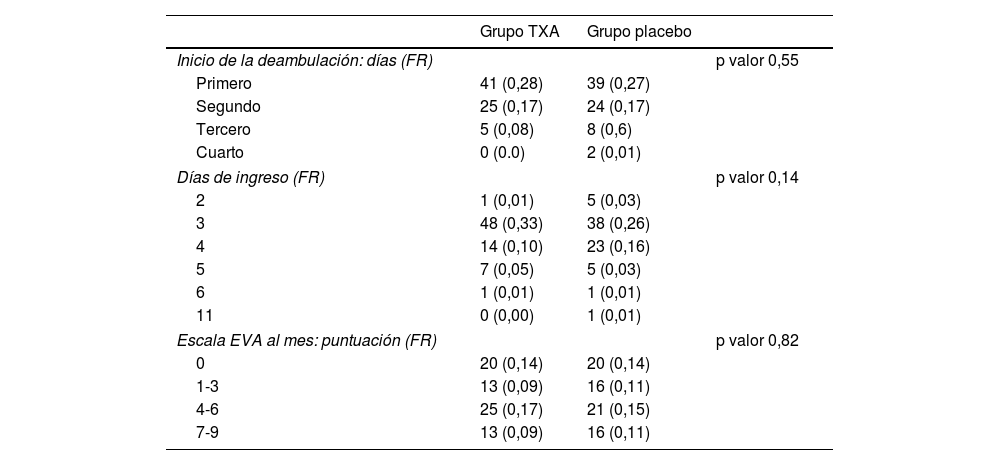
En cuanto a las variables clínicas y funcionales, no se encontraron diferencias estadísticamente significativas en ambos grupos en el momento de iniciar la bipedestación (p valor = NS), tampoco para los días totales de ingreso (p valor = NS) ni para la valoración del dolor según la EVA un mes tras la intervención quirúrgica (p valor = NS) (tabla 2).
Análisis descriptivo variables funcionales: distribución similar en ambos grupos
| Grupo TXA | Grupo placebo | ||
|---|---|---|---|
| Inicio de la deambulación: días (FR) | p valor 0,55 | ||
| Primero | 41 (0,28) | 39 (0,27) | |
| Segundo | 25 (0,17) | 24 (0,17) | |
| Tercero | 5 (0,08) | 8 (0,6) | |
| Cuarto | 0 (0.0) | 2 (0,01) | |
| Días de ingreso (FR) | p valor 0,14 | ||
| 2 | 1 (0,01) | 5 (0,03) | |
| 3 | 48 (0,33) | 38 (0,26) | |
| 4 | 14 (0,10) | 23 (0,16) | |
| 5 | 7 (0,05) | 5 (0,03) | |
| 6 | 1 (0,01) | 1 (0,01) | |
| 11 | 0 (0,00) | 1 (0,01) | |
| Escala EVA al mes: puntuación (FR) | p valor 0,82 | ||
| 0 | 20 (0,14) | 20 (0,14) | |
| 1-3 | 13 (0,09) | 16 (0,11) | |
| 4-6 | 25 (0,17) | 21 (0,15) | |
| 7-9 | 13 (0,09) | 16 (0,11) | |
FR: frecuencia relativa.
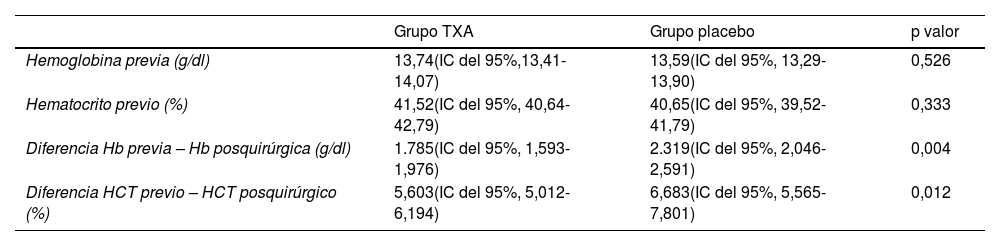
Respecto a las variables de eficacia se analizaron la hemoglobina (Hb) y el hematocrito (HCT), siguiendo estos datos una distribución normal para la Hb previa a la intervención quirúrgica. En el caso del HCT previo, los datos siguieron una distribución normal para el grupo TXA pero no para el grupo placebo. No se encontraron diferencias estadísticamente significativas entre ambos grupos ni para la Hb ni para el HCT. Por el contrario, sí se encontraron diferencias estadísticamente significativas en las diferencias entre la Hb y el HCT previos y posteriores a la intervención quirúrgica, siendo esta diferencia mayor para el grupo placebo (tabla 3).
Análisis estadístico variables de eficacia
| Grupo TXA | Grupo placebo | p valor | |
|---|---|---|---|
| Hemoglobina previa (g/dl) | 13,74(IC del 95%,13,41-14,07) | 13,59(IC del 95%, 13,29-13,90) | 0,526 |
| Hematocrito previo (%) | 41,52(IC del 95%, 40,64-42,79) | 40,65(IC del 95%, 39,52-41,79) | 0,333 |
| Diferencia Hb previa – Hb posquirúrgica (g/dl) | 1.785(IC del 95%, 1,593-1,976) | 2.319(IC del 95%, 2,046- 2,591) | 0,004 |
| Diferencia HCT previo – HCT posquirúrgico (%) | 5,603(IC del 95%, 5,012-6,194) | 6,683(IC del 95%, 5,565-7,801) | 0,012 |
Las variables Hb previo y HTC previo son similares en ambos grupos. Las variables diferencia Hb previa-posquirúrgica y HTC previo-posquirúrgico presentan diferencias estadísticamente significativas comparando ambos grupos, siendo mayor en los pacientes a los que no se les aplicó el ácido tranexámico.
En cuanto a la variable principal TBL, mostró una media de 662,30ml (intervalo de confianza (IC) del 95%, 600,8-723,7) para el grupo TXA y 831,5ml (IC del 5%, 752,8-910,2) para el grupo placebo, siendo la diferencia entre ambos de 167,78ml a favor de grupo TXA estadísticamente significativa, con un valor de p=0,001, lo que corresponde a un ahorro de un 20% con respecto al grupo placebo.
En lo referente al análisis de la seguridad, no hubo complicaciones con la herida quirúrgica, ningún paciente precisó reintervención, no hubo infecciones y en ningún caso fue necesario realizar transfusiones sanguíneas. Como único acontecimiento adverso, ajeno al uso del TXA, se reporta un caso con globos vesicales de repetición.
DiscusiónEn el presente estudio se obtiene una disminución de un 20% (167,78ml de media) de pérdidas totales de sangre con la administración del TXA en la cirugía protésica de rodilla. En la bibliografía, encontramos varios estudios de metodología similar a la nuestra. En 2010, Wong et al. analizaron 3brazos de tratamiento (en el primero se administró 1,5 g de TXA; en el segundo, 3 g, y en un tercer grupo, placebo), donde observaron una reducción en las pérdidas sanguíneas de 315ml de media en el primer brazo y de 402ml en el segundo brazo, en comparación con el grupo control11. Más tarde, Konig et al.12 y Georgiadis et al.13 demostraron una reducción en la pérdida de sangre de 353 y 231ml de media, respectivamente. Creemos que estos resultados de mayor magnitud en comparación con nuestro estudio pueden ser debido a la metodología utilizada en cuanto a gestos quirúrgicos, que, al no estar estandarizados, pueden motivar diferencias no relacionadas con la administración del fármaco14.
Con relación al ahorro en las pérdidas sanguíneas, la principal consecuencia derivada de la administración del TXA es la diminución de la tasa de transfusión. Diferentes estudios demuestran que los pacientes tratados mediante cirugía protésica de rodilla tratados con este fármaco no precisan trasfusión sanguínea tras la misma15-17. En nuestro caso, la tasa de transfusión fue cero tanto para los pacientes tratados con TXA como para el grupo control.
En cuanto al análisis de la funcionalidad, el interés radica en que, al disminuir las complicaciones derivadas de las pérdidas sanguíneas, el inicio de la rehabilitación no se ve retrasado por las mismas. Por este motivo, Grosso et al.18, en 2018, propusieron analizar los resultados funcionales y la recuperación precoz en pacientes a los que se le administraba TXA de forma intravenosa. Para ello, se aleatorizó a 560 pacientes en 2brazos de tratamiento; el primer grupo recibió TXA y el segundo, placebo. El resultado obtenido fue que los pacientes a los que se administró TXA fueron capaces de deambular más a partir del segundo día. Sin embargo, no obtuvieron diferencias en la EVA. Por otra parte, Serrano et al.19 analizaron los resultados funcionales posquirúrgicos con la escala Knee Society Score (KSS) y se observó que existían diferencias a las 6semanas tras la administración del fármaco, pero no a los 4meses. En 2019, Hirose et al.20 llevaron a cabo un análisis del balance articular (BA) tras administrar TXA intraarticular después del cierre de la herida quirúrgica. Obtuvieron una mejoría del BA al cuarto, décimo y decimocuarto día. Sin embargo, no hubo diferencia en el test de los 10m de deambulación, la EVA o la fuerza muscular.
En nuestro estudio, al igual que Guerreiro et al.21, no hemos encontrado diferencias significativas entre los 2grupos en cuanto a tiempo de inicio de bipedestación tras la cirugía, EVA al mes de la intervención y días de ingreso.
Desde nuestro punto de vista, estas diferencias existentes entre los distintos estudios en cuanto a los resultados funcionales se deben probablemente al análisis de múltiples variables secundarias. Por tanto, se considera fundamental la realización de un protocolo previo a la realización del estudio para definir claramente el objetivo principal, así como el tamaño muestral.
Respecto a las posibles reacciones adversas de la administración de TXA, cabe destacar los eventos tromboembólicos, tal y como se describe en su ficha técnica22. Sin embargo, en este ensayo clínico no se han reportado casos de los mismos en ninguno de los 2brazos de tratamiento. Tampoco se han registrado otros eventos relacionados con la técnica quirúrgica, como dehiscencia de la herida quirúrgica, hematoma con necesidad de drenaje o sangrado no controlable con medidas conservadoras. Los mismos resultados obtuvieron estudios similares como los realizados por Konig et al.12, Wong et al.11 y Geordiadis et al.13, en los que no se observó un aumento en la incidencia de tromboembolia ni de ninguna otra complicación cuando los pacientes recibieron TXA tópico.
En un metaanálisis realizado en 201823, en el que se incluyó a 73 ensayos clínicos con un total de 6.953 pacientes intervenidos de cirugía protésica de rodilla, se concluyó que la incidencia general de tromboembolia venosa fue del 2,1% en los pacientes que recibieron TXA frente al 2% en el grupo control. No obstante, estos resultados deben tomarse con cautela, ya que en los ensayos clínicos a menudo selecciona a los pacientes con criterios de inclusión estrictos que no reflejan la práctica clínica habitual, excluyendo a aquellos con elevado riesgo quirúrgico, como es el caso de nuestro estudio, lo que supone una falta de validez externa. Por este motivo, Poeran et al.24 llevaron a cabo un análisis retrospectivo donde se comparó el perfil de seguridad del TXA en 872.416 pacientes intervenidos de prótesis de rodilla y cadera en 510 hospitales de los Estados Unidos. El estudio concluye que aquellos que recibieron TXA mostraron una menor tasa de complicaciones tromboembólicas (0,6% vs. 0,8%), así como una disminución de fallo renal agudo (1,2% vs. 1,6%), con una diferencia significativa. Resultado similar obtuvieron Sabbag et al.25 en su estudio, en el que observaron que la administración de TXA en los pacientes que habían presentado un episodio de tromboembolia no aumentaba el riesgo de volver a presentar un nuevo episodio cuando eran tratados mediante una cirugía protésica de rodilla. En 2020, Porter et al.26 analizan también el perfil de seguridad del fármaco en 22.491 pacientes intervenidos de cirugía protésica de rodilla. Del total de pacientes, 5.501 presentaban un perfil de alto riesgo tromboembólico (trombosis venosa profunda, tromboembolia pulmonar, infarto de miocardio, accidente cerebrovascular, fibrilación auricular, bypass coronario, stents cardiacos). Se administró TXA aproximadamente en un 50% de estos pacientes sin encontrar una mayor incidencia de eventos tromboembólicos. La importancia de este último artículo es mayor, ya que refleja los resultados de la práctica clínica habitual, aumentando por tanto su validez externa.
Entre las limitaciones de nuestro estudio, encontramos que la muestra puede no ser representativa de la población general ya que se ha realizado en condiciones ideales, lo que disminuye la validez externa del mismo. Por otro lado, la participación de hasta 4cirujanos puede haber afectado a los resultados de pérdida sanguínea. Y, por último, cabe mencionar que los pacientes se han beneficiado de un seguimiento más estrecho, lo que puede haber condicionado el inicio de la bipedestación y el tiempo de ingreso.
ConclusionesLa administración tópica de 3 g de TXA en una única dosis ha demostrado ser segura y eficaz en nuestra población.
Consideramos que la tasa de transfusión sanguínea depende en mayor medida de una técnica depurada más que de la administración del fármaco.
Futuras líneas de investigación podrían estar enfocadas a realizar ensayos clínicos con mayor validez externa ya que se tiene más información acerca del perfil de seguridad del TXA. También consideramos que futuros estudios comparativos podrían estar enfocados en torno a variables funcionales como objetivo principal.
Código de protocolo: FPS-TRA-2017-02.
N.° EUDRACT: 2017-002480-17.
Clinicaltrials identifier: NCT03386656.
Nivel de evidenciaNivel de evidencia i.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesCada autor certifica que no tiene asociaciones comerciales que puedan suponer un conflicto de interés en relación con el documento enviado.