La artroplastia total de rodilla (ATR) es una intervención frecuente que puede asociar una pérdida hemática importante. Existen diversos métodos para tratar de evitar las transfusiones. Uno de los más destacados es el ácido tranexámico (ATX). Nuestro objetivo es analizar la eficacia en cuanto a ahorro de sangre, necesidades transfusionales, resultados funcionales y costo-efectividad tras su aplicación intraarticular (IA) en ATR.
Materiales y métodosLlevamos a cabo un estudio retrospectivo analítico de dos cohortes históricas (75 pacientes cada una) entre enero 2015 y diciembre 2016. Incluimos 150 pacientes (59,3% mujeres) con una edad media de 73,58 años. La intervención consistió en administrar 2 g de ATX IA con un tiempo de contacto de 30 min. Se recogieron datos demográficos, situación hematológica preoperatoria, datos de la cirugía, pérdida estimada de sangre total (PEST), necesidad de transfusión, resultados funcionales y análisis de costes. El nivel de significación estadística fue p ≤ 0,05.
ResultadosLa incidencia de transfusión fue de 17,33% en el grupo control y de 5,33% en el grupo del ATX (p = 0,039), con una reducción del riesgo relativo del 78,3%. La cohorte con ATX mostró una reducción en la PEST (p < 0,0005), unidades transfundidas (p = 0,019) y estancia hospitalaria (p = 0,004). También mejoraron todos los parámetros funcionales precoces, incluyendo una mejoría de 10°, tanto en la flexión como en la extensión (p < 0,0005). El empleo de ATX IA supuso un ahorro de 337,78 € por paciente.
ConclusionesEn nuestra experiencia, la administración de ATX IA en ATR es una medida costo-efectiva y eficaz desde el punto de vista del ahorro de sangre y de la mejora funcional en el postoperatorio inmediato.
Total knee arthroplasty (TKA) is a frequent intervention that can associate significant blood loss. There are several methods to avoid transfusions. One of the most relevant is tranexamic acid (TXA). Our purpose is to analyse the efficacy in terms of blood savings, transfusion needs, functional results, and cost-effectiveness of intra-articular (IA) administration in TKA.
Materials and methodsWe conducted a retrospective analysis of historical cohorts (75 patients each) between January 2015 and December 2016. We included 150 patients (59.3% women) with a mean age of 73.58 years. The intervention consisted of administering 2 g of IA TXA with a contact time of 30 minutes. Demographic data, preoperative haematological status, surgery data, estimated total blood loss (ETBL), need for transfusion, functional results, and cost analysis were collected. The level of statistical significance was p ≤ 0,05.
ResultsThe incidence of transfusion was 17.33% in the control group and 5.33% in the TXA group (p = 0.039), with a relative risk reduction of 78.3%. The TXA cohort showed a reduction in ETBL (p < 0.0005), units transfused (p = 0.019) and length of stay (p = 0.004). All early functional parameters also improved, including a 10° improvement in both flexion and extension (p < 0.0005). The use of IA TXA resulted in savings of 337.78 € per patient.
ConclusionsIn our experience, the administration of IA TXA in TKA is a cost-effective and efficient measure in terms of blood savings and immediate postoperative functional improvement.
La artroplastia total de rodilla (ATR) es una de las intervenciones más frecuentes en cirugía ortopédica1–5. A pesar de los últimos avances, se suele asociar con una pérdida de sangre considerable de hasta 2.000 mL1,5–10 y, por lo tanto, puede dar lugar a una anemia aguda en el postoperatorio con la necesidad de transfusión sanguínea. El acto transfusional puede aumentar la morbilidad (incluyendo infecciones nosocomiales de la herida quirúrgica, sobrecarga de líquidos, reacciones inmunológicas, transmisión de enfermedades infecciosas, reacción transfusional hemolítica, sepsis, lesión pulmonar aguda e incluso la muerte), el tiempo de rehabilitación y la estancia hospitalaria, así como los costes asociados a este proceso1,6–9,11–16.
El incremento de morbilidad y de complicaciones ha generado diversos programas para minimizar la transfusión de sangre alogénica. Entre ellos destacan la optimización preoperatoria de la hemoglobina (Hb) y la transfusión de sangre autóloga1,3,17,18. Desde el punto de vista de la cirugía, se puede reducir la pérdida de sangre mediante técnicas intraoperatorias y postoperatorias como son la anestesia hipotensiva, la hemostasia exhaustiva, el uso de manguitos de isquemia, el empleo de agentes tópicos (como el ácido tranexámico o ATX, la adrenalina y otros geles y polvos hemostáticos) y de antifibrinolíticos en general, el cierre de los drenajes, los vendajes de compresión y la crioterapia1,4,6–8,14,18. La popularidad de los agentes hemostáticos se ha incrementado en los últimos años, con un aumento considerable de su uso en la práctica médica y quirúrgica habitual16,19. Uno de los agentes más empleados es el ATX (un antifibrinolítico inhibidor del activador del plasminógeno), que se usa en muchos procedimientos quirúrgicos, incluida la ATR2,6–8,13,14,18.
Numerosos metaanálisis y ensayos clínicos aleatorizados han demostrado la eficacia del ATX vía intraarticular (IA) en la reducción de pérdida de sangre postoperatoria, de volumen de drenaje articular y de la necesidad de transfusión en pacientes intervenidos de ATR1,2,5–11,14–16,19. También ha demostrado un buen perfil de seguridad sin aumentar la incidencia de complicaciones tromboembólicas o de otro tipo1,2,8,13,20.
Un aspecto menos valorado es si el ATX puede influir en los resultados funcionales postoperatorios y a corto plazo21,22. Lograr una recuperación más rápida y segura en el periodo postoperatorio es cada vez más importante en la cirugía ortopédica. El impacto que tiene la administración de ATX IA tras ATR en el sangrado postoperatorio y en la inflamación de la extremidad puede conducir a una disminución del dolor y a una mejoría clínica medible mediante los resultados funcionales en el periodo postoperatorio agudo6,21. Con este trabajo intentaremos aportar nuevos conocimientos respecto a la influencia del ATX IA sobre la funcionalidad postoperatoria inmediata tras ATR.
Además, se han sugerido algunos beneficios en los costes (por la disminución de la necesidad de transfusión y un alta hospitalaria precoz), especialmente para las instituciones con tasas de transfusión superiores al 25%14.
El objetivo del presente estudio es demostrar la efectividad del ATX vía IA en cuanto a la disminución del sangrado perioperatorio y a la mejoría sobre los resultados funcionales a corto plazo en pacientes intervenidos de ATR. Secundariamente evaluaremos el perfil de seguridad en cuanto a complicaciones y su costo-efectividad. Nuestra hipótesis es que la administración de ATX intraarticular es una medida eficaz en cuanto a la disminución del sangrado perioperatorio y a la mejoría sobre los resultados funcionales a corto plazo en pacientes intervenidos de ATR, con un perfil de seguridad y una costo-efectividad satisfactorios.
Material y métodosEstudio retrospectivo analítico de dos cohortes de pacientes intervenidos de ATR en nuestro servicio. Se incluyeron en la cohorte de control pacientes intervenidos entre enero y diciembre de 2015. En la cohorte de tratamiento se incluyeron pacientes intervenidos entre enero y diciembre de 2016, cuyo protocolo modificado incluía la aplicación de ATX IA como medida de ahorro de sangre. Dicha modificación consistió en añadir 2 g (cuatro ampollas de 500 mg) de ATX IA (Amchafibrin® 500 mg solución inyectable, Meda Pharma S.L.), una vez cerrada la herida, y a través de un drenaje tipo redón de 10 Fr, el cual permaneció cerrado durante 30 min antes de la aplicación de vacío. En ambos grupos se excluyeron las cirugías de revisión y aquellos pacientes en los que no se habían recogido todos los datos necesarios. Además, por indicación del servicio de Anestesia del grupo de tratamiento se habían excluido a los pacientes anticoagulados o con un riesgo tromboembólico severo.
En ambas cohortes se realizó la misma técnica quirúrgica que consistió en una ATR reglada mediante abordaje parapatelar medial y manguito de isquemia preventivo que se liberó después del cierre de la herida. Todas las prótesis eran posteroestabilizadas y los componentes cementados. Se utilizaron los modelos Ápex KneeTM (MBA), Attune® (DePuy Synthes) y Optetrak Logic® (Exactech). El protocolo postoperatorio también fue similar e incluyó: hemograma de control a las 24 h, retirada de drenaje a las 24 h, sedestación a las 24 h y deambulación a las 48 h, salvo contraindicación clínica (por situación médica, necesidad de transfusión, dolor mal controlado, etc.) o explícita por parte de su cirujano (en cuyo caso quedaría reflejado en la historia clínica).
En ninguno de los grupos se estableció una optimización preoperatoria desde el punto de vista del ahorro de sangre. Todos los pacientes antiagregados suprimieron la toma del mismo o lo cambiaron por ácido acetilsalicílico (AAS) 100 mg, siendo suspendido 24 h antes de la cirugía. En el caso de los pacientes anticoagulados, se siguió el protocolo establecido por el Servicio de Hematología para su sustitución por heparina de bajo peso molecular, la cual fue suspendida al menos 12 h antes de la cirugía.
Se estimó el tamaño muestral usando el programa G * Power versión 3.1.7 (Franz Faul; UniKiel, Alemania) software. Según los datos históricos de transfusión en ATR, en nuestro servicio la incidencia media de los últimos 10 años fue del 36%. Suponiendo que el ATX IA reduce al menos a la mitad la necesidad de transfusión, encontraríamos una incidencia en ese grupo del 18%. Asumiendo estos datos, con un nivel α para dos colas = 0,05 y una potencia 1-β = 0,80, necesitamos 150 casos (75 en el grupo sin tratamiento y 75 en el grupo con ATX IA), los cuales obtuvimos mediante un muestreo aleatorio simple consecutivo de la base de datos de ATR de los años 2015 y 2016.
En todos los pacientes se recogieron datos demográficos y de salud (edad, sexo, índice de masa corporal [IMC], riesgo anestésico de la American Society of Anesthesiologists [ASA]), antecedentes hematológicos (trastornos de la coagulación, eventos trombóticos, fármacos), hemograma preoperatorio (Hb, hematocrito [Hto], International Normalized Ratio [INR], plaquetas y tiempo de tromboplastina parcial activado [TTPA]), los relativos a la intervención quirúrgica (cirugía navegada o convencional, tipo de anestesia, etc.), hemograma de control a las 24 h, débito de drenaje a las 24 h, PEST, complicaciones intrahospitalarias tanto locales como generales (incluyendo anemia postoperatoria, delirium, fiebre, flictenas, síncope e íleo paralítico), número de unidades transfundidas (de acuerdo con el evolutivo recogido en la historia clínica de los pacientes), resultados funcionales a corto plazo (inicio de sedestación y deambulación, balance articular medido previamente al alta hospitalaria, en grados con goniómetro Baseline HiRes 8” y a pie de cama por el facultativo correspondiente) y estancia hospitalaria. Se establecieron como criterios de alta hospitalaria los siguientes: buen estado general, afebril, estable hemodinámicamente, dolor controlado con analgesia pautada, exploración neurovascular distal satisfactoria, sin signos de trombosis venosa o tromboembolismo, buen aspecto de la herida quirúrgica, tolerancia de sedestación y deambulación asistida con andador o bastones ingleses.
Se han descrito diferentes métodos para calcular la PEST tras ATR, encontrando grandes diferencias en los resultados obtenidos. Según el estudio de Gao et al.23, el método más fiable para calcular la PEST tras esta cirugía es el balance de hemoglobina (Hb balance), descrito en el trabajo de Good et al.24, el cual incluye la fórmula descrita por Nadler et al.25 para calcular el volumen sanguíneo (BV) preoperatorio (fig. 1).
Las indicaciones de transfusión se basaron en un criterio restrictivo de transfusión, es decir, anemia aguda sintomática, o bien Hb < 8 g/dL en pacientes sin patología previa o Hb < 10 g/dL en pacientes con antecedentes cardiovasculares o neurológicos siguiendo las recomendaciones del consenso de Sevilla26.
Por último, se llevó a cabo un análisis de costes globales (transfusión de sangre alogénica, ATX y estancia hospitalaria), a partir de los datos procedentes de nuestro hospital y del banco de sangre autonómico: 197 €/unidad de sangre (teniendo en cuenta exclusivamente el coste de los concentrados de hematíes), 700 €/día de estancia hospitalaria y 0,364 €/vial de ATX).
Con estas premisas, se recogieron 150 pacientes (89 mujeres o 59,3%), con una edad media de 73,58 años y un riesgo ASA ≥ III en el 42% de los pacientes. Veintiuno (14%) estaban anticoagulados o antiagregados.
El análisis estadístico se efectuó con el programa SPSS versión 20.0 (IBM Corporation, Armonk, NY, EE. UU). Se utilizó la prueba de Kolmogórov-Smirnov para valorar la normalidad la distribución de las variables (n > 30). Se comprobó la homogeneidad de las cohortes comparando las variables independientes (edad, sexo, peso, IMC, lado, tipo de implante, empleo de navegación). La descripción de las variables cualitativas se realizó mediante su distribución de frecuencias (número y porcentajes). Las variables cuantitativas se describieron mediante la media y la desviación estándar (DE). Se comprobó la homogeneidad de los dos grupos, comparando las variables independientes. Un resumen descriptivo de las principales variables de la muestra y de su homogeneidad intercohortes puede verse en las tablas 1 y 2. Para el contraste de hipótesis en el caso de las variables cualitativas, se realizó el test de χ2 y/o la prueba exacta de Fisher, llevando a cabo la corrección de Yates cuando fue necesario. En el caso de las variables cuantitativas, se llevó a cabo la prueba t de Student o U de Mann-Whitney si la variable no seguía una distribución normal. En cuanto al acto transfusional, se valoraron los factores predisponentes mediante un análisis univariante de la muestra global, incluyendo variables sociodemográficas (edad, sexo, peso, IMC, riesgo ASA, empleo de anticoagulantes orales o ACO) analíticas (Hb, Hto, plaquetas, INR y TTPA) y perioperatorias (tipo de anestesia, débito de drenaje). En último lugar se calculó la odds ratio (OR), la reducción de riesgo relativo (RRR), la reducción de riesgo absoluto (RRA) y el número necesario a tratar (NNT).
Análisis cualitativo de la muestra
| Control frecuencia/% | ATX frecuencia/% | P | |
|---|---|---|---|
| Sexo | |||
| Mujer | 39/52% | 50/66,6% | p = 0,069 |
| Varón | 36/48% | 25/33,3% | |
| Anticoagulación previa | |||
| Sí | 8/10,6% | 0 | p = 0,006 |
| No | 67/89,3% | 75/100% | |
| Antiagregación previa | |||
| AAS 100 | 5/6,66% | 1/1,33% | p = 0,062 |
| AAS 300 | 1/1,33% | 0 | |
| Clopidogrel | 5/6,66% | 1/1,33% | |
| No | 64/85,3% | 73/97,3% | |
| INR rango analítico (0,8-1,2) | |||
| Sí | 73/97,3% | 75/100% | p = 0,245 |
| No | 2/2,7% | 0 | |
| Plaquetas rango analítico (150-400 mil/mm3) | |||
| Sí | 72/96% | 72/96% | p = 1 |
| No | 3/4% | 3/4% | |
| Trastorno coagulación | |||
| Trombofilia | 0 | 1/1,33% | p = 1 |
| Déficit factor VII | 1/1,33% | 0 | |
| No | 74/98,6% | 74/98,6% | |
| Anestesia | |||
| General | 6 | 3 | p = 0,492 |
| Intradural | 69 | 72 | |
| Cirugía | |||
| Convencional | 56 | 56 | p = 1 |
| Navegada | 19 | 19 | |
ATX: ácido tranexámico; INR: International Normalized Ratio; AAS: ácido acetilsalicílico.
Análisis cuantitativo de la muestra
| Control Media/DE | ATX Media/DE | p | |
|---|---|---|---|
| Edad (años) | 72,98/8,57 | 74,16/7,43 | p = 0,656 |
| IMC (kg/m2) | 30,64/4,99 | 30,84/3,77 | p = 0,438 |
| Hb previa (g/dL) | 14,77/1,25 | 14,64/1,65 | p = 0,579 |
| Hto previo (%) | 43,94/3,61 | 43,45/5,2 | p = 0,501 |
| TTPA (seg) | 35,20/18,24 | 32,39/2,90 | p = 0,189 |
ATX: ácido tranexámico; IMC: índice de masa corporal; Hb: hemoglobina; Hto: hematocrito; TTPA: tiempo de tromboplastina parcial activado; DE: desviación estándar.
Al analizar ambas cohortes no observamos diferencias en cuanto a los parámetros sociodemográficos principales, valores analíticos preoperatorios, empleo de antiagregantes, tipo de anestesia o cirugía (p n.s). Sí se objetivó una mayor toma previa de ACO en el grupo control (p = 0,006) (tablas 1 y 2).
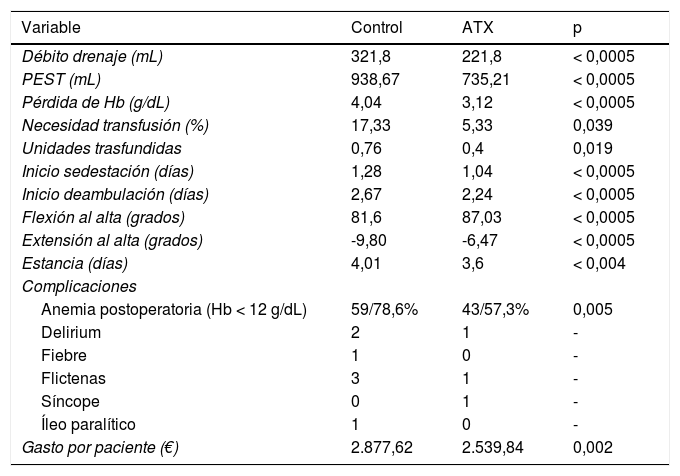
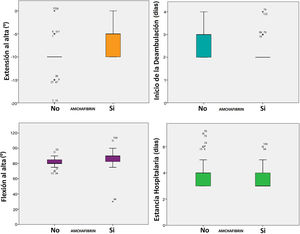
La administración de ATX IA produjo una reducción del débito de drenaje (321,8 vs. 221,8 mL, p < 0,0005), PEST (938,67 vs. 735,21 mL, p < 0,0005) y pérdida de Hb (4,04 vs. 3,12 g/dL, p < 0,0005), incrementando levemente el tiempo quirúrgico (75 vs. 82 min, p = 0,016). La incidencia de transfusión fue del 17,33% en el grupo control y de 5,33% en el grupo del ATX (p = 0,039), descendiendo el número de unidades transfundidas de forma significativa (p = 0,019). Secundariamente mejoró la evolución de los pacientes disminuyendo el inicio de la sedestación (de 1,28 a 1,04 días; p < 0,0005) y de la deambulación (de 2,67 a 2,24 días; p < 0,0005), lo que posibilitó una reducción de la estancia hospitalaria en una mediana de un día (p < 0,0005).
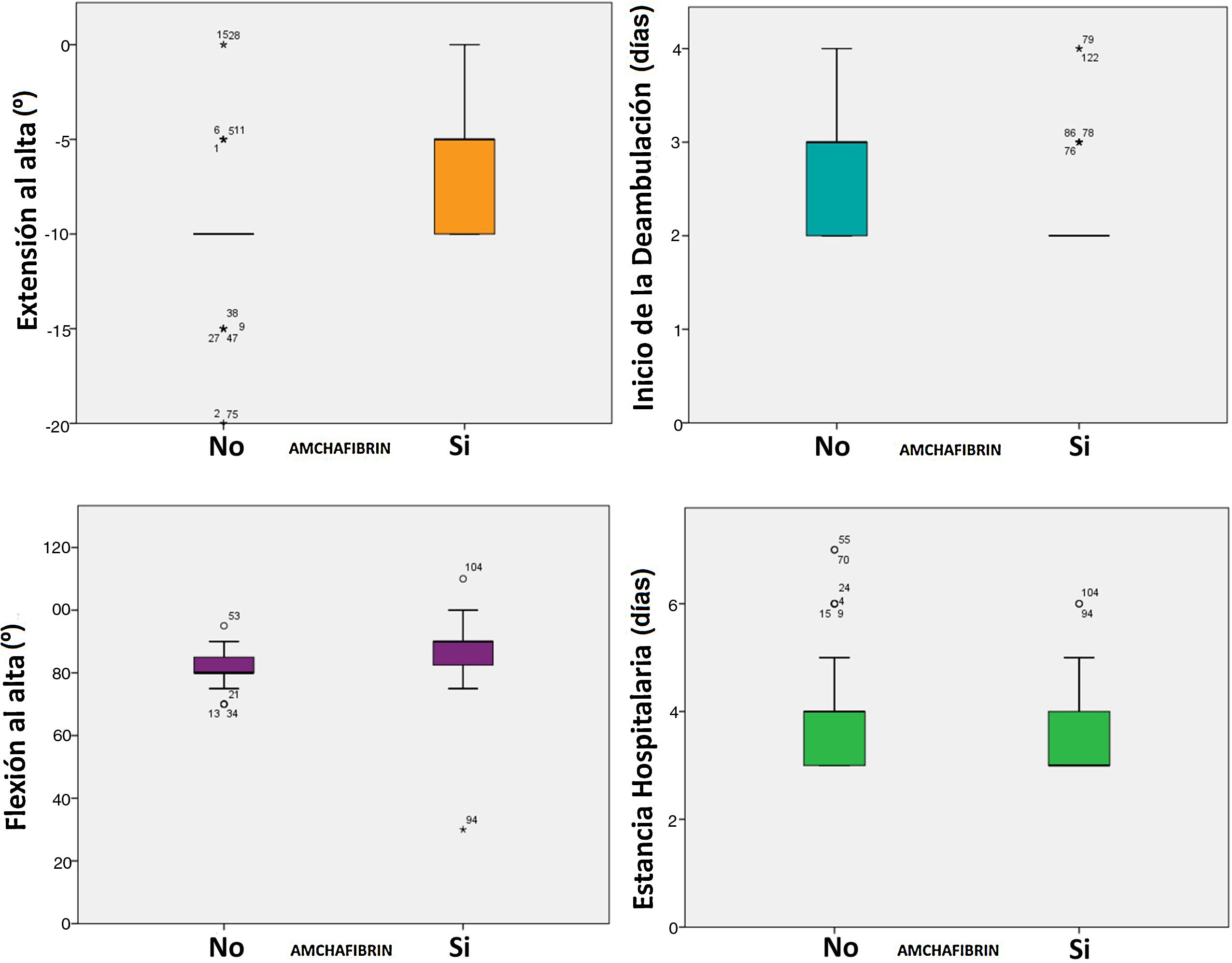
También mejoró significativamente todos los parámetros precoces de función, la flexión en una mediana de 10° (85 vs. 95, p < 0,0005) y la extensión en una mediana de 10° (-10 vs. 0°, p < 0,0005). La tasa de complicaciones fue del 25,33% en el grupo control y del 12% en el grupo del ATX (p = 0,036). No se registró ningún evento tromboembólico (tabla 3, fig. 2).
Contraste de hipótesis. Resultados de la administración de ATX IA
| Variable | Control | ATX | p |
|---|---|---|---|
| Débito drenaje (mL) | 321,8 | 221,8 | < 0,0005 |
| PEST (mL) | 938,67 | 735,21 | < 0,0005 |
| Pérdida de Hb (g/dL) | 4,04 | 3,12 | < 0,0005 |
| Necesidad transfusión (%) | 17,33 | 5,33 | 0,039 |
| Unidades trasfundidas | 0,76 | 0,4 | 0,019 |
| Inicio sedestación (días) | 1,28 | 1,04 | < 0,0005 |
| Inicio deambulación (días) | 2,67 | 2,24 | < 0,0005 |
| Flexión al alta (grados) | 81,6 | 87,03 | < 0,0005 |
| Extensión al alta (grados) | -9,80 | -6,47 | < 0,0005 |
| Estancia (días) | 4,01 | 3,6 | < 0,004 |
| Complicaciones | |||
| Anemia postoperatoria (Hb < 12 g/dL) | 59/78,6% | 43/57,3% | 0,005 |
| Delirium | 2 | 1 | - |
| Fiebre | 1 | 0 | - |
| Flictenas | 3 | 1 | - |
| Síncope | 0 | 1 | - |
| Íleo paralítico | 1 | 0 | - |
| Gasto por paciente (€) | 2.877,62 | 2.539,84 | 0,002 |
ATX: ácido tranexámico; PEST: pérdida estimada de sangre total; Hb: hemoglobina.
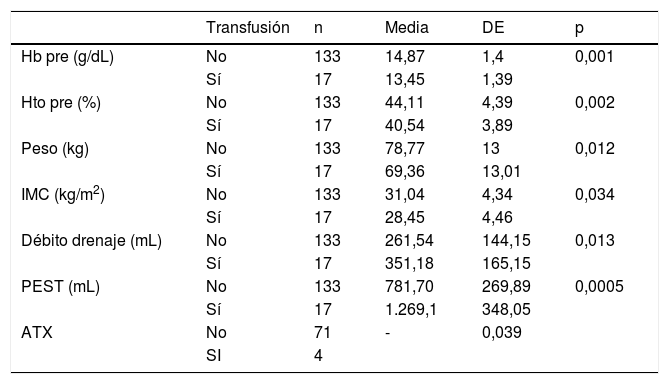
Analizando los factores asociados con la transfusión, podemos destacar un incremento de la misma en pacientes con un menor IMC, una menor Hb y Hto previos, un mayor débito de drenaje y una mayor PEST, que se consideraron factores de riesgo (tabla 4).
Determinantes de transfusión
| Transfusión | n | Media | DE | p | |
|---|---|---|---|---|---|
| Hb pre (g/dL) | No | 133 | 14,87 | 1,4 | 0,001 |
| Sí | 17 | 13,45 | 1,39 | ||
| Hto pre (%) | No | 133 | 44,11 | 4,39 | 0,002 |
| Sí | 17 | 40,54 | 3,89 | ||
| Peso (kg) | No | 133 | 78,77 | 13 | 0,012 |
| Sí | 17 | 69,36 | 13,01 | ||
| IMC (kg/m2) | No | 133 | 31,04 | 4,34 | 0,034 |
| Sí | 17 | 28,45 | 4,46 | ||
| Débito drenaje (mL) | No | 133 | 261,54 | 144,15 | 0,013 |
| Sí | 17 | 351,18 | 165,15 | ||
| PEST (mL) | No | 133 | 781,70 | 269,89 | 0,0005 |
| Sí | 17 | 1.269,1 | 348,05 | ||
| ATX | No | 71 | - | 0,039 | |
| SI | 4 |
Hb: hemoglobina; Hto: hematocrito; IMC: índice de masa corporal; PEST: pérdida estimada de sangre total; ATX: ácido tranexámico; DE: desviación estándar.
El ATX IA resultó ser un factor protector de complicaciones en general (OR = 0,402; IC 0,168-0,959) y de transfusión (OR = 0,269; IC 0,083-0,867). Para la transfusión se obtuvo una RRA del 15%, una RRR del 73,8% y un NNT de 7 (necesitaríamos administrar ATX IA a siete pacientes para evitar una transfusión).
Teniendo en cuenta estos valores, el coste total por paciente en el grupo que no recibió ATX fue de 2.877,62 €. El coste total por paciente en el grupo que sí recibió ATX fue de 2.539,84 €, obteniendo una diferencia de 337,78 € por paciente (p = 0,002), sumando un ahorro total de 25.333,5 € en los 75 pacientes de la muestra.
DiscusiónDe acuerdo con los resultados de nuestro estudio, el empleo de ATX IA reduce de forma significativa el riesgo relativo de transfusión y la pérdida estimada de sangre total asociada con la ATR (p < 0,0005). Además, objetivamos una aceleración de la recuperación postoperatoria con un descenso de la estancia hospitalaria y una mejoría de los parámetros funcionales al alta. Todo ello supuso un ahorro de costes de 337,78 € por paciente.
La cantidad de sangre perdida durante un ATR tiene un amplio rango de valores atribuible a distintos factores. En cualquier caso, no es una pérdida de sangre desdeñable, encontrando cifras en la literatura de hasta 2.000 mL1,5–10,27. Se estima que la administración de ATX disminuye la pérdida de sangre postoperatoria en un 25%17,27. En nuestro estudio observamos una disminución significativa de la PEST tras la administración de ATX IA. De acuerdo con los trabajos de Alshryda et al.20 y de Wong et al.27, también se puede apreciar un aumento en las cifras de la Hb postoperatoria y una disminución del volumen de drenaje. En nuestro caso podemos apreciar también estos efectos en el grupo del ATX IA, encontrando una menor pérdida de Hb postoperatoria (22,77%). Todo ello hace del ATX un factor protector frente a la transfusión. No utilizarlo supondría un incremento de hasta seis veces en el número de unidades transfundidas12,20,21. Estos datos se reproducen en nuestra serie con un descenso de la tasa de transfusión del 12% (p = 0,039) y un descenso en el número de unidades transfundidas. Por lo tanto, podemos afirmar que la aplicación de ATX IA se ha convertido en uno de los métodos de ahorro de sangre más populares en la ATR debido a su efectividad en la reducción de la pérdida de sangre postoperatoria y a la necesidad de transfusión sanguínea sin un aumento significativo de complicaciones postoperatorias27–29. Numerosos trabajos han descartado un aumento en el riesgo de eventos tromboembólicos tras la administración de ATX IA1,2,8,13,19,20,27. En nuestro estudio no recogimos ninguna complicación de estas características.
Como podemos apreciar en la literatura, la mayoría de los estudios se centran en la eficacia del ATX desde un punto de vista del ahorro de sangre. La evidencia disponible demuestra que, independientemente de la formulación de ATX utilizada, los pacientes sometidos a ATR muestran una reducción significativa en la pérdida de sangre y en la necesidad de transfusión, en comparación con el placebo. Sin embargo, no se observa una diferencia clara entre las distintas formulaciones disponibles de administración de ATX. Además, el empleo de dosis repetidas de ATX intravenoso y oral o dosis más altas de ATX intravenoso y tópico no ha demostrado un descenso significativo de la pérdida de sangre o del riesgo de transfusión18. Un factor menos destacado en la bibliografía es si el ATX puede influir en los resultados funcionales postoperatorios y a corto plazo. Existen pocos trabajos que traten sobre los aspectos funcionales postoperatorios relacionados con la aplicación de ATX. Dentro de este pequeño grupo, la mayoría analizan la eficacia de su formulación IA3,7,22,27,28. Esto podría deberse al impacto que tiene la administración de ATX IA tras la ATR en el sangrado postoperatorio y en la inflamación de la extremidad, lo que podría conducir a una disminución del dolor y a una mejoría clínica medible mediante los resultados funcionales en el periodo postoperatorio agudo6,21. Todo ello derivaría en una recuperación precoz que puede conducir a una disminución de los costes sanitarios debido a una estancia hospitalaria más corta y a una menor necesidad de rehabilitación poshospitalaria21. Por ejemplo, en el estudio de Chimento et al.30 se encuentra una disminución de la estancia media hospitalaria (p = 0,0001) en el grupo al que se le administra ATX IA (4,7 días) respecto del grupo control (5,3 días). Nuestro estudio corrobora este hallazgo de gran importancia, con una disminución de la estancia de cuatro a 3,6 días (p = 0,004). En cuanto a los resultados funcionales, podemos observar que los resultados publicados son más heterogéneos. Estudios con un menor tamaño muestral, como los de Wong et al.27 y Georgiadis et al.7, o con bajas dosificaciones de ATX, como los de Alshryda et al.3 y Sa-Ngasoongsong et al.28, no han podido demostrar beneficios teóricos. Además, la mayoría de los estudios se centran en un periodo de tiempo comprendido entre las seis y las 18 semanas postoperatorias. Solo los estudios de Wong et al.27 (rango de movilidad) y Grosso et al.21 (deambulación) analizan variables incluidas en nuestro estudio durante el postoperatorio inmediato. Al contrario que en nuestro estudio, Wong et al.27 no encontraron diferencias en cuanto a la flexo-extensión postoperatoria. Esto puede ser debido al reducido tamaño muestral que encontramos en su estudio. Sin embargo, nuestros datos parecen corroborar la mejoría significativa en la deambulación postoperatoria tras la administración de ATX IA en ATR, tal y como podemos observar en el trabajo de Grosso et al.21. Este beneficio podría extenderse más allá del periodo de hospitalización. Serrano et al.22 reportan una mejora significativa en todas las categorías del functional Knee Society Score (fKSS) (incluyendo la deambulación) a las seis semanas postoperatorias. No ocurre lo mismo con el rango de movilidad, por lo que el beneficio del ATX IA que encontramos en nuestro estudio respecto a esta variable podría ser más limitado en el tiempo.
Múltiples factores pueden contribuir a estos hallazgos. La disminución de la anemia y sus síntomas asociados (fatiga, mareos, desorientación) y del sangrado y edema locales, y por lo tanto del dolor, permiten la recuperación de la funcionalidad de la rodilla a un ritmo más acelerado. Sin embargo, tal y como afirman Serrano et al.22 es posible que estos resultados no se extiendan más allá de las seis a ocho semanas. Es poco probable que la disminución de la anemia postoperatoria y de la inflamación de la rodilla (que generalmente se corrigen durante las primeras semanas tras la intervención) se traduzca en un mayor rendimiento a largo plazo.
Por otro lado, el uso de ATX IA ofrece una buena costo-efectividad, así como una gran facilidad de administración8,9,16,19. Tuttle et al.12 realizaron un análisis de costes basado únicamente en la reducción de la tasa de transfusión, obteniendo un ahorro de 83,73 $/paciente (76,18 €/paciente). Si excluyésemos los costes derivados de la estancia hospitalaria, obtendríamos un ahorro de 49,76 €/paciente (en nuestro estudio solo hemos tenido en cuenta el coste por unidad de sangre alogénica transfundida, sin tener en cuenta otros costes derivados del proceso de transfusión). Gillette et al.13 calcularon un ahorro medio estimado de todo el proceso de 879 $/paciente (799,7 €/paciente). Chimento et al.30 observaron que, aunque el coste de farmacia es más alto, los costes derivados del banco de sangre y de la estancia hospitalaria son significativamente menores tras la administración de ATX IA, obteniendo un ahorro de 1.521 $/paciente (1.383,78 €/paciente). En nuestro caso, el ahorro estimado ascendería a 337,78 €/paciente. Numerosos factores pueden haber contribuido a estos resultados. Además del ahorro directo que supone disminuir la tasa de transfusión, también hay que tener en cuenta el descenso de complicaciones asociadas y de pruebas de laboratorio realizadas. Una sedestación y deambulación tempranas facilitan un alta hospitalaria precoz, lo que reduce la estancia y sus costes. Tal y como afirman Gillette et al.13, estos datos adquieren mayor relevancia debido al esperado incremento en los próximos años en el número de ATR.
En cuanto a las limitaciones de nuestro estudio, en primer lugar debemos hacer referencia al diseño del mismo. Los datos se recogieron de forma retrospectiva, por lo que los investigadores no estaban cegados en cuanto al tratamiento. Si bien esto podría inducir en un sesgo en cuanto a los resultados del estudio, creemos que su posible influencia se ve limitada debido a que gran parte de los resultados se basan en datos objetivos (pérdida sanguínea, unidades transfundidas, estancia hospitalaria) y los aspectos más «subjetivos» no fueron medidos en primera persona, ya que fueron recogidos por miembros de la Unidad de Artroplastias en los años previos al estudio, según el protocolo de artroplastias vigente en la unidad.
En segundo lugar, cabe mencionar la diferencia que encontramos entre ambos grupos en cuanto a la toma de ACO. Como bien hemos comentado previamente, se excluyeron del grupo de tratamiento a los pacientes anticoagulados o con un riesgo tromboembólico severo por indicación del Servicio de Anestesia. Sin embargo, el número de pacientes con INR, TTPA y plaquetas en rango analítico normal era similar y sin diferencias significativas entre ambos grupos. Además, se controló su normalización previa a la cirugía, siguiendo las indicaciones del Servicio de Hematología, por lo que no lo consideramos un factor determinante que pueda sesgar los resultados de nuestro estudio.
Por último, la medición del rango articular podría ser susceptible de un sesgo de interpretación. Sin embargo, el goniómetro es el instrumento más utilizado para este fin y está ampliamente respaldado por la literatura, encontrando una fiabilidad intraobservador alta y una fiabilidad interobservador entre moderada y alta31.
En conclusión podemos afirmar que, en nuestra experiencia, la administración de ATX IA en ATR es una medida costo-efectiva y eficaz desde el punto de vista del ahorro de sangre y de la mejora funcional postoperatoria inmediata.
Nivel de evidenciaNivel de evidencia IV.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.