La fractura de cadera (FC) en el anciano tiene elevada prevalencia y riesgo de morbimortalidad a corto y largo plazo. Puede disminuir la esperanza de vida casi 2años y precisar asistencia socio-sanitaria permanente en uno de cada 5pacientes. Su gestión como un proceso donde prime el paciente sobre las actividades de la organización puede aportar nuevas perspectivas, herramientas de optimización y rediseño del flujo de trabajo para hacerlo más eficiente.
ObjetivoDesarrollar una guía clínica intrahospitalaria para el manejo de pacientes con FC adaptada al entorno, clara y concisa, para poder intervenir al paciente en las mejores condiciones posibles y favorecer su adecuada recuperación.
Material y métodosCuatrocientos siete pacientes divididos en 3grupos: preimplantación (conocer el alcance del problema y las áreas de mejora); implantación (tras el desarrollo de la guía de manejo) y postimplantación (valoró la implementación de esta).
ResultadosLos resultados clínicos obtenidos con la presente guía permitieron mejorar la programación quirúrgica y reducir los tiempos de demora (aumentando la proporción de pacientes intervenidos en las primeras 48h y reducir la estancia media hospitalaria en 3 días), concienciar del problema a todos los servicios implicados, mejorar el manejo de los fármacos que alteraban la hemostasia, optimizar la terapia transfusional y reducir la estancia hospitalaria y las complicaciones perioperatorias.
ConclusiónLa implantación de esta guía, con criterios globales integrados, ha logrado mejorar los resultados de este proceso y conseguido una gestión más eficiente, reduciendo el consumo de recursos y, como consecuencia, el gasto sanitario.
Hip fracture (HF) in the elderly has a high prevalence and risk of morbidity and mortality in the short and long term. It can reduce life expectancy by almost 2years, and require permanent socio-sanitary assistance in one in 5patients. Its management as a process where the patient takes priority over the activities of the organization can bring new perspectives, optimization tools and redesign of the workflow to make it more efficient.
Objectiveto develop an in-hospital clinical guide for the management of patients with HR adapted to the environment, clear and concise, to be able to intervene in the best possible conditions and favor their adequate recovery.
Material and methods407 patients divided into 3groups: pre-implementation (knowing the scope of the problem and areas for improvement); implementation (after the development of the management guide) and post-implementation (valued its implementation).
ResultsThe clinical results obtained with this guide allowed improving surgical programming and reducing delay times (increasing the proportion of patients operated in the first 48hours and reducing the average hospital stay in 3 days), raising awareness of the problem at all Services involved, improve the management of drugs that altered hemostasia, optimize transfusion therapy and reduce hospital stay and perioperative complications.
ConclusionThe implementation of this guide, with integrated global criteria, has improved the results of this process, and achieved a more efficient management, reducing the consumption of resources and as a consequence, health expenditure.
La fractura de cadera (FC), o rotura del tercio proximal del fémur desde la cabeza femoral hasta 5cm por debajo del trocánter menor, es actualmente uno de los principales problemas de salud pública de la población de mayor edad en los países desarrollados. Supone la causa más frecuente de ingreso hospitalario en los servicios de traumatología1 y la Organización Mundial de la Salud espera que su incidencia se triplique en los próximos 50 años. En 2015, según el Conjunto Mínimo Básico de Datos del Sistema Nacional de Salud (SNS), se produjeron 53.867 hospitalizaciones por FC en España, generalmente en mujeres (72,6%) y mayores de 65 años (92,6%).
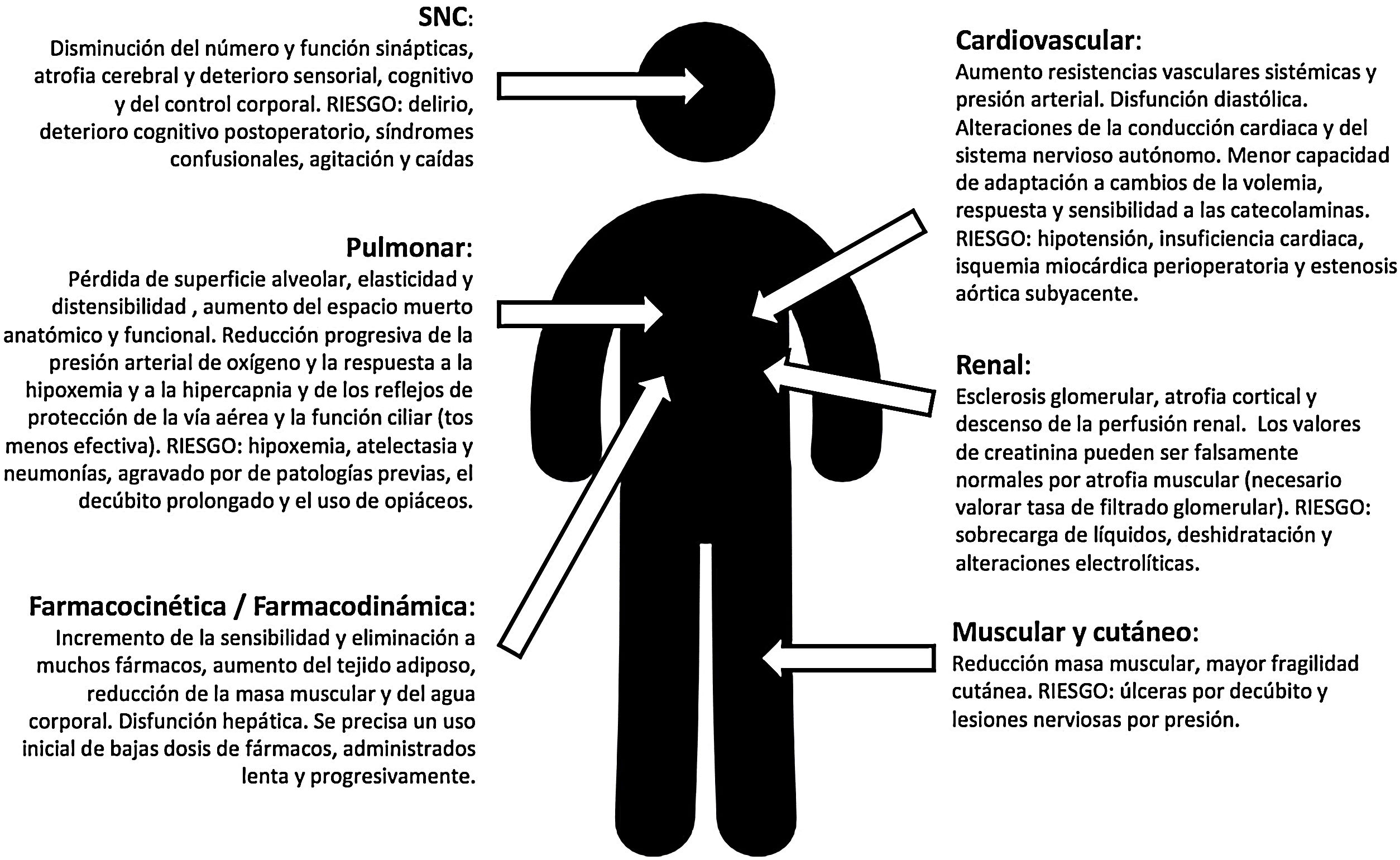
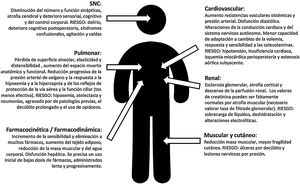
La FC (junto a las modificaciones fisiológicas de la edad (fig. 1), presenta un elevado riesgo de morbimortalidad a corto y largo plazo (reduce la esperanza de vida casi 2años), de deterioro funcional, de dependencia (uno de cada 5pacientes requerirá asistencia socio-sanitaria permanente2) y necesidad de institucionalización tras la fractura3.
La cirugía de la FC se ha incrementado en los últimos 20años, pasando de un 86% en 1997 a un 91,48% en el 2007 y actualmente es excepcional el tratamiento conservador en estas fracturas. Permite la movilización precoz, evitando el encamamiento y el riesgo de desarrollar infecciones respiratorias, urinarias, trombosis venosa profunda o úlceras de decúbito. La cirugía debe ser precoz (preferentemente antes de 48 h) tras la optimización de las condiciones médicas del paciente y el ajuste de su medicación. La demora quirúrgica se asocia a peor pronóstico y mayor mortalidad al año, a veces por falta de consenso sobre los fármacos que alteran la hemostasia o la dificultad para planificar los quirófanos.
La FC tiene además un elevado impacto económico sanitario (en España, el coste medio está entre 7.031 y 12.331 euros, dependiendo fundamentalmente de los días de ingreso hospitalario, y siendo el doble del coste medio de otras causas), al que se deben añadir los generados en el entorno del paciente y los gastos no cuantitativos derivados del cambio en el estilo de vida y la pérdida de productividad para los pacientes, sus familiares y la sociedad.
Por todo ello es necesario un protocolo de actuación entre todos los profesionales involucrados en este proceso que consiga un cuidado integral desde el ingreso hasta el alta hospitalaria, e incluso, que se mantenga una vez finalizado el proceso para dar a estos pacientes la oportunidad de mantener su calidad de vida algunos años más. Los servicios de Ortogeriatría se han consolidado como los más eficientes a la hora de tratar al paciente anciano de forma global4,5.
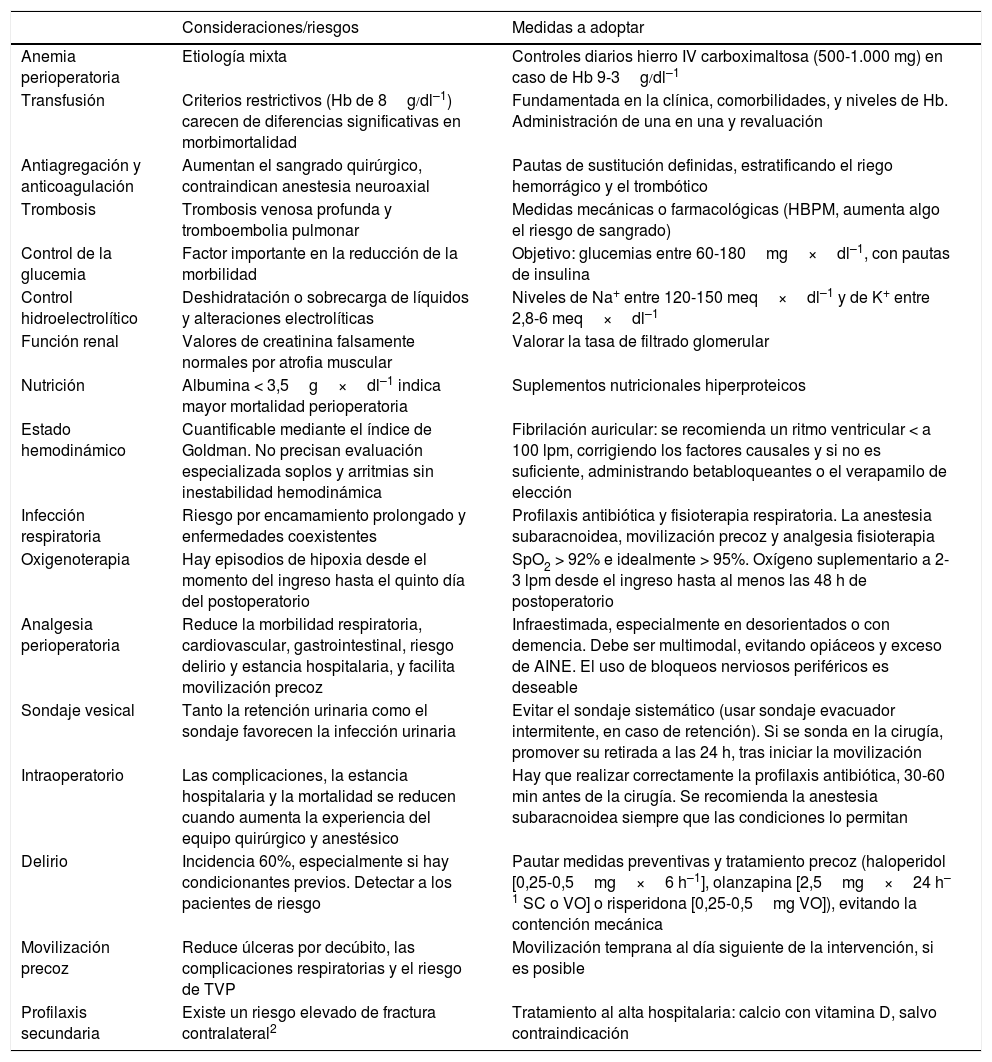
El presente artículo describe la experiencia en la implementación de una guía clínica intrahospitalaria para el manejo perioperatorio de pacientes con FC en el Hospital Puerta de Hierro Majadahonda de Madrid. En el anexo 1 se puede observar el resumen de dicha guía con los aspectos más importantes considerar para un cuidado integral del paciente con FC y las medidas a adoptar. Fue elaborada tras un análisis previo de la situación que valoró las deficiencias existentes en el proceso en nuestro entorno.
El objetivo de la guía clínica era exponer de manera clara y concisa los cuidados perioperatorios necesarios para que el paciente pudiera ser intervenido lo antes posible en las mejores condiciones con una recuperación más eficiente.
Material y métodosEstudio realizado en 3 fases tras la pertinente aprobación del Comité de Ética (Acta n.° 309, con fecha del 27 de abril del 2015) en el Hospital Universitario Puerta de Hierro Majadahonda (HUPHM), centro hospitalario de tercer nivel del Servicio Público de Salud de la Comunidad de Madrid, que cumple las normas éticas del Comité de Investigación y de la Declaración de Helsinki de 1975 con la revisión de octubre del 2013 (https://jamanetwork.com/journals/jama/fullarticle/1760318).
Criterios de inclusión: pacientes diagnosticados de FC de edad igual o mayor a 65 años, que ingresan en el servicio de Urgencias del HUPHM y son programados para intervención quirúrgica.
Criterios de exclusión: menores de 65 años, FC patológicas o periprotésicas, politraumatizados, tratamiento conservador y falta de obtención del consentimiento informado para recabar datos.
Cronograma: el estudio se dividió en 3periodos, con análisis de los datos entre periodos previo a la adopción de medidas:
Primer periodo (grupo preimplementación [PRE], n = 88): estudio retrospectivo de los pacientes intervenidos de FC en 2013, con el objetivo de conocer el alcance del problema y las posibles áreas de mejora. Con los datos obtenidos se realizó una guía clínica por los servicios de Anestesia y Traumatología, con el apoyo de Medicina Interna y Urgencias.
Segundo periodo (grupo implementación [IMPL], n = 112): estudio prospectivo de los pacientes intervenidos de FC desde febrero hasta junio del 2016 aplicando la guía desarrollada.
Tercer periodo (grupo postimplementación [POST], n = 207): estudio prospectivo que analiza el grado de cumplimiento de la guía clínica instaurada desde noviembre del 2016 hasta junio del 2017.
Se recogieron datos demográficos (edad, sexo), sociales (lugar de residencia en el momento de la FC, domicilio o residencia), de dependencia (capacidad para realizar las actividades básicas para la vida diaria sin ayuda), presencia de enfermedades coexistentes (hipertensión arterial [HTA], diabetes mellitus [DM], fibrilación auricular, insuficiencia cardiaca, enfermedad cerebrovascular [ACV]), insuficiencia respiratoria e insuficiencia renal crónica), deterioro cognitivo (información obtenida durante la anamnesis y la historia clínica), consumo crónico de antiagregantes y anticoagulantes, y los riesgos anestésico (según la clasificación de la American Society of Anesthesiologists (ASA) y cardiovascular (criterios de Goldman).
Se recopilaron datos sobre el tipo de FC (extracapsular o intracapsular), parámetros quirúrgicos (osteosíntesis con clavo intramedular, tornillos canulados o artroplastia parcial o total) y anestésicos (anestesia general [AG], anestesia regional [AR] subaracnoidea y bloqueos nerviosos femoral y femorocutáneo).
Se recogieron datos analíticos, destacando hemoglobinas (Hb) seriadas (al ingreso, a las 24 h, a las 48 h, postintervención y antes del alta hospitalaria), saturación de transferrina (considerando valores < 20% como indicativos de depósitos de hierro deplecionados), índice internacional normalizado (INR) en caso de tratamiento crónico con acenocumarol al ingreso, a las 24h y a las 48 h (para realizar una anestesia neuroaxial es necesario un INR por debajo de 1,5) y creatinina (como marcador de función renal, al ingreso, a las 48 h y antes del alta hospitalaria).
Respecto a la terapia transfusional, se registraron el número de concentrados de hematíes, el momento de administración y el umbral transfusional. También se recogió la optimización con hierro IV para la corrección de la anemia, se administró hierro carboximaltosa tanto a los pacientes anémicos (Hb al ingreso inferior a 13g/dl–1 en varones y de 12g/dl–1 en mujeres) como a los que a pesar de tener cifras de Hb en rango tenían una saturación de transferrina < 20% y vitamina K (para acelerar la corrección de los parámetros de coagulación).
Se registraron las fechas de ingreso, intervención y alta para poder calcular la demora quirúrgica (determinando si fue por causas médicas o de gestión de quirófanos), la estancia hospitalaria, el destino al alta (domicilio, residencia o centro de cuidados intermedios).
Los parámetros de morbilidad intrahospitalaria recogidos fueron el grado de anemización (valoración del descenso de las cifras de Hb con relación al tiempo y según el tipo de fractura), la alteración de la función renal (valorada por la creatinina y la urea), la morbilidad tras el alta hospitalaria (reingreso en los 3primeros meses tras la intervención) y las tasa de mortalidad intrahospitalaria, a las 6 semanas (primera revisión posquirúrgica) y a los 3 y 6 meses tras la intervención quirúrgica.
Análisis estadístico: se realizó un análisis descriptivo de las variables categóricas mediante frecuencias absolutas y relativas, y en las variables numéricas, mediante la media y desviación estándar o mediana y percentiles 25 y 75, valores mínimo y máximo, según cumplimiento de la asunción de normalidad. El análisis univariante se hizo con la prueba U Mann-Whitney o t de Student para contrastar variables numéricas y la prueba de la chi al cuadrado o el estadístico exacto de Fisher para el contraste de hipótesis de variables categóricas, según procediera. Para las comparaciones entre los 3grupos se realizó la prueba no paramétrica de Kruskall-Wallis o ANOVA de una vía, según correspondiera. Se realizó la corrección de Bonferroni para eliminar el error tipo i acumulado como consecuencia de las comparaciones múltiples y un análisis de regresión logística multivariable para evaluar la asociación entre ser transfundido, presentar anemia al ingreso y el tipo de fractura. Para evaluar factores de riesgo asociados con la mortalidad global, se llevó a cabo un análisis multivariable mediante regresión logística, representando las odds ratios (OR) y sus respectivos intervalos de confianza (IC) del 95%. El nivel de significación se ha fijado en 0,05. El paquete estadístico utilizado es Stata/IC v.14.1. (StataCorp. 2015. Stata Statistical Software: Release 14. College Station, TX, EE- UU.: StataCorp LP).
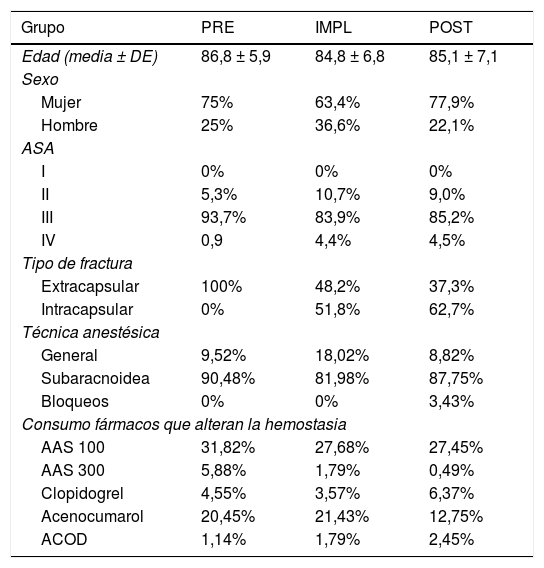
ResultadosNo hubo diferencias entre los grupos en las características demográficas (tabla 1).
Características demográficas
| Grupo | PRE | IMPL | POST |
|---|---|---|---|
| Edad (media ± DE) | 86,8 ± 5,9 | 84,8 ± 6,8 | 85,1 ± 7,1 |
| Sexo | |||
| Mujer | 75% | 63,4% | 77,9% |
| Hombre | 25% | 36,6% | 22,1% |
| ASA | |||
| I | 0% | 0% | 0% |
| II | 5,3% | 10,7% | 9,0% |
| III | 93,7% | 83,9% | 85,2% |
| IV | 0,9 | 4,4% | 4,5% |
| Tipo de fractura | |||
| Extracapsular | 100% | 48,2% | 37,3% |
| Intracapsular | 0% | 51,8% | 62,7% |
| Técnica anestésica | |||
| General | 9,52% | 18,02% | 8,82% |
| Subaracnoidea | 90,48% | 81,98% | 87,75% |
| Bloqueos | 0% | 0% | 3,43% |
| Consumo fármacos que alteran la hemostasia | |||
| AAS 100 | 31,82% | 27,68% | 27,45% |
| AAS 300 | 5,88% | 1,79% | 0,49% |
| Clopidogrel | 4,55% | 3,57% | 6,37% |
| Acenocumarol | 20,45% | 21,43% | 12,75% |
| ACOD | 1,14% | 1,79% | 2,45% |
AAS: ácido acetilsalicílico; ASA: clasificación de riesgo anestésico.
Sin diferencias estadísticamente significativas entre los grupos en edad, sexo o grado ASA.
En el PRE todas las fracturas fueron extracapsulares, debido al código utilizado para localizar las historias clínicas (esta parte del estudio se realizó retrospectivamente).
Unidad de edad: años.
Sin diferencias estadísticamente significativas entre los grupos en la distribución o en el porcentaje de los fármacos antiagregantes (p = 0,165) o anticoagulantes (p = 0,318) consumidos.
ACOD: anticoagulantes orales de acción directa.
La distribución de las enfermedades médicas es la típica en los pacientes de edad avanzada (mediana de edad de 88 años (PRE) y 86 (IMPL y POST), con un 25% mayor de 90 años y solo un 25% por debajo de los 80 años). Las más frecuentes fueron: HTA, DM y las alteraciones del ritmo cardiaco, seguidas de insuficiencia cardiaca, ACV y la enfermedad respiratoria crónica.
El 35% de los pacientes tenían 2 o más factores de riesgo cardiovascular (clase ii-iii de los criterios de Goldman de riesgo cardiovascular en cirugía no cardiaca), que implicaba un riesgo de muerte de origen cardiaco del 1-2% y de complicaciones graves de origen cardiaco entre el 3-10%.
El 51,14% de los pacientes estaban institucionalizados antes de su ingreso por FC, el 57,5% necesitaba algún tipo de ayuda para la realización de las actividades básicas para la vida diaria y el 40,8% presentaba algún grado de deterioro cognitivo.
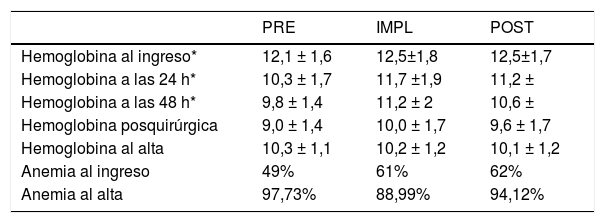
La anemia al ingreso (tabla 2) fue un factor condicionante de transfusión (tabla 3) en los grupos IMPL y POST, no así en el PRE (p = 0,218), debido probablemente al porcentaje tan elevado de pacientes transfundidos.
Anemia perioperatoria
| PRE | IMPL | POST | |
|---|---|---|---|
| Hemoglobina al ingreso* | 12,1 ± 1,6 | 12,5±1,8 | 12,5±1,7 |
| Hemoglobina a las 24 h* | 10,3 ± 1,7 | 11,7 ±1,9 | 11,2 ± |
| Hemoglobina a las 48 h* | 9,8 ± 1,4 | 11,2 ± 2 | 10,6 ± |
| Hemoglobina posquirúrgica | 9,0 ± 1,4 | 10,0 ± 1,7 | 9,6 ± 1,7 |
| Hemoglobina al alta | 10,3 ± 1,1 | 10,2 ± 1,2 | 10,1 ± 1,2 |
| Anemia al ingreso | 49% | 61% | 62% |
| Anemia al alta | 97,73% | 88,99% | 94,12% |
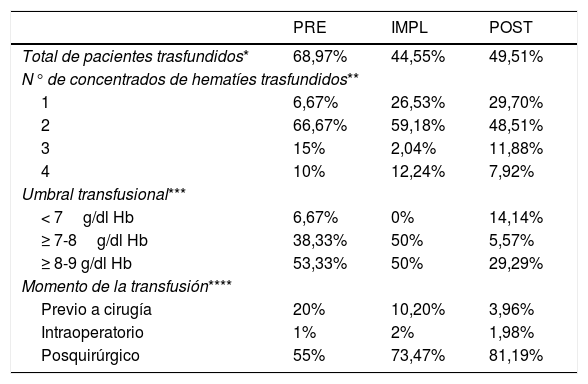
Terapia transfusional
| PRE | IMPL | POST | |
|---|---|---|---|
| Total de pacientes trasfundidos* | 68,97% | 44,55% | 49,51% |
| N° de concentrados de hematíes trasfundidos** | |||
| 1 | 6,67% | 26,53% | 29,70% |
| 2 | 66,67% | 59,18% | 48,51% |
| 3 | 15% | 2,04% | 11,88% |
| 4 | 10% | 12,24% | 7,92% |
| Umbral transfusional*** | |||
| < 7g/dl Hb | 6,67% | 0% | 14,14% |
| ≥ 7-8g/dl Hb | 38,33% | 50% | 5,57% |
| ≥ 8-9 g/dl Hb | 53,33% | 50% | 29,29% |
| Momento de la transfusión**** | |||
| Previo a cirugía | 20% | 10,20% | 3,96% |
| Intraoperatorio | 1% | 2% | 1,98% |
| Posquirúrgico | 55% | 73,47% | 81,19% |
En el IMPL hubo diferencias tanto para las fracturas extracapsulares (p = 0,008) como para las intracapsulares (p = 0,001), con un 48% menos de riesgo de transfusión respecto al PRE (OR 0,52; IC del 95%, 0,28-0,98; p = 0,045). En el POST hubo diferencias para las fracturas intracapsulares (p = 0,042), no así en las extracapsulares (p = 0,053), aunque en ambos casos se transfunde menos que en los 2grupos anteriores, con un riesgo de transfusión respecto al PRE un 42% menor (OR 0,58; IC del 95%, 0,33-1,01; p = 0,055). En todos los grupos, el hecho de que la FC sea extracapsular multiplica por 2,08 veces el riesgo de transfusión respecto a la fractura intracapsular.
Se observó un déficit de hierro (saturación de transferrina < 20%) tanto en los pacientes con anemia al ingreso (81,65%) como aquellos con Hb en rango normal (80,89%), sin diferencias entre los grupos (p = 0,876), La administración de hierro no influyó en la tasa de transfusión (p > 0,9), pero sí en el número de bolsas transfundidas, con una disminución del riesgo del 64% de tener que transfundirse un segundo concentrado de hematíes respecto a los pacientes a los que no se les administró el hierro (OR = 0,36, IC del 95%, 0,15-0,84; p = 0,018).
La implementación de la guía clínica supuso cambios en la forma de transfundir (tabla 3), tanto en el umbral transfusional, como en el número de concentrados de hematíes transfundido.
Al realizar un análisis multivariable de predictores de mortalidad, se observó que solo la edad (p < 0,001) era un indicador de riesgo, con una OR de 1,11 (IC del 95%, 1,05-1,19). No resultaron ser indicadores de riesgo el sexo (p = 0,369), la cifra de Hb al ingreso (p = 0,369), la transfusión (p = 0,136), la procedencia del paciente (p = 0,105), la cirugía antes de 48 h (p = 0,977), la técnica anestésica (p = 0,867), el uso de antiagregantes (p = 0,807) o el de anticoagulantes (p = 0,68).
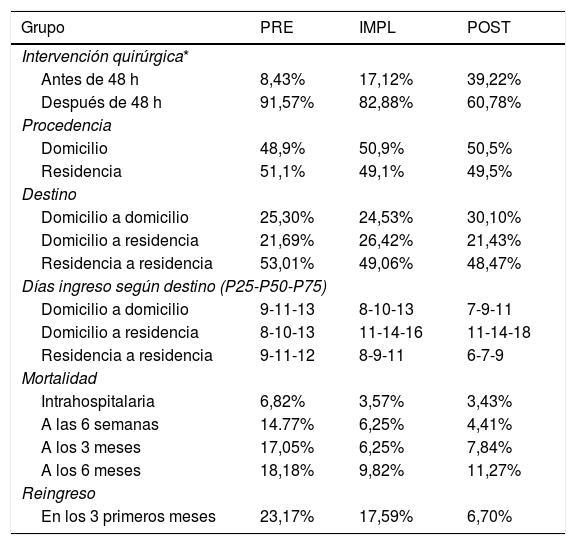
En cuanto a la demora quirúrgica (tabla 4), existe un aumento de la mortalidad en los pacientes intervenidos tras las primeras 48 h del ingreso; sin embargo, este dato no es estadísticamente significativo (p = 0,4). En el PRE la demora quirúrgica era de 6 días y una cuarta parte de los pacientes se intervenía con una demora > 7 días. En el IMPL la demora se redujo a 4 días y en el POST. a 3 días. Durante el estudio se ha conseguido reducir a la mitad la demora en la intervención quirúrgica. La proporción de los pacientes intervenidos en las primeras 48 h en el PRE está por debajo del 10%; sin embargo, en el POST se aproxima al 40%.
Datos de gestión relativos a la cirugía de fractura de cadera
| Grupo | PRE | IMPL | POST |
|---|---|---|---|
| Intervención quirúrgica* | |||
| Antes de 48 h | 8,43% | 17,12% | 39,22% |
| Después de 48 h | 91,57% | 82,88% | 60,78% |
| Procedencia | |||
| Domicilio | 48,9% | 50,9% | 50,5% |
| Residencia | 51,1% | 49,1% | 49,5% |
| Destino | |||
| Domicilio a domicilio | 25,30% | 24,53% | 30,10% |
| Domicilio a residencia | 21,69% | 26,42% | 21,43% |
| Residencia a residencia | 53,01% | 49,06% | 48,47% |
| Días ingreso según destino (P25-P50-P75) | |||
| Domicilio a domicilio | 9-11-13 | 8-10-13 | 7-9-11 |
| Domicilio a residencia | 8-10-13 | 11-14-16 | 11-14-18 |
| Residencia a residencia | 9-11-12 | 8-9-11 | 6-7-9 |
| Mortalidad | |||
| Intrahospitalaria | 6,82% | 3,57% | 3,43% |
| A las 6 semanas | 14.77% | 6,25% | 4,41% |
| A los 3 meses | 17,05% | 6,25% | 7,84% |
| A los 6 meses | 18,18% | 9,82% | 11,27% |
| Reingreso | |||
| En los 3 primeros meses | 23,17% | 17,59% | 6,70% |
El 20% de pacientes que vivían previamente en su domicilio intervenidos de FC precisaron ingresar en un hospital de cuidados intermedios para su recuperación funcional. Los pacientes que regresaron a su domicilio necesitaron un apoyo de los trabajadores sociales con el objetivo de adaptar su vivienda a su nueva situación, aspecto que se pudo reducir un 18,2%.
En los pacientes que estaban previamente institucionalizados se redujo la estancia hospitalaria un 36,4%, de una media de 11 días (PRE) a 7 días de ingreso (POST).
Debemos añadir que los criterios de ingreso en hospitales de media estancia en la Comunidad de Madrid cambiaron durante el estudio, determinando el aumento de un día del ingreso hospitalario en los grupos IMPL y POST, debido a la centralizaron en la gestión de estos hospitales y a la mayor burocracia administrativa. Esto influyó sobre la estancia hospitalaria, que es el mayor coste económico de la FC en su fase aguda.
Sabiendo que el coste medio diario de una cama de traumatología es de 177-199 €/día6, se disminuyó el gasto 708-796 €/día, lo que supone un ahorro en 6 meses de 144.556-164.772 €. La terapia transfusional también tiene un peso importante en el coste económico de este proceso, tanto por el número de concentrados de hematíes (se estima que cada concentrado de hematíes cuesta 243 €), como por la prolongación que supone en el ingreso hospitalario, sin contar los gastos indirectos de las complicaciones asociadas a la transfusión de hemocomponentes7. La disminución en la tasa de transfusión y el número de concentrados de hematíes transfundido alcanza un ahorro medio del 40% (42% POST [23.575,86 €]) y 38% IMPL [21.865,14 €] en el gasto relacionado a la terapia transfusional respecto al PRE [37.725,75 €]).
DiscusiónEl predominio de mujeres en nuestro estudio es equiparable a los registros nacionales o mundiales8, debido fundamentalmente a su mayor esperanza de vida9 y a la pérdida de masa ósea posmenopáusica8. La elevada tasa de pacientes institucionalizados se debe al gran número de residencias ubicadas en el área de población a estudio. Esto ayuda a explicar el alto grado de dependencia previo al ingreso, más de la mitad de los pacientes necesitaban algún tipo de ayuda para la realización de las actividades básicas de la vida diaria (57,5%) y la elevada edad de los pacientes, valores similares a los de Castilla-La Mancha (2016)2, Ávila (2015)6 o Guadalajara (2017)10; por otro lado, tiene la ventaja de poder acortar la estancia hospitalaria al facilitar el alta nuevamente a sus residencias.
Más del 80% de los pacientes se catalogaron como riesgo anestésico ASA III («riesgo importante»), no discriminando el riesgo entre los diferentes pacientes al tener la mayoría el mismo nivel, por lo que se deberían usar otras, como The Nottingham Hip Fracture Score (NHFS), que predice el riesgo de mortalidad en los primeros 30 días tras la FC11, aspecto que se ha tenido en cuenta en las revisiones sucesivas de la guía clínica.
Respecto al uso de fármacos que alteran la hemostasia, las guías de buena praxis se revisan constantemente y la guía clínica debe actualizarse, informando a todos los actores implicados en este proceso, ya que es un aspecto fundamental del adecuado manejo de los pacientes con FC.
El AAS no supone un problema en la demora quirúrgica porque se mantiene durante el ingreso de forma indefinida12.
El clopidogrel debe suspenderse para poder realizar técnicas anestésicas neuroaxiales con seguridad y, a raíz de ciertos estudios13 que demuestran mayor eficacia que el AAS, se espera que su uso se incremente en el futuro. Las recomendaciones de la Sociedad Española de Anestesiología indican que el hipotético riesgo hemorrágico producido por el mantenimiento del clopidogrel no puede justificar el retrasar la intervención hasta la desaparición de su efecto, ya que incrementa las complicaciones tromboembólicas y la mortalidad14. La Asociación de Anestesiólogos de Gran Bretaña e Irlanda recomienda no suspender el clopidogrel al ingreso, no demorar la intervención quirúrgica y no transfundir de forma profiláctica plaquetas15.
Los anticoagulantes contraindican la anestesia neuroaxial y deben suspenderse. En el caso del acenocumarol se recomienda administrar vitamina K y monitorizar el INR, ya que en 24-48 h la coagulación puede estar corregida.
Respecto a los anticoagulantes de acción directa (ACOD), las recomendaciones se realizan basándose en su farmacocinética16. El nivel plasmático desciende alrededor del 90% transcurridas 3 semividas desde que se alcanza el pico plasmático del fármaco tras su administración (36h para el apixaban, 27h el rivaroxabán y 48h el dabigatrán). El empleo de los test de coagulación para su monitorización no es adecuado, sin embargo, se deben hacer una vez cumplidos los tiempos de seguridad de retirada de estos fármacos, pues su normalidad asegura la competencia hemostática. Se recomienda17 suspender los ACOD 2 días antes de la cirugía en pacientes con función renal normal (http://qxaapp.secardiologia.es/landing/).
Los programas de optimización perioperatoria de la anemia (patient blood management [PBM]) se basan en 3 pilares: la optimización de la eritropoyesis preoperatoria, la minimización de las pérdidas sanguíneas intraoperatorias y la mejoría de la tolerancia a la anemia. El PBM tiene unos excelentes resultados en las cirugías programadas, sin embargo, en la FC la prioridad es la intervención precoz, por lo que la optimización de estos pacientes está muy limitada.
La anemia al ingreso se correlaciona con el aumento de la morbilidad, la mortalidad, la estancia hospitalaria y el riesgo de transfusión de hemocomponentes7. Nuestros datos (incidencia del 40-50%, y mayor prevalencia en mayores de 85 años) son similares a otros estudios18.
La anemia del anciano es de etiología mixta: nutricional (déficits de hierro, ácido fólico y vitamina B12) o un origen inflamatorio o por trastornos crónicos. Además, hay también ferropenia sin anemia. La guía europea de manejo de sangrado perioperatorio19 recomienda tratar el déficit de hierro mediante su administración por vía intravenosa en cirugías no demorables. Varios estudios20 han encontrado una correlación entre la administración de hierro IV y la menor necesidad de transfusión, siendo más efectivo en los pacientes con Hb > 12g/dl–1. En los estudios que se realizaron en pacientes anémicos, la tasa de transfusión se mantiene; sin embargo, disminuye el número de concentrados de hematíes transfundidos, tal y como ocurre en nuestro estudio.
El Documento de Consenso Sevilla21 sobre alternativas a la transfusión indica que, en los pacientes con FC, la administración preoperatoria de hierro IV y la aplicación de criterios restrictivos en la terapia transfusional mejoran la tasa transfusional y la morbilidad postoperatoria, especialmente en pacientes no anémicos o con fractura subcapital. Debido al déficit nutricional se recomienda administrar también vitamina B12 y ácido fólico. Hay estudios en los que se compara la administración aislada de hierro con la administración combinada con agentes estimulantes de la eritropoyesis (rHuEPO en una dosis de 40.000 UI o mitad de dosis en caso de insuficiencia renal)22. El problema es que la rHuEPO está contraindicada en pacientes con HTA no controlada, antecedentes de enfermedad tromboembólica venosa o arterial, o en aquellos que no puedan recibir tratamiento profiláctico antitrombótico, causas por las que no se ha generalizado su administración, por el alto número de comorbilidades asociadas que tienen estos pacientes.
El tercer pilar del PMB es la disminución de las pérdidas sanguíneas intraoperatorias con el tratamiento con fármacos antifibrinolíticos, como el ácido tranexámico, que ha demostrado disminuir las pérdidas sanguíneas en la cirugía ortopédica23 (utilización fuera de ficha técnica). Está contraindicado en pacientes con antecedentes de trombosis arterial, insuficiencia renal grave y antecedentes de convulsiones, y ha de ajustarse la dosis en caso de insuficiencia renal leve o moderada por el aumento del riesgo de complicaciones trombóticas. Debido a las contraindicaciones tanto del ácido tranexámico como de la eritropoyetina, en este estudio se consideró tan solo la administración de hierro IV para la optimización de la anemia. Algunos estudios recomiendan además prescribir hierro al alta para mejorar la recuperación24.
La transfusión de hemocomponentes debe ser siempre valorada individualmente, ya que aumenta la morbimortalidad, la estancia hospitalaria y el riesgo de infección, posiblemente por el efecto inmunomodulador de la misma25. La anemia al ingreso es el principal factor que incrementa el riesgo de transfusión26, aspecto también presente en nuestro estudio. También fueron factores de riesgo las FC extracapsulares (duplica el riesgo de transfusión) y la demora quirúrgica (se redujo de un 20% de pacientes trasfundidos preoperatoriamente en el PRE al 3% en el GI). El umbral transfusional se ha ido restringiendo a valores hoy día27 de Hb < 8g/dl–1. Nuestro protocolo ha reducido un 40% los pacientes transfundidos con Hb > 8g/dl–1.
En cuanto a la mortalidad, la AR fue la más habitual en los 3grupos, similar a otros estudios2,6. Es importante reseñar que no hay diferencias28 en la morbimortalidad entre la AG y la AR, siendo lo más importante mantener una adecuada estabilidad hemodinámica intraoperatoria. La demora de la cirugía tiene un mayor peso sobre la morbimortalidad que la técnica anestésica en sí18.
La tasa de mortalidad intrahospitalaria en España29 se sitúa en el 5 y el 8% (4,8% en mujeres y 8,9% en hombres). En el primer mes se considera que está entre el 6 y el 12% y al año llega al 30%. La Agencia para la Investigación y la Calidad de la Asistencia Sanitaria (AHQR) considera la mortalidad intrahospitalaria asociada a la FC como un indicador de calidad asistencial. Los factores de riesgo de mortalidad varían según los estudios (edad avanzada, el sexo masculino, paciente frágil e institucionalización29, edad y dependencia5). En nuestro estudio, solo la edad fue un factor de riesgo (una media de 5 años más en los pacientes fallecidos).
La estancia media hospitalaria de la FC en España30 es de 12-14 días y guarda relación con la demora de la intervención, la tasa de transfusión y las complicaciones perioperatorias infecciosas y cardiorrespiratorias, especialmente la insuficiencia cardiaca31. La demora en la cirugía de la FC aumenta la morbimortalidad32,33. Los factores implicados en la demora quirúrgica se pueden dividir en médicos (índice de comorbilidad de Charlson > 234, optimización del paciente, consumo de fármacos que alteran la hemostasia (nuestro factor principal de demora) y organizativos35 (día de la semana del ingreso, retrasándose la cirugía si el ingreso se producía durante el final de la semana36 (la planificación de los quirófanos es responsable de un 20% de la demora quirúrgica37). Hay variaciones entre los diferentes estudios y guías entre el periodo recomendable entre la optimización del paciente y el momento de la cirugía (de 1 a 4 días)38. La Sociedad Española de Traumatología y Cirugía Ortopédica, dentro de las recomendaciones del Ministerio de Sanidad, recomienda no demorar la cirugía más de 48 h en ausencia de contraindicación médica formal, en consonancia con las guías actuales tanto nacionales39, como internacionales40. No obstante, las últimas ediciones de las guías de Nueva Zelanda41 y de Escocia42 se plantean reducir ese tiempo a 24-36h, aunque no parece haber beneficios especialmente reseñables, tal como demuestra el Sistema de Salud Canadiense43. Nuestros resultados están lejos de estas recomendaciones, pero coinciden con la mediana obtenida en los datos del SNS en España.
Respecto a los parámetros clínicos y de intervención, la demora quirúrgica del PRE es similar a Sánchez-Hernández y Sáez-López en 20106, mientras que para el POST es menor. La estancia quirúrgica, la tasa de transfusión y la técnica anestésica utilizada no difiere mucho otros artículos publicados, no así la mortalidad en el POST (que es menor)2,6,31,35,37,44.
En el PRE la programación quirúrgica se realizaba semanalmente, con una demora de casi 6 días hasta su intervención, dependiendo del día de la semana cuando ingresaba y que aumentaba un día más de media en los pacientes antiagregados-anticoagulados y el 53% eran transfundidos con Hb > 8g/dl–1. A la luz de los datos obtenidos en el segundo periodo, se consiguió con el beneplácito de Dirección una nueva distribución de los quirófanos de Traumatología, habilitándose uno de ellos para las intervenciones de fracturas, priorizando dentro de ellas a las fracturas de cadera.
La difusión de la Guía clínica intrahospitalaria del manejo perioperatorio de los pacientes ingresados con FC se realizó para todos los servicios implicados, con la colaboración de la Dirección y buscando la colaboración del paciente mediante una hoja informativa del proceso que se entregaba a su llegada a Urgencias.
Las limitaciones del presente estudio se pueden resumir en 3: asumir el diagnóstico previo de deterioro cognitivo del paciente, no realizándose una evaluación específica al ingreso. No se recogieron datos sobre el empeoramiento del deterioro cognitivo poscirugía, determinando la poca profundidad en el análisis de la morbilidad. Respecto a las causas de mortalidad, el sistema informático solo recoge las defunciones, no la etiología de las mismas, por lo que no se pudieron analizar cuáles fueron las principales causas de mortalidad. Por último, los factores de riesgo de mortalidad no consiguieron ser estadísticamente significativos para algunas de las variables por no alcanzar un tamaño muestral suficiente. Sería recomendable realizar un estudio con un mayor número de pacientes para poder llegar a conclusiones.
Debemos indicar que, tras finalizar este estudio, se incorporó al hospital el servicio de Ortogeriatría, comenzando el tratamiento integral del paciente con FC, valorando la función cognitiva, el estado funcional, el grado de dependencia y el estado nutricional mediante escalas, para facilitar los cuidados de estos pacientes, datos que permitirán la medición de resultados.
ConclusiónLa implantación de una guía para el manejo de los pacientes con FC ha conseguido una gestión más eficiente, reduciendo el consumo de recursos y el gasto sanitario. Ha disminuido las tasas de complicaciones perioperatorias, de transfusión y de reingresos, así como los días de ingreso y la mortalidad intraoperatoria y en los primeros 6 meses. Ha optimizado la programación quirúrgica, incrementado el número de quirófanos de traumatología y reducido los tiempos de demora quirúrgica. Además, ha logrado mejorar los resultados y la comprensión de este proceso por parte del paciente y sus familiares.
Sin embargo, aún es necesario seguir trabajando para conseguir que una proporción mayor de pacientes se beneficie de la reducción en la demora quirúrgica, principalmente los pacientes que ingresan al final de la semana, donde los resultados no han sido tan satisfactorios.
Nivel de evidenciaNivel de evidencia ii.
FinanciaciónEl presente trabajo no ha sido financiado ni recibido becas o subvenciones de ningún tipo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| Consideraciones/riesgos | Medidas a adoptar | |
|---|---|---|
| Anemia perioperatoria | Etiología mixta | Controles diarios hierro IV carboximaltosa (500-1.000 mg) en caso de Hb 9-3g/dl–1 |
| Transfusión | Criterios restrictivos (Hb de 8g/dl–1) carecen de diferencias significativas en morbimortalidad | Fundamentada en la clínica, comorbilidades, y niveles de Hb. Administración de una en una y revaluación |
| Antiagregación y anticoagulación | Aumentan el sangrado quirúrgico, contraindican anestesia neuroaxial | Pautas de sustitución definidas, estratificando el riego hemorrágico y el trombótico |
| Trombosis | Trombosis venosa profunda y tromboembolia pulmonar | Medidas mecánicas o farmacológicas (HBPM, aumenta algo el riesgo de sangrado) |
| Control de la glucemia | Factor importante en la reducción de la morbilidad | Objetivo: glucemias entre 60-180mg×dl–1, con pautas de insulina |
| Control hidroelectrolítico | Deshidratación o sobrecarga de líquidos y alteraciones electrolíticas | Niveles de Na+ entre 120-150 meq×dl–1 y de K+ entre 2,8-6 meq×dl–1 |
| Función renal | Valores de creatinina falsamente normales por atrofia muscular | Valorar la tasa de filtrado glomerular |
| Nutrición | Albumina < 3,5g×dl–1 indica mayor mortalidad perioperatoria | Suplementos nutricionales hiperproteicos |
| Estado hemodinámico | Cuantificable mediante el índice de Goldman. No precisan evaluación especializada soplos y arritmias sin inestabilidad hemodinámica | Fibrilación auricular: se recomienda un ritmo ventricular < a 100 lpm, corrigiendo los factores causales y si no es suficiente, administrando betabloqueantes o el verapamilo de elección |
| Infección respiratoria | Riesgo por encamamiento prolongado y enfermedades coexistentes | Profilaxis antibiótica y fisioterapia respiratoria. La anestesia subaracnoidea, movilización precoz y analgesia fisioterapia |
| Oxigenoterapia | Hay episodios de hipoxia desde el momento del ingreso hasta el quinto día del postoperatorio | SpO2 > 92% e idealmente > 95%. Oxígeno suplementario a 2-3 lpm desde el ingreso hasta al menos las 48 h de postoperatorio |
| Analgesia perioperatoria | Reduce la morbilidad respiratoria, cardiovascular, gastrointestinal, riesgo delirio y estancia hospitalaria, y facilita movilización precoz | Infraestimada, especialmente en desorientados o con demencia. Debe ser multimodal, evitando opiáceos y exceso de AINE. El uso de bloqueos nerviosos periféricos es deseable |
| Sondaje vesical | Tanto la retención urinaria como el sondaje favorecen la infección urinaria | Evitar el sondaje sistemático (usar sondaje evacuador intermitente, en caso de retención). Si se sonda en la cirugía, promover su retirada a las 24 h, tras iniciar la movilización |
| Intraoperatorio | Las complicaciones, la estancia hospitalaria y la mortalidad se reducen cuando aumenta la experiencia del equipo quirúrgico y anestésico | Hay que realizar correctamente la profilaxis antibiótica, 30-60 min antes de la cirugía. Se recomienda la anestesia subaracnoidea siempre que las condiciones lo permitan |
| Delirio | Incidencia 60%, especialmente si hay condicionantes previos. Detectar a los pacientes de riesgo | Pautar medidas preventivas y tratamiento precoz (haloperidol [0,25-0,5mg×6 h–1], olanzapina [2,5mg×24 h–1 SC o VO] o risperidona [0,25-0,5mg VO]), evitando la contención mecánica |
| Movilización precoz | Reduce úlceras por decúbito, las complicaciones respiratorias y el riesgo de TVP | Movilización temprana al día siguiente de la intervención, si es posible |
| Profilaxis secundaria | Existe un riesgo elevado de fractura contralateral2 | Tratamiento al alta hospitalaria: calcio con vitamina D, salvo contraindicación |