Los defectos óseos del fémur distal son un problema común en la cirugía de revisión de rodilla. El problema se agrava en el contexto de una infección activa. En casos extremos, esta pérdida de hueso compromete la viabilidad de un protocolo de recambio en dos tiempos usando espaciadores dinámicos, debido a la inestabilidad inherente de estos espaciadores. El uso de un espaciador prefabricado de cadera usado de manera «inversa» con una articulación tipo ball-and-socket es una opción terapéutica en casos de defecto óseo masivo e infección.
Material y métodosSe realiza una revisión retrospectiva de nuestra base de datos institucional desde enero del 2010 hasta diciembre del 2013 para localizar todos los casos de defecto femoral distal masivo en un contexto séptico en el que esta técnica ha sido utilizada. Se recogen datos epidemiológicos, características de la infección (clínicas y microbiológicas) y eventos entre los tiempos quirúrgicos. Evaluamos como objetivo principal la tasa de erradicación de la infección tras al menos 18 meses de evolución del 2.° tiempo. También evaluamos las complicaciones relacionadas con la técnica. Finalmente cada paciente completó una escala analógica visual de dolor, y un cuestionario de satisfacción (SAPS).
ResultadosFinalmente seis pacientes cumplieron los criterios de inclusión. La mediana del defecto femoral fue de 117cm (rango: 32-191cm). El tiempo medio con espaciador fue de 7,6 meses. Entre las complicaciones relacionadas con la técnica solo tuvimos un caso de luxación del espaciador. A todos los pacientes, excepto uno, se le realizó el segundo tiempo, reconstruyendo la articulación con una megaprótesis cementada, con un seguimiento medio tras el segundo tiempo de 34,7 meses. Al final del seguimiento se controló la infección en todos los casos. Todos los pacientes manifestaron altos grados de satisfacción con la técnica empleada y un correcto control del dolor, con una media de la escala analógica visual de 1 (rango 0-4).
ConclusiónPresentamos una técnica reproducible, segura y con una baja tasa de complicaciones. Los pacientes refieren una gran satisfacción con el procedimiento y no tuvimos casos de recidiva de la infección tras un seguimiento mínimo de 18 meses.
Bone loss in the distal femur is a common problem in knee revision surgeries. The problem is exacerbated in the context of an active infection. In extreme cases this bone loss could compromise the feasibility of a two-stage exchange protocol using dynamic spacers due to the inherent instability of this type of spacers. Use of a hip prefabricated spacer in a “reverse” way forming a ball-and- socket joint is a therapeutic option in cases of massive bone defect and infection.
Material and methodsA retrospective review was performed of our institutional database to identify all cases of massive distal femoral defect in which this technique was used from January 2010 to December 2013. A record was made of the epidemiological data, characteristics of the infection (clinical and microbiological), and adverse event during the spacer stage. The main end-point was the infection eradication rate (minimum: 18 months of follow-up). The complications associated with the technique were also assessed. Finally, each patient completed a visual analogue pain scale, and a satisfaction questionnaire (SAPS).
ResultsThis technique was successfully used in six cases so far, controlling the infection in all cases. Mean femoral defect was 117cm (range: 32-191cm). Mean time with spacer was 7.6 months, with no major complications. All but one patient reached second stage reconstruction with a mega-prosthesis, and mean time since second stage was 34.7 months. All patients stated high levels of satisfaction with the technique employed, as well as and low pain scores (mean visual analogue pain scale: 1; range: 0-4).
ConclusionA reproducible and safe technique is described. Patients report a high level of satisfaction with the procedure, and there were no cases of recurrence of the infection after a minimum follow-up of 18 months.
La artroplastia total de rodilla ha sido una de las intervenciones más exitosas en la historia reciente de la cirugía ortopédica1, mejorando la calidad de vida a millones de personas. Una de las complicaciones más temidas en este procedimiento es la infección periprotésica, con tasas publicadas de infección crónica que oscilan entre el 1-15%1–4. Por diferentes razones, en los próximos años se espera que exista un crecimiento exponencial en la necesidad de implantar prótesis de rodilla y de cadera; esto, unido a la existencia de una población cada vez más longeva, hará que las necesidades de cirugías de revisión, tanto sépticas como asépticas, se incrementen enormemente5. Con cada revisión, el cirujano se enfrenta con la problemática de una menor reserva ósea y un posible incremento en las tasas de infección. La coexistencia de ambos problemas incrementará la complejidad de la revisión.
La pérdida de hueso es un problema habitual en el escenario de la infección periprotésica de rodilla6. Esta pérdida de tejido óseo se produce debido a una combinación de la infección per se (osteólisis por fagocitosis frustrada) y la cirugía previa. En los casos de múltiples intentos de recambio, el defecto óseo puede llegar a ser dramático7,8. En tales situaciones extremas, la artrodesis funcional9,10 o la amputación por encima de la rodilla podrían ser las únicas opciones válidas11.
El estándar actual de tratamiento de una infección periprotésica crónica de cadera o rodilla, con unas elevadas tasas de control de la infección1,12 es el recambio protésico en dos tiempos. El uso transitorio de un espaciador impregnado con antibiótico es un paso importante en dicho protocolo. En el caso de los denominados espaciadores articulados o dinámicos13,14, la existencia de un defecto óseo masivo someterá a dichos espaciadores a un escenario biomecánico complejo generado por la pérdida ósea masiva; estos espaciadores difícilmente serán capaces de acomodarse al defecto óseo residual13.
El objetivo del presente estudio es analizar de forma retrospectiva nuestros resultados con una técnica desarrollada en una unidad monográfica en patología séptica y reconstructiva del aparato locomotor. Esta técnica nos permite utilizar espaciadores dinámicos en casos de defecto masivo del fémur distal en un contexto séptico. Con esta técnica, además de tratar la infección, hipotetizamos que el paciente se podría beneficiar de las propiedades dinámicas de un espaciador articulado8.
Material y métodosDiseño del estudioSe realiza una revisión retrospectiva de la base de datos prospectiva de la unidad, incluyendo todos los casos sépticos con defecto femoral distal masivo (enero del 2010 hasta diciembre del 2013) en los que está técnica ha sido utilizada. Nuestro centro es un hospital universitario con más de 1.000 camas que acoge a una unidad de referencia nacional en patología séptica musculoesquelética. No se solicitó aprobación por el CEIC, ya que este estudio se llevó a cabo como parte del trabajo rutinario en nuestra unidad; los pacientes fueron estudiados de forma retrospectiva y tratados acorde a los estándares de tratamiento en nuestro centro. Todos los pacientes firmaron un consentimiento informado para el procedimiento. Se recogieron datos epidemiológicos, comorbilidades de los pacientes, características de la infección, tanto clínicas como microbiológicas, se valoró el defecto óseo femoral, los eventos adversos entre los tiempos quirúrgicos, y las características quirúrgicas del segundo tiempo. Evaluamos como objetivo principal la tasa de erradicación de la infección tras al menos 18 meses de evolución del 2.° tiempo. También evaluamos las complicaciones relacionables con la técnica quirúrgica a estudio.
DefinicionesEn esta serie solo se consideraron casos de infección periprotésica crónica o de osteomielitis crónica del fémur distal, eligiendo un criterio temporal de 4 semanas desde la implantación para diferenciar entre casos crónicos y agudos, según la clasificación de Tsukayama2.
El diagnóstico final de infección se estableció cuando el paciente cumplía al menos uno de los siguientes criterios de infección según propone la Sociedad Americana de Enfermedades Infecciosas15 (IDSA) publicada en 2013: 1) existencia de una fístula en comunicación con la articulación; 2) pus intraarticular sin otra explicación; 3) ≥ 2 cultivos positivos con el mismo microorganismo; 4) histología compatible con inflamación aguda (criterio de Feldman16).
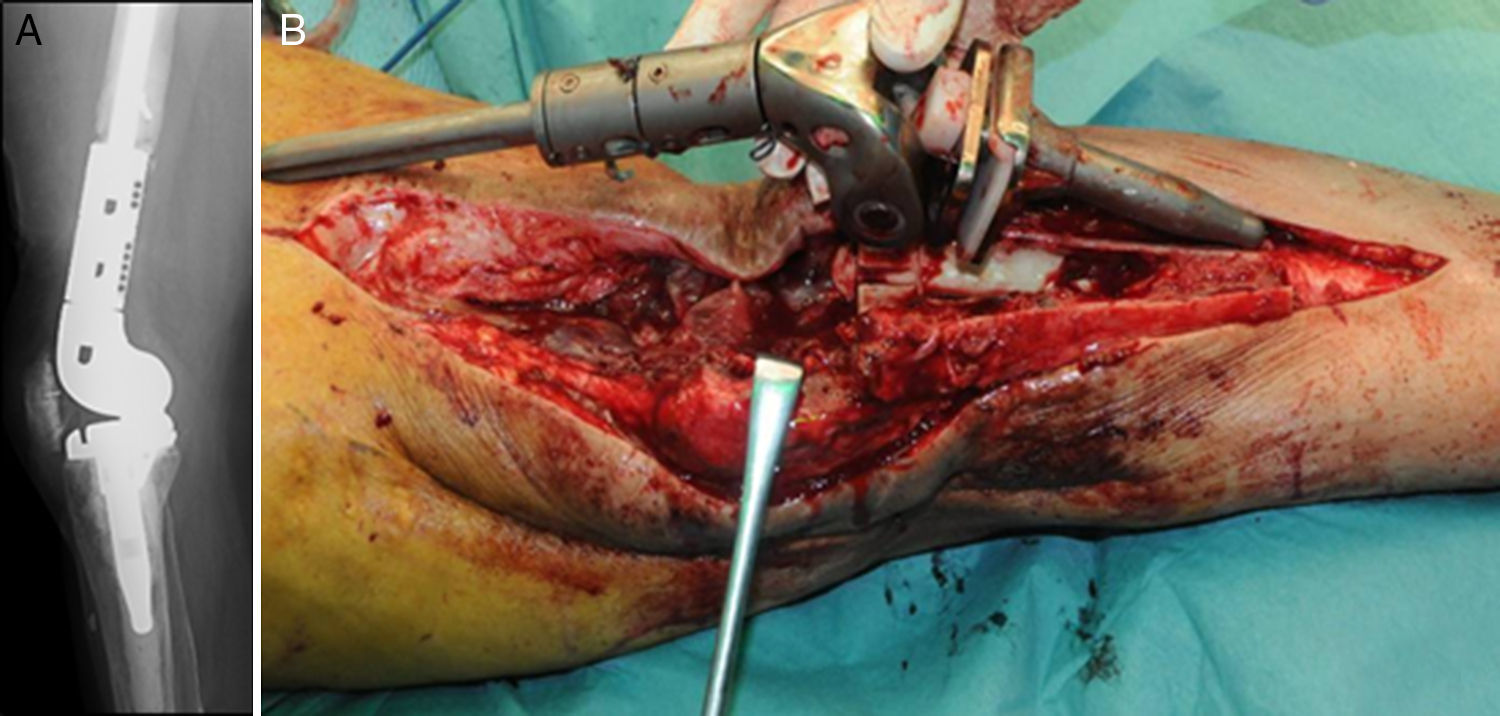
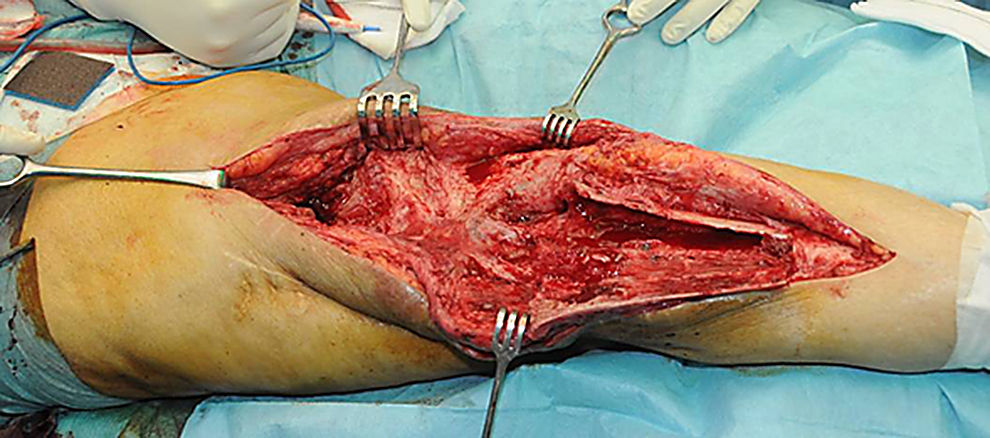
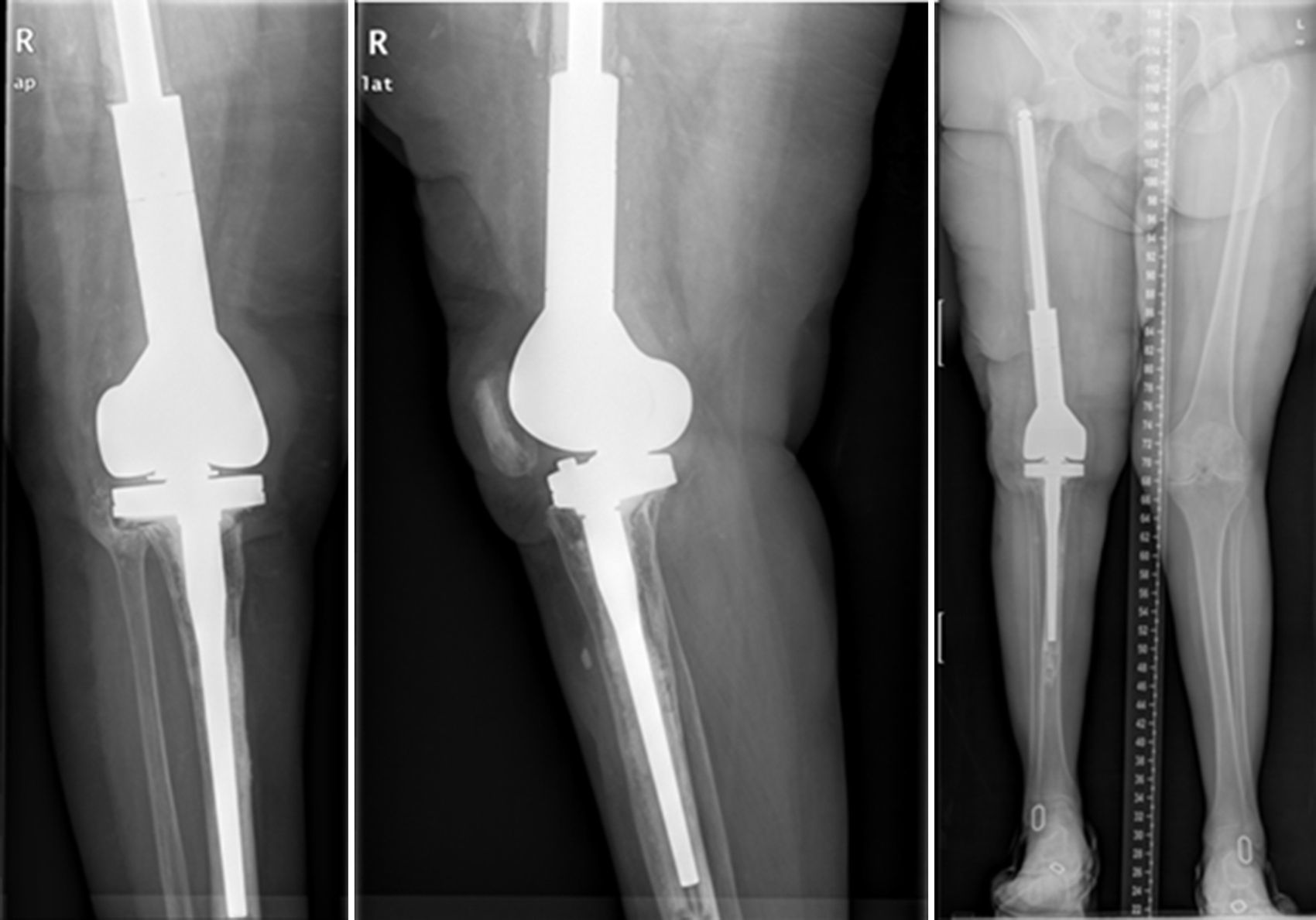
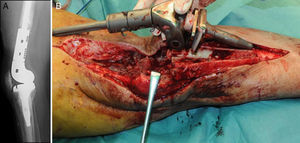
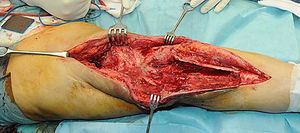
Descripción de la técnica quirúrgica a estudioLos componentes infectados se retiran de manera estándar (fig. 1A y 1B). Posteriormente se realiza un desbridamiento exhaustivo, incluyendo el canal endomedular en caso de prótesis con vástago. Antes de la administración de los antibióticos intraoperatorios, se toman al menos 6 muestras para el cultivo microbiológico. Después se realiza una irrigación a baja presión en todo el campo quirúrgico expuesto. Se evalúa el defecto óseo final tras el desbridamiento (fig. 2). En los casos que nos encontramos una pérdida extensa de fémur distal utilizamos un espaciador de cadera prefabricado (Vancogenx®, Tecres, Somatocammpagna, Italia) para construir una articulación tipo ball-and-socket. El espaciador de cadera se produce de manera industrial en fábrica, con un aspecto similar al de una hemiartroplastia de cadera fabricada con cemento acrílico impregnado con gentamicina y vancomicina. La parte interna del espaciador consiste en una varilla de acero inoxidable que proporciona estabilidad mecánica. Estos espaciadores están disponibles en 6 versiones: 3 tamaños de la cabeza (46, 54 y 60mm) con un vástago largo (275-290mm) o un vástago corto (153-168mm). Los espaciadores se impregnan con una concentración 1:1 de antibiótico, por lo que dependiendo del tamaño de la cabeza y la longitud del vástago, contendrán entre 1,1 a 3,2 g de ambos antibióticos (tabla 1). Según el defecto residual, se selecciona el tamaño del espaciador prefabricado. En la mayoría de los casos se utilizó el espaciador de cabeza pequeña (46mm). El espaciador de cadera se utiliza de manera «invertida», con la cabeza frente a la superficie de la meseta tibial remanente. La cabeza del espaciador se convierte en el componente «bola» de esta articulación ball-and-socket. Para construir el recipiente sobre la superficie de la tibia proximal, se utiliza cemento cargado con antibiótico. La mezcla se realiza sin vacío13 utilizando altas dosis de dos antibióticos termoestables sinérgicos, seleccionados según el perfil de sensibilidad antibiótica del microorganismo14. En la mayoría de los casos añadimos, por cada bolsa de cemento óseo de 40 gramos, 4 g de vancomicina en polvo y 4 g de tobramicina en polvo. En casos de infección protésica de una prótesis con vástago, el canal endomedular tibial se rellena con una barra de cemento con antibiótico hecha durante la cirugía; esto nos dará más estabilidad al espaciador y permitirá rellenar el espacio muerto del canal medular tibial.
Características clínicas y quirúrgicas de los pacientes del estudio
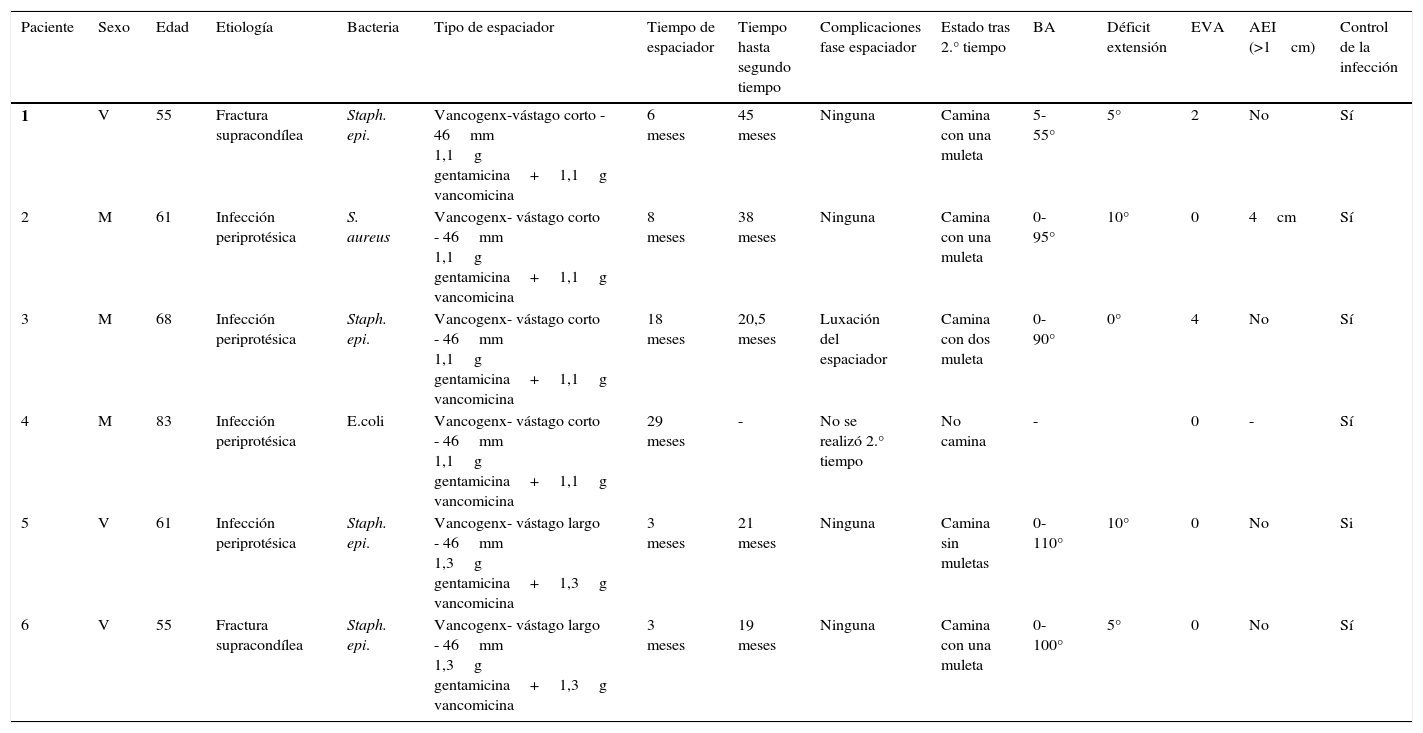
| Paciente | Sexo | Edad | Etiología | Bacteria | Tipo de espaciador | Tiempo de espaciador | Tiempo hasta segundo tiempo | Complicaciones fase espaciador | Estado tras 2.° tiempo | BA | Déficit extensión | EVA | AEI (>1cm) | Control de la infección |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | V | 55 | Fractura supracondílea | Staph. epi. | Vancogenx-vástago corto - 46mm 1,1g gentamicina+1,1g vancomicina | 6 meses | 45 meses | Ninguna | Camina con una muleta | 5-55° | 5° | 2 | No | Sí |
| 2 | M | 61 | Infección periprotésica | S. aureus | Vancogenx- vástago corto - 46mm 1,1g gentamicina+1,1g vancomicina | 8 meses | 38 meses | Ninguna | Camina con una muleta | 0-95° | 10° | 0 | 4cm | Sí |
| 3 | M | 68 | Infección periprotésica | Staph. epi. | Vancogenx- vástago corto - 46mm 1,1g gentamicina+1,1g vancomicina | 18 meses | 20,5 meses | Luxación del espaciador | Camina con dos muleta | 0-90° | 0° | 4 | No | Sí |
| 4 | M | 83 | Infección periprotésica | E.coli | Vancogenx- vástago corto - 46mm 1,1g gentamicina+1,1g vancomicina | 29 meses | - | No se realizó 2.° tiempo | No camina | - | 0 | - | Sí | |
| 5 | V | 61 | Infección periprotésica | Staph. epi. | Vancogenx- vástago largo - 46mm 1,3g gentamicina+1,3g vancomicina | 3 meses | 21 meses | Ninguna | Camina sin muletas | 0-110° | 10° | 0 | No | Si |
| 6 | V | 55 | Fractura supracondílea | Staph. epi. | Vancogenx- vástago largo - 46mm 1,3g gentamicina+1,3g vancomicina | 3 meses | 19 meses | Ninguna | Camina con una muleta | 0-100° | 5° | 0 | No | Sí |
AEI: acortamiento de la extremidad inferior; BA: balance articular; E. coli: Escherichia coli; EVA: escala visual análoga; M: mujer; S. aureus: Staphylococcus aureus; Staph. epi.: Staphylococcus epidermidis; V: varón.
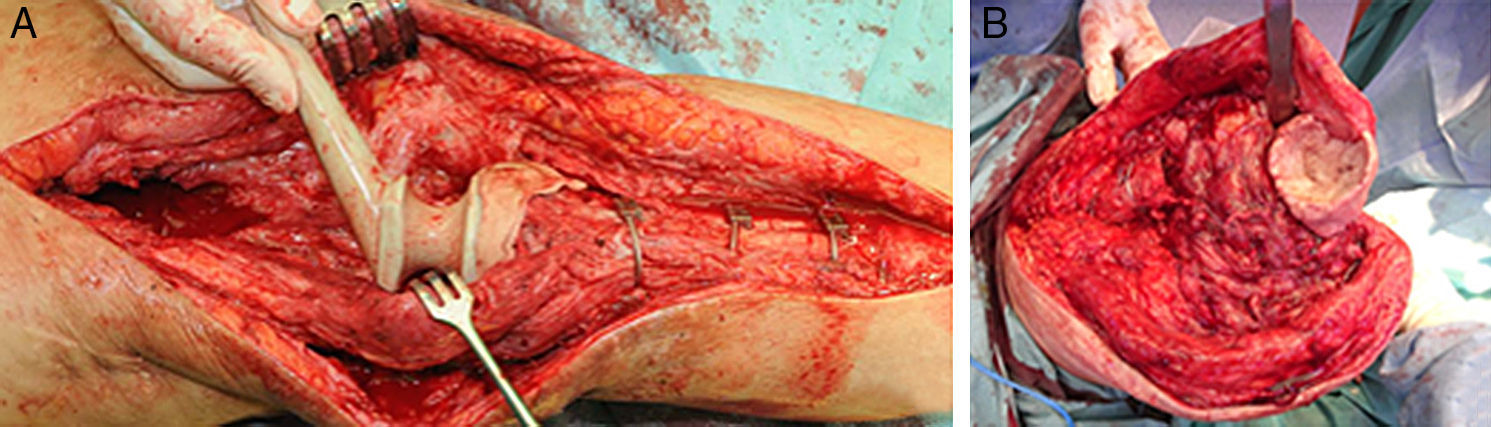
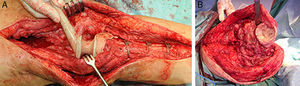
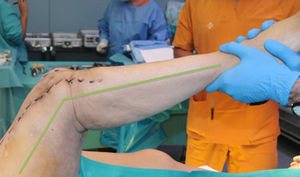
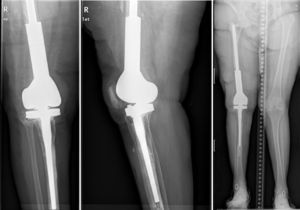
El cemento impregnado con antibiótico, en fase moldeable, se coloca alrededor y dentro del defecto tibial metafisario y unido, si lo hubiera, al vástago tibial, formando un recipiente de cemento capaz de articularse con la cabeza del espaciador. La cabeza del espaciador se utiliza como molde, para lograr una articulación congruente (fig. 3A y 3B). El vástago del espaciador de cadera se inserta en la diáfisis femoral y se cementa en su parte más distal para facilitar la retirada del espaciador en el segundo tiempo. El espaciador de cadera puede ser introducido tanto como sea necesario (fig. 4) para lograr la tensión deseada en las partes blandas y evitar el acortamiento del miembro. La parte más prominente del espaciador puede recortarse según sea necesario. Después de la polimerización del cemento, se evalúan la estabilidad y la amplitud de movimiento (fig. 5).
En el postoperatorio se utiliza una férula hasta que la herida está correctamente cicatrizada. Luego, se coloca una rodillera articulada posquirúrgica, para control del varo-valgo. La flexión de la rodilla se permite en función de la tolerancia del paciente, con un máximo de 90°. El paciente no puede cargar peso durante la etapa del espaciador pero puede caminar con muletas o caminador y realizar rehabilitación. Los pacientes son dados de alta a su domicilio con controles en consultas externas. Según nuestro protocolo14, el segundo tiempo se realiza después de un mínimo de 8 semanas con tratamiento antibiótico dirigido, bajo la supervisión de nuestros especialistas en enfermedades infecciosas, y cuando los niveles de PCR y VSG han vuelto a la normalidad tras un periodo mínimo de 2 semanas sin antibióticos.
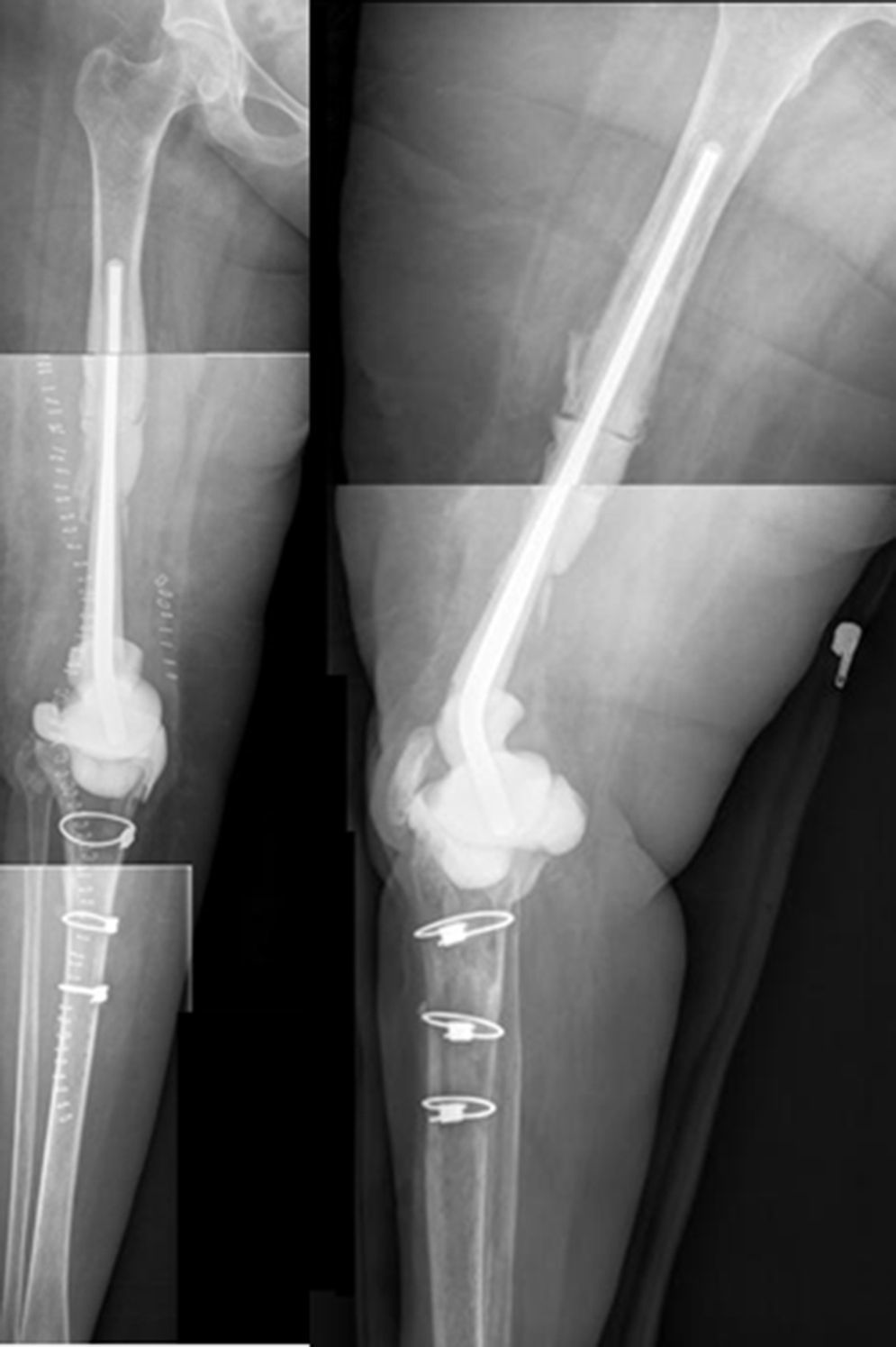
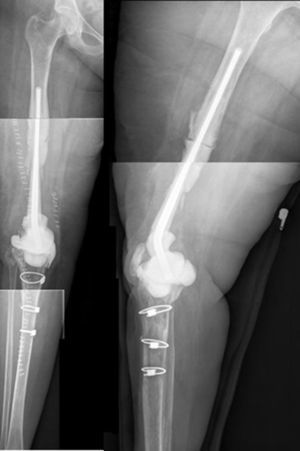
En el segundo tiempo (fig. 6) se realiza el protocolo estándar de la unidad. Utilizamos una profilaxis antibiótica dirigida, en función del patógeno previo, que se administra antes de la incisión quirúrgica. Se retiran los componentes del espaciador y se realiza un nuevo desbridamiento exhaustivo. Tras la retirada de los implantes se recogen al menos 6 muestras profundas de tejidos significativos para cultivo microbiológico. No se sonican los espaciadores retirados. El tipo de reconstrucción se elegirá en función del defecto óseo remanente, del estado de las partes blandas y del tipo de paciente. Diferentes técnicas pueden utilizarse para llevar a cabo está reconstrucción en el segundo tiempo, basados mayoritariamente el uso de megaprótesis modulares para solventar los grandes defecto óseos. En esta serie no se han usado implantes recubiertos de plata, que podría ser una opción en este tipo de pacientes multiintervenidos y donde la recidiva sería dramática. El paciente continúa con un tratamiento dirigido al patógeno previo hasta el resultado provisional de los cultivos; si estos son negativos el tratamiento se suspende a los 5-7 días con excepción de alguna infección por anaerobios.
SeguimientoEl tiempo mínimo exigido para poder incluir a los pacientes en el estudio fue de 18 meses tras el segundo tiempo. El objeto principal de estudio fue la erradicación de la infección. Para definir el éxito del tratamiento los pacientes debían cumplir los siguientes criterios, internacionalmente aceptados17: 1) erradicación de la infección caracterizada por una herida correctamente cicatrizada sin fistulización o drenaje, sin existir recurrencias de la infección por el mismo patógeno; 2) la no necesidad de una nueva intervención quirúrgica tras el segundo tiempo motivada por la infección y 3) la no existencia de una muerte relacionable con la infección periprotésica.
Los pacientes que no cumplían con el mínimo de seguimiento exigido o que no pudieron ser seguidos adecuadamente se excluyeron de nuestro análisis. Finalmente en el último control de seguimiento, cada paciente completó una escala analógica visual de dolor18 y un cuestionario de satisfacción autoadministrado19 (SAPS).
Método estadísticoEl tratamiento de los datos se hizo de forma anónima y confidencial. Se utilizó una base de datos creada con el programa Microsoft® Excel® 2008 para Mac (versión 12.3.6), con el que se realizó el análisis estadístico. Dado el tamaño muestral solo se realizó un análisis retrospectivo descriptivo de los pacientes y de las variables de la serie.
ResultadosDesde enero del 2010 hasta diciembre del 2013 hemos tratado a 7 pacientes utilizando esta técnica. Finalmente 6 pacientes cumplían los criterios de selección para ser incluidos en este estudio. Nuestra serie incluye a 3 hombres y 3 mujeres con una edad media en el momento de la intervención de 66,8 años (rango: 55-83 años). En cuatro de los casos se utilizó la técnica para solventar defectos femorales distales masivos tras una infección periprotésica crónica de rodilla y en dos casos se utilizó para tratar una seudoartrosis séptica tras una fractura supracondílea de fémur (tabla 1). La mediana del defecto óseo femoral fue de 117cm (rango: 32-191cm). En todos los pacientes se aisló un microorganismo patógeno en las muestras intraoperatorias del primer tiempo, siendo el Staphylococcus epidermidis el patógeno más frecuentemente aislado (66,6%). A todos los pacientes se les pudo realizar el segundo tiempo, excepto a uno, debido a un empeoramiento de su insuficiencia cardíaca congestiva de base. El tiempo promedio con el espaciador fue de 7,66 meses y durante este período hemos tenido una única complicación relacionada con la técnica: una luxación del espaciador en una paciente obesa que se redujo de forma cerrada. Durante el seguimiento clínico se comprobó la correcta evolución de la piel, sin existir problemas de cobertura. Tras parar el tratamiento antibiótico, en todos los pacientes se consideró que existía control de la infección y se programaron para realizar el segundo tiempo. Durante el segundo tiempo se pudo observar una superficie articular totalmente congruente, sin signos de inestabilidad, ni signos de desgaste ni de rotura. No tuvimos ninguna dificultad técnica al extraer el espaciador o el cemento, o a la hora de colocar la prótesis de revisión de rodilla. En el segundo tiempo, tras realizar un nuevo desbridamiento y toma de muestras, se implantó una prótesis tumoral modular cementada (Mega-C®, Link, Hamburgo, Alemania). Todos los cultivos intraoperatorios del segundo tiempo fueron negativos. El tiempo medio de seguimiento tras el segundo tiempo fue de 34,7 meses (rango: 19-45 meses). El balance articular pasivo está por encima de 0-90° en todos pacientes, excepto en un paciente que sufre una adherencia del aparato extensor después de la segunda cirugía (paciente 1). Tres pacientes presentaron un déficit extensor activo menor (<15°). Todos los pacientes, excepto el paciente número 4, están caminando sin dolor, con o sin caminador. Solo un paciente (paciente 2) presentó una dismetría en la longitud de sus extremidades clínicamente relevante, que fue corregida con un alza en el zapato. La puntuación media del VAS es de 1 (rango: 0-4). Para la medición de satisfacción, utilizamos un análogo a la escala de satisfacción del paciente19, usando solo los tres primeros elementos (sin valorar la cuarta esfera de valoración que se refiere a la actividad deportiva o recreacional, que consideramos ilógica en este tipo de pacientes). El 83% (5/6) quedaron muy satisfechos con los resultados de la cirugía y solo uno (paciente número 4) refirió estar moderadamente satisfecho. El 83% (5/6) quedaron muy satisfechos con el control del dolor, y parcialmente satisfecho solo el 17% (1/6). Cuando se pregunta por la capacidad de realizar las tareas diarias, 4/6 quedaron muy satisfechos, 1/6 estaba parcialmente satisfecho y 1/6 estaba insatisfecho tras el procedimiento. Sin embargo, cuando se les preguntó si repetirían la cirugía, todos ellos respondieron afirmativamente.
Dos pacientes fueron sometidos a una cirugía tras el segundo tiempo pero ninguna relacionada con la infección; en un caso el motivo fue una luxación de la rótula (paciente 5) y otro por adherencias severas del aparato extensor tras el segundo tiempo (paciente 1). Ambos han evolucionado favorablemente tras 7 y 8 meses después de la última revisión.
Merece la pena explicar la historia del paciente número 4, la única de esta serie en la que no se realizó el segundo tiempo. Es una mujer de 83 años que sufrió una amputación transfemoral izquierda debido a una infección periprotésica de rodilla bilateral en otro hospital. Fue derivada a nuestro centro para intentar salvar el miembro restante. Se decidió realizar un recambio en dos tiempos usando esta técnica, pero a la espera del segundo tiempo, sufrió un deterioro agudo de su insuficiencia cardiaca congestiva. Ahora está libre de dolor, sin signos de infección, utilizando una silla de ruedas debido a la disnea severa. Tiene un balance articular conservado, por encima de 0-90°. Junto a ella y a su familia, se decide no realizar el segundo tiempo debido al alto riesgo quirúrgico y el hecho de que no caminaría otra vez a causa de su disnea y la amputación contralateral. Está muy satisfecha con la cirugía y su control del dolor, a pesar de sus limitaciones.
DiscusiónEl objetivo del estudio fue investigar los resultados iniciales con una técnica novedosa en el tratamiento de los defectos óseos masivos del fémur distal dentro de un contexto séptico. En un intento por aprovechar las ventajas de un espaciador dinámico prefabricado hemos implementado la técnica a estudio. Tras el análisis inicial de los resultados podemos afirmar que es una técnica reproducible, segura y con un resultado aceptable en estos casos tan complejos, con una gran satisfacción de los pacientes tras el procedimiento y sin casos de recidiva de la infección tras un seguimiento mínimo de 18 meses y con una baja tasa de complicaciones relacionadas con la técnica.
En el siglo XXI, debido al creciente número de artroplastias de rodilla y motivado por el aumento de la esperanza de vida de los pacientes, se espera un importante incremento de la incidencia de revisiones de rodilla por aflojamientos tanto sépticos como asépticos20,21. Es conocido que la infección periprotésica es la primera causa de revisión de una prótesis de rodilla22 y que el riesgo de infección se incrementa con cada revisión20. Además, con cada revisión, el cirujano se enfrenta con un defecto óseo cada vez mayor8,23. Es por ello que en los casos «terminales» de infección periprotésica el defecto óseo puede llegar a ser catastrófico. Los factores que contribuyen a la pérdida de stock óseo son el tipo de implante, la osteólisis periprotésica, el aflojamiento del componente, la existencia de infección, o causas iatrogénicas durante la cirugía de extracción protésica23,24. El tratamiento de la pérdida de reserva ósea incluye el uso de cemento óseo, los aumentos de metal modulares, el injerto impactado, los aloinjertos estructurales y recientemente los suplementos de metal trabecular, en función de la ubicación, el tamaño del defecto y las preferencias del cirujano6. La mayoría de estas opciones están contraindicadas en la cirugía de revisión séptica, por lo que el tratamiento simultáneo de la infección y del defecto óseo está lejos de ser un tema resuelto25. Hoy en día no se ha establecido el tratamiento ideal para estos casos.
El recambio en dos tiempos es el protocolo más aceptado para erradicar la infección protésica crónica12,23. Otras opciones en casos de defecto masivo podrían ser la artrodesis funcional o falsa artrodesis9 e incluso puede quedar como opción última la amputación8. El espaciador con antibióticos es una parte fundamental del protocolo de recambio en dos tiempos. El objetivo del espaciador es aportar una concentración adecuada y mantenida de antibióticos26, evitar retracciones y mantener la tensión de las partes blandas y el aparato extensor; el proporcionar cierta funcionalidad en caso de utilizar espaciadores dinámicos27 y sobre todo, el facilitar la segunda cirugía al disminuir la fibrosis postoperatoria28. Además, parecen tener mejores resultados funcionales durante el tiempo de espera a la reconstrucción definitiva29. Sin embargo el hecho de usar espaciadores dinámicos o estáticos no parece influir en el resultado final, excepto por un posible aumento en el balance articular final27,28, aunque esto último no ha sido totalmente confirmado. Otras posibles ventajas de los espaciadores dinámicos son facilitar la movilidad y las transferencias, contribuyendo a una mejor calidad de vida mientras se espera a la segunda cirugía. Se han utilizado diferentes tipos de espaciadores dinámicos, uno de los cuales son los llamados «espaciadores industrialmente prefabricados». Estos espaciadores están impregnados con un tipo y una cantidad de antibiótico determinada. Dichos espaciadores han sido ampliamente utilizados en Europa, y recientemente se han empezado a distribuir en Estados Unidos (InterSpace®, Inc. Exactech, Gainesville, Florida). Sin embargo, hay que recordar que su uso está limitado por su elevado precio y por su falta de modularidad en defectos óseos masivos. Es por eso que hemos sido testigos del aumento de la divulgación de espaciadores realizados intraoperatoriamente para solucionar este problema8,26,30. Estas «técnicas personales» no están exentas de limitaciones, tales como la seguridad mecánica de estos montajes, las propiedades de elución del antibiótico, la pérdida de tiempo quirúrgico, así como el coste económico. Por el contrario, entre los beneficios reconocidos a estos espaciadores industrialmente fabricados precisamente está el que han demostrado ser mecánicamente fiables, tener un perfil farmacológico seguro (es decir, que proporcionan una liberación local de antibióticos conocida) y, muy importante, que su uso puede ahorrar un valioso tiempo quirúrgico durante el procedimiento. Es por eso que el uso de espaciadores articulados prefabricados es la técnica de elección en nuestra unidad13,14.
El espaciador que describimos toma el principio de «ball-and-socket» descrito y validado por MacAvoy et al30. Este utiliza una jeringa de bulbo como molde para el compartimento femoral y una cabeza bipolar impregnada de 55mm para marcar el recipiente tibial en el otro extremo. Esta técnica presenta el riesgo potencial de una rotura del componente femoral o bien un aflojamiento, ya que no es compatible con un tallo largo.
Algunos de los inconvenientes de la técnica descrita podrían ser la movilidad multidireccional y la inestabilidad de la articulación artificial en una rodilla mecánicamente incompetente. Anticipándonos a tal complicación, limitamos el movimiento de la articulación a una flexión-extensión controlada, mediante el uso de una rodillera articulada. En nuestra serie inicial solo hemos tenido un caso de luxación, en una paciente obesa mórbida (donde el uso de la rodillera estabilizadora está comprometido).
Otros temas de discusión posibles son la construcción de un par de fricción cemento-cemento y el efecto de las partículas de desgaste. Incluso, se ha propuesto que estas partículas de desgaste sean una posible causa de la persistencia de la infección31. Hay que decir que esta superficie articular es utilizada por otros modelos de espaciadores sin especial problema, además se trata de un corto periodo de tiempo, sin dejar cargar el peso por completo, limitando así el desgaste.
Esta técnica ha demostrado ser segura con un bajo número de complicaciones. No tuvimos ningún caso de rotura del implante o de aflojamiento del sistema. Los pacientes fueron capaces de caminar parcialmente con o sin ayuda, y todos, excepto uno (por su estado de salud), llegaron al segundo tiempo. Los marcadores de infección se normalizaron en todos nuestros pacientes, y ninguno tuvo complicaciones cutáneas, confirmando la resolución de la infección, que es el objetivo principal en cualquier cirugía reconstructiva séptica. Su capacidad funcional física y mental fueron muy positivas tras el procedimiento. Todos estaban altamente satisfechos con la cirugía, probablemente debido al control de la infección, después de una larga lucha, y todos repetirían el procedimiento.
Reconocemos las limitaciones del estudio que presentamos. Por una parte se trata de un estudio retrospectivo con todas las limitaciones inherentes a dicho diseño, sobre todo el no poder disponer de todos los datos potencialmente útiles. Por otra parte se trata de un tamaño muestral pequeño, con solo 6 casos, pero somos consientes de que estamos presentando casos extremos, muy poco frecuentes en la práctica clínica habitual. Otra limitación podría ser la definición elegida de infección periprotésica; actualmente existe controversia en la comunidad científica sobre la definición ideal de infección protésica; el uso de una definición internacionalmente aceptada (IDSA) hace que consideremos que esta no sea una limitación relevante para el estudio.
ConclusiónA la luz de lo expuesto, consideramos que esta técnica es una herramienta útil y que puede ser un recurso válido en el caso de una infección periprotésica de rodilla asociada a un defecto óseo del fémur distal o casos de defecto femoral distal masivo en un contexto séptico.
Nivel de evidenciaNivel de evidencia IV.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo no hubiese sido posible sin la ayuda de la Dra. Dolors Rodríguez-Pardo y el Dr. Carles Pigrau de la unidad de infecciosas de nuestro hospital. De la misma manera agradecer al Dr. Juan Carlos Juárez del servicio de farmacia y a la Dra Mayli Lung del departamento de microbiología.