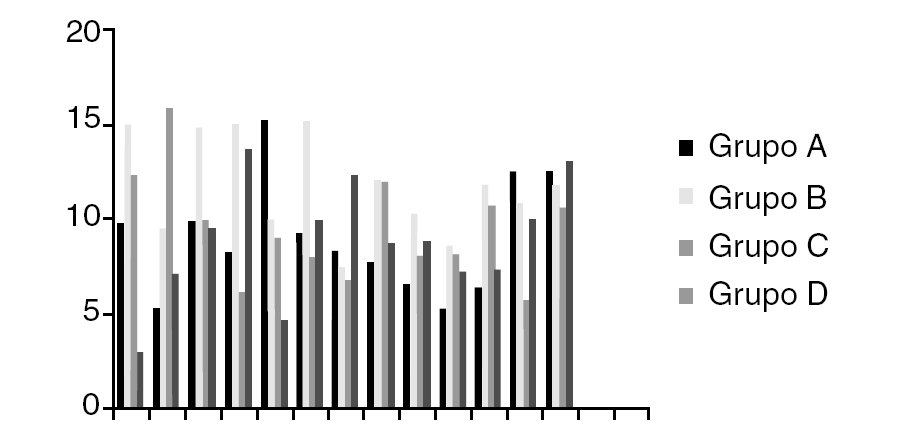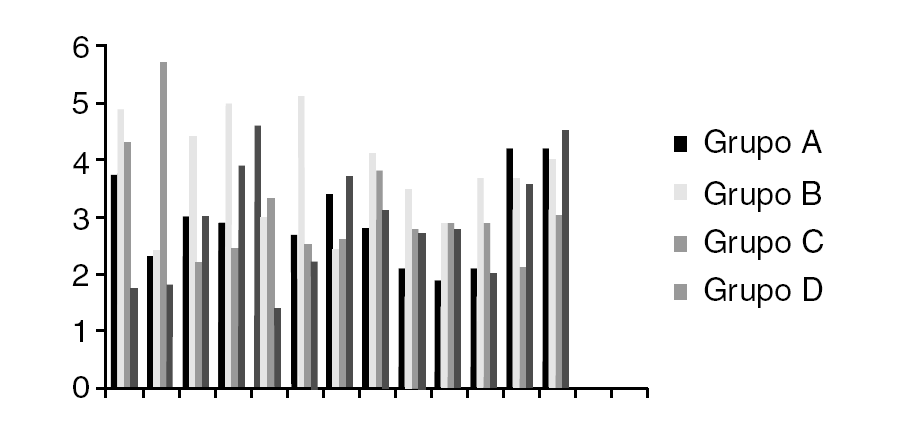La cirugía protésica de rodilla se asocia a importantes pérdidas sanguíneas, contabilizadas entre 0,8 y 1,5 l, que llevan a que entre el 33,3 y el 100% de los pacientes sean transfundidos1-4. Habitualmente realizamos la cirugía protésica primaria de rodilla con torniquete, lo que permite la isquemia preventiva del miembro, habiendo valorado diferentes trabajos cuál era el mejor momento para retirarla, si antes del cierre de la incisión para identificar y coagular en la mayor medida posible los vasos sangrantes, o tras cerrar la herida y colocar un vendaje compresivo1-3,5-7. Por otro lado, utilizamos drenajes para reducir los hematomas en las heridas y la posible infección en las prótesis8-10; aunque no todos los autores comparten esta técnica11.
Pensando en las diferentes maneras de retirar la isquemia y utilizar los redones planificamos un trabajo que incluyese variaciones de ambos parámetros, para valorar las pérdidas sanguíneas visibles. El objetivo final era ver cuál era la actuación óptima para disminuir las pérdidas sanguíneas sin complicaciones asociadas y, con ello, disminuir las transfusiones.
MATERIAL Y MÉTODO
Estudiamos prospectivamente las pérdidas sanguíneas en 60 pacientes, todos ellos diagnosticados de gonartrosis e intervenidos consecutivamente entre octubre de 2003 y marzo de 2004 por el mismo equipo de cirujanos, sin que el realizar estas cuantificaciones supusiese ninguna variación en la técnica básica habitual.
Agrupamos a los pacientes en cuatro grupos, en función del momento de retirar la isquemia y del modo de funcionar los drenajes de forma aleatorizada. Los pacientes de los cuatro grupos eran comparables respecto a la edad, el sexo y los valores hematológicos prequirúrgicos. Ninguno de ellos presentaba enfermedades asociadas que pudieran modificar los resultados; no se incluyeron pacientes con anomalías en la coagulación o con tratamientos prolongados que pudiesen alterarla (ácido acetilsalicílico, esteroides,...), confirmado preoperatoriamente con una analítica de la coagulación. También excluimos a los pacientes intervenidos previamente de rodilla.
Se administraron antibióticos (cefazolina 1 g por vía intravenosa cada 8 horas) media hora antes de la cirugía, y doce horas antes de la cirugía se inició la profilaxis tromboembólica con la misma heparina de bajo peso molecular.
La cirugía se realizó a través de una incisión longitudinal en la piel y parapatelar medial interna. La elección del tipo de prótesis se dejó a discreción del cirujano, pero todas ellas eran cementadas y conservaban el ligamento cruzado posterior. Se utilizaron guías extramedulares para los cortes tibiales e intramedulares para los femorales, colocándose un tapón óseo en el agujero femoral distal. En todos los casos se colocaron dos drenajes tipo redón, uno intraarticular y el otro subcutáneo. La cápsula, el tejido celular subcutáneo y la piel se suturaron independientemente.
Todas las intervenciones se efectuaron con isquemia preventiva de la extremidad con un torniquete en la raíz del muslo, a 300-350 mmHg.
Los cuatro grupos que estudiamos fueron: grupo A, se cerró la herida quirúrgica sin retirar la isquemia, y tras el vendaje compresivo se abrieron los redones que se dejaron con vacío durante 48 horas; grupo B, tras colocar la prótesis se retiró la isquemia y se realizó hemostasia, tras el vendaje compresivo los redones estuvieron abiertos con vacío durante 48 horas; grupo C, se retiró la isquemia tras el implante, realizándose una minuciosa hemostasia, y tras el vendaje compresivo los redones salieron del quirófano abiertos sin vacío las 24 horas iniciales, tras las cuales se colocó vacío durante las siguientes 24 horas; grupo D, se cerró la herida quirúrgica sin retirar la isquemia y tras el vendaje compresivo los redones se colocaron abiertos sin vacío las primeras 24 horas, y se aplicó el vacío las siguientes 24.
En todos los pacientes se valoraron:
-- Las pérdidas sanguíneas visibles totales (operatorias y en los drenajes hasta su retirada).
-- Los niveles de hemoglobina y hematocrito, registrándose estos datos en el momento de incluirlos en el programa de cirugía (aproximadamente 45-90 días antes de la cirugía); en el momento de la preparación inmediata de la anestesia, y el control postquirúrgico, a las 24 horas de la cirugía cuando ya se habían recogido la práctica totalidad de las pérdidas.
Utilizamos las pruebas de ji cuadrado y «t» de Student para valorar estadísticamente los datos recogidos. Se consideraron significativos valores p < 0,05.
RESULTADOS
En el grupo A no se retira la isquemia antes del cierre quirúrgico; redones abiertos y con vacío. En este grupo, formado por 15 pacientes (12 mujeres, 3 varones) de una edad media de 72 ± 4 años (63-80) no se observó ninguna complicación durante el ingreso hospitalario por la cirugía, ni trombosis venosa profunda, ni infección superficial de la piel, y en ningún paciente se vio hinchazón de la rodilla que obligase a restringir la rehabilitación.
El sangrado promedio medido fue de 663 cc (desviación estándar [DE]: 191,70 cc) (rango 400 cc-965 cc). El drenaje postoperatorio las segundas 24 horas después de la cirugía fue escaso, con una media de 94,33 cc (DE: 104,58 cc) (15 cc-400 cc), lo que permitió considerar el valor hematológico a las 24 horas de la cirugía como control post-quirúrgico, pues las pequeñas pérdidas no influyeron en las cifras hematológicas. Las cifras del hematocrito descendieron una media de 8,96 (DE: 3,00) (rango 5,2-15,2) entre el valor preanestésico y el control postquirúrgico; y las de hemoglobina 3,06 (DE: 0,89) (1,9-4,6).
En el grupo B, con 15 pacientes (12 mujeres, 3 varones) de una edad media de 72,4 años (DE: 6,52 años) (61-84) no se observó ninguna complicación durante el ingreso hospitalario por la cirugía; tampoco observamos trombosis venosa profunda, ni infección superficial de la piel, y en ningún paciente vimos hinchazón de la rodilla que obligase a cambiar la rehabilitación.
El sangrado promedio medido fue de 934,6 cc (DE: 246,79 cc) (rango 663 cc-1.481 cc). El drenaje postoperatorio, las segundas 24 horas después de la cirugía fue mínimo, con media de 91,67 cc (DE: 78,16 cc) (20 cc-290 cc). Las cifras de hematocrito descendieron una media de 11,71 (DE: 2,60) (rango 7,4-15,1) entre el valor preanestésico y el control postquirúrgico; y las de hemoglobina 3,77 (DE: 0,92) (2,4-5,1).
En el grupo C, con otros 15 pacientes (12 mujeres, 3 varones) de una edad media de 69 años (DE: 5,82 años) (60-80) no se observó ninguna complicación de interés durante el ingreso hospitalario como consecuencia de la cirugía; no observamos trombosis venosa profunda y en ningún paciente encontramos hinchazón de la rodilla que obligase a restringir la rehabilitación. Un paciente presentó una pequeña infección superficial de la herida que curó sin necesidad de gestos quirúrgicos añadidos.
El sangrado medido promedio fue de 383,2 cc (DE: 139,16 cc) (rango 199 cc-661 cc). El drenaje durante las segundas 24 horas después de la cirugía fue pequeño, con una media de 62,66 cc (DE: 38,21 cc) (10 cc-135 cc). Las cifras de hematocrito descendieron una media de 8,90 (DE: 3,09) (rango 4,2-15,8) entre el valor preanestésico y el control postquirúrgico; y las de hemoglobina 2,97 (DE: 1,05)
(1,6-5,7).
En el grupo D, formado por 15 pacientes (7 mujeres, 8 varones) con una edad media de 69 años (DE: 9,10 años) (55-84) no se observó ninguna complicación durante el ingreso hospitalario por la cirugía; tampoco se presentó trombosis venosa profunda ni vimos hinchazón de la rodilla que obligase a variar el programa de rehabilitación. Un paciente presentó una pequeña necrosis superficial de la herida que curó sin necesidad de tratamiento quirúrgico.
El sangrado medido promedio fue de 265 cc (DE: 89,70 cc) (rango 110 cc-420 cc).
El drenaje durante las segundas 24 horas después de la cirugía fue pequeño, con una media de 104,33 cc (DE: 87,35 cc) (15 cc-300 cc), lo que permitió tomar el control hematológico a las 24 horas de la cirugía como control post-quirúrgico. Las cifras de hematocrito habían descendido una media de 8,86 (DE: 2,89) (rango: 2,9-13,6) entre el valor preanestésico y el control postquirúrgico y las de hemoglobina 2,9 (DE: 0,93) (1,4-4,5).
La comparación estadística entre los cuatro grupos mostró una pérdida sanguínea significativamente menor (p < 0,0000) en los grupos C y D en los que los redones se mantuvieron abiertos pero sin vacíos las primeras 24 horas; que se traducía en un descenso del hematocrito con diferencias también significativas estadísticamente (p < 0,353).
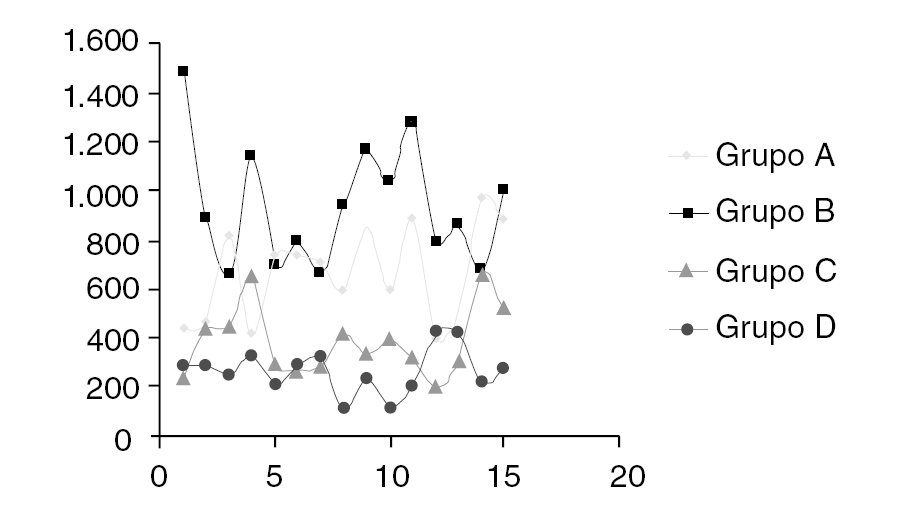
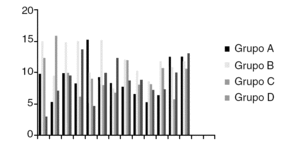
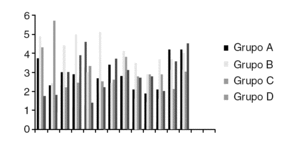
Los datos obtenidos (fig. 1) muestran un menor sangrado, estadísticamente significativo (p < 0,0000), si se realiza como sistemática tras el implante de una prótesis total de rodilla cementada el mantener los dos redones (intraarticular y subcutáneo) abiertos pero sin vacío las primeras 24 horas y con vacío las siguientes 24; siempre tras un vendaje algodonado compresivo. Tanto si se retira la isquemia preventiva y realiza una cuidadosa hemostasia como si se cierra la herida quirúrgica sin retirar la isquemia. En ningún caso se observaron complicaciones que puedan relacionarse con el método. Estas menores pérdidas sanguíneas (figs. 2 y 3) significan por tanto una menor repercusión clínica, y menores necesidades de reposición sanguínea.
Figura 1. Pérdidas sanguíneas en los diferentes grupos.
Figura 2. Descenso de hematocrito en los diferentes grupos.
Figura 3. Descenso de hemoglobina en los diferentes grupos.
DISCUSION
Algunos autores afirman que las pérdidas sanguíneas en las prótesis totales de rodilla son importantes12. Desde la medicina basada en la evidencia planteamos este trabajo para cuantificar las pérdidas sanguíneas, realizando variaciones en dos gestos habituales en la artroplastia total de rodilla: la retirada del torniquete para la isquemia y el manejo de los redones de drenaje.
En la literatura se ha valorado cuál es el momento más adecuado para retirar la isquemia tras la implantación de una prótesis total de rodilla, si tras insertar la prótesis y antes de cerrar la herida para identificar y coagular los vasos sangrantes, o postoperatoriamente, tras colocar el vendaje compresivo. Jorn et al2 y Christodoulou et al6 encuentran mayor pérdida sanguínea en el grupo de pacientes al que retiran el torniquete antes del cierre quirúrgico, señalando que retirar el torniquete tras el vendaje compresivo ofrece mejores condiciones de hemostasia, ya que la actividad fibrinolítica se controla mejor y sin complicaciones significativas6. Lotke et al1 también observaron una mayor pérdida con la retirada intraoperatoria de la isquemia. Hersekli et al7 señalan que retirar el torniquete antes del cierre de la herida no reduce las pérdidas sanguíneas totales en la artroplastia total de rodilla. Por una parte, Widman e Isacson5 y Burkart et al13 no vieron diferencias en las pérdidas sanguíneas perioperatorias en función del momento de retirar el torniquete, como tampoco Barwell et al3 al valorar la hemoglobina 48 horas después de la cirugía3.
Nosotros incluimos como segundo parámetro de interés el modo de utilizar el drenaje colocado. En la bibliografía recogida no hemos encontrado datos relativos a este punto relacionados con las artroplastias totales de rodilla.
En nuestro estudio hemos demostrado que hay un menor sangrado tras una cirugía de prótesis total de rodilla cuando se mantienen los dos redones, intraarticular y subcutáneo, abiertos pero sin vacío las primeras 24 horas y con vacío las siguientes 24, tanto si se efectúa una hemostasia cuidadosa tras retirar la isquemia, como si se cierra la herida sin retirar la isquemia. Las directrices que habitualmente se describen para el ahorro de transfusión de sangre alogénica14 incluyen reajustar las indicaciones de transfusión (aceptándose como cifras a considerar hemoglobina de 8 g/dl-1 y hematocrito del 24%, salvo alteraciones del estado general), optimización preoperatoria de los niveles de hemoglobina por encima de 13 g/dl-1 y minimizar el sangrado quirúrgico. Creemos que esta simple rutina descrita de redones sin vacío al final de la cirugía puede ser de máxima utilidad. Todo ello con interés para cubrir el objetivo con el que trabajamos de disminuir las necesidades de transfusión de sangre alogénica15,16.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.
Correspondencia:
M.J. Sangüesa Nebot.
Servicio de Traumatología y Cirugía Ortopédica.
Hospital Arnau de Vilanova de Valencia.
C/ San Clemente n.o 12.
46015 Valencia.
Correo electrónico: mjosan@comv.es
Recibido: noviembre de 2004.
Aceptado: junio de 2005.