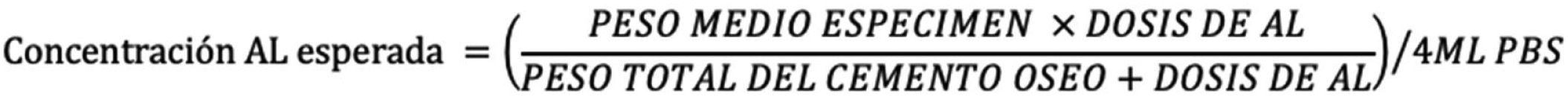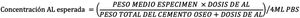Actualmente, no disponemos de un gold standard para el manejo del dolor postoperatorio tras una artroplastia total de rodilla, dado que se pueden administrar analgésicos a través de diferentes vías y ninguna de estas está exenta de riesgos. El sistema ideal de administración de analgésicos debería proporcionar dosis terapéuticas, no tóxicas, en el sitio quirúrgico, especialmente durante las primeras 72h.
El cemento óseo utilizado en las artroplastias se ha usado como un medio de liberación de fármacos, especialmente antibióticos, desde 1970. Basado en este principio, se desarrolló este estudio con el objetivo de conocer el perfil de elución de dos anestésicos locales (hidrocloruro de lidocaína e hidrocloruro de bupivacaína) desde el cemento óseo de polimetilmetacrilato (PMMA).
Material y métodosSe obtuvieron especímenes de cemento óseo Palacos® R+G e hidrocloruro de lidocaína o hidrocloruro de bupivacaína según el grupo de estudio. Estos especímenes se sumergieron en PBS (por sus siglas en inglés de phosphate buffered saline) y se retiraron de la solución en diferentes cortes temporales establecidos. Posteriormente, se analizó la concentración de anestésico local en el líquido mediante cromatografía líquida.
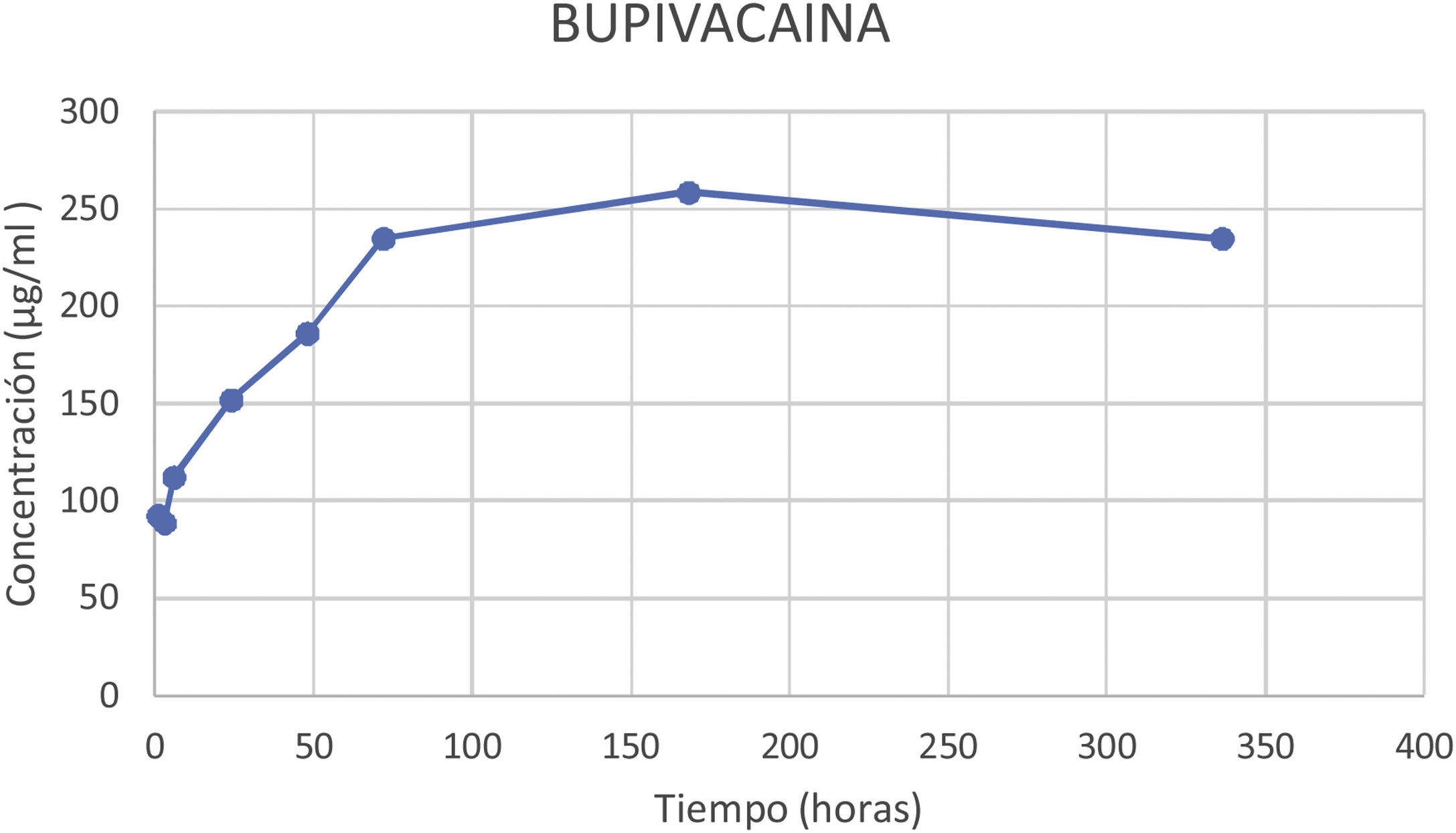
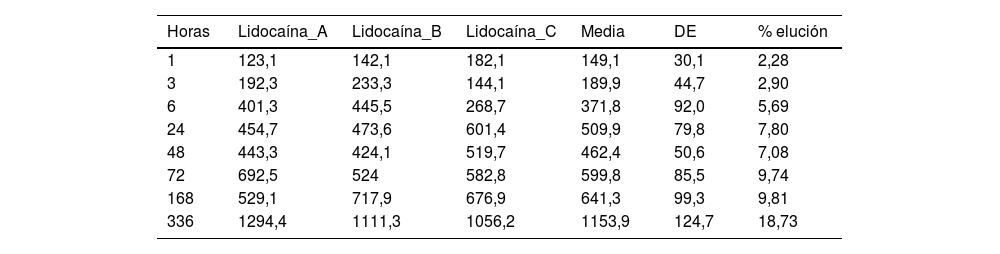
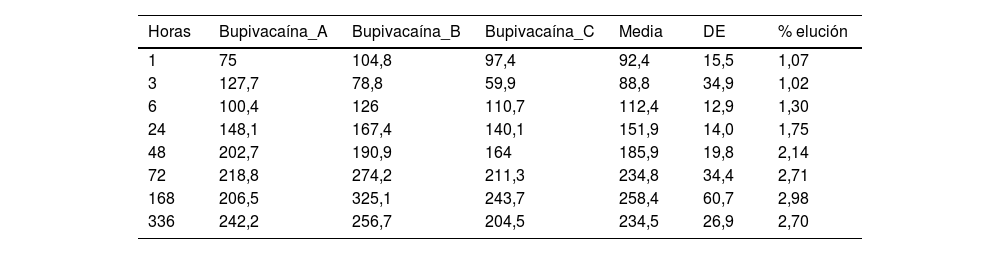
ResultadosEl porcentaje de lidocaína eludida del cemento óseo PMMA de este estudio ha sido del 9,74% del contenido total de lidocaína por espécimen a las 72h y del 18,73% a las 336h (14 días). En el caso de la bupivacaína, el porcentaje de elución ha sido del 2,71% del contenido total de bupivacaína por espécimen a las 72h y del 2,70% a las 336h (14 días).
ConclusionesLos anestésicos locales eluyen in vitro desde el cemento óseo, alcanzando a las 72h dosis cercanas a las dosis utilizadas en bloqueos anestésicos.
Currently, we do not have a gold standard for pain management after total knee arthroplasty. We may use one of more drug delivery systems, none of which are ideal.
An ideal depot delivery system would provide therapeutic, nontoxic, doses of drug at the surgical side, especially during 72h postoperatively.
The bone cement used in arthroplasties has been used as a drug delivery system, especially antibiotics, since 1970. Based on this principle, we developed this study with the aim to characterize the elution profile of two local anesthetics (lidocaine hydrochloride and bupivacaine hydrochloride) from PMMA (polymethilmethacrylate) bone cement.
Material and methodsPalacos® R+G bone cement and lidocaine hydrochloride or bupivacaine hydrochloride specimens were obtained depending on the study group. These specimens were immersed in PBS (phosphate buffered saline) and removed from the solution at different set times.
Subsequently, the concentration of local anesthetic in the liquid was analyzed by liquid chromatography.
ResultsThe percentage of lidocaine eluted from PMMA bone cement in this study was 9.74% of the total lidocaine content per specimen at 72h and 18.73% at 336h (14 days). In case of bupivacaine, the elution percentage was 2.71% of the total bupivacaine content per specimen at 72h and 2.70% at 336h (14 days).
ConclusionsLocal anesthetics elute in vitro from PMMA bone cement, reaching doses at 72h close to the doses used in anesthetic blocks.
La artroplastia total de rodilla (ATR) es uno de los procedimientos más utilizados en pacientes con dolor crónico refractario de rodilla en los que ha fracasado el tratamiento conservador1.
El dolor posquirúrgico tras la implantación de una ATR generalmente es moderado o severo y puede ser de difícil control, especialmente durante los 3 primeros días postoperatorios2. Conseguir un control del dolor óptimo permite mejorar la función, facilitar la rehabilitación y atenuar la progresión de dolor agudo a crónico3. Actualmente, no existe un gold standard para el manejo del dolor postoperatorio tras ATR4–7, dado que se pueden administrar analgésicos a través de diferentes vías y ninguna de estas es ideal, ya que las reacciones adversas son frecuentes y pueden surgir complicaciones8. El sistema ideal de administración de analgésicos debería poder proporcionar dosis terapéuticas, no tóxicas, en el sitio quirúrgico, especialmente durante las primeras 72h. En el tratamiento del dolor posterior a la implantación de una ATR se podría utilizar el cemento óseo de polimetilmetacrilato (PMMA) como un sistema de liberación local de fármacos para conseguir un efecto analgésico.
Desde 1970, se han realizado estudios analizando la capacidad del cemento óseo de PMMA como sistema de liberación local de fármacos, especialmente antibióticos9. El patrón de elución de estos fármacos muestra una alta liberación de fármaco inicial seguida de un descenso de la misma en los siguientes días10.
La elución de los fármacos desde el cemento estará condicionada por algunos factores, como la captación de agua del cemento, la porosidad de la matriz del cemento, la composición del cemento, la superficie de cemento, el tamaño de partículas del fármaco y el contenido de fármaco11–13.
Siguiendo estos trabajos iniciales y teniendo en cuenta que los anestésicos locales (AL) son fármacos con un excelente perfil de seguridad y efectividad, algunos autores han ensayado la capacidad de elución de los AL desde el cemento óseo de PMMA8,14, obteniendo cifras de elución variables en función del fármaco y el cemento utilizado.
El objetivo de este estudio es analizar el perfil de elución del hidrocloruro de lidocaína y el hidrocloruro de bupivacaína desde el cemento óseo de PMMA con gentamicina.
Material y métodosEste estudio se desarrolló contando con la aprobación del comité ético de investigación clínica (HCB 2020/0097) y siguiendo las normativas de los estándares internacionales ISO 5833:2022 Implants for surgery-Acrylic resin cements y del Standard Specification for Acrylic Bone Cement ASTM F451-16.
Se definieron dos grupos de estudio: grupo de cemento con hidrocloruro de lidocaína (GL) y grupo de cemento con hidrocloruro de bupivacaína (GB).
Se definió la dosis de AL teniendo en cuenta los porcentajes de elución reportados en estudios previos8,14 y buscando conseguir una dosis eludida total de 0,20g de lidocaína y 0,14g de bupivacaína. Estas dosis corresponden a dosis habituales utilizadas en bloqueos anestésicos y a la estimación habitual de 3mg/kg y 2mg/kg para un paciente de peso medio de 70kg para la lidocaína15 y bupivacaína16, respectivamente. Las dosis calculadas fueron de 2,48g en el grupo de lidocaína (GL) y 3,58g en el grupo de bupivacaína (GB). Se utilizaron hidrocloruro de lidocaína e hidrocloruro de bupivacaína (Fagron®, Terrassa).
Se utilizó Palacos® R+G (Heraeus Medical GMBH, Alemania), un cemento óseo compuesto de PMMA de alta viscosidad y fraguado rápido que contiene gentamicina.
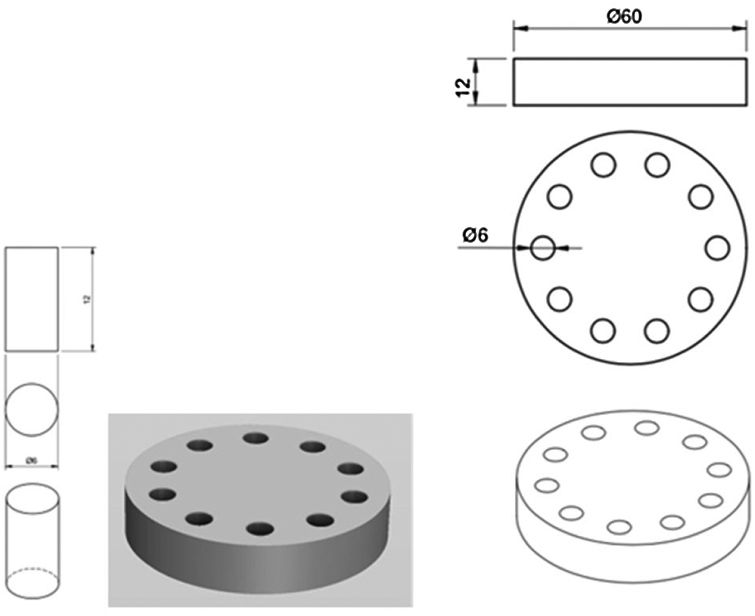
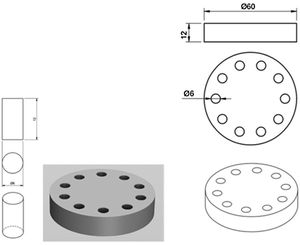
Se fabricaron los moldes (fig. 1) para la creación de los especímenes cilíndricos de 6mm de diámetro × 12mm de altura mediante mecanizado en teflón. Como la normativa no especifica las dimensiones de los especímenes para los análisis de elución, se utilizaron las referencias para los estudios mecánicos en este tipo de cementos, especificadas en la ISO 5833:2002.
Para la preparación de los especímenes de los grupos GL y GB, se mezclaron los AL en polvo (hidrocloruro de lidocaína o hidrocloruro de bupivacaína) con el componente en polvo del cemento siguiendo el método de dilución geométrica. A la mezcla se añadió el componente líquido del cemento siguiendo las recomendaciones del fabricante. La mezcla se dejó reposar 30segundos y se introdujo en los moldes, eliminando el excedente. Se dejó secar durante 30minutos y posteriormente se extrajeron los especímenes.
Se estableció un tamaño muestral de 3 especímenes por grupo de estudio y corte temporal de forma arbitraria, dado que no existe ninguna normativa que regule el estudio de la elución actualmente.
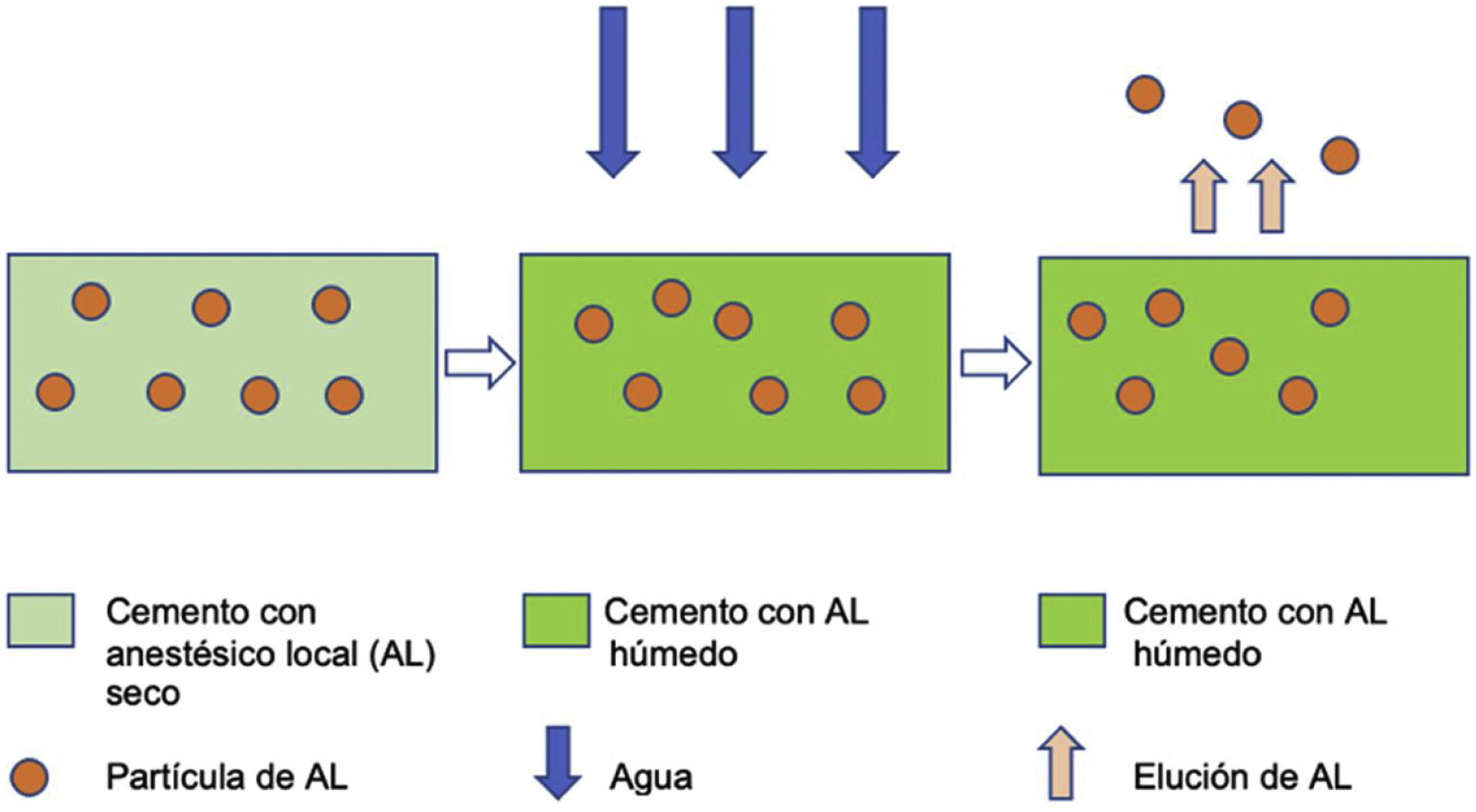
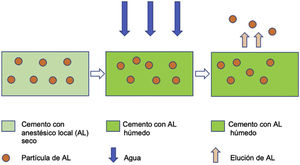
El proceso de elución sigue la ley de difusión (fig. 2), se realiza desde la superficie y está directamente relacionada con la capacidad de absorber agua del cemento. Con el objetivo de obtener especímenes con superficies de contacto similares, se seleccionaron los 3 especímenes (A, B, C) más homogéneos de cada grupo en cuanto a talla y peso.
Los especímenes se introdujeron en crioviales, se sumergieron en 4ml de solución salina (PBS) a temperatura ambiente y se colocaron en un agitador oscilante. En los puntos de corte establecidos (1h, 3h, 6h, 24h, 48h, 72h, 168h y 336h) se retiraron los especímenes de la solución y se almacenaron los crioviales a −80°C. En las muestras obtenidas, se analizó la concentración de AL en el líquido mediante cromatografía líquida (HPLC).
Para dar validez interna al método de determinación, se repitió el análisis de la concentración de AL por triplicado, en cada grupo de estudio y corte temporal.
ResultadosLas tablas 1 y 2 muestran la concentración de lidocaína y bupivacaína en μg/ml en cada una de las muestras analizadas, y la media y desviación estándar (DE) de concentración en cada punto temporal. Al mismo tiempo, se muestra el porcentaje de lidocaína y bupivacaína liberada respecto al total de AL presente en la mezcla de cemento.
Concentración (μg/ml) y elución media (%) de lidocaína
| Horas | Lidocaína_A | Lidocaína_B | Lidocaína_C | Media | DE | % elución |
|---|---|---|---|---|---|---|
| 1 | 123,1 | 142,1 | 182,1 | 149,1 | 30,1 | 2,28 |
| 3 | 192,3 | 233,3 | 144,1 | 189,9 | 44,7 | 2,90 |
| 6 | 401,3 | 445,5 | 268,7 | 371,8 | 92,0 | 5,69 |
| 24 | 454,7 | 473,6 | 601,4 | 509,9 | 79,8 | 7,80 |
| 48 | 443,3 | 424,1 | 519,7 | 462,4 | 50,6 | 7,08 |
| 72 | 692,5 | 524 | 582,8 | 599,8 | 85,5 | 9,74 |
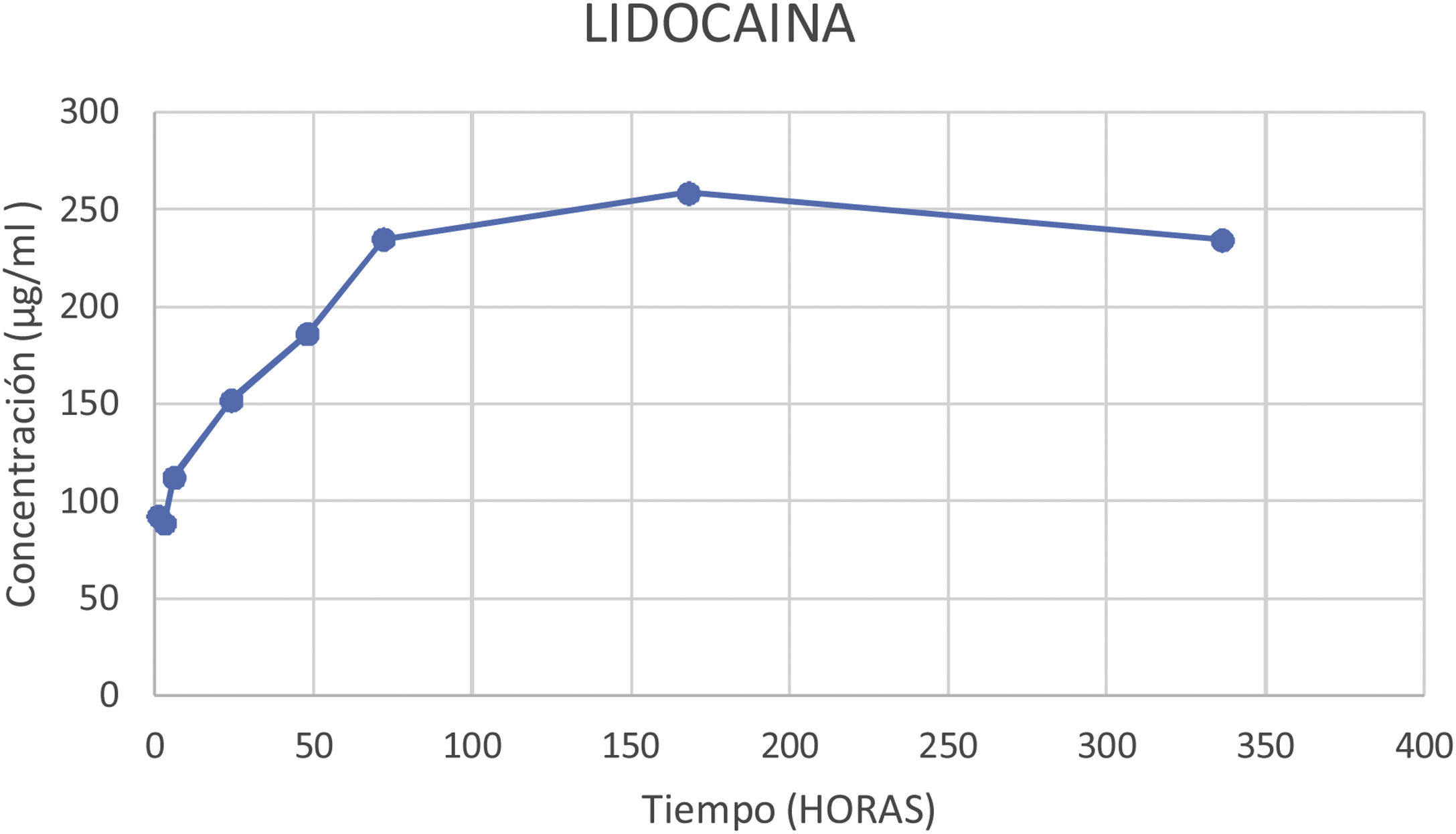
| 168 | 529,1 | 717,9 | 676,9 | 641,3 | 99,3 | 9,81 |
| 336 | 1294,4 | 1111,3 | 1056,2 | 1153,9 | 124,7 | 18,73 |
Concentración (μg/ml) y elución media (%) de bupivacaína
| Horas | Bupivacaína_A | Bupivacaína_B | Bupivacaína_C | Media | DE | % elución |
|---|---|---|---|---|---|---|
| 1 | 75 | 104,8 | 97,4 | 92,4 | 15,5 | 1,07 |
| 3 | 127,7 | 78,8 | 59,9 | 88,8 | 34,9 | 1,02 |
| 6 | 100,4 | 126 | 110,7 | 112,4 | 12,9 | 1,30 |
| 24 | 148,1 | 167,4 | 140,1 | 151,9 | 14,0 | 1,75 |
| 48 | 202,7 | 190,9 | 164 | 185,9 | 19,8 | 2,14 |
| 72 | 218,8 | 274,2 | 211,3 | 234,8 | 34,4 | 2,71 |
| 168 | 206,5 | 325,1 | 243,7 | 258,4 | 60,7 | 2,98 |
| 336 | 242,2 | 256,7 | 204,5 | 234,5 | 26,9 | 2,70 |
Para el cálculo del porcentaje de lidocaína liberada respecto al total de lidocaína presente en el espécimen, se ha realizado la siguiente estimación: en el grupo GL se han añadido 2,48g de lidocaína a 40,8g de cemento en polvo, representando un peso en polvo total de 43,28g. En el grupo GB, se han añadido 3,58g de bupivacaína a 40,8g de cemento en polvo representando un peso en polvo total de 44,38g. Si el peso medio de los especímenes ha sido de 0,43g y se han sumergido en 4ml de PBS, la concentración máxima esperada, si eluyera el 100% de lidocaína, sería de 6160μg/ml en el grupo GL y de 8672μg/ml en el grupo GB. Estos cálculos se han realizado mediante la fórmula representada en la figura 3.
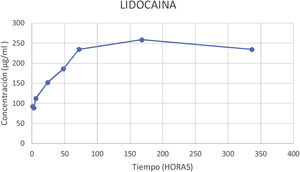
El porcentaje de lidocaína eludida del cemento óseo PMMA de este estudio ha sido del 9,74% del contenido total de lidocaína por espécimen a las 72h y del 18,73% a las 336h (14 días).
En la figura 4 podemos observar la gráfica de la concentración promedio eludida de lidocaína en los diferentes cortes temporales.
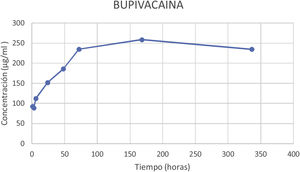
El porcentaje de bupivacaína eludida del cemento óseo PMMA de este estudio ha sido del 2,71% del contenido total de bupivacaína por espécimen a las 72h y del 2,70% a las 336h (14 días). En la figura 5 podemos observar la gráfica de la concentración promedio eludida de bupivacaína en los diferentes cortes temporales.
DiscusiónPara llevar a cabo este estudio hemos elegido el cemento óseo Palacos®? R+G, un cemento de viscosidad alta que contiene sulfato de gentamicina como los cementos que utilizamos habitualmente en nuestro medio. Palacos®? (Heraeus) es una de las marcas más utilizadas en el mercado para la fijación de artroplastias17.
Hemos seleccionado dos AL para valorar su elución en cemento óseo con antibiótico. Por un lado, la lidocaína, como anestésico de vida media corta, y por otro lado, la bupivacaína, como anestésico de vida media más larga. Ambos presentan buena resistencia térmica, condición imprescindible, dado que in vitro el PMMA puede alcanzar picos de temperatura durante el curado de hasta 80-90°C11,18.
Se han realizado dos estudios previos analizando la elución de diferentes AL adicionados a cementos óseos de PMMA. En el estudio realizado por Bond et al.8 añadieron lidocaína, prilocaína, bupivacaína y tetracaína a 5 cementos óseos de PMMA sin antibiótico. Se reportó un porcentaje de elución de los diferentes AL entre el 0,05 y el 1,10% a las 72h. En el estudio realizado por Balaguer et al.14 añadieron lidocaína y bupivacaína a un cemento óseo de PMMA de viscosidad media que contenía gentamicina. Se reportó un porcentaje de elución de lidocaína del 25,49% a las 72h y del 38,48% a los 14 días. Al mismo tiempo reportaron un porcentaje de elución de bupivacaína del 3,18% a las 72h y del 4,53% a los 14 días.
En nuestro estudio los porcentajes de elución de lidocaína han sido del 9,74% a las 72h y del 18,73% a los 14 días (336h). En el caso de la bupivacaína, el porcentaje de elución ha sido del 2,71% a las 72h y del 2,70% a los 14 días (336h).
En los dos grupos de estudio GL y GB y en los dos cortes temporales, la elución ha sido inferior a la reportada por Balaguer et al. Estas diferencias de resultado podrían justificarse por el hecho de que no utilizaron el mismo cemento óseo que nosotros y por el uso de una dosis de AL diferente. A pesar de haber utilizado dosis mayores de AL en nuestro estudio, el porcentaje de elución es menor. Este resultado podría justificarse por el hecho de que la elución de fármacos desde el cemento óseo se realiza desde la superficie10, pudiendo llegar a limitarse a pesar del incremento de dosis de fármaco.
Nuestros resultados y los de Balaguer et al. muestran una elución superior a la reportada por Bond et al. En el estudio de Bond se utilizó cemento óseo sin antibiótico, suero fisiológico en lugar de PBS y otras características geométricas de las muestras.
En cuanto a la interpretación de nuestros resultados y desde un punto de vista teórico, deberíamos tener en cuenta dos factores principalmente: la cantidad máxima total eludida de fármaco y la dosis de fármaco necesaria para bloquear las fibras A y C que se encargan de la conducción del dolor.
Si utilizáramos la totalidad del cemento (40,8g), la dosis máxima eluida de lidocaína se alcanzaría a los 14 días (336h) con un porcentaje de elución del 17,66%, correspondiente a 0,438g de AL. En cuanto a la bupivacaína, la dosis máxima se alcanzaría a los 7 días (168h) con un porcentaje de elución del 2,98%, correspondiente a 0,106g de bupivacaína.
En el caso de la lidocaína, la dosis máxima superaría a la dosis tóxica de 3,5mg/kg en un adulto de 70kg. En cambio, la bupivacaína no superaría la dosis tóxica de 2mg/kg en un adulto de 70kg19. En este sentido, hemos de tener en cuenta que esta interpretación descarta los fenómenos de absorción, metabolización y eliminación de los AL que estarían presentes en estudio in vivo.
Si interpretamos los resultados de elución obtenidos a las 72h, observamos que la cantidad de lidocaína eludida corresponde a 0,22g y la de bupivacaína a 0,09g. Estas cifras son cercanas a las dosis habituales utilizadas en bloqueos anestésicos de 0,20g de lidocaína y 0,14g de bupivacaína.
Respecto a la dosis necesaria de AL para conseguir un efecto terapéutico, podemos utilizar como referencia los estudios electrofisiológicos clásicos20–24 que determinan la cantidad de AL in vitro que bloquea la conducción nerviosa de las fibras A y C responsables de la transmisión de los estímulos dolorosos. Estos estudios in vitro establecen dosis de 0,084-0,8mM25,26 en el caso de la lidocaína y de 0,048-0,200mM24,27 en el caso de la bupivacaína.
Los resultados de elución obtenidos en nuestro estudio a las 72h en los dos grupos de estudio GL y GB superan las dosis mínimas establecidas para los dos fármacos.
Los AL pueden ser administrados en el contexto de la artroplastia de rodilla por diferentes técnicas como el bloqueo anestésico, la LIA (por sus siglas en inglés de local anesthetic infiltration), por punción articular o de forma experimental utilizando el cemento óseo como carrier de fármacos. Esta última técnica permitiría evitar los efectos adversos asociados a las técnicas anteriormente enumeradas y podría permitir una elución de fármaco mantenida durante más tiempo.
Posteriormente al análisis de elución de estos fármacos, deberíamos analizar cómo su adición al cemento óseo actúa sobre las propiedades de trabajabilidad y mecánicas.
Estudios previos han reportado que la adición manual de 2g de polvo de antibiótico al componente en polvo del cemento óseo reduce la resistencia en flexión un 20% y la resistencia al impacto un 23%10. Las normativas de los estándares internacionales ISO 5833:2022 Implants for surgery-Acrylic resin cements y del Standard Specification for Acrylic Bone Cement ASTM F451-16 establecen unos valores mínimos de resistencia a la flexión de 50MPa, resistencia a la compresión de 70MPa y módulo de Young de 1800MPa.
Respecto a los AL, Giordano et al.28 reportaron que la adición de AL al cemento óseo incrementa su resistencia al impacto. Lotfi et al.29 reportaron que los cementos óseos que fraguan en un entorno líquido que contiene ropivacaína disminuyen su resistencia a la compresión respecto a aquellos que fraguan al aire.
La principal limitación de este estudio es el hecho de no poder generalizar los resultados a las condiciones in vivo dado que es un estudio in vitro y el pequeño tamaño muestral analizado.
Nuestras líneas futuras contemplan la realización de las pruebas de trabajabilidad y mecánicas para confirmar que la adición de estos fármacos no altera estas propiedades del cemento óseo de PMMA. Y paralelamente, la posibilidad de utilizar otros anestésicos como la levobupivacaína o la ropivacaína, con una semivida media y con un perfil de seguridad alto.
Nivel de evidenciaNivel de evidencia V.
FinanciaciónEl presente trabajo ha sido parcialmente financiado por la Sociedad Española de Cirugía Ortopédica y Traumatología (SECOT) con la ‹‹Ayuda a Proyectos de Investigación en COT›› de la Fundación SECOT y por la Beca Josep Trueta de la Societat Catalana de Cirurgia Ortopèdica i Traumatologia (SCCOT).
Conflicto de interesesNinguno.
Los autores declaran que no existe conflicto de interés respecto a la obtención de los cementos óseos empleados de la marca Palacos® R+G ni de los anestésicos locales (hidrocloruro de lidocaína ni hidrocloruro de bupivacaína) de la marca Fagron®.