La sustitución protésica ha constituido uno de los avances más importantes durante las cuatro últimas décadas, desplazando antiguos procedimientos empleados en la terapéutica quirúrgica de la patología de la cadera, como la artrodesis o la artroplastia de resección1-4.
Los resultados prometedores obtenidos con las prótesis cementadas durante los años setenta estimularon su empleo en los pacientes afectos de coxartrosis5. Sin embargo, con el paso del tiempo comenzaron a observarse diferentes problemas relacionados con la cementación: tasa alta de fracasos protésicos en pacientes menores de 50 años, cercana al 50% en los primeros 10 años, según diferentes autores6-8, reacción inflamatoria producida por partículas de polimetilmetacrilato que daba lugar a zonas de osteolisis alrededor de la prótesis, la llamada «enfermedad del cemento»9-11, y problemas técnicos que planteaba la eliminación del cemento a la hora de la cirugía de revisión12. Estos problemas impulsaron el desarrollo de otras técnicas de fijación protésica como alternativa a la cementación. El objetivo básico consistía en lograr la fijación directa del implante, mediante el crecimiento óseo, con el fin de obtener la osteointegración activa de la prótesis al hueso receptor13-15.
Con esta idea, se fueron introduciendo durante los años ochenta una gran diversidad de implantes de cadera con el objeto de mejorar la estabilidad y el contacto óseo, incrementando así la probabilidad del crecimiento de hueso en el implante, la denominada fijación biológica. No obstante, a pesar de los excelentes resultados obtenidos con las prótesis no cementadas, se han observado, con el paso del tiempo, diferentes problemas, como son el despegamiento de la superficie de recubrimiento poroso, zonas de lisis periprotésica, migración distal del vástago femoral y una atrofia ósea en la zona proximal que comprometen de forma importante la estabilidad de estos implantes14,16,17.
La valoración postquirúrgica de los cambios remodelativos del hueso periprotésico, en particular la atrofia ósea y el estado de la interfase hueso-prótesis, resulta complicada. Mediante los métodos radiológicos, los más empleados en la actualidad para el seguimiento de estos pacientes, no se consiguen cuantificar de forma objetiva y en fases tempranas estos fenómenos15. La radiología convencional es un método de escasa sensibilidad, ya que es necesaria una disminución de la masa ósea mayor del 30% para poder ser detectada. Por otro lado, es una técnica poco reproducible al depender en gran medida de la técnica radiológica empleada, tipo de película, distancia al objetivo y grado de exposición del fémur16,18,19.
La osteolisis periprotésica aparece radiológicamente como un adelgazamiento difuso de la cortical femoral o como una lesión quística focal, que si es muy extensa puede dar lugar a grandes zonas líticas (fig. 1)17,20,21. La incidencia de osteolisis varía según el tipo de prótesis no cementada y depende fundamentalmente de la forma, tamaño, composición y tipo de recubrimiento en superficie.
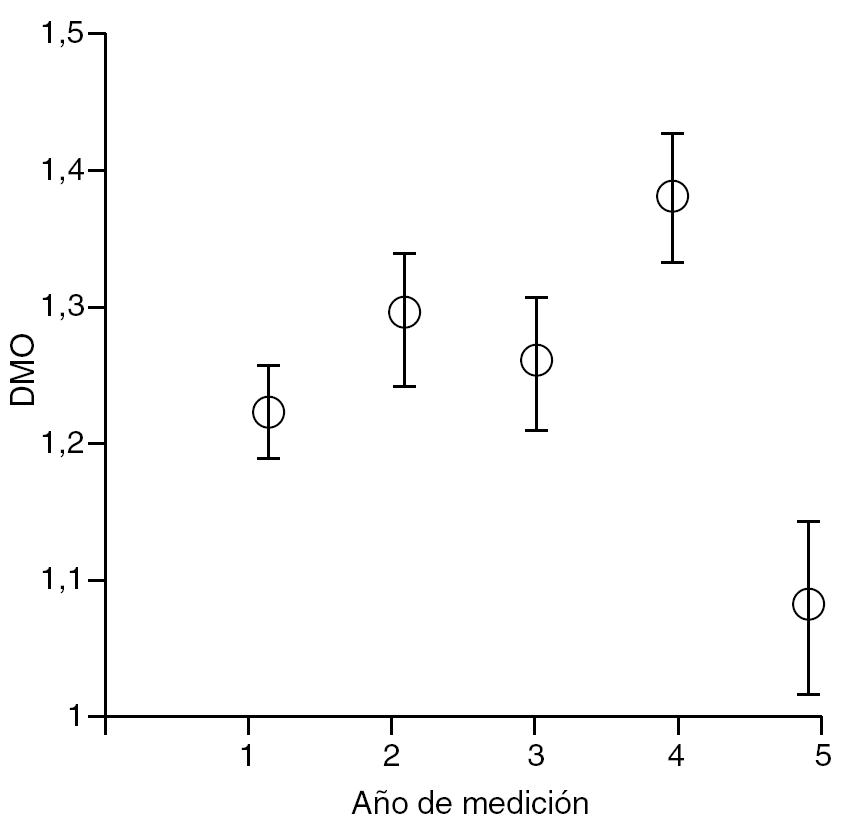
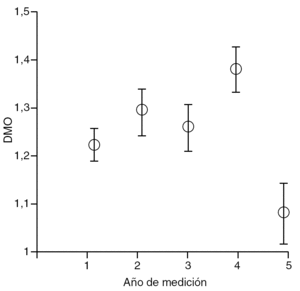
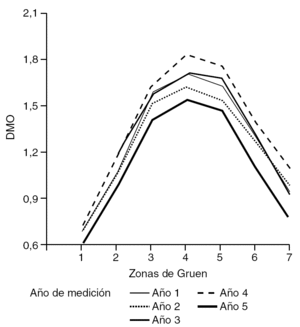
Figura 1. Intervalo de confianza de Bonferroni al 95%, según el año de medición. DMO: densidad mineral ósea.
La migración del componente femoral es otro fenómeno visible en el análisis radiológico. Desplazamientos no progresivos y menores de 3 mm no se consideran aflojamientos protésicos. Más bien, esto es consecuencia de un asentamiento del vástago en el canal femoral, tras un período variable postquirúrgico, que va a depender también del tipo de diseño protésico17,22,23. Los desplazamientos mayores de 3 mm darían lugar a una inestabilidad inicial del componente femoral y pondrían en peligro la osteointegración al hueso receptor.
Los estudios gammagráficos con el tecnecio 99 presentan una elevada sensibilidad en la detección y seguimiento de cualquier proceso patológico; sin embargo, su especificidad es muy limitada y una captación periprotésica no es sinónimo de aflojamiento del implante18,24,25. Así, en estudios isotópicos realizados para el control de artroplastias de cadera, se ha observado que el aumento de captación del radiofármaco se normaliza a nivel del cotilo a los seis meses, a nivel de la cortical diafisaria al año y en el calcar y el vértice del vástago femoral a los cinco años tras la cirugía, por lo que la captación del isótopo durante este período se puede considerar normal19,26,27. Otros métodos, como la tomografía axial computarizada (TAC) o la resonancia magnética nuclear (RMN), no permiten mediciones cuantitativas precisas de la masa ósea alrededor del implante protésico. Esto es debido a que el metal de la prótesis induce a errores en el análisis del hueso adyacente. A pesar del desarrollo en los últimos años de la técnica diagnóstica SPECT (tomografía de emisión de fotón único) y de su posible empleo en la evaluación del turnover óseo, no se ha demostrado su valor en la predicción o detección del fracaso protésico20,28,29.
En las últimas décadas, el desarrollo de técnicas absorciométricas ha permitido cuantificar de forma precisa la pérdida ósea involutiva que se produce a partir de la cuarta década de la vida. Estas técnicas se han utilizado para el diagnóstico y seguimiento de la osteoporosis, sobre todo en mujeres postmenopáusicas. Recientemente, gracias a la medición cuantitativa que realiza la densitometría sobre la masa ósea, se está empleando esta técnica para valorar el cambio óseo producido alrededor de un material extraño como es la prótesis de cadera21-23,30,31.
En el presente estudio se ha pretendido valorar la osteointegración de un modelo de prótesis de cadera anatómica, cuantificando los cambios óseos periprotésicos mediante densitometría de absorción de rayos X y establecer la influencia de la calidad ósea previa a la cirugía en el remodelado periprotésico (edad, sexo, peso, talla).
MATERIAL Y MÉTODO
En todos los pacientes se implantó un mismo modelo protésico (ABG II, Stryker©, Michigan, USA) con una configuración anatómica del componente femoral y hemisférica en el componente acetabular.
La fijación se restringe a la zona de la metáfisis, donde presenta un diseño en forma de escamas en las superficies anterior, posterior e interna del vástago, que le confiere una mayor estabilidad al implante. La zona proximal del vástago está recubierta de hidroxiapatita, presentando un espesor de unas 60 micras con el fin de obtener una fijación secundaria de la prótesis24,32,33.
El aparato utilizado en el estudio fue un densitómetro de tercera generación, Hologic QDR 4500.
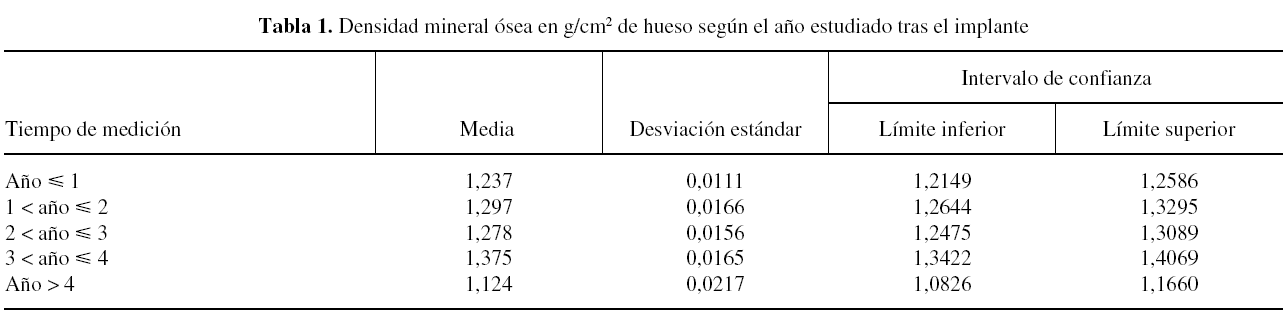
La evaluación de la adaptación de la prótesis de cadera ABG II en el tiempo se realizó controlando la densidad mineral ósea tras la intervención quirúrgica, tanto en la cadera protetizada como en la sana, la edad y el sexo y el índice de masa corporal (IMC). El procedimiento analizado consistió en comparar una cadera con prótesis y otra sin ella. Las zonas de medición fueron las tres de DeLee en el cotilo y las siete de Gruen en el fémur, y el tiempo transcurrido desde la operación hasta la densitometría en años (tabla 1).
A todos los pacientes se les solicitó un consentimiento informado, explicándoles fundamentalmente la técnica diagnóstica que se les iba a realizar y el fin de la misma.
Así, se seleccionaron los pacientes intervenidos de sustitución articular de cadera mediante la prótesis ABG II, con carácter primario, en el período comprendido entre enero de 1998 y diciembre de 2003, incluyendo un total de 73 pacientes.
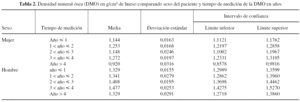
Los programas informáticos empleados en el estudio fueron: Systat 10.0 para la realización de la base de datos y Statgraphics plus versión 3.0 para el análisis estadístico. Independientemente de la respuesta analizada, sea la densidad mineral ósea (DMO) en el fémur o en el cotilo, el diseño de análisis de covarianza fue de cuatro factores y dos covariables (la edad y el IMC, los cuales no pueden ser controlados). La unidad experimental en este estudio está constituida por cada paciente, y la observación de la DMO de una determinada área ósea, bajo las condiciones en que ésta se realiza (sexo, procedimiento analizado, zona de medición y año de evaluación ósea). Se utilizó la prueba de hipótesis de Kolmogorov-Smirnov, dado que se trata de muestras pequeñas y variable aleatoria continua. Con el método de multicomparación se consiguió relacionar dos variables y obtener cómo influyen ambas en la respuesta. El método elegido fue el de intervalos múltiples de Bonferroni, procedimiento que utiliza el mismo valor del nivel de significación para todas las comparaciones y funciona independientemente de las características de cada diseño.
RESULTADOS
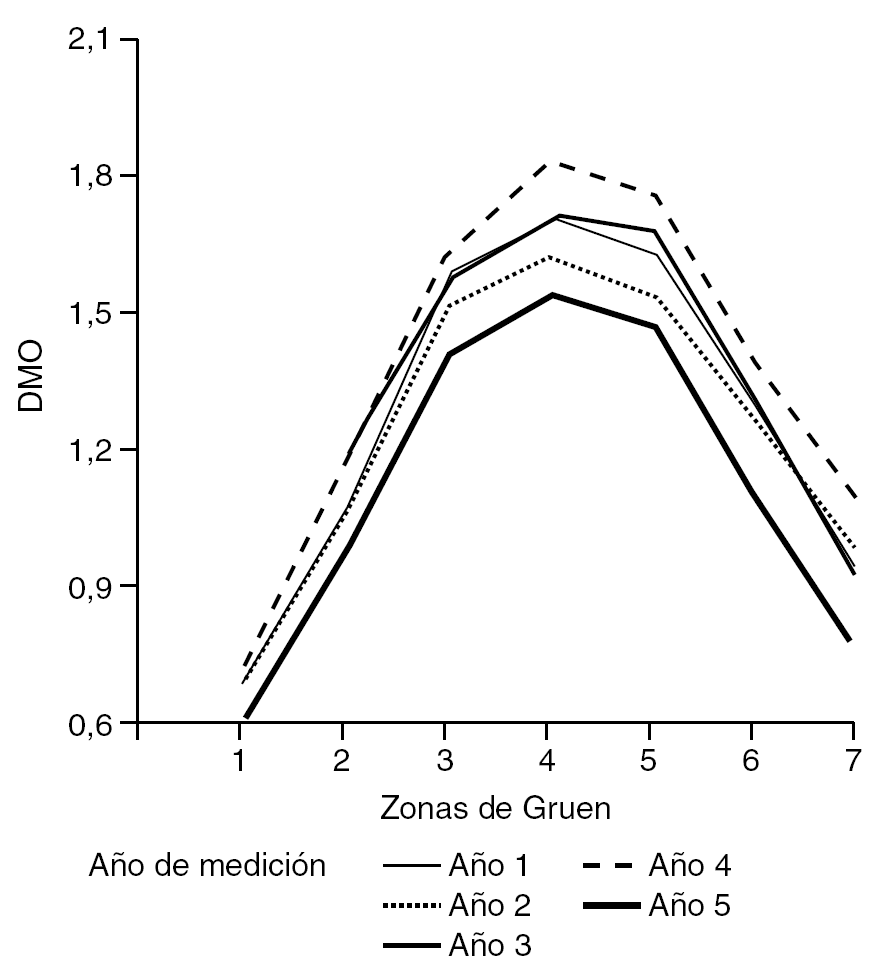
En cuanto al año de realización del estudio densitométrico tras la cirugía, se mostró cómo la DMO aumentó tras el primer año de la cirugía, manteniéndose en niveles hasta el cuarto año, momento en el que apareció un marcado descenso de la misma (tabla 1 y fig. 1).
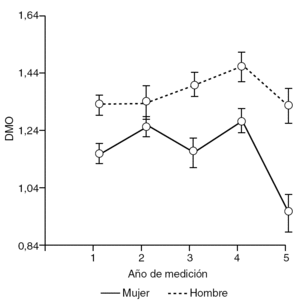
Tras el estudio general del contenido óseo en ambos fémures, se llevó a cabo el análisis de las interacciones entre los diferentes efectos principales. Examinando el comportamiento de la DMO según el sexo del paciente, comparando las caderas intervenidas con el grupo control, se observó cómo en el sexo femenino la DMO media es significativamente menor en las dos caderas analizadas. Sin embargo, es en el varón donde se observó un descenso más significativo de la DMO cuando se compararon ambas caderas (p < 0,05).
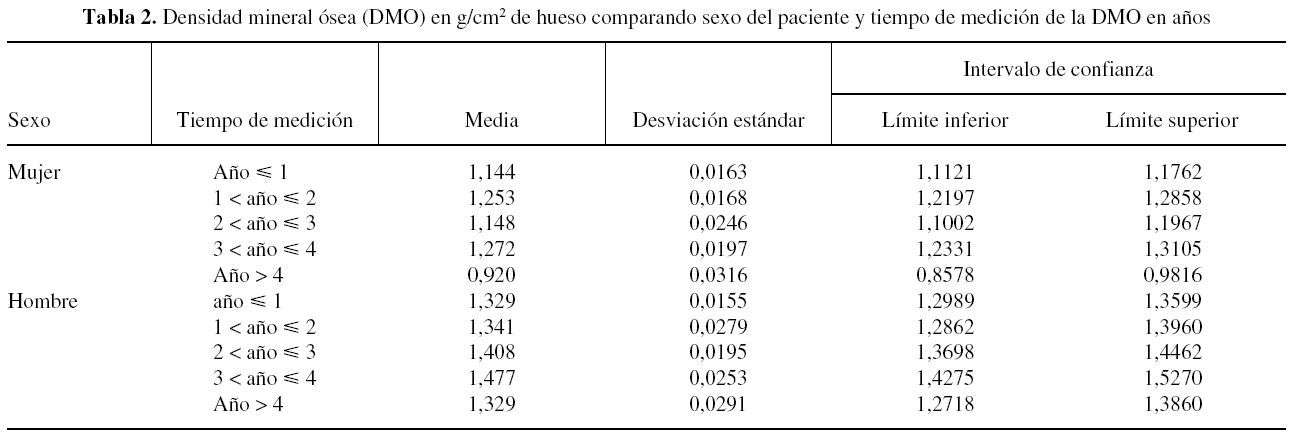
Al investigar los cambios de masa ósea alrededor del implante para varones y mujeres, se recogió cómo en el sexo masculino el cambio de la masa ósea a lo largo del tiempo apenas muestra diferencias. Esta variación fue incluso ascendente en el tercer y cuarto año tras la cirugía, para posteriormente descender en el quinto año a valores similares al primer año. Sin embargo, en el grupo de mujeres, con menor masa ósea que en el hombre, se apreció un descenso más acusado de la DMO a partir del cuarto año tras la implantación de la prótesis, (tabla 2 y fig. 2).
Figura 2. Interacción entre el sexo del paciente y el año de medición de la densidad mineral ósea (DMO).
Si se examina el gráfico de interacción entre año de medición y sexo (fig. 2), resulta evidente la interacción entre ambos efectos (p < 0,05), puesto que la DMO de las mujeres presentó una tendencia irregular a través del tiempo con respecto al comportamiento de los hombres. Así, al observar el tercer año de medición, mientras la densidad ósea de cadera de los hombres aumenta, la de las mujeres disminuye.
Interesa destacar los cambios de la DMO que se van produciendo en las diferentes zonas de Gruen, de la cadera intervenida, con el paso del tiempo postquirúrgico. Se observó cómo a partir del primer año la DMO iba aumentando en todas las áreas, siendo prácticamente constantes los valores hasta el quinto año (fig. 3). Es a partir de entonces cuando se produjo un descenso generalizado de la DMO en todas las áreas de Gruen, siendo más significativa en las áreas 1 y 7. Asimismo, se mostró cómo en la zona 7 existe una mayor dispersión de resultados en comparación con la misma área proximal pero externa, la zona 1 de Gruen.
Figura 3. Interacción entre las áreas de Gruen en la cadera intervenida y el año de medición de la densidad mineral ósea (DMO).
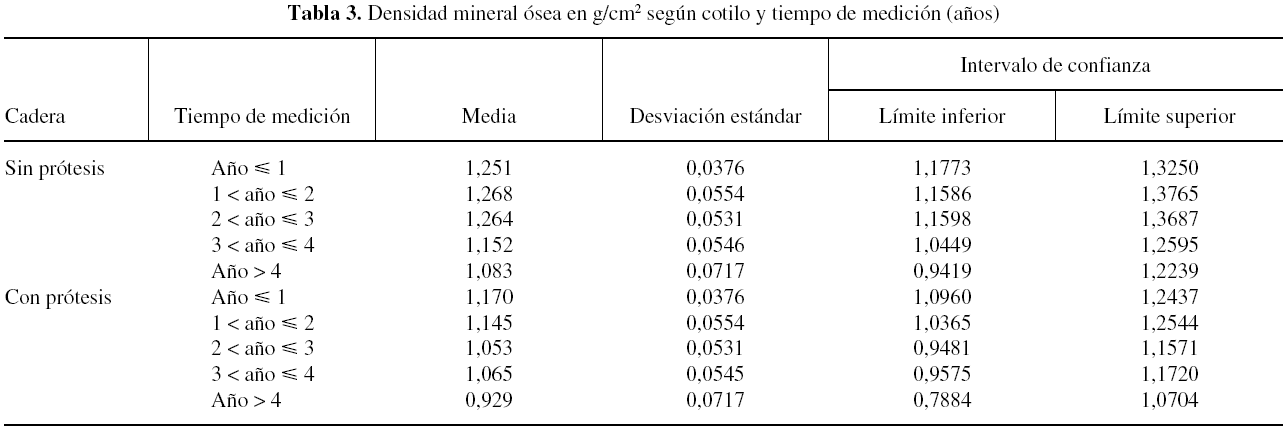
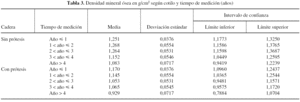
En cuanto al análisis de ambas caderas en relación al tiempo de medición analizado desde la cirugía hasta la densitometría, se muestra un descenso progresivo de la masa ósea en la cadera protetizada, que es más evidente a partir del tercer año tras la cirugía. El descenso de la masa ósea en el acetábulo control es progresivo, siendo más evidente a partir del tercer año (tabla 3).
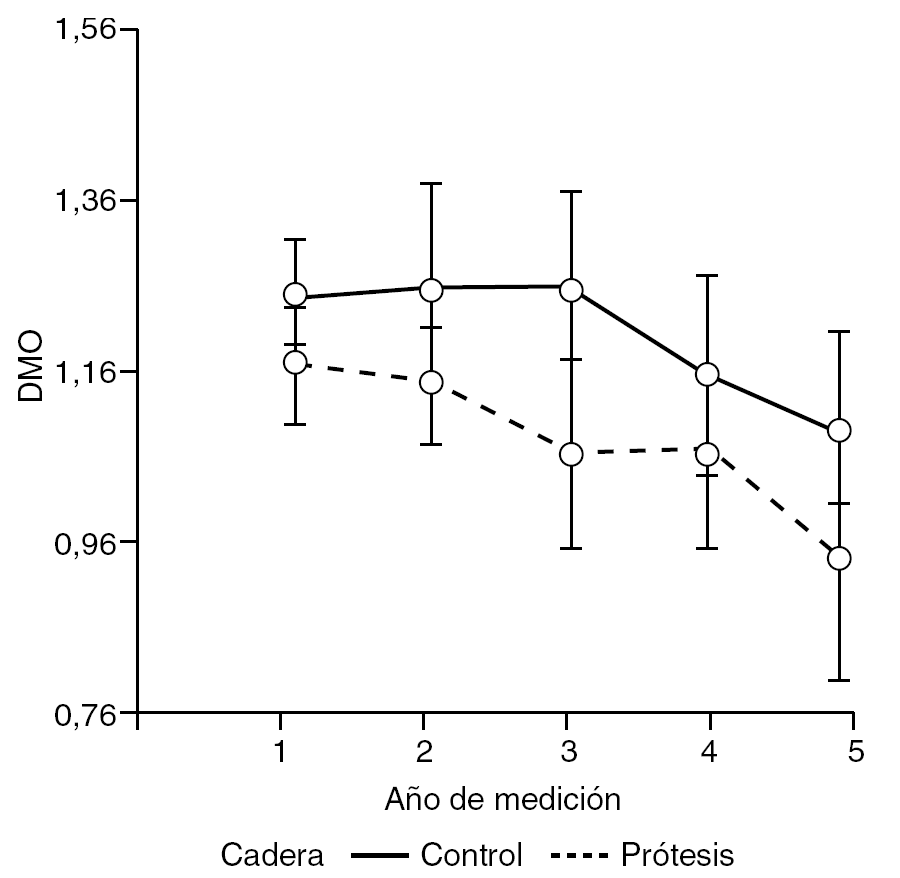
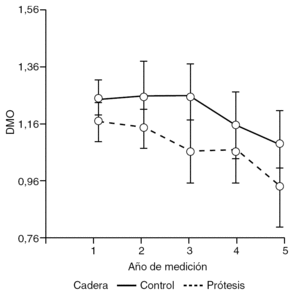
Por lo tanto, podría considerarse la existencia de interacción entre ambos efectos, sin embargo, según los resultados derivados del análisis de varianza, ésta no es suficientemente grande como para asumir que afecta la respuesta (DMO) (fig. 4).
Figura 4. Interacción entre el año de medición y cotilo analizado. DMO: densidad mineral ósea.
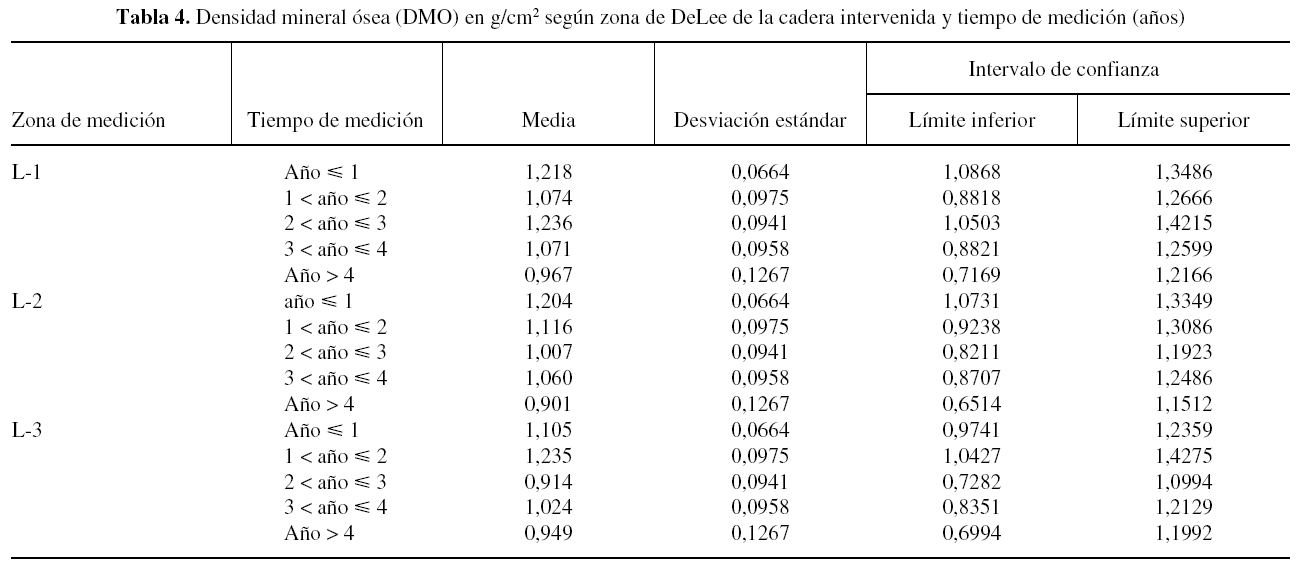
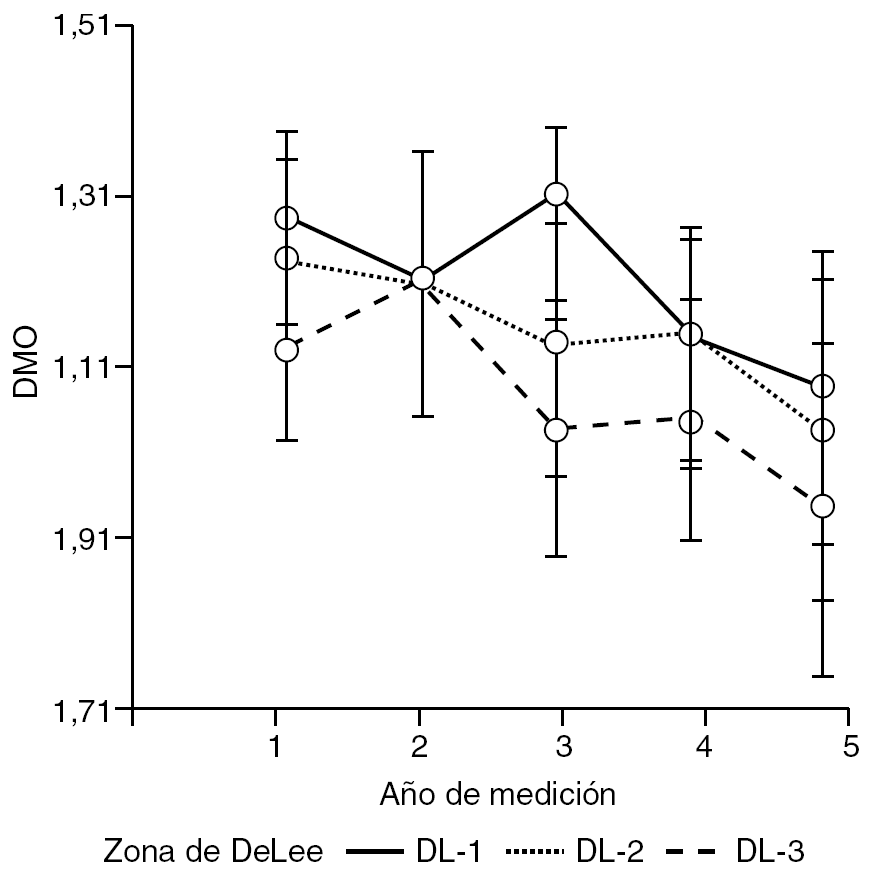
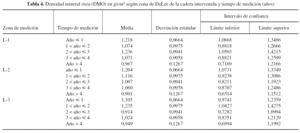
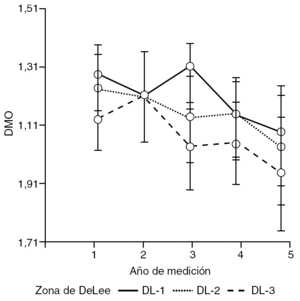
Al investigar los cambios que acontecen en las diferentes áreas de DeLee, de la cadera intervenida, con respecto al tiempo de medición densitométrica, se observa un descenso de la DMO en todas ellas. Es el área 3 de DeLee la que sufre mayor pérdida ósea a partir del tercer año tras la colocación del cotilo. En el área 1 se mostró cómo la DMO asciende hasta el tercer año, momento en el que se produjo un descenso constante hasta el quinto año. Es esta zona la que presenta mayor pendiente de descenso a partir del tercer año postimplante, (tabla 4 y fig. 5).
Figura 5. Interacción entre el año de medición y el área de DeLee analizada en la cadera con prótesis. DMO: densidad mineral ósea.
Asimismo, se aprecia que existe una homogeneidad, en el transcurso del tiempo, desde la colocación del implante hasta la realización de la densitometría ósea. La mayoría de los pacientes incluidos en la serie (34,25%) presentan menos de un año desde la cirugía y la prueba diagnóstica, oscilando a continuación, la distribución en frecuencia, hasta los 5 años de seguimiento, entre un 5 y un 20% cada año. De estos datos se deduce que aproximadamente a un 10% de los pacientes se los evaluó horizontalmente hasta los 5 años. Estos datos son comprensibles en un estudio prospectivo inicial. De seguir este estudio en su progresión, habría que pensar que dentro de 5 años, aproximadamente, el 35% de los pacientes dispondrán de un estudio comparativo horizontal anualmente hasta cumplir los 5 años.
El porcentaje de mujeres en las cuales se implantó la prótesis anatómica ascendió al 53,42%. En este grupo la masa ósea de forma generalizada es sustancialmente menor, con una media de 1,147 g/cm2 con relación a varones (1,377 g/cm2) a nivel femoral (fig. 2), mientras que a nivel acetabular es de 0,967 g/cm2 en mujeres y 1,308 g/cm2 en varones (fig. 3).
La DMO media es de 1,678 g/cm2 en el área 4, cuando se compara con las metafisarias superiores, DMO media de 0,680 g/cm2 en el área 1 (fig. 2).
Así, al analizar las diferentes áreas de Gruen, en ambas caderas, se observa un descenso de la DMO en la cadera con prótesis, en comparación con la contralateral sana. Se aprecia, en ambas caderas, una variación en cuanto a la respuesta del hueso en las distintas áreas de Gruen, siendo estadísticamente significativa (p < 0,05). Por ello cabe esperar que la respuesta ósea sea diferente en la cadera con prótesis, dando como resultado un descenso generalizado de la masa ósea, siendo ésta más evidente en determinadas zonas. Sin embargo, es llamativo cómo en ambas caderas el comportamiento en la variación de DMO de proximal a distal es el mismo. Este fenómeno se refleja en diferentes estudios densitométricos34,35.
En la zona metafisaria ínfero-interna (área 6) se aprecia un aumento de la DMO de más del 5%, área que se corresponde con la zona de fijación del vástago. Este fenómeno, a menudo, es puesto de manifiesto en estudios radiográficos mediante imágenes de densificación de la esponjosa, las cuales traducirían los cambios de fuerzas y la estimulación osteogénica del hueso periprotésico35,36. En contraposición, en la zona de la cortical súpero-externa (área 2) se muestra un descenso de la densidad ósea de menos 5 a menos 7%. Este último dato es contrario al mostrado por otro estudio37, donde encuentran incrementos de la DMO en el área 2. Este hecho puede estar en relación con un menor apoyo del vástago en la zona metafisaria externa en contraposición con un mejor apoyo interno, dando lugar a micromovimientos en la zona 2 de Gruen responsables de esta pérdida de masa ósea.
DISCUSION
Los cambios óseos adyacentes a la prótesis de cadera han sido tema de interés en ortopedia desde el comienzo de las artroplastias. El aflojamiento aséptico de la prótesis y la pérdida ósea periprotésica son procesos ampliamente estudiados debido a las nefastas consecuencias que conllevan25. Como problema añadido se encuentra el desarrollo de técnicas diagnósticas precisas que determinen de forma precoz el aflojamiento protésico26-28,34,38. Los métodos radiológicos, los más empleados en la actualidad, sólo detectan variaciones de la DMO por encima del 30%27,29,35,37. La mayoría de los estudios sobre cirugía protésica de cadera están basados en el análisis de datos clínicos y estudios de radiografías simples28,30. Mediante TAC y RMN únicamente se obtienen datos cualitativos de la pérdida ósea alrededor del implante. Es mediante la densitometría ósea como se diagnostican disminuciones de la DMO alrededor de la prótesis de cadera de aproximadamente un 5%29,31,36,39, lo que equivale a cambios de DMO de en torno a 0,16 g/cm2. Por todo ello, se considera la DEXA un método reproducible, capaz de analizar cuantitativamente la DMO alrededor del implante metálico30,32,40.
En el presente estudio, un mismo modelo de prótesis de cadera es analizado realizando grupos en cuanto a sexo, zonas de medición en las diferentes áreas examinadas y tiempo desde que se implantó la prótesis hasta la realización del estudio densitométrico.
La colocación adecuada del paciente en el momento de realizar la exploración densitométrica es fundamental, ya que es el factor más variable en este estudio, por lo que el correcto entrenamiento de las personas encargadas de realizarla es primordial. El paciente se debe colocar en decúbito supino, estabilizando el miembro inferior a explorar en rotación neutra.
No sólo la estabilidad inicial de la prótesis influye en la remodelación ósea, también va a depender de la extensión de la superficie porosa y de la rigidez del componente femoral, ya sea por el mayor diámetro de sección del vástago o por el distinto tipo de aleación que lo compone. Así, los vástagos más rígidos, con mayor diámetro y longitud, van a dificultar el relleno distal y como resultado van a mostrar una menor DMO alrededor de la punta, cuando son comparadas con prótesis más flexibles.
En el presente estudio, al analizar las variaciones de la DMO en el fémur intervenido, se comprobó que la edad, el peso y la talla establecían diferencias significativas entre subgrupos. Sin embargo, fue el sexo la variable inherente a los pacientes que más influyó en el remodelado óseo.
La presencia en el análisis estadístico de las covariables edad e IMC son fundamentales. Estas variables presentan valores significativos (para edad una p = 0,0415 y para IMC una p = 0,0103), lo que indica que ambas contribuyen a disminuir el error experimental y por consiguiente ayudan a detectar las verdaderas diferencias entre las caderas estudiadas, a la hora de analizar las variaciones de la DMO.
En cuanto a las diferencias de la DMO que acontecen entre hombres y mujeres, con el empleo de un modelo de prótesis anatómica de cadera, pueden justificarse por las variaciones encontradas en el contenido mineral óseo en el primer año de estudio.
Cuando se observan los datos de medición en las diferentes áreas del fémur, se aprecia que hay una mayor masa ósea en las zonas inferiores periprotésicas, hecho que se constata para ambos sexos.
Con el vástago anatómico ABG II se ha observado que la transmisión de cargas entre hueso e implante se lleva a cabo en una zona del fémur en la cual se alcanza un equilibrio entre la rigidez del hueso y la rigidez del vástago36,39,40. Esta zona corresponde a la parte superior del área 2 y área 6 de Gruen. Así, se intenta conseguir que la transferencia de cargas se traslade a zonas más proximales del fémur, manteniéndose el estímulo fisiológico para una mayor conservación ósea por debajo de dicha zona39,40. Este fenómeno se refleja en el presente trabajo, donde la DMO es más elevada en la zona metafisaria, en relación con el trocánter mayor y calcar.
Al analizar por separado las zonas más proximales del fémur intervenido, con el paso del tiempo se observa una mayor dispersión en los valores de la DMO en el calcar en comparación con el trocánter mayor. Aun siendo la zona 1 de Gruen la que presenta menor DMO en todos los años estudiados, es la zona del calcar donde se produce el descenso de la DMO de forma más significativa a partir del cuarto año postimplante (p < 0,05).
Otra zona interesante a estudio en la cadera intervenida, en cuanto a los cambios producidos con el paso del tiempo, es el área alrededor de la punta del vástago (área 4 de Gruen). En dicha zona se encuentra un ascenso progresivo de la DMO desde el primer año al cuarto postimplante, a partir del cual se produce un descenso evidente de la misma. Los eventos osteogénicos iniciales están en relación con fenómenos adaptativos entre implante y hueso receptor, mientras que los procesos líticos que ocurren a partir del cuarto año son debidos a micromovimientos de la zona distal de un vástago con anclaje fundamentalmente metafisario. Esta osteopenia distal daría como resultado un descenso o ausencia del efecto punta o formación en pedestal con el paso del tiempo en este modelo de tallo femoral.
Llama la atención al analizar la densidad ósea del cotilo según el tiempo de medición, cómo va disminuyendo la masa ósea en ambas caderas de forma casi paralela, aunque siempre con menor densidad ósea en el acetábulo intervenido. Podría decirse que el comportamiento de ambos cotilos es el mismo a través del tiempo. Este fenómeno puede explicarse por la elevada frecuencia de bilateralidad en la coxopatía de base, que hace de la cadera no intervenida una cadera más dolorosa, con el paso del tiempo, en comparación con la implantada. Consecuentemente, el paciente descarga de forma progresiva la cadera con coxartrosis, dando lugar a un descenso generalizado de la DMO en el cotilo control con el paso del tiempo40.
Al analizar los cambios que ocurren en las diferentes zonas óseas periacetabulares según los años de seguimiento (fig. 4), se aprecia un descenso de la DMO en todas ellas a partir del quinto año postimplante. Es interesante remarcar el comportamiento del área 1 de DeLee, donde la DMO asciende hasta el tercer año de seguimiento, momento en el que se produce un descenso progresivo hasta el último año del estudio. Esto se debe al anclaje adicional de los tornillos, los cuales se introducen en dicha zona40, dando lugar a un aumento de la fijación inicial y a una activación de los procesos osteogénicos entre el primer y tercer año. Sin embargo, a partir del tercer año de seguimiento se produciría un anclaje insuficiente por ineficacia de los tornillos, activándose entonces los fenómenos osteolíticos, siendo éstos responsables del descenso de la DMO en el área 1 de DeLee. En el área 2, la DMO se mantiene constante a través del período de seguimiento.
Al comparar ambos acetábulos se muestra cómo el comportamiento de la DMO del cotilo sano es más errático, en las diferentes zonas de DeLee, siendo al final del seguimiento la DMO prácticamente igual en las tres áreas. La pérdida de masa ósea en el cotilo control a partir del quinto año post-implante está en relación con la descarga del miembro no intervenido, que se va haciendo sintomático, y con la pérdida ósea involutiva que acontece con el paso del tiempo40.
*Premio Fundación SECOT de Investigación Clínica en Cirugía Ortopédica y Traumatología 2005.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.
Correspondencia:
J.A. de Pedro Moro.
Unidad Docente de Traumatología.
Facultad de Medicina.
Avda. Alfonso X el Sabio, s/n.
37007 Salamanca.
Correo electrónico: jpedrom@usal.es
Recibido: marzo de 2006.
Aceptado: junio de 2006.