La artrosis ya no se considera un proceso inevitablemente asociado al envejecimiento, sino un grupo heterogéneo de enfermedades con características comunes, secundarias a alteraciones bioquímicas y biomecánicas y que no sólo afecta al cartílago, sino al hueso subcondral y a todas las estructuras articulares. Sin embargo, aún quedan importantes lagunas en el conocimiento de la etiopatogenia de esta entidad. Consecuencia de ello es que los métodos terapéuticos utilizados habitualmente sólo proporcionen un alivio sintomático o puedan aplicarse exclusivamente en fases avanzadas, cuando es mejor conocida. Es pues necesario profundizar en el conocimiento de las alteraciones más precoces de la artrosis, de manera que seamos capaces de aplicar medidas preventivas y tratamientos que vayan más allá de la sustitución protésica y que de forma eficaz detengan la enfermedad o al menos reduzcan su velocidad de progresión.
LA ETIOPATOGENIA DE LA ARTROSIS SEGÚN LA MORFOLOGÍA
En la artrosis se afectan todos los elementos de la articulación, aunque por su especial relevancia patogénica hay que destacar los cambios que se producen en el cartílago y hueso subcondral. Se desconoce cual de estas dos estructuras se lesiona inicialmente o de forma predominante en los estadios más precoces, así como el papel etiopatogénico desempeñado por cada uno1.
Clásicamente se ha considerado que en la artrosis, por un fracaso biomecánico de la matriz fundamental, por una alteración de la función reguladora del condrocito o, más verosímilmente, por una combinación de ambos mecanismos, el tejido lesionado en primer lugar era el cartílago. Secundariamente, como una respuesta reactiva se produciría la alteración del hueso subcondral, por modificación de la biomecánica articular y por la reacción sinovial inflamatoria derivada de la absorción de partículas cartilaginosas. Esta secuencia fue firmemente cuestionada en los trabajos de Radin, que apuntaron que las alteraciones en el cartílago podrían ser derivadas de cambios patológicos en la rigidez del hueso subcondral2. Desde entonces, y sobre todo en los últimos años, numerosas publicaciones han subrayado la importancia del hueso subcondral en la patogenia de la enfermedad3-7.
A favor de la teoría clásica está el hecho de que uno de los cambios más tempranos de la artrosis sea el edema de la matriz extracelular, que es consecuencia de la pérdida del equilibrio entre la presión hidrostática existente en la matriz, que tiende a expansionarla, y la tensión de la malla de colágeno, cuyo objetivo es contenerla. Está demostrado que en la artrosis hay una depleción de proteoglicanos, como confirma el hipocromatismo observado en la matriz al teñirla con colorantes catiónicos como el azul alcián o la safranina O8. De igual modo, otros estudios han constatado un aumento en la síntesis de proteoglicanos en los estadios más precoces de la enfermedad, e incluso se ha sugerido que, al incrementarse el volumen por el edema, la concentración total de proteoglicanos podría permanecer invariada9. También se ha visto que la macromolécula de los proteoglicanos sintetizados en la artrosis es diferente a la de los agregados normales y se encuentra una mayor cantidad proporcional de fragmentos del mismo8. Todos estos datos hacen pensar que las alteraciones tincionales encontradas en la matriz del cartílago dañado podrían deberse a cambios en la distribución de los agregados o a una presencia superior de fragmentos de estos agregados.
También se lesiona la arquitectura del cartílago por una rotura y posterior fragmentación de las fibras colágenas secundaria a la debilitación entre los enlaces covalentes de las mismas8. Ello se traduce en un fracaso de la malla de colágeno en su función de soporte del tejido y de contención de la presión hidrostática existente en su interior. Estas alteraciones en los haces de colágeno tampoco se distribuyen uniformemente, y son más marcadas en las áreas donde la destrucción articular es mayor.
Además de la lesión del cartílago, está demostrado que en la artrosis existe un remodelado y esclerosis del hueso subcondral, que podría comprometer la capacidad de amortiguar y distribuir las cargas en la articulación, con el consiguiente efecto artrogénico2,7. Sin embargo, en estadios iniciales se ha detectado tanto un aumento como una disminución de la formación y reabsorción óseas, y no hay acuerdo sobre si estos cambios son precedentes, concomitantes o subsiguientes a las alteraciones en el cartílago, si son causa de las mismas o simplemente condición necesaria para su progresión10,11. Para aumentar la confusión, hay indicios de que las alteraciones óseas podrían ser sistémicas1.
Por otro lado, se ha implicado de forma relevante en la etiopatogenia de la artrosis a la zona de cartílago calcificado, mediante un doble mecanismo. En primer lugar, el avance de la limitante basófila llevaría asociada una disminución del espesor del cartílago3,4. En segundo lugar, la zona de cartílago calcificado podría ser el origen de factores de crecimiento que estimularían el remodelado óseo y harían que el cartílago fuera más vulnerable a estímulos mecánicos6. También se han identificado en esta capa grietas horizontales y verticales probablemente secundarias a fuerzas de cizallamiento a través de las cuales pueden penetrar vasos y transmitir una respuesta inflamatoria que probablemente juegue un papel importante en el desarrollo de la enfermedad5.
En consecuencia, queda un interesante campo de investigación abierto en el estudio de la etiopatogenia de la artrosis. Es necesario conocer qué estructura se altera inicialmente y cómo se modifica cada tejido con el transcurso del tiempo, lo que obliga a llevar a cabo estudios cuantitativos y secuenciales. En el ámbito de la clínica esta investigación descansa fundamentalmente en el estudio por imagen de las alteraciones articulares y de los marcadores de actividad biológica de la enfermedad.
LA ETIOPATOGENIA DE LA ARTROSIS SEGÚN LAS TÉCNICAS DE IMAGEN
Las limitaciones en el conocimiento de la etiopatogenia de la artrosis se deben en parte a la ausencia de métodos eficaces que reconozcan y analicen las alteraciones anatómicas en los estadios más precoces de la enfermedad y permitan seguir su historia natural. Las técnicas de imagen, al no ser destructivas, desempeñan un papel principal en la investigación de la artrosis. Sin embargo, y debido a las especiales características de la artrosis, que puede ser asintomática y de progreso lento, es necesario que las pruebas de imagen cumplan unos requisitos para poder ser aplicadas al estudio de la etiopatogenia de la enfermedad. Es preciso que tengan sensibilidad para detectar alteraciones en estadios precoces y discriminar cambios pequeños en su evolución. También deben contar con la especificidad y precisión suficientes para estudiar individualmente los distintos elementos articulares y hacer estimaciones cuantitativas de las alteraciones. Finalmente, la técnica debe ser tan inocua como para poder utilizarse repetidamente durante la prolongada evolución de la artrosis. Los métodos de imagen utilizados para estudiar la etiopatogenia de la artrosis son la radiología convencional, la tomografía computerizada, la ecografía y la resonancia magnética.
Aunque la radiología convencional es el método más frecuentemente utilizado para evaluar la artrosis, sólo proporciona una estimación indirecta de la degeneración del cartílago, que se expresa como una disminución del espacio articular, y se ha mostrado ineficaz para detectar lesiones precoces, por lo que su utilidad para investigar la lesión del cartílago es limitada12. Los métodos que han intentado incrementar la precisión de las determinaciones del espacio articular, como el empleo de calibradores o el análisis digitalizado de la imagen tampoco han conseguido superar esas dificultades13.
Sin embargo, al obtener una imagen del tejido calcificado, la radiografía constituye una técnica óptima para evaluar la participación del hueso subcondral en la artrosis. La limitación de su uso viene dada porque los signos específicos de deterioro óseo, como la esclerosis o la presencia de quistes u osteofitos, aparecen en fases tardías y progresan lentamente. La técnica de radiografía microfocal obtiene imágenes de gran aumento que permiten cuantificar con precisión la estructura del hueso14. Cuando este procedimiento se ha combinado con métodos morfométricos y estereológicos precisos, capaces de detectar y cuantificar cambios pequeños, ha demostrado ser muy útil para analizar el papel del hueso subcondral en la etiopatogenia de la artrosis15.
La tomografía computarizada proporciona una imagen de la anatomía ósea de gran calidad, es más sensible que la radiología convencional y permite obtener reconstrucciones tridimensionales, lo que la convierte en un instrumento excelente para analizar el papel del hueso subcondral en la patogenia de la artrosis. Ha demostrado su eficacia para evaluar cambios precoces en el hueso trabecular en modelos experimentales de artrosis3,10. Su principal inconveniente estriba en que se trata de una prueba que conlleva una cantidad no despreciable de irradiación ionizante, lo que limita su empleo en estudios secuenciales. Respecto al estudio del cartílago, la tomografía computarizada combinada con la artrografía, ha permitido seguir con precisión la evolución de la condromalacia rotuliana, pero el que se trate de una prueba que produzca irradiación y que como la radiología convencional sólo permita una estimación indirecta del grosor ha condicionado su utilización en la práctica clínica16.
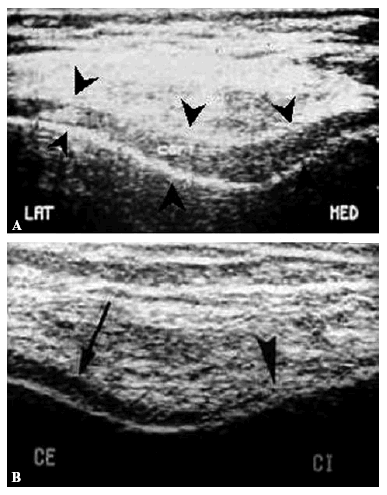
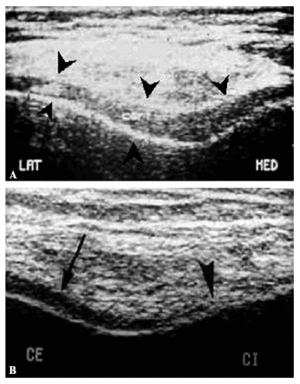
Con la ecografía pueden valorarse las alteraciones en la superficie y el grosor del cartílago (Fig. 1). Las determinaciones del grosor del cartílago han mostrado una buena correlación anatómica en estudios in vitro, y los estudios in vivo pueden reproducirse de manera fiable17. Por el contrario, los estudios morfológicos de la artrosis con ecografía han puesto en evidencia las limitaciones de la técnica, ya que, aunque con ella se pueden evaluar lesiones groseras del cartílago, tiene poca sensibilidad para detectar cambios precoces. Además, no da información de la patología del hueso subcondral y el acceso a las zonas sometidas a carga de articulaciones como la rodilla o la cadera está limitado por cuestiones anatómicas, por lo que sólo se puede valorar una muestra de la superficie articular total, lo que constituye un inconveniente severo para estudiar la patogenia de una enfermedad como la artrosis, que con frecuencia afecta a la superficie articular de forma irregular. Por todo lo expuesto, aunque la ecografía constituye una técnica complementaria eficaz para seguir la evolución de la enfermedad, tiene escasas aplicaciones en el estudio de su etiopatogenia.
Figura 1. Estudio ecográfico del grosor del cartílago rotuliano. A: Cartílago sano. Puede delimitarse el cartílago y cuantificar su grosor. B: Cartílago artrósico. En la superficie articular lateral el cartílago se identifica con facilidad (flecha). En la vertiente medial el espesor del cartílago ha disminuido y el tejido adquiere un aspecto desflecado (cabeza de flecha).
La obtención de imágenes mediante resonancia magnética (RM) constituye un método diagnóstico ideal para la evaluación de las enfermedades osteoarticulares y para investigar la etiopatogenia de la artrosis. Proporciona una definición anatómica y clara de los tejidos blandos, tiene una resolución espacial muy alta, obtiene imágenes en múltiples planos y permite una visualización directa del cartílago. También posibilita la cuantificación de sustancias y variables funcionales implicadas en la fisiopatología del aparato locomotor. Además, esta técnica no tiene efectos adversos y se tolera lo suficientemente bien como para utilizarla en exámenes secuenciales incluso en pacientes asintomáticos. Desde el punto de vista experimental no es destructiva, por lo que puede utilizarse para estudiar simultáneamente varias características en la misma pieza. A pesar de estas cualidades, la incorporación de la RM al estudio de la artrosis es todavía lenta porque el cartílago es un tejido especialmente difícil de analizar con esta técnica, debido a la falta de contraste entre este tejido y las estructuras adyacentes18.
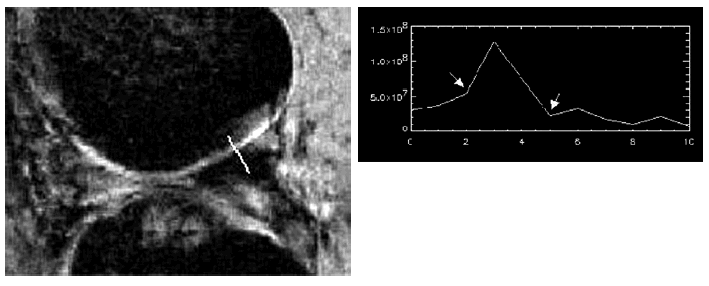
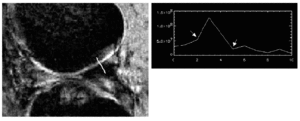
Estas dificultades han estimulado la investigación de nuevas secuencias para delimitar con claridad el cartílago articular. Aunque hasta la fecha no existe un consenso acerca de cuál es la secuencia ideal para estudiar el cartílago, las secuencias de eco de gradiente ofrecen una gran gama de contrastes y han permitido medir el volumen del cartílago19-21. Entre éstas las secuencias con supresión de grasa proporcionan imágenes en las que el cartílago queda contrastado al ser la única estructura brillante de la articulación, por lo que han demostrado ser las mejores para cuantificar las alteraciones en este tejido y valorar su implicación en la patogenia de la artrosis20-22. A tal fin se han aplicado técnicas de análisis digitalizado y de procesamiento de la imagen fundamentados en la geometría analítica que han demostrado una excelente correlación con las alteraciones histopatológicas15,23 (Fig. 2). Además de los estudios que determinan el grosor o el volumen, la RM también detecta variaciones en la intensidad de señal del cartílago24. Estas variaciones son consecuencia de los cambios en la hidratación del tejido resultado de la alteración en la composición de proteoglicanos, que es uno de los cambios más tempranos en la artrosis. Ciertas secuencias, como las de eco-espín, ofrecen una imagen nítida de la placa y del hueso trabecular subcondral, por lo que la RM también se ha aplicado con éxito para investigar la participación del hueso subcondral en el desarrollo de la artrosis25.
Figura 2. Determinación computarizada del grosor del cartílago femoral en imágenes de RM. Mediante un método computarizado se obtienen líneas perpendiculares al cartílago que recogen los cambios de intensidad de señal. El «pico» de la curva corresponde al aumento de intensidad de señal del cartílago. El grosor del cartílago puede medirse calculando la distancia entre los dos puntos «valle» de la curva (flechas), que indican la caída de intensidad correspondiente al hueso subcondral y al líquido sinovial
Además de los problemas de contraste, el cartílago es un tejido difícil de evaluar por RM debido a que se trata de una fina lámina difícil de cuantificar por la limitada resolución espacial de los sistemas de RM habitualmente empleados en clínica. Numerosos trabajos han medido con éxito pequeñas alteraciones del cartílago utilizando equipos de RM de alto campo. La principal ventaja de estos sistemas es que proporcionan una buena resolución espacial y han demostrado ser de gran utilidad en la investigación de la etiopatogenia de la artrosis15. Está no obstante por certificar la inocuidad de estos sistemas en la práctica clínica y, hasta la fecha, sólo se han aplicado a nivel experimental.
LA ETIOPATOGENIA DE LA ARTROSIS SEGÚN LOS MARCADORES BIOLÓGICOS
La búsqueda de marcadores biológicos de actividad de la artrosis en suero, orina o líquido sinovial es un capítulo todavía no bien resuelto y en el cual se centran las más recientes investigaciones. Mediante diversas técnicas de laboratorio se detectan y cuantifican los metabolitos o fragmentos de moléculas derivados de su síntesis y destrucción, es decir, del proceso de recambio estructural del cartílago. El conocimiento de estos procesos puede ser de gran utilidad para descifrar la patogenia y evolución de la enfermedad. Desgraciadamente, estas técnicas todavía son muy costosas, no se dispone de ellas en todos los laboratorios y aún no se conocen en profundidad la sensibilidad y especificidad de cada una.
Metabolismo del cartílago y aclaramiento de metabolitos
En condiciones normales, el cartílago articular muestra un perfecto equilibrio entre los fenómenos de síntesis y degradación de la matriz extracelular. Sus distintos componentes se regulan de diferente manera, de forma que, por ejemplo, el recambio del colágeno tipo II es mucho más lento que el del agrecano, proteoglicano mayoritario del cartílago hialino; la actividad de los condrocitos varía también según la zona del cartílago donde estén situados.
La liberación de los componentes de la matriz cartilaginosa deriva de la degradación del cartílago maduro, pero también puede ser consecuencia de un incremento en su síntesis lo cual da lugar, a veces, a la producción de nuevas moléculas, denominadas neoepítopos, que pueden ser estudiadas mediante anticuerpos26.
Después de la digestión enzimática, las macromoléculas de la matriz cartilaginosa abandonan el cartílago y alcanzan el líquido sinovial, donde sufren una nueva degradación. Desde el espacio sinovial entran en el torrente linfático y llegan a los nódulos linfoides. Parte de los metabolitos son retenidos y degradados definitivamente a este nivel, mientras que otros atraviesan los ganglios linfáticos y alcanzan la circulación27. Un factor de confusión en la interpretación de los niveles séricos de un marcador del cartílago es la posible interferencia que pueden producir en los mismos las fuentes tisulares extraarticulares del propio marcador, lo cual debilita la posibilidad de encontrar un marcador absolutamente fiable de lo que ocurre en la articulación lesionada28.
Marcadores séricos de lesión y reparación del cartílago
Puesto que el agrecano y el sulfato de queratano son los componentes predominantes del cartílago y tienen un rápido recambio metabólico, reúnen las condiciones ideales para ser marcadores de la lesión tisular. Sin embargo, hasta el momento actual no se ha demostrado la utilidad de estos compuestos para investigar la etiopatogenia de la artrosis29.
El colágeno tipo II es el componente orgánico mayoritario de la matriz del cartílago articular. A diferencia de la degradación de los proteoglicanos, que se considera un fenómeno reversible, la destrucción del colágeno representa una fase irreversible de la lesión cartilaginosa. El propéptido C-terminal del colágeno tipo II (CPII) es un producto de la síntesis de este colágeno que puede cuantificarse en el suero y otros fluidos corporales. La tinción inmunohistoquímica para CPII se encuentra aumentada en el cartílago artrósico, fundamentalmente en las áreas donde se produce mayor degradación del cartílago, pero hasta la fecha este marcador no ha demostrado su utilidad en la artrosis a pesar de expresar la respuesta inicial reparadora de los condrocitos30. La degradación del colágeno produce liberación de fragmentos de los ligandos cruzados de piridolina y deoxipiridolina que pueden ser cuantificados en orina por cromatografía líquida de alta presión o por métodos inmunológicos31. El principal inconveniente de estos procedimientos es que no diferencian entre el colágeno tipo I y II y reflejan más la degradación del hueso que la del cartílago. La degradación del colágeno tipo II da lugar también a la formación de telopéptidos (IICTP), pero su utilidad como marcadores aún está en fase de investigación en estudios clínicos y en modelos animales de experimentación. El empleo de anticuerpos contra los neoepítopos carboxi y aminoterminal generados por la fragmentación del colágeno II por diversas metaloproteasas ha podido demostrar la acción directa de la colagenasa en la fragmentación de las fibras de colágeno del cartílago y su actividad incrementada en las artrosis32.
La proteína oligomérica de la matriz del cartílago (COMP) es una macromolécula, miembro de la familia de las trombospondinas, que se encuentra en elevadas cantidades en el cartílago, aunque recientemente ha sido demostrada su síntesis en otros tejidos tales como los meniscos, los tendones, la piel y la membrana sinovial33. Los niveles de COMP en el líquido sinovial y el suero han sido minuciosamente estudiados en la artrosis. Los estudios longitudinales han demostrado una elevación de los niveles de COMP en los enfermos con una artrosis acelerada con respecto a aquellos con enfermedad estable a lo largo de 5 años. En uno de estos estudios se definió la progresión de la enfermedad como una reducción del espacio articular de al menos 2 mm en la radiología simple34. Lógicamente, los resultados han de ser interpretados con precaución, ya que los criterios quirúrgicos dependen de factores subjetivos y la técnica radiológica empleada puede dar medidas variables de la interlínea articular. En otro estudio longitudinal se observaron niveles elevados de COMP en pacientes con gonartrosis respecto a sujetos controles después de 3 años de seguimiento. Se apreció, además, correlación entre el grado de captación del marcador radiactivo en la gammagrafía ósea y los niveles séricos del marcador35. De toda esta información puede deducirse que la COMP procede no sólo del cartílago lesionado, sino de otros tejidos articulares como la membrana sinovial.
Además de los marcadores descritos, existen otros que, aunque se han estudiado con menor profundidad, podrían desempeñar un papel importante en el estudio de la etiopatogenia de la artrosis. El ácido hialurónico es un constituyente de todas las matrices extracelulares y se encuentra en abundancia en la membrana sinovial y el cartílago. Sus niveles plasmáticos se elevan de manera significativa en la artrosis, pero su significado es incierto ya que la sinovial es la fuente principal de esta molécula36. Otro gran número de constituyentes de la matriz cartilaginosa, entre los que destacan el versicano, la decorina, el biglicano, la fibromodulina y la osteonectina, se producen en grandes cantidades en la artrosis, lo cual tal vez representa un intento de reparación por parte del tejido lesionado, pero aún está por demostrar su utilidad como marcadores de la enfermedad37,38.
Marcadores identificados en el líquido sinovial
El volumen del cartílago en una articulación representa un reservorio de marcadores para su secreción hacia el líquido sinovial. De ello se deduce que la cuantificación de un marcador en líquido sinovial tiene mayor relevancia en los estadios iniciales de la artrosis, cuando el grosor del cartílago aún no ha disminuido, la síntesis de proteoglicanos está incrementada y la reparación condrocitaria es un fenómeno activo. En contraste, en fases avanzadas de la enfermedad parece existir una relación inversa entre la concentración de proteoglicanos en líquido sinovial y el grado de pérdida cartilaginosa.
Cualquier metabolito procedente del cartílago articular, fibrocartílago, tendones y ligamentos, sinovial y hueso subcondral es secretado al espacio articular dependiendo de factores tales como la composición y permeabilidad de la matriz extracelular del tejido, la cinética de su síntesis y degradación y las interacciones entre el marcador y otros componentes de la matriz. Una vez que el marcador ha entrado en el líquido sinovial su concentración, lógicamente, dependerá del volumen de líquido existente en ese momento, pero realizar una medida fiable de dicho volumen es técnicamente muy difícil ya que siempre después de una artrocentesis queda un volumen de líquido sinovial residual significativo39.
Por otro lado, la concentración de un marcador en líquido sinovial depende de otros factores como la inflamación articular, la cual induce cambios en la permeabilidad de los capilares sinoviales y en el espacio intersticial, y el dolor, que interfiere con el movimiento de la articulación.
Las proteínas y otras macromoléculas presentes en el líquido sinovial atraviesan el intersticio y llegan a los linfáticos sinoviales40. Su concentración, pues, depende del grado de flujo linfático desde la articulación, parámetro que puede estimarse midiendo el aclaramiento de albúmina sérica radioiodinada (RISA) desde la articulación41. Para investigar el efecto de la sinovitis de bajo grado en el «lavado» de los marcadores se ha medido el aclaramiento de RISA en la rodilla de perro normal después de la inyección intraarticular de una cantidad significativa de pirofosfato42. La sinovitis inducida, por leve que sea, se acompaña de un incremento en el aclaramiento de RISA, de lo cual se deduce que en la pequeña sinovitis que se produce en la artrosis se incrementa significativamente el aclaramiento de proteínas desde el espacio articular.
El queratán sulfato y el condroitín sulfato son glicosaminoglicanos constituyentes de los proteoglicanos del cartílago articular que pueden encontrarse en el líquido sinovial de pacientes con artrosis como fragmentos de moléculas de agrecano43-46. La concentración en líquido sinovial de estas moléculas y del propéptido del colágeno tipo II se han usado como marcadores de actividad y gravedad de la artrosis47-49. Pueden encontrarse también elevadas en líquido sinovial metaloproteasas tales como colagenasa, gelatinasa y estromelisina, el inhibidor tisular de metaloproteasas y las citocinas25,26. En la artrosis canina inducida experimentalmente por sección del ligamento cruzado anterior se han detectado niveles muy elevados de queratán sulfato en líquido sinovial52. El líquido sinovial obtenido de pacientes que han sufrido una rotura traumática del ligamento cruzado anterior, condición clínica que se asocia a una alta incidencia de artrosis, contiene también altas concentraciones de queratán sulfato y citocinas53.
FUTURO
La elevada incidencia de artrosis en la población, junto con su progresivo envejecimiento, está produciendo un interés creciente por el conocimiento de la patogenia de esta enfermedad. Para profundizar en este conocimiento es imprescindible realizar estudios cuantitativos que puedan detectar cambios precoces. Las técnicas de imagen constituyen herramientas muy útiles para este objetivo y ofrecen la posibilidad de seguir el curso de la enfermedad, lo que tiene una aplicación inmediata en la evaluación de la eficacia de los tratamientos de la artrosis. Todos los métodos de imagen tienen inconvenientes, pero entre ellos, la RM parece el más eficaz para valorar las alteraciones articulares. Pese a estas condiciones, queda por definir las secuencias de pulso óptimas para delimitar el cartílago y para estudiar los cambios más precoces de los diferentes componentes articulares. Una vez superadas estas dificultades es muy probable que la RM sea el patrón oro para investigar la etiopatogenia de la artrosis y estudiar su evolución. La radiología convencional y la tomografía computerizada siguen desempeñando un papel principal en la detección de alteraciones tempranas en el hueso subcondral, pero tienen limitaciones importantes para evaluar el cartílago. Debido a la incapacidad para examinar toda la articulación, la ecografía se presenta como una técnica eficaz para seguir la enfermedad, pero es menos útil para investigar la patogenia de la artrosis.
Las limitaciones de los métodos de imagen ha impulsado la búsqueda, identificación y validación de diferentes marcadores bioquímicos que puedan darnos alguna información sobre la progresión de la enfermedad. La lista de marcadores potenciales aumenta según crece el conocimiento sobre la composición y biología del cartílago, aunque muy pocos parecen ser realmente aplicables en la clínica. Antes de poder recomendar su empleo han de confirmarse los datos preliminares publicados hasta el momento.