La mayoría de alteraciones del sistema músculo-esquelético pueden definirse mediante un diagnóstico de presunción, que se basa especialmente en una valoración clínica, radiológica y analítica1-3. Sin embargo, determinadas lesiones precisan ser biopsiadas, especialmente aquellas lesiones focales cuyo origen pueda ser neoplásico o infeccioso1,3,4. En un sentido amplio se puede afirmar que la biopsia es necesaria ante toda alteración en la que la obtención de muestra de tejidos pueda ser determinante para su diagnóstico, su estadiaje o su tratamiento3. Existen dos tipos fundamentales de biopsia ósea (BO): abierta o quirúrgica (BQ) y cerrada, percutánea o por punción (BP). La BQ implica incisión en la piel; la BP no requiere incisión pues recurre a agujas o trefinas. Las BO por aspiración, percutáneas y por punción se describieron a principios de la década de los treinta, siendo la biopsia vertebral percutánea (BVP) descrita por primera vez en 1935 por Robertson y Ball5, con seis casos de punción-aspiración raquídea. En 1948, Valls6 describe una técnica estandarizada de BVP utilizando agujas de aspiración y un aparato externo no radiológico, y limitándola a la zona torácica inferior y lumbar, evitando la zona torácica alta para evitar complicaciones. Obtuvo resultados satisfactorios en un 68% de 86 casos. Esta técnica será adaptada y modificada por otros autores como Ray7 y Frankel8. También Ottolenghi en una serie de más de mil biopsias percutáneas describe la técnica de la biopsia torácica aunque sigue limitándola a T9 e inferiores9. La técnica moderna de BVP con el uso de control radiológico se describe en 1956 cuando Craig10 publica las dos primeras BVP con trefina. A partir de la década de los ochenta comienzan a publicarse series amplias de biopsia ósea percutánea (BOP) o BVP guiadas por tomografía computarizada (TC) que muestran buenos resultados11-14. Esta metodología se ha generalizado y afianzado en los últimos años, de manera que la TC se ha convertido en la técnica de elección para dirigir las BVP15-23. Además, con modalidad de «TC-escopia» permite un control continuado de la situación de la aguja, donde el avance se muestra prácticamente en tiempo real4,24,25.
La hipótesis de nuestro trabajo ha sido que la BVP es una técnica fiable, sensible, específica, reproducible y segura para el diagnóstico de las lesiones focales de la columna vertebral. También se pretende demostrar que la BVP guiada por TC es la técnica de elección para confirmar la sospecha de patología en el raquis y establecer el diagnóstico específico de aquellas lesiones focales que precisan un tratamiento médico y/o quirúrgico, especialmente de las neoplasias malignas y las infecciones. Indicada correctamente y practicada en condiciones óptimas, la BVP es una técnica que consigue obtener una muestra adecuada para un diagnóstico histológico en un porcentaje de casos equiparable al de la BQ. Finalmente, se pretende demostrar que esta técnica percutánea presenta pocos inconvenientes, siendo múltiples sus ventajas respecto a la BQ, destacando la mínima morbilidad para el paciente.
Hemos realizado un estudio retrospectivo de la BVP guiada por TC en el estudio de las lesiones focales de la columna vertebral (CV) con el objetivo de analizar la suficiencia de la muestra de tejido, la adecuación de la biopsia, sensibilidad y especificidad del diagnóstico y finalmente la seguridad del procedimiento con los criterios de inclusión que se describen en el apartado de material y método.
MATERIAL Y MÉTODO
Hemos realizado un estudio retrospectivo de una serie de 236 pacientes consecutivos sometidos a BVP desde febrero de 1993 hasta febrero de 2001 (8 años).
Criterios de inclusión
Los criterios de inclusión en la serie fueron la presunción diagnóstica de neoplasia o infección ante una lesión focal del raquis, la realización de BVP guiada por TC (ELSCINT modelo 2400 Elect, año de adquisición 1993) de dicha lesión y el seguimiento clínico-radiológico del paciente, incluyendo la respuesta al tratamiento, durante un periodo mínimo de un año.
Selección de enfermos y calendario
De los 236 casos recogidos se rechazaron 13 por los siguientes motivos: traslado a otro centro con imposibilidad de recoger datos (n = 5); paciente que no acude a controles clínicos o radiológicos (n = 4); pérdida de los resultados de la BVP (n = 2); paciente que no ha colaborado en la realización de la técnica, de tal manera que ésta fue incompleta (n = 1); fallecimiento de un paciente (n = 1) antes de 24 horas por complicaciones de su patología de base, que impidió un seguimiento mínimo para confirmar un diagnóstico. La serie definitiva para el estudio consta de 222 pacientes. En esta serie de 222 pacientes se practicaron 247 punciones. La mayoría de BVP consistió en una sola punción, mientras que en 25 pacientes se realizaron dos punciones, y hubo un solo caso de tres punciones. Si la BVP quedó bien indicada y fue aceptada totalmente por el paciente, debidamente informado, se procedió a programarla y realizarla en un intervalo de tiempo no superior a siete días. Los casos que presentaron clínica deficitaria neurológica de instauración reciente se consideraron como urgentes para el diagnóstico y fueron programados lo más pronto posible. La BVP no precisa ingreso del paciente. Todas las punciones se practicaron por un radiólogo experimentado (ARG). La mayoría de las muestras remitidas fueron estudiadas por el mismo equipo de patólogos. En todo aquel paciente que nos es remitido para realizar una BVP se requieren como condiciones previas: a) que aporte una exploración clínica y radiológica completa, con orientación diagnóstica; b) que haya sido informado de la técnica, cómo se le va a hacer y por qué; c) que confirme que ha entendido las explicaciones técnicas y dé el consentimiento por escrito, firmado por él y/o un testigo, y d) que venga acompañado de al menos un familiar o persona allegada.
El procedimiento técnico de la BVP ha seguido las normas publicadas en la bibliografía internacional2,16,17,22,23,26. Podemos biopsiar cualquier segmento de la columna vertebral, aunque pueden existir dificultades en acceder a las lesiones del arco anterior de C1 o del cuerpo de C2.
Técnica quirúrgica
El paciente se despoja totalmente de su ropa y objetos personales, se viste con una bata de exploración desechable y es colocado sobre la mesa de TC. Se canaliza una vena periférica en extremidad superior (flexura de codo o dorso de la mano) con un catéter cuyo diámetro mínimo sea 18G y se instaura una infusión de solución salina fisiológica (suero fisiológico, de 250 a 500 cc) para su mantenimiento y para tratamiento inicial de posibles reacciones adversas. A continuación se coloca al paciente en decúbito prono, que es la posición ideal para practicar la BVP. Solamente en algunas lesiones cervicales o ante intolerancia del prono por dolor insoportable, disnea o gran incomodidad se puede modificar la técnica utilizando el decúbito lateral, teniendo en cuenta en este último caso que el lado a biopsiar debe ser el contrario sobre el que se apoya el paciente, para tener un mejor acceso a la lesión. Las punciones en posición en decúbito supino son muy infrecuentes y se reservan generalmente a punciones de segmentos cervicales inferiores.
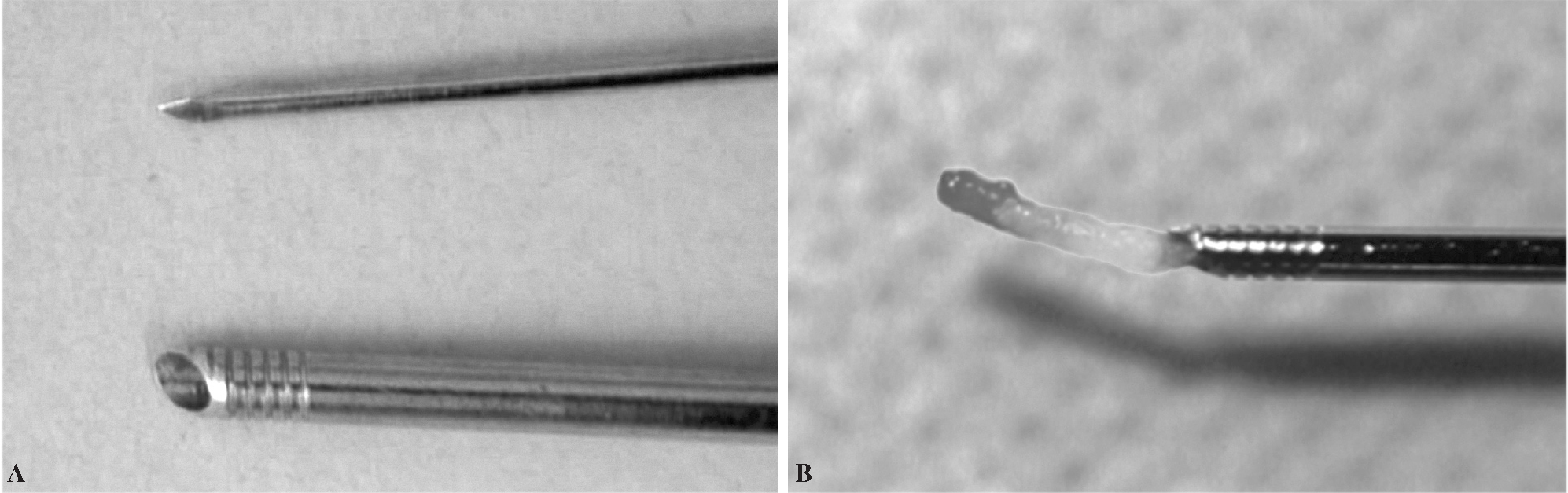
La inmensa mayoría de pacientes se atiende por vía ambulatoria y requieren únicamente anestesia local. Se ha utilizado en todos los casos de la serie la misma unidad de TC convencional (ELSCINT modelo 2400 Elect, año 1993), con un protocolo técnico determinado. Consiste básicamente en iniciar la exploración con un escanograma o scout view de localización sobre el cual se programan varios cortes finos (2,5-5 mm de grosor) en la zona problema. Han de ser cortes perpendiculares a la mesa, evitando siempre los cortes oblicuos, con angulación del gantry proximal o distal. Las angulaciones deben reservarse únicamente para calcular y definir el trayecto de la aguja siempre dentro del mismo plano de la lesión perpendicular al suelo, de tal manera que en cada corte repetido de dicho plano tengamos imagen de toda la aguja, angulada o no, desde la piel hasta su extremo. Sobre la imagen axial seleccionada en la pantalla de la consola programamos la vía de acceso, calculando distancias y midiendo ángulos con una precisión que puede llegar a ser de décimas de milímetro y de grado en grado. A continuación estas mediciones se trasladan al paciente buscando en primer lugar el punto de entrada mediante la colocación del marcador del aparato luminoso sobre el plano de corte seleccionado, lo que permite dibujar el plano seleccionado sobre toda la piel del dorso, teniendo como referencia la línea media central (palpación de apófisis espinosas). Se inyecta lidocaína al 1%, de 1 a 5 cc, llegando hasta la periferia de la lesión y a la cortical ósea, especialmente cuando haya periostio. Usamos una aguja más larga (de punción lumbar) para anestesiar tejidos más profundos. Usamos trefinas de tamaño pequeño medio. Las que más utilizamos son la Ostycut® (Angiomed, Bard, SA), cuyos calibres suelen ser 13G (diámetro muestra 2,4 mm), 14G (diámetro de 2 mm) o 17G (diámetro 1,4 mm) y cuya longitud varía entre 5 y 15 cm. Constan de una cánula de punta roma y roscada y un fiador rígido con punta afilada (fig. 1).
Figura 1. Agujas trefina usadas para la biopsia vertebral percutánea. A) Extremo con rosca. B) Retención del cilindro de tejido.
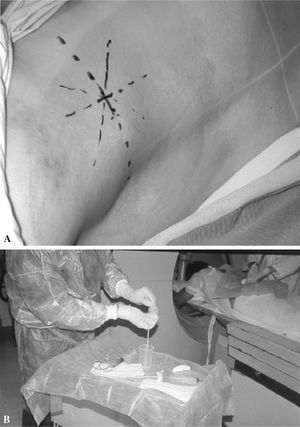
Una vez alcanzada la periferia de la lesión se confirma la correcta situación del extremo de la aguja mediante TC y se advierte al enfermo de que la exploración está en su fase más importante, por lo que debe intentar colaborar para finalizarla satisfactoriamente. Comienza la técnica coaxial, con la introducción de una aguja fina por el interior de la cánula de la trefina, cuya longitud ha de ser algo mayor que la de la propia trefina para alcanzar y atravesar la lesión (figs. 2-8).
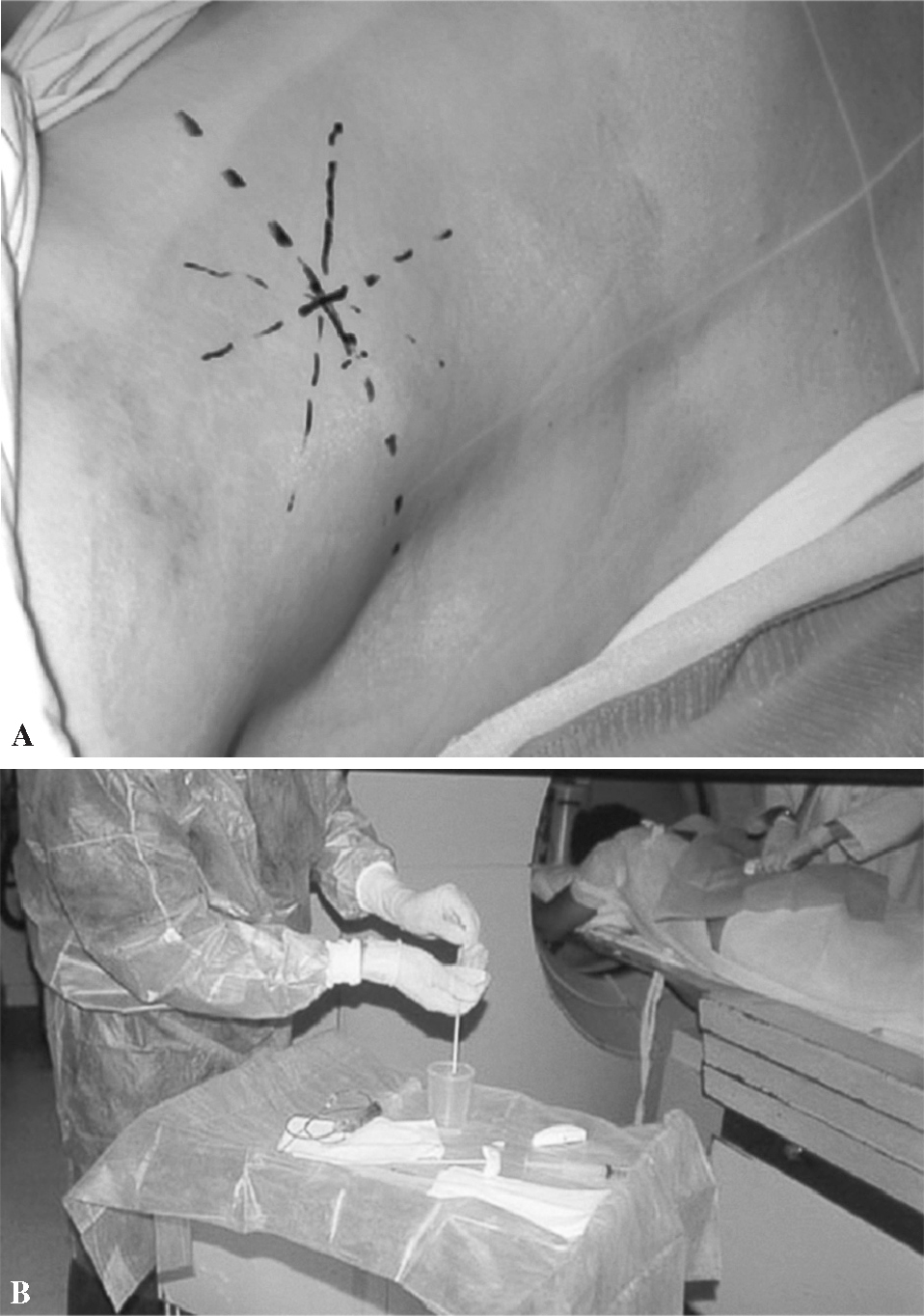
Figura 2. Marcaje del punto de entrada (A) y mesa de trabajo preparada (B).
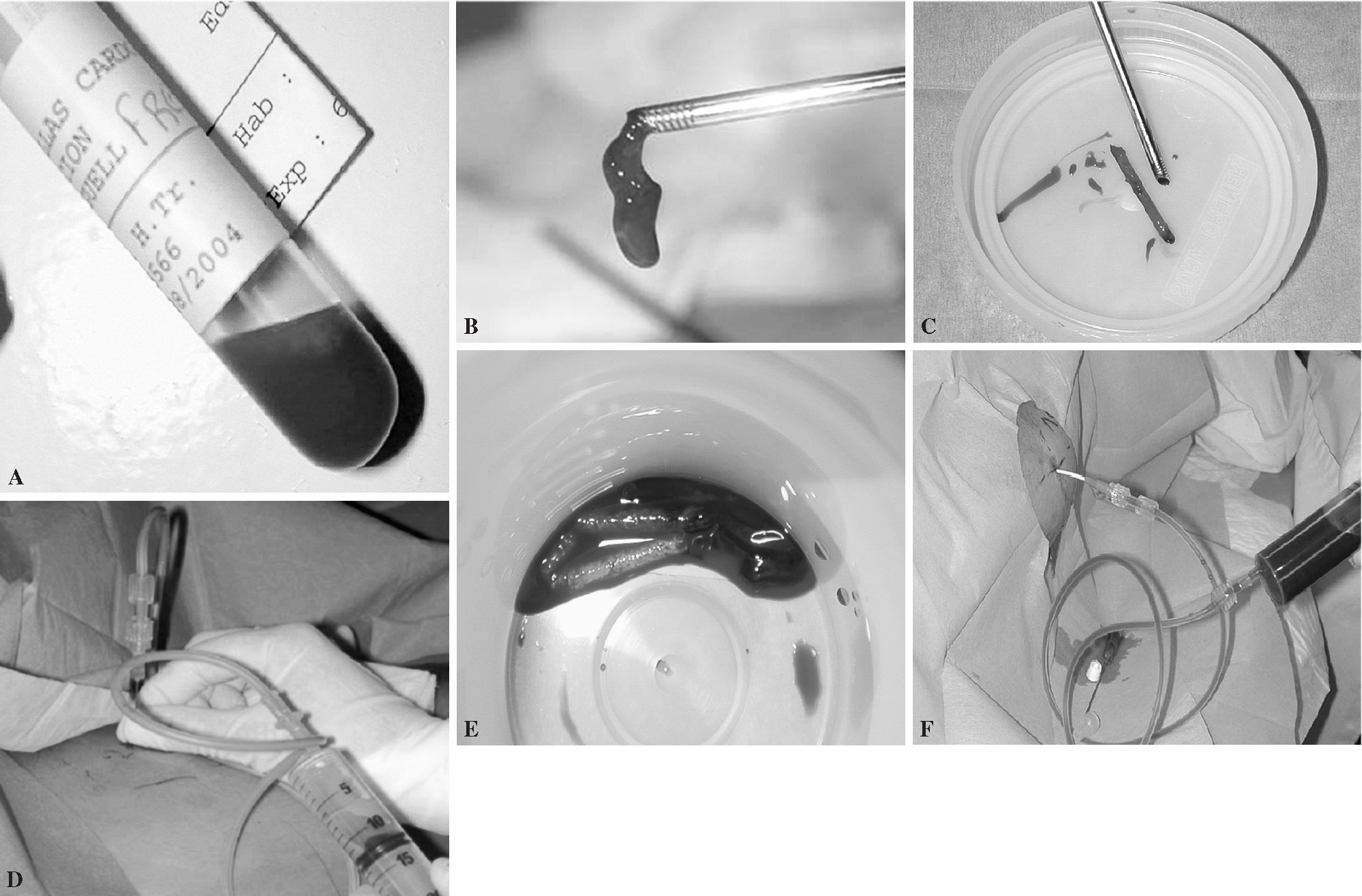
Figura. 3. Diferentes muestras de biopsia vertebral percutánea. (A) Muestra de «sangre». (B) Muestra de «cilindro hemático». (C) Muestra de «cilindro óseo». (D) Muestra de «pus». (E) Muestra de «tejido blando». (F) Muestra de «otros tejidos».
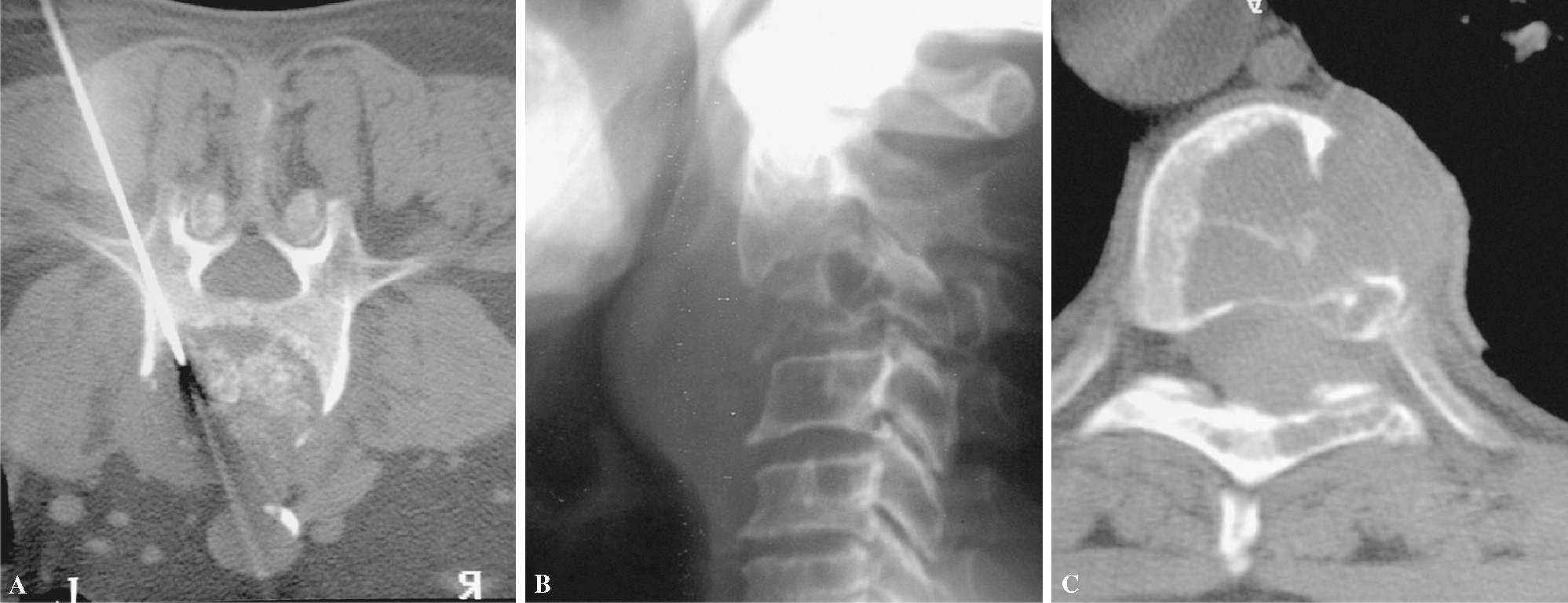
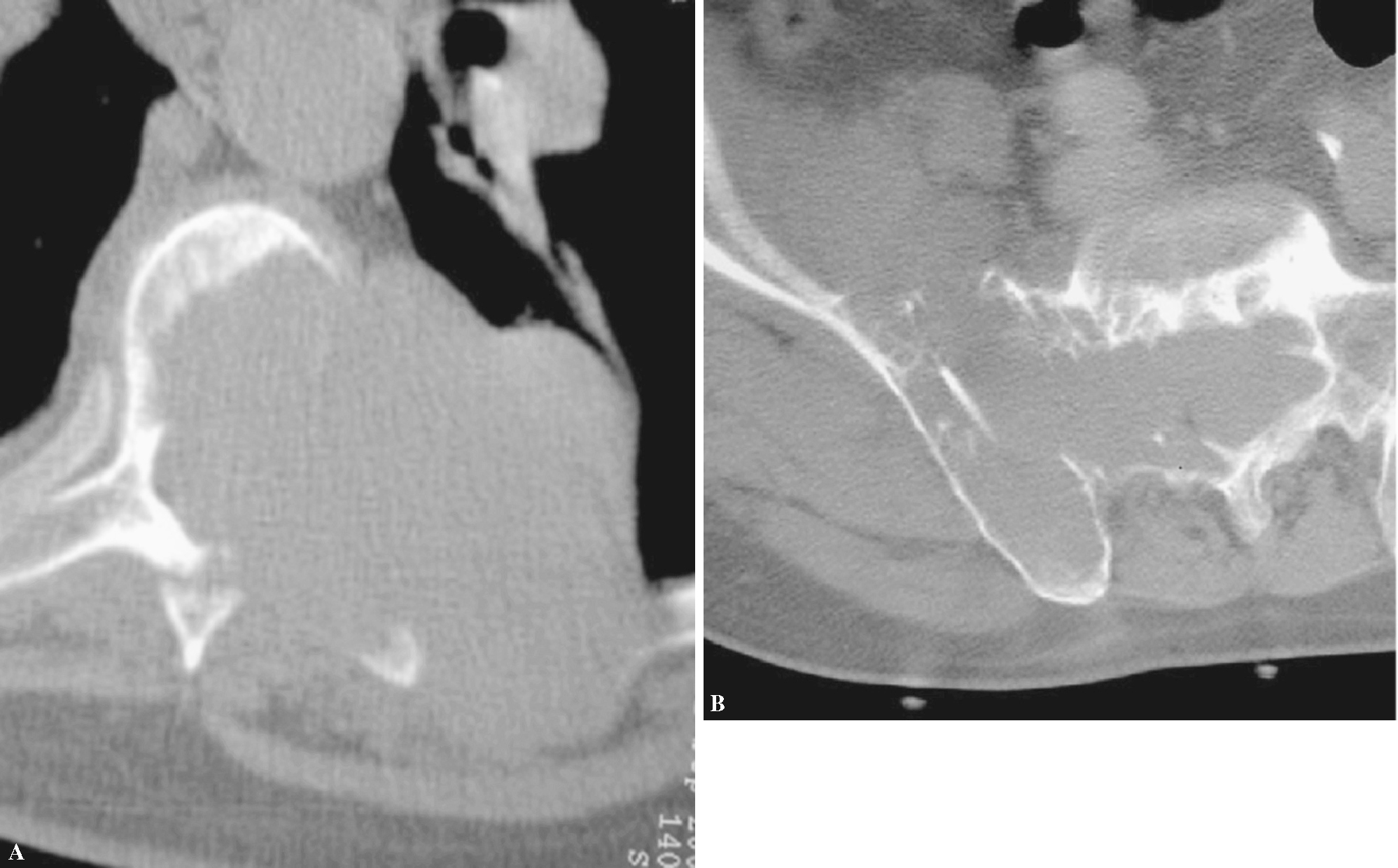
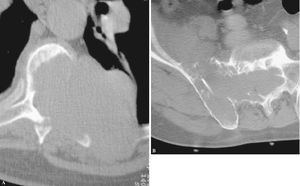
Figura 4. Imágenes de falsos positivos y negativos. (A) Falso negativo de una posible metástasis de pulmón. Osteolisis con calcificaciones que hicieron sospechar tuberculosis. (B) Falso positivo con osteolisis de C2 que por biopsia quirúrgica resultó ser un cordoma. (C) Biopsia vertebral percutánea falso positivo de metástasis, en la que el patrón radiográfico «mini cerebro», las pruebas de laboratorio y la cirugía de estabilización confirmaron un mieloma.
Figura 5. Aspecto de plasmocitomas que sobrepasan espacios articulares, infrecuente en los tumores óseos. (A) Articulación costovertebral. (B) Articulación sacroilíaca.
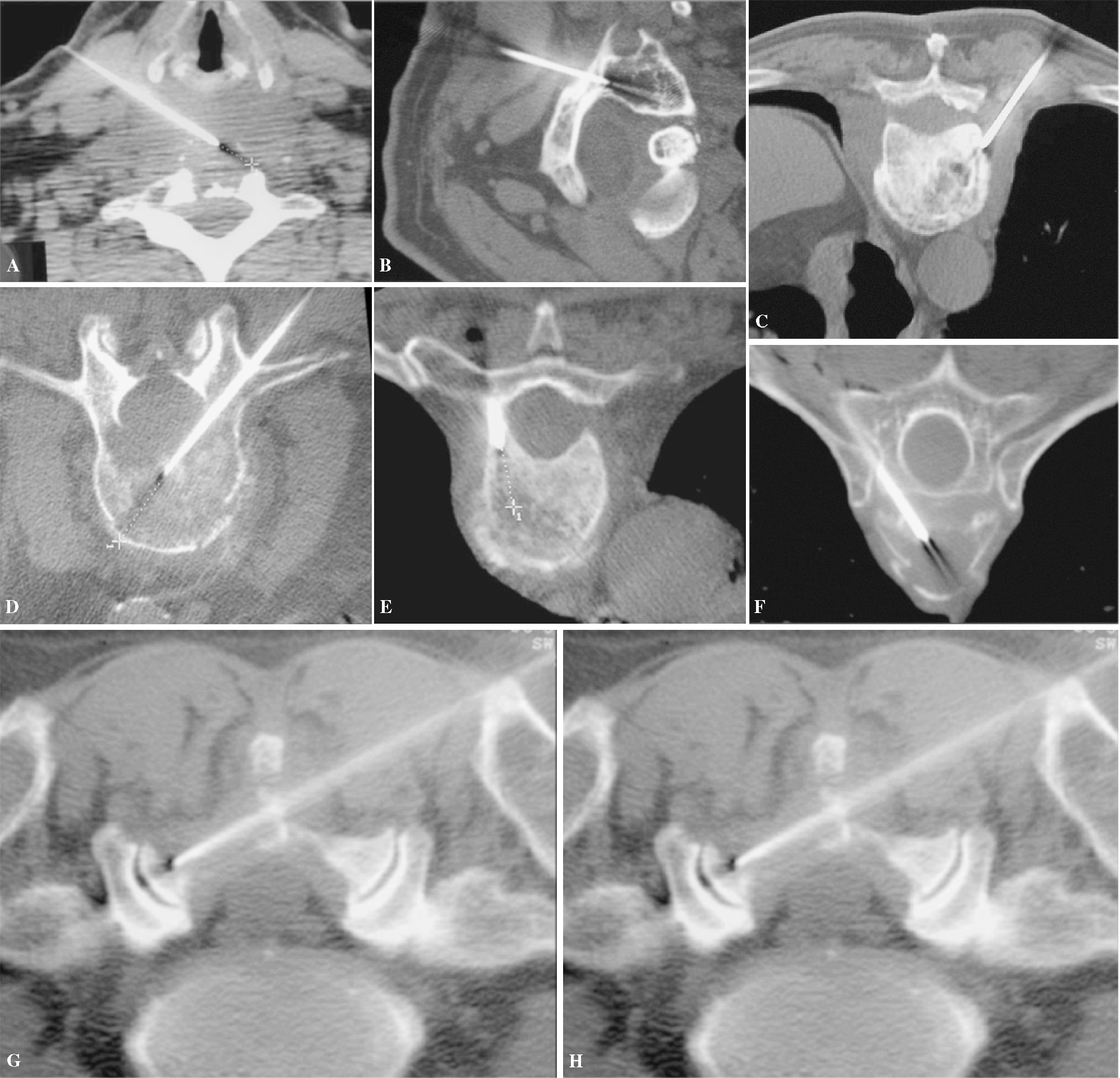
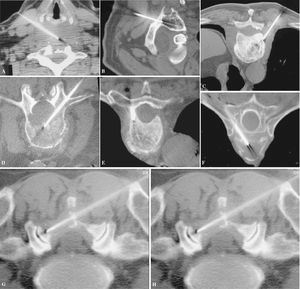
Figura 6. (A) Vía anterolateral para raquis cervical. (B) Vía posterior transpedicular cervical en C1. (C) Vía estándar posterolateral para vértebras toracolumbares. (D) Vía transpedicular. Otras vías de acceso: (E) Transpedicular dorsal. (F) Transcostovertebral. (G) Tangencial, atravesando toda la lámina. (H) Transcostal, acceso a masa en agujero de conjunción cervicotorácico a través de la primera costilla.
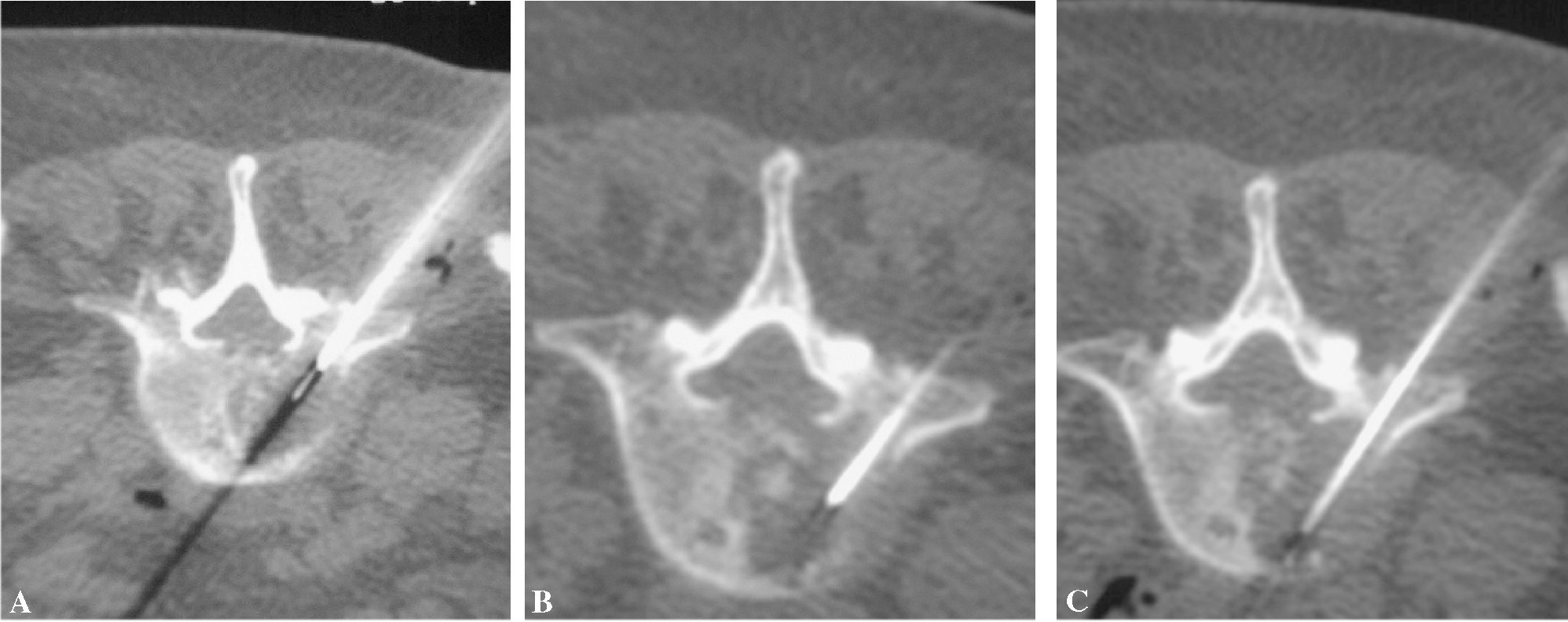
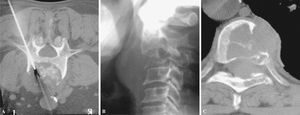
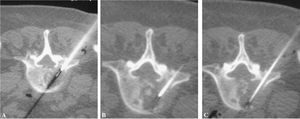
Figura 7. La trefina, guiada por cortes de tomografía computarizada, avanza hasta la periferia de la lesión (inicio de técnica coaxial) (A), luego hasta el centro (B) y, finalmente, (C) llega al extremo opuesto de la lesión.
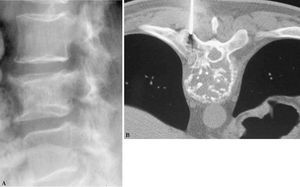
Figura 8. Lesiones solitarias: (A) Radiología de un cordoma. (B) Tomografía computarizada de un plasmocitoma.
La muestra se reparte entre Citología y Anatomía Patológica, y también Microbiología y Hematología para realizar citometría de flujo si se sospecha tumor de células redondas. La duración media de la BVP fue de 50 minutos (45-60 minutos).
Definición de variables
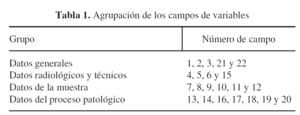
Este estudio ha sido dividido en 22 campos de variables. Cada una de las diferentes variables se ha asociado a un número, con fines estadísticos. Los diferentes campos se agrupan con respecto al tema tratado: datos generales, aspectos del diagnóstico por la imagen, datos sobre el procedimiento de la biopsia y finalmente los resultados (tabla 1).
Análisis estadístico
A partir de la historia clínica de cada paciente se han recogido y ordenado numéricamente una serie de datos. A continuación se han distribuido en 22 campos de variables, dentro de un programa Access®. La información recogida fue la más significativa de cada paciente y consistió en datos personales, localización anatómica, características de la imagen, aspectos técnicos de la biopsia, aspecto macroscópico de la muestra obtenida, realización de BQ, resultados histológicos o microbiológicos y diagnóstico final o definitivo.
La explotación de los datos se ha realizado mediante el sistema SPSS (Statistical Package for the Social Science), versión 11.5. Las variables continuas incluidas en el análisis se han resumido mediante estadísticos descriptivos: media, mediana, desviación, máximo y mínimo. Asimismo, las variables categóricas se han resumido mediante estadísticos de frecuencias: número de casos y porcentaje. Se ha valorado la normalidad de las variables continuas a través de la técnica EDA (Exploratory Data Analysis), que incluye: histograma, boxplot, density plot y pp-plot. Para valorar la asociación de las diferentes variables cuantitativas o en las remodificaciones de variables continuas se han realizado pruebas de hipótesis a través de la prueba exacta de Fisher. Se han estimado los estadísticos clásicos de evaluación de pruebas diagnósticas: sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN) y exactitud diagnóstica, así como los intervalos de confianza al 95% (IC 95%) para valorar la capacidad diagnóstica de la BVP en patologías vertebrales en general y en los cuatro grupos con un número mayor de eventos («metástasis»; «plasmocitoma/mieloma», «linfoma», «infección»). Se estableció un nivel de significación α = 0,05 en todas las pruebas realizadas.
RESULTADOS
El grupo del estudio está constituido por 222 casos, de un total de 236 pacientes consecutivos sometidos a BVP desde abril de 1993 hasta marzo de 2001 (8 años). El 72,5% de los pacientes se han biopsiado en los últimos 4 años del estudio. Casi el 90% de pacientes son mayores de 40 años (edad media: 57,9 años; r: 6-8); 119 varones (54%) y 103 mujeres (46%). Localización: 82% columna toracolumbar, 11% sacro y 7% columna cervical.
Resultados globales
Sensibilidad 86%, especificidad 100%, VPP 100%, VPN 14,3% y exactitud diagnóstica 84,2%. En 217 pacientes (98%) se obtuvo material histológico; en 207 (93%) el material fue adecuado para el diagnóstico, y en 5 (2,2%) no existía material valorable. En 187 pacientes (84,2%) existió coincidencia entre el resultado de la BVP y el diagnóstico final, y en 30 no (13,5%). En 5 pacientes (2,2%) no se obtuvo ningún diagnóstico (tabla 2).
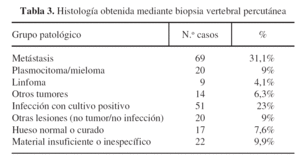
Los diagnósticos más frecuentes fueron metástasis vertebral 69 (31%) e infección con cultivo positivo 51 (23%). En 150 casos (68%) la BVP fue el elemento básico en el diagnóstico. A continuación desglosaremos los resultados (tabla 3).
Número de lesiones y localización anatómica
En las lesiones solitarias hemos encontrado relación estadísticamente significativa entre la localización anatómica y la patología (p < 0,001) (fig. 3A y B). No hemos encontrado ningún caso de lesión solitaria cervical en los grupos «plasmocitoma/mieloma» y «linfoma». Ningún caso de espondilodiscitis se corresponde con lesión múltiple. La mayoría de lesiones aisladas del sacro corresponden al grupo de «otros tumores» (44%).
También hemos observado que la mayoría de lesiones múltiples (68%) correspondían al grupo «metástasis». La localización más frecuentemente observada ha sido la afectación simultánea del cuerpo y partes blandas.
También se ha relacionado de forma estadísticamente significativa el tipo de lesión y la localización segmentaria (p < 0,001). La afectación del cuerpo y partes blandas es muy característica de las infecciones, mientras que en los tumores primarios o secundarios también se afecta cuerpo y partes blandas, pero acompañándose del arco vertebral. La afectación exclusiva del cuerpo vertebral es más frecuente en las metástasis. También existe relación estadísticamente significativa entre la localización en el sacro y el tipo de patología (p = 0,012).
Patrones radiológicos
El patrón radiológico más frecuente es el patrón «osteolítico», con un 70% de casos (n = 155). Le siguen el patrón «mixto» con un 19% (n = 42) y el patrón «osteoblástico» con un 7% (n = 16). La lesión localizada exclusivamente en «partes blandas» comprende el 2% de casos (n = 5), siendo el patrón más infrecuente el patrón «normal», tanto en radiografía simple como en TC, con 2% (n = 4) (fig. 8).
Realización de una segunda punción
En el 88% de BVP (n = 197) se realizó una única punción. La práctica de una segunda punción en un mismo procedimiento de BVP se hizo especialmente en los primeros años del estudio, en casos en que la primera punción mostró material insuficiente, negativo o dudoso. En total la segunda punción se realizó en el 11% de las BVP (n = 25). De éstas, la mayoría (n = 22) resultaron positivas para el diagnóstico, una fue falso positivo y otra falso negativo. No hemos encontrado relación significativa entre los enfermos que precisaron una segunda punción y la localización anatómica, el patrón radiológico o el tipo de patología. Dentro de un segmento, el tipo de patología que más se relacionó con una doble punción fueron las lesiones con afectación del cuerpo y las partes blandas, con el 52% de casos (n = 13).
Histología de la biopsia vertebral percutánea
Metástasis e infecciones en conjunto representan el 55% de toda la serie. Un 27% (n = 59) de pacientes han mostrado un resultado negativo para tumor o infección, con un 9% de lesiones pseudotumorales simuladoras de infección, 8% de casos con tejido normal-curado-reactivo y un 10% de biopsias que no han proporcionado un diagnóstico histológico definido.
Complicaciones y seguridad
En ninguno de los 222 pacientes se han producido complicaciones mayores o significativas relacionadas con la técnica de la BVP. Sí se han producido una serie de complicaciones menores, la mayoría de las cuales han sido más bien incidentes o incidencias, pues se han resuelto en la misma sala de Radiología, sin consecuencias en la evolución del proceso y sin necesidad de tratamiento médico o quirúrgico especializado. En relación con el paciente éstas han sido: cuatro reacciones vagales de grado moderado, durante o inmediatamente después de la técnica (no hemos considerado las reacciones leves); un hematoma subcutáneo inmediato, que no precisó tratamiento, y una reacción alérgica local al anestésico, resuelta con tratamiento local.
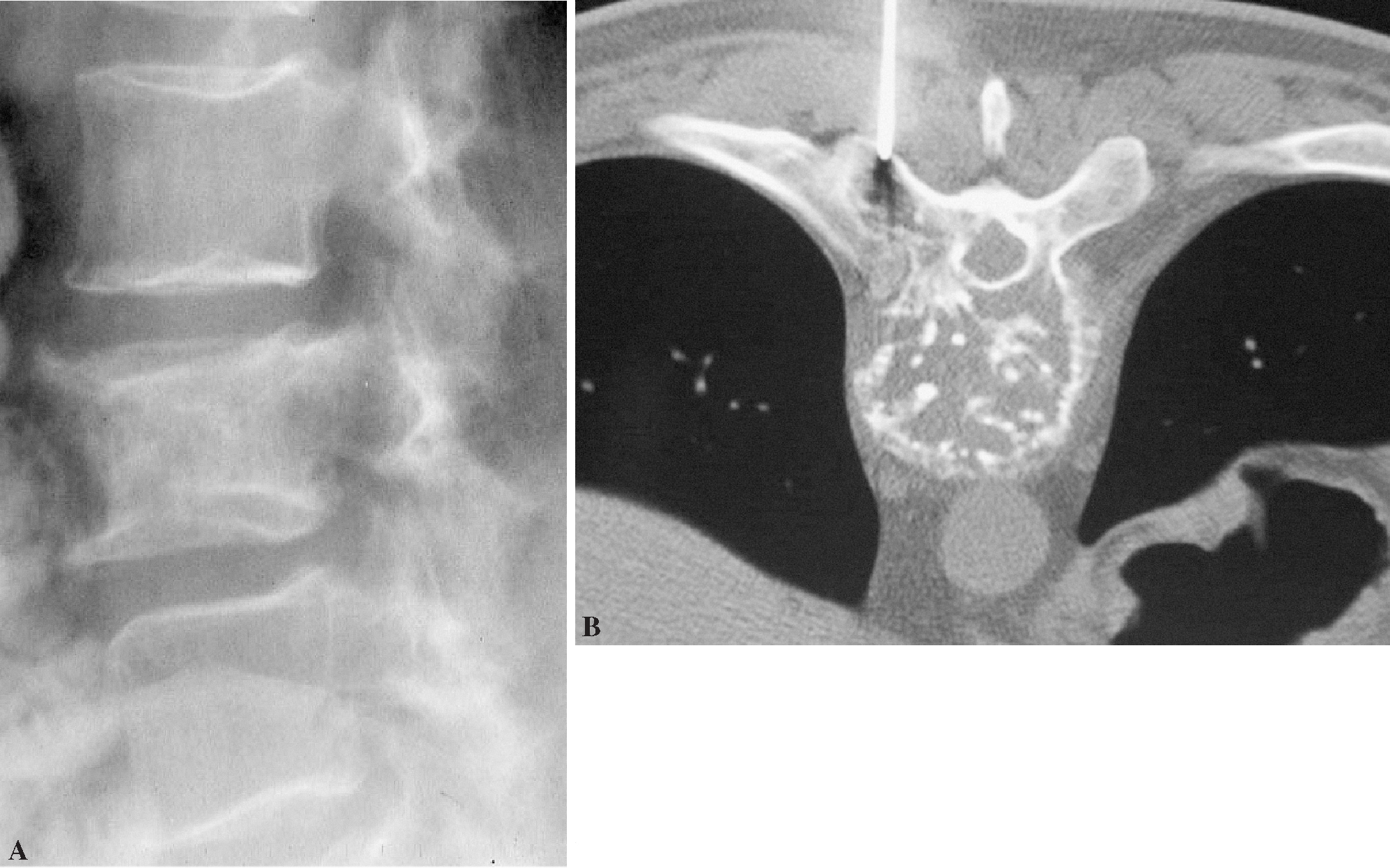
En relación con la técnica las complicaciones han sido tres roturas de aguja por separación entre los componentes plásticos y los metálicos, debido al sobreesfuerzo realizado al atravesar una zona cortical o muy osteoblástica y/o al uso de martillo para introducir las agujas (fig. 9); en todos los casos el fragmento metálico pudo ser extraído del paciente sin problemas mediante instrumentación especializada y asimismo la muestra pudo ser recuperada del interior de la aguja en perfectas condiciones.
Figura 9. Rotura de la aguja durante la biopsia vertebral percutánea. Rotura consistente en el despegamiento del componente metálico con respecto al soporte proximal de material plástico.
Por lo que respecta al dolor post-punción, se hizo un muestreo en un pequeño grupo de 40 pacientes consecutivos, con llamada a su domicilio 24 o 48 horas después de la BVP, resultando en la mayoría de ellos la aparición de molestias o dolor moderado (o aumento del mismo en casos en que ya existía), sin ninguna repercusión importante en su actividad normal y fácilmente controlable con tratamiento médico oral en alguno de los casos, cuadro clínico que se resolvía en pocos días.
DISCUSIÓN
Una biopsia correcta es aquella que provee suficiente material para un diagnóstico correcto sin modificar el tratamiento quirúrgico ni el curso clínico26. Conociendo la morbilidad de la biopsia abierta, incluso cuando se realiza en las mejores condiciones, se deben buscar otras posibilidades de obtención de muestra de tejido. Hay que recurrir a otros procedimientos que, manteniendo o aumentando la efectividad diagnóstica de la biopsia abierta, sean poco agresivos hacia los tejidos normales y den menos complicaciones27. Su elevado nivel diagnóstico así como sus ventajas respecto a la BQ están ampliamente reconocidos28.
Al igual que muchos autores7,10,25, nosotros creemos, y lo demostramos con nuestra serie de pacientes, que la BP se debe considerar ante la indicación de cualquier biopsia de hueso o partes blandas. Es una excelente alternativa para biopsiar cualquier lesión ósea focal que precise determinación de su composición histológica (o del germen causal en caso de infección) con miras a establecer un adecuado tratamiento. Bien indicada, y realizada con sistemática, demuestra cada vez más sus ventajas respecto a la BQ, destacando la fiabilidad, sencillez, seguridad, bajo coste y mínima morbilidad2,3,10-12,14,23,26.
Así pues, constatamos que se han producido cambios de conceptos y situaciones respecto a la BO. La BP es ahora una técnica rutinaria y segura que se practica en los servicios de Radiología. Su elevado nivel diagnóstico, así como sus ventajas respecto a la BQ, están ampliamente reconocidos15,29, todo ello favorecido también por el progreso en las técnicas de estudio de tejidos, especialmente de citología, inmunohistoquímica y citometría de flujo.
Si bien no se discute que la BQ pertenece a los cirujanos ortopédicos oncológicos8, no ocurre lo mismo con la BP, con opiniones diversas sobre «quién» debe realizarla. Para nosotros, y según la mayoría de recientes publicaciones, la BP pertenece al radiólogo10,12,20,21. Muchas son las razones para ello, entre otras un mejor aprovechamiento de las posibilidades de las nuevas tecnologías de imagen (TC, resonancia magnética y ultrasonografía), una adecuada planificación mental de una lesión vista por imagen, la mayor precisión en alcanzar la lesión con mínimos riesgos mediante nuevas herramientas de punción y una racionalización de la técnica en áreas no quirúrgicas, una reducción significativa de tiempos de exploración y de diagnóstico y un menor coste final. Por otra parte, el radiólogo intervencionista participa en la toma de decisiones en equipo y posee conocimientos anatómicos, clínicos e incluso de técnica quirúrgica. Por tanto, la realización de la BP por parte de los radiólogos es una realidad desde la década de los noventa, con un franco aumento de las indicaciones y de la efectividad diagnóstica que va desde un 60 a un 95% de casos según las series, siendo por tanto competitivos con los resultados de la BQ11.
El objetivo de toda BP debe ser la obtención de material suficiente y adecuado para el diagnóstico y tratamiento de las lesiones. Para ello debemos repartir la muestra entre Citología, Anatomía Patológica y Microbiología, siguiendo la máxima de «cultivar los tumores y analizar las infecciones».
Si bien es ventajoso que durante la punción haya un citopatólogo presente para el análisis rápido de la muestra28, ello no es imprescindible13. Las extensiones inmediatas pueden ser falsamente negativas, siendo necesario complementar dichas extensiones con el estudio de bloque celular10. En nuestro hospital, por razones de presión asistencial y atomización de las áreas de Radiología, no disponemos de un citopatólogo durante las BVP, aunque siempre enviamos la muestra a Patología dentro de los quince minutos posteriores a la punción. Únicamente en casos muy concretos disponemos de un citopatólogo in situ, por ejemplo ante una segunda punción por ser la primera negativa o dudosa, o en aquellos casos con sospecha de patología compleja y de difícil diagnóstico (linfomas, etc.).
Pudiera parecer que al realizar una BP deberíamos obtener siempre un buen cilindro de hueso, pero no es así por varias razones. En primer lugar, la mayoría de lesiones tumorales e infecciosas son líticas26,30 (en nuestra serie un 70%), por tanto el tejido óseo calcificado ha sido reabsorbido y sustituido por la lesión. En segundo lugar, se ha demostrado que es igual o más importante que obtener muestra de hueso la obtención de muestra de tejido hemático de la zona problema, y no se debe despreciar ni una sola gota de sangre1,4,10,30. En tercer lugar, se ha observado que las zonas más densas y osificadas de una lesión contienen las áreas menos celulares o menos indiferenciadas en caso de tumores. Además, la obtención de muestras es de menos valor al asociarse a un mayor grado de maceración del tejido1,29. También cabe decir que las muestras calcificadas son un obstáculo para las técnicas de inmunohistoquímica12. Por todo ello, las áreas «diana» para las BP deben ser las osteolíticas y aquellas con mayores signos de agresividad6,29. En caso de infección debemos biopsiar y cultivar las zonas abscesificadas. Por otra parte, el material obtenido debe incluir el lavado mediante suero fisiológico de todo el instrumental empleado.
Todo ello se ha visto favorecido también por el progreso en las técnicas de estudio de tejidos, especialmente de citología, inmunohistoquímica y la citometría de flujo. Por lo que respecta a la guía para practicar la biopsia, se han utilizado tanto la fluoroscopia como la TC o ambas. Normalmente se utiliza el control por escopia para las lesiones periféricas y la guía con TC en casos de lesiones centrales, profundas o muy pequeñas6,27. Cada vez se utiliza más la TC, como en nuestro estudio12,27-32.
En conclusión, la biopsia vertebral percutánea guiada por TC es una técnica fiable, sensible, específica y segura para el diagnóstico de las lesiones focales de la CV. La seguridad y los porcentajes de diagnóstico convierten a la BVP en la técnica de elección para obtener muestras de tejido e identificar el tipo de lesión en las patologías que afectan a la CV con mayor frecuencia.
Mediante la BVP hemos obtenido material histológico en un 98% de los 222 pacientes de nuestra serie, sin evidencia de complicaciones significativas. La muestra obtenida ha permitido alcanzar un diagnóstico histológico en el 93% de pacientes. La sensibilidad de la BVP para detectar la existencia de una lesión vertebral es del 86%, la especificidad del 100% y el VPP del 100%.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.
Correspondencia:
E. Cáceres.
Servicio de Cirugía Ortopédica y Traumatología IMAS. Hospital del Mar.
Passeig Marítim 25-29.
08003 Barcelona. España.
Correo electrónico: ECaceres@imas.imim.es
Recibido: diciembre de 2006.
Aceptado: diciembre de 2006.