La utilización de guías impresas en 3D ha demostrado mejorar la precisión en osteotomías pélvicas en cadáver, y obtener mejores márgenes quirúrgicos in vivo. Este estudio analiza su impacto sobre la supervivencia global y libre de enfermedad a medio-largo plazo en los pacientes con tumores del anillo pélvico.
Materiales y métodosSe diseñó un estudio de cohortes con 25 pacientes con sarcomas pélvicos o sacros primarios, 10 en el grupo 3D y 15 en el grupo control, con un seguimiento medio de 47 meses. Se compararon los márgenes obtenidos (libres, marginales o intralesionales) y se analizaron las curvas de supervivencia libre de enfermedad y global.
ResultadosLa tasa de márgenes libres fue mayor en el grupo 3D (80 vs. 66,7%; p=0,345). Las tasas de recidiva local (50 vs. 60%; p=0,244) y a distancia (20 vs. 47%; p=0,132) fueron menores en el grupo 3D. La supervivencia global fue mayor en el grupo 3D (60 vs. 40%; p=0,327). La tasa de complicaciones fue similar en ambos grupos (40% de infección profunda).
ConclusionesEl uso de guías 3D en la resección de tumores pélvicos primarios no solo consigue una tasa de márgenes libres superior y un mejor control local de la enfermedad, sino que también muestra una tendencia hacia una mayor supervivencia libre de enfermedad a distancia (87 vs. 53%; p=0,293) y global (60 vs. 40%; p=0,327) a medio plazo.
3D-printed patient-specific instruments (PSIs), also known as 3D guides, have been shown to improve accuracy in resection of pelvic tumors in cadaver studies and achieve better surgical margins in vivo. This study evaluates the clinical impact of 3D-printed guides on medium-term local and distant disease control, as well as disease-free and overall survival in patients.
Material and methodsA cohort study included 25 patients with primary pelvic or sacral sarcomas: 10 in the 3D group and 15 in the control group, with a median follow-up of 47 months. Demographic and clinical data, including tumor histology, stage, resection technique, associated reconstruction, adjuvant therapies, and complications, were evaluated. Surgical margins (free, marginal, and contaminated) and relapse-free and overall survival curves were analyzed.
ResultsThe 3D group achieved a higher rate of free margins (80% vs 66.7%, p = 0.345). Local recurrence (50% vs 60%, P=.244) and distant disease relapse (20% vs 47%, p = 0.132) rates were lower in the 3D group. At the end of the follow-up, the 3D group had a higher overall survival rate (60% vs 40%, p = 0.327). The complication rate was similar in both groups, with a deep infection rate of 40%.
ConclusionsThe use of 3D guides in resecting primary pelvic tumors not only achieves a higher rate of free margins compared to conventional techniques but also shows a trend towards higher local, distant, and overall disease-free survival. Further studies with larger sample sizes and higher levels of evidence are necessary to validate these clinical trends.
La resección tumoral de los sarcomas localizados en el anillo pélvico representa un gran desafío para el cirujano ortopédico debido a su tamaño significativo y su proximidad a estructuras vasculonerviosas y órganos vitales. Según Cartiaux et al. (2008), la probabilidad de conseguir márgenes tumorales adecuados en la resección pélvica (considerando un margen libre de 10mm con± 5mm de error) es solo del 52% (IC: 37-67%)1. Unos márgenes de resección subóptimos (marginales o contaminados) se relacionan con una alta tasa de recurrencia local (28-35%), lo cual tiene un impacto pronóstico muy desfavorable2.
En los últimos años, se han implementado varias herramientas para mejorar la precisión de estos márgenes. Algunos grupos han comenzado a utilizar navegación guiada por TAC3–5 o navegación óptica6 con buenos resultados. La rápida extensión de la impresión 3D en el mundo ortopédico trajo consigo el diseño y fabricación de plantillas de corte paciente-específicas (PCPs), también llamadas guías 3D, para mejorar la precisión de osteotomías en diferentes localizaciones7–9. Las PCPs han sido utilizadas por varios grupos en la cirugía de resección oncológica compleja con buenos resultados10–12. Han demostrado ser igual de precisas que la navegación con la ventaja de un menor tiempo quirúrgico13 y un potencial menor coste.
Estudios cadavéricos han confirmado una mayor precisión en osteotomías pélvicas tumorales con el uso de este tipo de guías14–16. Aunque es esperable un impacto en la tasa de recurrencia local y en la supervivencia libre de enfermedad con la consecución de unos mejores márgenes de resección, estudios analíticos al respecto no han sido previamente publicados, salvo un único trabajo del grupo belga de Evrard et al. en 201912. Este grupo analizó el efecto del uso de PCPs sobre el control local de la enfermedad (tasa de recurrencia local), pero no su impacto sobre el intervalo libre de enfermedad (ILE) o supervivencia global (SG).
De manera que, avanzando en esta línea de investigación, nos planteamos como objetivo analizar la tasa de márgenes de resección adecuados utilizando guías 3D en resección de sarcomas pélvicos y su impacto, no solo en la tasa de recurrencia local y a distancia, sino también en la supervivencia libre de enfermedad y global de estos pacientes. La hipótesis de trabajo del presente estudio plantea que la aplicación de PCPs en la resección de tumores primarios del anillo pélvico consigue mejores márgenes locales, y que esto tiene un impacto positivo sobre el control local de la enfermedad y la supervivencia libre de enfermedad y global de estos pacientes.
Material y métodoInclusión de pacientes, diseño y análisisSe diseñó un estudio de cohortes en el que se incluyeron todos los pacientes afectados por sarcomas óseos o de partes blandas del anillo pélvico (pelvis y sacro) intervenidos en nuestro centro entre los años 2011 y 2018. Se excluyeron aquellos casos con diagnóstico de sarcoma pélvico que no fueron intervenidos quirúrgicamente y las pérdidas de seguimiento.
Sobre un tamaño muestral de 25 pacientes, se identificaron 2 grupos: un grupo de 10 pacientes en los que se utilizaron PCPs y un segundo grupo de 15 en los que se llevó a cabo una resección convencional. Contamos con la previa aprobación del comité de ética de nuestro centro.
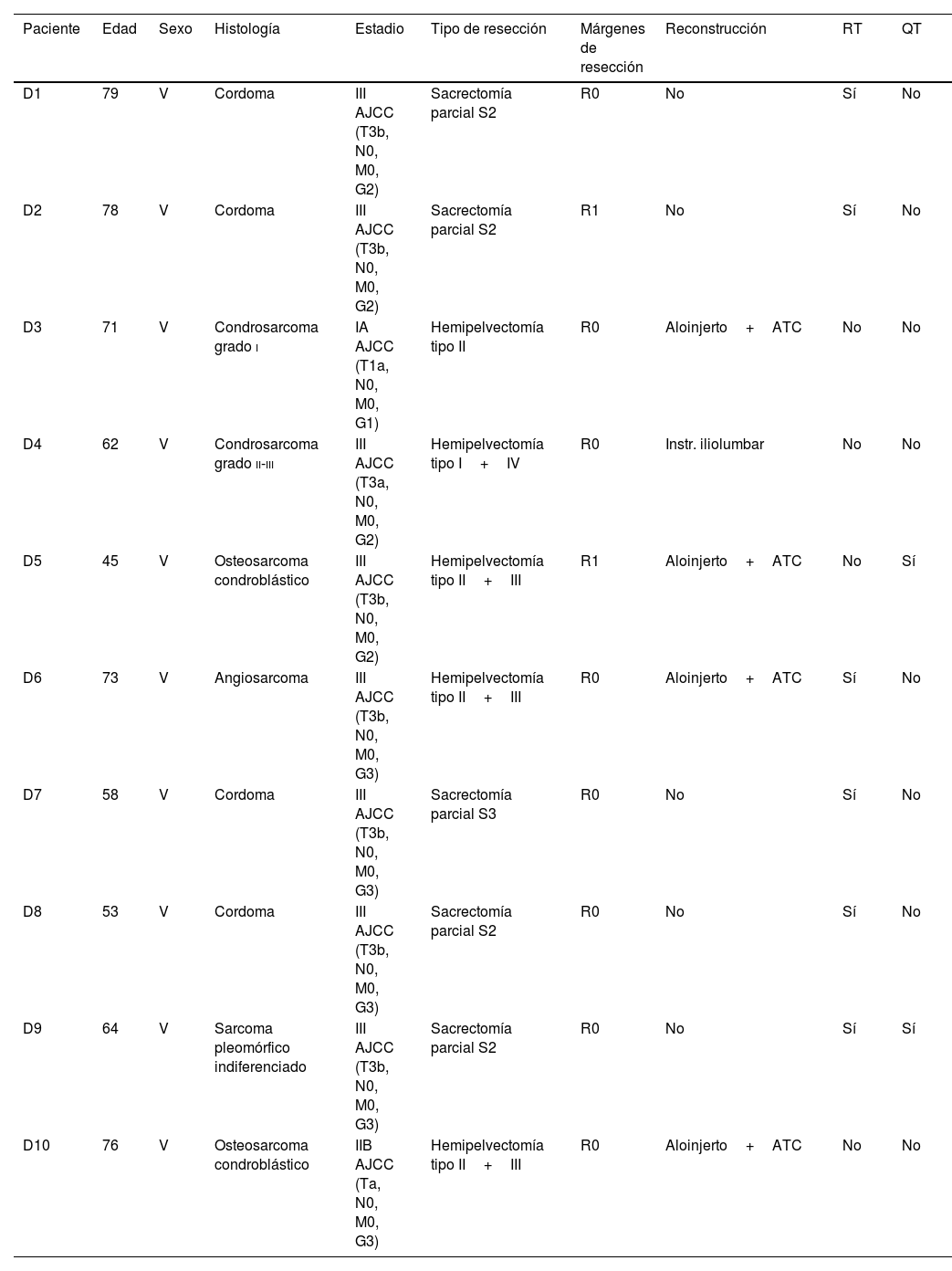
Se recogieron los datos demográficos y clínicos de todos los pacientes, incluyendo tipo histológico, estadio tumoral, tipo de resección, reconstrucción asociada y tratamiento adyuvante (tablas 1 y 2). Se evaluaron los márgenes de resección obtenidos en cada grupo utilizando el sistema internacional de la UICC: R0, R1 y R2. Definimos márgenes R0 o márgenes libres como aquellos con al menos 1mm de tejido sano alrededor del tumor; resección R1 o marginal como aquella con <1mm de tejido sano y R2 o intralesional como aquella con márgenes macroscópicamente afectos. Los pacientes se estadificaron siguiendo la clasificación de la American Joint Committee on Cancer (AJCC) 8.ª edición.
Datos demográficos y clínicos del grupo 3D
| Paciente | Edad | Sexo | Histología | Estadio | Tipo de resección | Márgenes de resección | Reconstrucción | RT | QT |
|---|---|---|---|---|---|---|---|---|---|
| D1 | 79 | V | Cordoma | III AJCC (T3b, N0, M0, G2) | Sacrectomía parcial S2 | R0 | No | Sí | No |
| D2 | 78 | V | Cordoma | III AJCC (T3b, N0, M0, G2) | Sacrectomía parcial S2 | R1 | No | Sí | No |
| D3 | 71 | V | Condrosarcoma grado i | IA AJCC (T1a, N0, M0, G1) | Hemipelvectomía tipo II | R0 | Aloinjerto+ATC | No | No |
| D4 | 62 | V | Condrosarcoma grado ii-iii | III AJCC (T3a, N0, M0, G2) | Hemipelvectomía tipo I+IV | R0 | Instr. iliolumbar | No | No |
| D5 | 45 | V | Osteosarcoma condroblástico | III AJCC (T3b, N0, M0, G2) | Hemipelvectomía tipo II+III | R1 | Aloinjerto+ATC | No | Sí |
| D6 | 73 | V | Angiosarcoma | III AJCC (T3b, N0, M0, G3) | Hemipelvectomía tipo II+III | R0 | Aloinjerto+ATC | Sí | No |
| D7 | 58 | V | Cordoma | III AJCC (T3b, N0, M0, G3) | Sacrectomía parcial S3 | R0 | No | Sí | No |
| D8 | 53 | V | Cordoma | III AJCC (T3b, N0, M0, G3) | Sacrectomía parcial S2 | R0 | No | Sí | No |
| D9 | 64 | V | Sarcoma pleomórfico indiferenciado | III AJCC (T3b, N0, M0, G3) | Sacrectomía parcial S2 | R0 | No | Sí | Sí |
| D10 | 76 | V | Osteosarcoma condroblástico | IIB AJCC (Ta, N0, M0, G3) | Hemipelvectomía tipo II+III | R0 | Aloinjerto+ATC | No | No |
ATC: artroplastia total de cadera; Instr.: instrumentación; M: mujer; QT: quimioterapia; RT: radioterapia; V: varón.
Datos demográficos y clínicos del grupo control
| Paciente | Edad | Sexo | Histología | Estadio | Tipo de resección | Márgenes de resección | Reconstrucción | RT | QT |
|---|---|---|---|---|---|---|---|---|---|
| S1 | 76 | V | Sarcoma indiferenciado de células fusiformes | IIB AJCC (T2a, N0, M0, G3) | Hemipelvectomía tipo I | R0 | PMMA | No | No |
| S2 | 39 | M | Leiomiosarcoma | IV AJCC (T3, N0, M1, G3) | Hemipelvectomía tipo I+IIB | R1 | No | No | Sí |
| S3 | 62 | V | Cordoma | IIB AJCC (T2a, N0, M0, G2) | Sacrectomía parcial S3 | R0 | No | Sí | No |
| S4 | 57 | V | Cordoma | III AJCC (T3a, N0, M0, G2) | Sacrectomía total | R0 | Instr. iliolumbar | Sí | No |
| S5 | 73 | V | Osteosarcoma secundario condroblástico | III AJCC (T3b, N0, M0, G3) | Hemipelvectomía tipo I+II+III | R0 | No | No | Sí |
| S6 | 65 | V | Osteosarcoma condroblástico | III AJCC (T3b, N0, M0, G3) | Hemipelvectomía tipo IIA+III | R1 | Aloinjerto+ATC | Sí | Sí |
| S7 | 60 | V | Sarcoma pleomórfico indiferenciado | IIB AJCC (T2a, N0, M0, G3) | Hemipelvectomía tipo IIA+III | R0 | No | No | No |
| S8 | 60 | M | Cordoma | III AJCC (T3b, N0, M0, G2) | Sacrectomía parcial S3 | R1 | No | Sí | No |
| S9 | 50 | V | Cordoma | III AJCC (T3b, N0, M0, G2) | Sacrectomía parcial S2 | R0 | No | No | No |
| S10 | 71 | V | Leiomiosarcoma | III AJCC (T3a, N0, M0, G3) | Hemipelvectomía tipo I+IIB | R0 | No | No | Sí |
| S11 | 42 | V | Cordoma | III AJCC (T3a, N0, M0, G2) | Sacrectomía parcial S3 | R1 | No | No | No |
| S12 | 73 | M | Osteosarcoma condroblástico | IIB AJCC (T2a, N0, M0, G3) | Hemipelvectomía tipo I | R0 | No | No | No |
| S13 | 66 | V | Condrosarcoma | IIB AJCC (T2b, N0, M0, G3) | Hemipelvectomía tipo I+IIB | R0 | No | No | No |
| S14 | 62 | V | Condrosarcoma grado II-III | III AJCC (T3b, N0, M0, G3) | Hemipelvectomía tipo I+II+III | R1 | No | No | No |
| S15 | 42 | V | Cordoma | III AJCC (T3b, N0, M0, G3) | Sacrectomía total | R0 | No | Sí | No |
ATC: artroplastia total de cadera; Instr.: instrumentación; M: mujer; PMMA: polimetilmetacrilato; QT: quimioterapia; RT: radioterapia; V: varón.
Se recogieron las complicaciones en cada caso, la recidiva local o a distancia si la hubo, y el tiempo hasta recidiva o fallecimiento. Con ello, calculamos la supervivencia libre de enfermedad local, a distancia y global de cada paciente. Se utilizaron estadísticos no paramétricos como la U de Mann-Whitney y el test exacto de Fisher para comparar las variables entre los 2 grupos. Además, se elaboraron curvas Kaplan-Meier para las variables supervivencia libre de enfermedad hasta recidiva local y a distancia y supervivencia global, aplicando la prueba de log-rank para su análisis.
Los datos clínico-radiológicos se recogieron a partir de la revisión de las historias clínicas y los estudios de imagen incluidos en el sistema Picture Archiving and Communication System (PACS). Todas las pruebas estadísticas se llevaron a cabo utilizando el software SPSS® v.20 (IBM, Armonk, NY, EE. UU.).
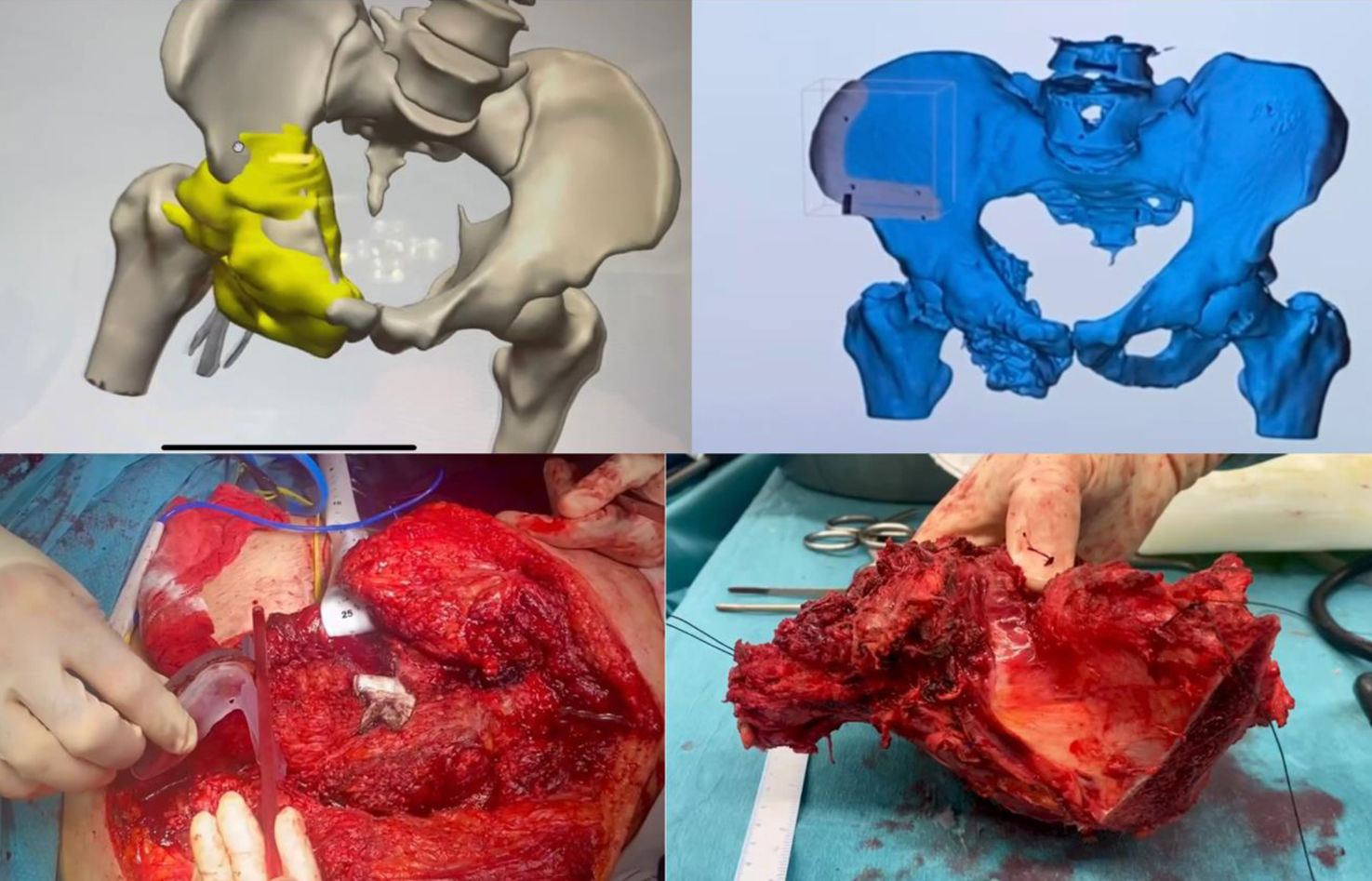
Planificación, diseño e impresión de las PCPsLas imágenes obtenidas de los estudios por lotes realizados del área afecta (tomografía computarizada y/o resonancia magnética nuclear) fueron tratadas en 3D Slicer, un software de segmentación que permite obtener un archivo en formato STL con una réplica tridimensional tanto de la pelvis como del tumor (fig. 1A). Sobre esta réplica tridimensional se diseñan las guías de corte específicas para cada caso utilizando un software específico: Meshmixer® (Autodesk Inc., EE. UU.) (fig. 1B). Esto genera un nuevo archivo en formato STL con una réplica tridimensional de dichas plantillas.
Planificación y diseño de las guías 3D. A) Modelo tridimensional de la pelvis y el tumor con la guía impresa en 3D resaltada en amarillo. B) Visualización de la guía 3D acoplada a la pelvis en un modelo tridimensional. C) Imagen intraoperatoria mostrando la colocación de la guía 3D en el paciente. D) La pieza resecada, incluyendo el tumor, se muestra para verificación postoperatoria.
Se tienen en cuenta los relieves anatómicos particulares para el acople preciso de la guía al hueso junto con el ajuste del plano de corte a la localización del tumor. Estos archivos en formato STL son reconocidos por los softwares utilizados para la impresión 3D. En estos softwares se programan distintos parámetros para mejorar la calidad de la impresión y la dureza y resistencia de los modelos y guías. En la preparación de la impresión de las biorréplicas tanto de la pelvis como del tumor se trabajó con el software Cura (Ultimaker®) y se realizó la impresión en material termoplástico (ácido poliláctico) con una impresora 3D modelo Ultimaker 2 (Ultimaker®) que imprime por depósito de filamento fundido. En la preparación de las guías se trabajó con el software PreForm (Formlabs®) y se realizó la impresión en resina biocompatible (Resina BioMed Clear, Formlabs®) con una impresora 3D modelo Form2 (Formlabs®) que imprime por estereolitografía.
El tiempo medio de impresión de las réplicas de la pelvis con el tumor fue de 10h, mientras que las guías se pudieron obtener en menos de 2h. La esterilización de las piezas se realizó a baja temperatura con óxido de etileno a 55°C para evitar deformación del material. El diseño de las guías permite que éstas solo puedan encajar en una única posición sobre el relieve óseo para aumentar su precisión. Su fijación provisional se llevó a cabo con material de osteosíntesis, para proporcionar estabilidad durante el uso de la sierra oscilante para la osteotomía (fig. 1C).
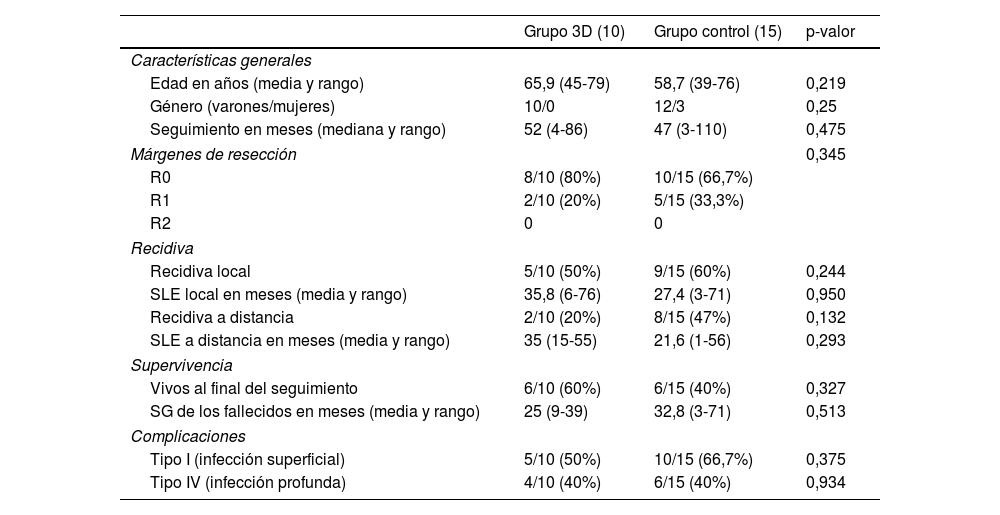
ResultadosLa media de edad fue de 65,9 años (rango: 45-79) en el grupo 3D y de 58,7 años (rango: 39-76) en el grupo convencional. Todos fueron varones en el grupo 3D, frente a un 80% en el grupo control. La mediana de seguimiento fue de 52 meses (rango: 4-86) en el grupo 3D y de 47 meses (rango: 3-110) en el grupo control (tabla 3).
Comparativa entre ambos grupos de los principales resultados del estudio
| Grupo 3D (10) | Grupo control (15) | p-valor | |
|---|---|---|---|
| Características generales | |||
| Edad en años (media y rango) | 65,9 (45-79) | 58,7 (39-76) | 0,219 |
| Género (varones/mujeres) | 10/0 | 12/3 | 0,25 |
| Seguimiento en meses (mediana y rango) | 52 (4-86) | 47 (3-110) | 0,475 |
| Márgenes de resección | 0,345 | ||
| R0 | 8/10 (80%) | 10/15 (66,7%) | |
| R1 | 2/10 (20%) | 5/15 (33,3%) | |
| R2 | 0 | 0 | |
| Recidiva | |||
| Recidiva local | 5/10 (50%) | 9/15 (60%) | 0,244 |
| SLE local en meses (media y rango) | 35,8 (6-76) | 27,4 (3-71) | 0,950 |
| Recidiva a distancia | 2/10 (20%) | 8/15 (47%) | 0,132 |
| SLE a distancia en meses (media y rango) | 35 (15-55) | 21,6 (1-56) | 0,293 |
| Supervivencia | |||
| Vivos al final del seguimiento | 6/10 (60%) | 6/15 (40%) | 0,327 |
| SG de los fallecidos en meses (media y rango) | 25 (9-39) | 32,8 (3-71) | 0,513 |
| Complicaciones | |||
| Tipo I (infección superficial) | 5/10 (50%) | 10/15 (66,7%) | 0,375 |
| Tipo IV (infección profunda) | 4/10 (40%) | 6/15 (40%) | 0,934 |
SG: supervivencia global; SLE: supervivencia libre de enfermedad.
Ambos grupos presentaron histologías similares, siendo el cordoma (40% en ambos) el tumor más prevalente, seguido del osteosarcoma (20% en ambos), condrosarcoma (20% en el grupo 3D y 13,3% en el grupo control), sarcomas pleomórficos indiferenciados (10 y 13,3%) y otras histologías menos frecuentes (leiomiosarcoma, angiosarcoma).
La mayoría de los pacientes en el grupo 3D presentaron un estadio III al diagnóstico (80%). De los 2 restantes, uno presentaba un condrosarcoma de bajo grado limitado a zona II periacetabular (estadio IA) y otro un osteosarcoma en zona I, estadio IIB. En el grupo convencional, el 60% comenzaron con un estadio III, un 33,3% IIB y un caso de estadio IV por una metástasis única renal de leiomiosarcoma.
En aquellos con afectación sacra, se llevó a cabo sacrectomía total si la lesión incluía S1; o parcial a nivel de S2 o S3 en caso contrario. El 50% de los pacientes del grupo 3D fueron sometidos a sacrectomía parcial vs. 26,7% en el grupo convencional de sacrectomía parcial y un 13,3% de sacrectomía total. El tipo de hemipelvectomía interna se planificó en función de las zonas de Enneking en las que se localizaba el tumor, siendo la más frecuente una tipo II+III en el grupo 3D (30%) y una tipo I+IIB en el convencional (20%).
En cuanto a la terapia adyuvante, 6 pacientes en el grupo 3D recibieron radioterapia (RT) adyuvante (60%), de forma preoperatoria en 4 de ellos y postoperatoria en 2, asociada en todos los casos a radioterapia intraoperatoria (RIO). En el grupo control, el porcentaje fue similar (53,3%): 3 pacientes recibieron RT de forma preoperatoria (asociada a RIO en 2 de los 3 casos), 2 con RT postoperatoria tras una dosis de RIO y 2 solo RIO como única dosis. Respecto a la quimioterapia (QT), fue pautada en 2 pacientes del grupo 3D (20%) con diagnóstico de osteosarcoma pélvico y en 4 pacientes del grupo control (26,7%): neoadyuvante en un caso de osteosarcoma y de forma adyuvante en un osteosarcoma condroblástico (diagnosticado inicialmente por biopsia de condrosarcoma) y en los 2 casos de leiomiosarcoma.
No se observaron diferencias significativas entre el número de complicaciones y el tipo entre el grupo a estudio y el control, siendo las más frecuentes las infecciones. Se produjeron un 40% de infecciones profundas (tipo IV) en ambos grupos (p=0,934). No hubo diferencias significativas en la incidencia de infección superficial (asociada o no a la profunda), siendo del 50% en el grupo 3D y del 66,7% en el grupo control. Se observó un porcentaje menor de infección superficial (asociada o no a la profunda) en el grupo de guías 3D (50%) frente al grupo control (66,7%), aunque estas diferencias no resultaros estadísticamente significativas (p=0,375).
Márgenes de resecciónSe observó un porcentaje mayor de márgenes libres (R0) en el grupo 3D (80%) que en el grupo control (66,7%), diferencias que no resultaron estadísticamente significativas (p=0,345) (tabla 3). Además, uno de los márgenes R1 del grupo 3D fue planificado para disminuir la morbilidad en un paciente de 78 años con antecedentes de carcinoma vesical y de colon con afectación tumoral de la raíz de S1 izquierda. En la comparación entre subgrupos (hemipelvectomías y sacrectomías) se observó la misma tendencia. El 20% de las hemipelvectomías en el grupo 3D presentaron márgenes R1 vs. 33,3% en el grupo convencional (p=0,298). De manera similar, en cuanto a las sacrectomías, solo un paciente de 5 en el grupo 3D presentó resección marginal (20%) frente a 2 de 6 en el grupo convencional (33,3%) (p=0,234).
Recidiva local y a distanciaLa tasa de recidiva local en el grupo en el que se emplearon PCPs fue del 50%, mientras que en el grupo control fue del 60% (p=0,244) (tabla 3). De entre los pacientes que sufrieron recidiva local se observó una mayor supervivencia libre de enfermedad local (SLE local) en el grupo 3D (35,8 meses, rango: 6-76) que en el control (27,4 meses, rango: 3-71).
En cuanto a la recidiva a distancia, el grupo 3D presentó una tasa del 20 vs. 47% en el control (p=0,132) (tabla 3). La SLE a distancia también fue mayor en el grupo con PCPs (35 meses, rango: 15-55) que en el grupo control (21,6 meses, rango: 1-56).
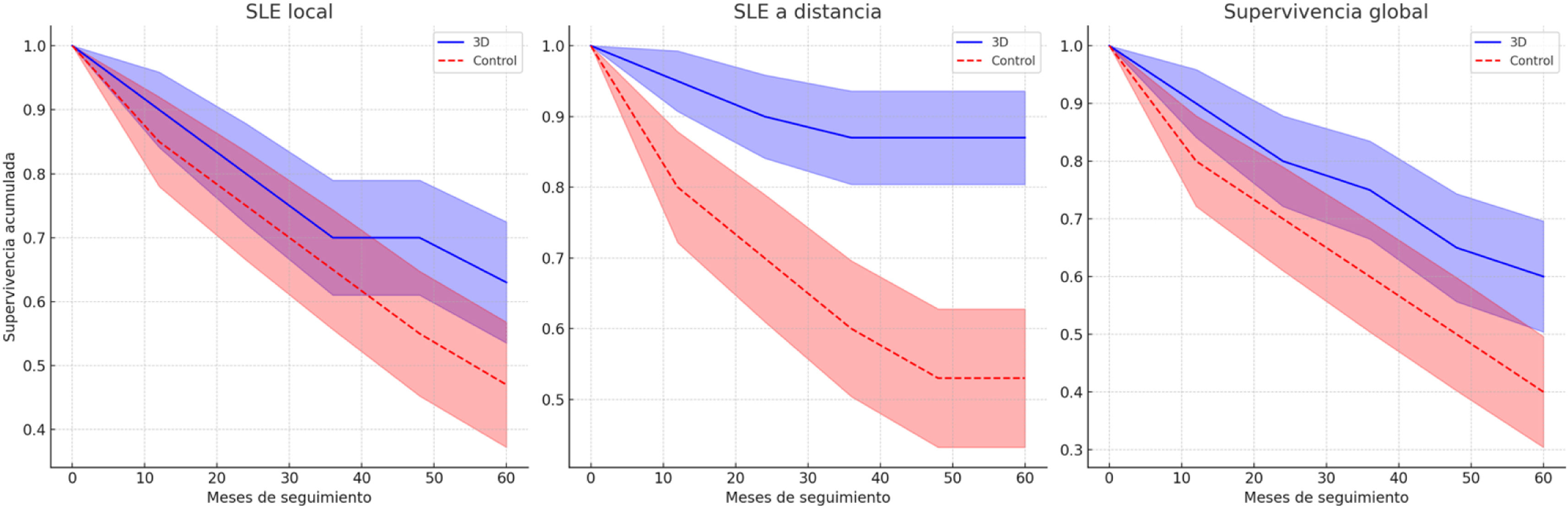
Análisis de supervivenciaA los 5 años de seguimiento, un 63% de los pacientes del grupo 3D estaban libres de enfermedad local vs. 47% en el grupo control (log-rank p=0,950) (fig. 2A). Lo mismo ocurre en cuanto a la SLE a distancia, un 87% de los pacientes del grupo 3D permanecen sin metástasis a distancia a los 5 años frente a solo un 53% del grupo control (log-rank p=0,293) (fig. 2B).
. Análisis de supervivencia. A) Supervivencia libre de enfermedad (SLE) local comparando el grupo con guías 3D y el grupo control. B) Supervivencia libre de enfermedad a distancia comparando el grupo con guías 3D y el grupo control. C) Supervivencia global (SG) comparando el grupo con guías 3D y el grupo control.
Al final del seguimiento se observó una mayor tasa de supervivientes en el grupo 3D (60%) vs. grupo control (40%) (p=0,327). De hecho, a los 5 años, el 60% de los pacientes en el grupo 3D seguían vivos vs. 47% en el grupo convencional (fig. 2C) (log-rank p=0,513).
DiscusiónEntre las posibles aplicaciones de la tecnología de impresión 3D en la oncología musculoesquelética se encuentran las herramientas paciente-específicas (PCPs) obtenidas mediante modelos de planificación e impresión 3D17, especialmente útiles en la resección de tumores en localizaciones complejas como los pélvicos18. La obtención de unos márgenes quirúrgicos adecuados es un factor pronóstico independiente para recidiva local (p=0,001) y supervivencia global (p=0,025)19 en estos pacientes.
En los últimos años se han publicado varias series de casos en los que se han empleado este tipo de guías como ayuda en la resección de tumores pélvicos con buenos resultados. No obstante, la mayoría son estudios descriptivos y con seguimientos relativamente cortos: mediana de 7,820, 2410 o 26 meses11. Sabemos que las recidivas locales ocurren principalmente durante los 3 primeros años desde el diagnóstico y son extremadamente inusuales pasados los 5 primeros años21, por lo que consideramos como adecuado un seguimiento mínimo de 36 meses para el análisis del impacto del uso de estas herramientas sobre la tasa de recidiva local. Así, nuestra mediana de seguimiento fue de 52 meses en el grupo 3D y 47 en el grupo control.
Es conocido que el uso de PCPs aporta una mayor precisión en la resección tumoral en sarcomas pélvicos15, pero solo un trabajo hasta la fecha analiza el impacto clínico a medio plazo sobre el control local. El estudio de Evrard et al. demuestra una menor tasa de recidiva local a medio plazo (seguimiento medio de 52 meses) con el uso de guías 3D (p=0,035)12. El grupo belga infiere a partir de sus resultados una probable correlación con una mayor supervivencia global de los pacientes en el grupo 3D, pero no lo analiza.
Nuestro trabajo es el primero en analizar el impacto clínico sobre la tasa de recurrencia a distancia y de supervivencia libre de enfermedad y global del uso de guías 3D en sarcomas pélvicos. El análisis llevado a cabo en el presente estudio muestra la consecución de mejores márgenes con el uso de las guías 3D con respecto al grupo control: 80% de márgenes libres vs. 66,7%; p=0,345. Estos resultados son consistentes con lo publicado por otros grupos: 90,9% de márgenes libres en el grupo 3D vs. 63,6% en el grupo control10; 88,8 vs 68,4% (p =0,479)12; 98% en la serie de casos 3D de Dong et al.11.
Esta mayor tasa de márgenes libres en el grupo 3D se correlaciona en nuestro análisis no solo con un mejor control local de la enfermedad (SLE local del 63 vs. 47%, log-rank p=0,950) sino también a distancia (SLE a distancia del 87 vs. 53%, log-rank p=0,293). En definitiva, las tasas de supervivencia global son sustancialmente mayores en el grupo 3D respecto al control al final del seguimiento: 60 vs. 40% (log-rank p=0,513). Puede afirmarse que el uso de este tipo de guías mejora la supervivencia global de estos pacientes en aproximadamente un 20% sobre la clásica supervivencia global a 5 años del 4019-47%22 de estos tipos de tumores.
Los datos obtenidos a partir de nuestro análisis arrojan una tendencia clínicamente relevante, pero son estadísticamente no significativos. Esto podría deberse al modesto tamaño muestral (N=25) que disminuye la potencia estadística del análisis para obtener significación estadística y a la heterogeneidad de la histología de los sarcomas pélvicos. De hecho, las recurrencias locales y a distancia son un evento multifactorial que, aunque íntimamente relacionado con la calidad de los márgenes quirúrgicos2, no solo depende de la precisión de la resección sino también del tipo histológico, grado, tamaño, localización y respuesta a las terapias adyuvantes22.
Como limitación añadida al estudio, incluimos el diseño retrospectivo. Sin embargo, la baja incidencia de estos tumores dificulta el reclutamiento de un número considerable de pacientes para un estudio prospectivo aleatorizado. Además, dada la evidencia en la literatura acerca de la mejora que este tipo de guías ofrece14,15, un estudio aleatorizado con pacientes podría considerarse por muchos como éticamente inaceptable.
Estas mejoras con las guías 3D se consiguen con una tasa similar de complicaciones a la técnica convencional, siendo la más frecuente, al igual que en otras series, la infección del lecho quirúrgico en un 40% de nuestros pacientes (35,623-41%24).
Además, parece que su uso no aumenta de manera relevante los tiempos quirúrgicos; sino que los disminuye respecto a otras herramientas como la navegación13. En nuestro caso, no ha sido posible comparar los tiempos quirúrgicos entre ambos grupos dado que los datos de los que disponíamos en cuanto a la duración de la cirugía incluían de una manera inconsistente el tiempo reconstructivo (en aquellos casos realizados en el mismo acto quirúrgico), aportando un sesgo de confusión. Sin embargo, el trabajo de Evrard et al. muestra similares tiempos quirúrgicos (p=0,887)12.
A diferencia del grupo belga, en nuestro caso todo el diseño, procesado e impresión de las guías se lleva a cabo en el propio centro hospitalario (point of care manufacturing), lo cual optimiza los tiempos y abarata los costes de producción de las guías25. El ahorro sanitario de evitar una recurrencia local probablemente cubriría el coste de producción de PCPs para muchos pacientes. Sin embargo, esto es solo una hipótesis. Sería necesario un estudio de costes para validar la eficiencia del uso de estas herramientas para el sistema sanitario.
Como conclusión del presente estudio, el uso de herramientas paciente-específicas impresas en 3D (PCPs) en la resección de tumores pélvicos primarios no solo consigue una tasa de márgenes libres superior, sino que muestra una tendencia hacia una mayor supervivencia libre de enfermedad local, a distancia y global de estos pacientes. Estudios con mayor tamaño muestral y nivel de evidencia serían necesarios para validar la tendencia clínica observada con los resultados de este trabajo.
Nivel de evidenciaNivel de evidencia III.
Consideraciones éticasEl presente estudio se ha realizado en conformidad con el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki). Todos los sujetos involucrados dieron su consentimiento informado por escrito. Además, el estudio cuenta con la aprobación del Comité Ético de Investigación Clínica (CEIC) del centro sanitario.
FinanciaciónLa presente investigación se ha llevado a cabo gracias a la ayuda a Proyectos de Iniciación a la Investigación concedida por la Fundación SECOT en el año 2023 por el proyecto “Transformación digital en oncología ortopédica: inteligencia artificial y realidad aumentada para una cirugía personalizada” y a la financación de fondos europeos por el proyecto TED2021-132200B-I00 / TED2021-129392B-I00 - “Digital transformation in cancer treatment. Artificial intelligence, 3D printing and augmented reality for personalizedmedicine (IAR3D-ONC)”.
Conflicto de interesesLos autores declaran no presentar ningún conflicto de intereses.
Especial agradecimiento al equipo de bioingeniería del servicio UPAM-3D de nuestro centro por su disposición, colaboración y entrega en la labor asistencial y científica.