Influencia de los antiinflamatorios no esteroideos en las osificaciones heterotópicas. Estudio experimental
Influence of nonsteroid anti-inflammatory agents on heterotopic ossification. Experimental study
CIMA SUÁREZ, M.; TRIVIÑO LÓPEZ, A.; LUNA BLANCO, L., y HERNÁNDEZ VAQUERO, D.
Servicio de Cirugía Ortopédica y Traumatología. Hospital San Agustín. Avilés. Departamento de Cirugía. Facultad de Medicina. Oviedo.
Correspondencia:
Dr. D. HERNÁNDEZ VAQUERO.
Apartado de Correos 341.
33400 Avilés (Asturias).
Recibido: Octubre de 1998.
Aceptado: Marzo de 1999.
RESUMEN: Una de las medidas recomendadas para la prevención de las osificaciones periarticulares tras artroplastias de cadera es la administración de indometacina. Debido a sus graves efectos secundarios no se utiliza de manera habitual y se está investigando la utilidad de otros antiinflamatorios y de dosis más reducidas. Después de un estudio preliminar sobre la evolución histológica de las diferentes fases de la osteoinducción se ha realizado un estudio experimental en 40 ratas macho Wistar. Se implantaron aloinjertos descalcificados en la musculatura abdominal; en el grupo experimental se administró diclofenaco sódico a dosis de 6 mg/kg de peso/día durante 5 días y en el grupo control se inyectó 1 cc de suero fisiológico durante el mismo período de tiempo. Los estudios histológicos realizados en la osteoinducción mostraron que el pericito no es una célula diana de la proteína morfogenética ósea. Para el estudio definitivo los animales fueron sacrificados y se realizó cuantificación del tejido óseo maduro mediante análisis digital de imágenes, apreciándose un 17± 7% de media de neoformación ósea en el grupo control y un 10 ± 4% en el grupo experimental, con una diferencia estadísticamente significativa (p < 0,05). La administración de diclofenaco sódico durante un corto período de tiempo puede disminuir la presencia de osificaciones periarticulares secundarias al implante de una artroplastia de cadera.
PALABRAS CLAVE: Osteoinducción. Antiinflamatorios no esteroideos. Rata. Diclofenaco.
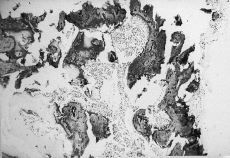
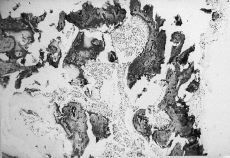
ABSTRACT: Indomethacin is one measure recommended for the prevention of periarticular ossification after hip arthroplasty. However, due to its severe side effects, it is not used regularly and other anti-inflammatory agents administered at lower doses are being studied. After a preliminary study of the histological evolution of different phases of osteoinduction, an experimental study was made of 40 male Wistar rats. Decalcified allografts were implanted in abdominal muscles. The experimental group received sodium diclofenac, 6 mg/kg body weight/day for 5 days and the control group received an injection of 1 cc saline solution for the same period of time. Histological studies of bone induction showed that the pericyte is not a target cell of the osseous morphogenetic protein. For the definitive study, animals were killed and mature bone tissue was quantified by digital image analysis, showing 17 ± 7% mean bone neoformation in the control group and 10 ± 4% in the experimental group, which was statistically significant (p KEY WORDS: Bone induction. Nonsteroid anti-inflammatory agents. Diclofenac. Se denomina osificación heterotópica (OH) a la formación de tejido óseo en estructuras extraesqueléticas. Generalmente la osificación asienta en grupos musculares periarticulares, aunque también pueden aparecer en tendones, ligamentos, meniscos o en el tejido celular subcutáneo.4 Los pacientes más frecuentemente afectados son los lesionados en la médula espinal o el encéfalo y los que han sufrido intervenciones quirúrgicas musculoesqueléticas. En estos dos grupos se han realizado la mayoría de los estudios. En la cirugía protésica de la cadera las OH pueden ocasionar fracasos funcionales hasta en un 12% en algunas series, siendo la anquilosis el resultado final más temido.3 Son numerosos los autores que relacionan los malos resultados de las artroplastias de cadera con grados avanzados de OH, afectando sobre todo a la movilidad y a la deambulación.6,11 Aunque no plenamente incorporada en la práctica clínica, la profilaxis más utilizada para la prevención de las OH es la administración de indometacina y de otros antiinflamatorios no esteroideos (AINE). Actualmente no existe consenso en cuanto al tipo de AINE, dosis, ni duración de la profilaxis. Algunos autores sólo recomiendan su empleo en pacientes con alto riesgo de presentación de OH, ya que los tratamientos prolongados tienen un índice de intolerancias cercano al 33%.9 Se ha pretendido estudiar la formación ósea dentro de un aloinjerto descalcificado que se implantó en la musculatura abdominal de la rata y la influencia de un AINE (diclofenaco) en el proceso. Material y Método En la primera parte del trabajo se analizaron las diferentes fases de la osteoinducción, intentando averiguar cuáles son las células diana de la proteína morfogenética ósea (BMP) del aloinjerto descalcificado. En un segundo diseño se dividió a los animales en un grupo control y otro experimental; a los animales del grupo experimental se les administró diclofenaco sódico para valorar su influencia sobre la formación ósea, relacionando después esta neoformación ósea en el grupo control y experimental. Se utilizaron 63 ratas machos de la cepa Wistar, observándose las directrices europeas relativas al enjaulado de roedores de laboratorio (Directiva 86/109 de la CEE de Noviembre de 1986). Los animales se distribuyeron en: a) donantes: 13 ratas para la extracción de sus fémures y tibias como aloinjertos; b) estudio preliminar: 10 ratas a las que se les implantaron dos aloinjertos en la musculatura de la pared abdominal, y c) 40 ratas, 20 al grupo control y 20 al grupo experimental. En el grupo b se estudió la evolución histológica del aloinjerto para evaluar las diferentes fases de la osteoinducción. Se sacrificaron dos ratas, respectivamente, en la primera, segunda, tercera, cuarta y sexta semanas después del implante. Los aloinjertos extraídos fueron sometidos a diferentes técnicas histológicas, dependiendo del tiempo de sacrificio del animal: b1) los aloinjertos extraídos en la primera y segunda semanas, que se seccionaron en seis preparaciones cada uno, realizándose dos tinciones de hematoxilina-eosina (HE), dos tinciones inmunohistoquímicas para vimentina y dos tinciones inmunohistoquímicas para actina-miosina, y b2) los aloinjertos extraídos en la tercera, cuarta y sexta semanas también se les practicaron seis cortes por injerto, realizándose las tinciones de HE y de Von Kossa. En algún caso en los cortes de la tercera semana se realizó tinción para la vimentina. El anticuerpo antivimentina pone en evidencia células mesenquimales y otro tipo de células como los pericitos, mientras la tinción de Von Kossa muestra la presencia de tejido óseo maduro. En el grupo c, el estudio comparativo definitivo, los animales fueron divididos de forma aleatoria en dos grupos (20/20). Todos los animales fueron intervenidos, implantándose dos aloinjertos en la musculatura de la pared abdominal, siendo todos ellos sacrificados a las 6 semanas del implante. De cada aloinjerto tanto del grupo control como del experimental se hicieron cuatro preparaciones histológicas que se tiñeron con HE. A las ratas del grupo control se les inyectó desde el mismo día del implante hasta el quinto día después de la intervención 1 cc de suero salino fisiológico por vía subcutánea en el dorso del animal. A las ratas del grupo experimental se les proporcionó por la misma vía desde el mismo momento y durante similar tiempo que las del grupo control con una solución de diclofenaco diluido en suero fisiológico, a razón de 6 mg/kg de peso/día. A todos los animales, tanto del grupo control como del experimental, se les extrajo el estómago en el momento del sacrificio para comprobar microscópicamente la indemnidad de la mucosa. La cuantificación del tejido óseo maduro se llevó a cabo mediante analizador de imágenes, empleando un programa de ordenador diseñado para tal efecto. Para la realización del estudio estadístico se utilizó el programa SPSS para Windows. Se estudió el porcentaje de osificación dentro de los aloinjertos del grupo control y experimental. Dado que es una variable continua, se empleó la «t» de Student, considerándose diferencia significativa para una p < 0,05. Resultados Estudio preliminar (grupo b) En este apartado se estudiaron las fases de la inducción ósea provocada por el aloinjerto implantado en la pared abdominal de la rata no tratada. Se estudiaron el 85% de los cortes histológicos, desechándose el resto por técnica inadecuada para el estudio. En la primera semana lo más característico es una marcada reacción inflamatoria alrededor del injerto. Las células predominantes en esta fase son de forma redondeada con fenotipo indiferenciado, pudiendo corresponder a las llamadas «células mesenquimales», que microscópicamente son indiferenciables de los fibroblastos inmaduros; también aparecen linfocitos, algunos polimorfonucleares, histiocitos y monocitos. El aloinjerto aún no ha sido invadido por esta proliferación celular. En la segunda semana persiste la reacción inflamatoria, con características similares a la etapa anterior. El número de vasos neoformados es ahora mucho mayor y aparece invasión vascular del injerto. En algunas zonas se detecta la entrada de diferentes frentes celulares multinucleados que labran canales en el implante; también se encontraron algunos acúmulos aislados de condrocitos positivos para la vimentina. En la tercera semana la reacción inflamatoria ha disminuido mucho de tamaño. Se aprecian en múltiples zonas del implante frentes condroblásticos de células multinucleadas e incluso formación de tejido osteoide. Al igual que en la fase anterior es visible la formación de un gran número de vasos. En la cuarta semana predomina netamente la presencia de tejido condroide y áreas de tejido osteoide, si bien en muchos casos ya se pueden observar zonas de formación de tejido óseo maduro y médula ósea. En la sexta semana, por último, ya no aparecen los condroblastos, siendo el tejido óseo maduro y la médula ósea el hallazgo fundamental. Estudiando las trabéculas óseas se pueden apreciar los ribetes celulares correspondientes a los osteoblastos; asimismo, en la médula ósea se visualizan elementos celulares de las series roja y blanca (Fig. 1). Los hallazgos histológicos son superponibles a los que se aprecian en una osificación heterotópica madura.
Figura 1. Estudio preliminar (sexta semana). Nótese el tejido óseo inmaduro y médula ósea de trabéculas estructuradas normalmente.
Estudio comparativo AINE/suero (grupo c)
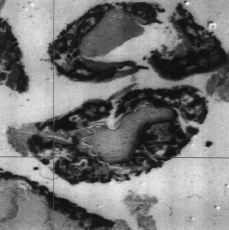
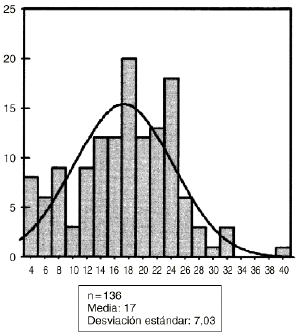
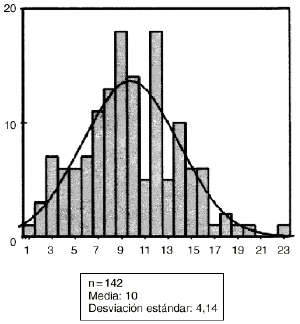
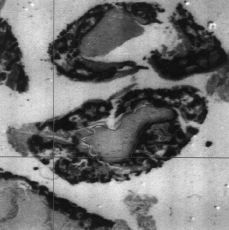
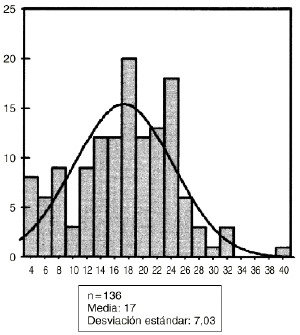
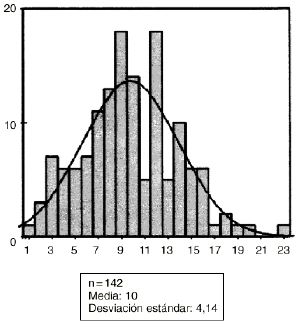
Los hallazgos obtenidos desde el punto de vista histológico en el grupo control fueron similares a los obtenidos en el estudio microscópico preliminar. Sin embargo, en el grupo de animales tratados con diclofenaco la mayor diferencia aparecía en los estudios digitálicos de imagen (Fig. 2). La observación de los porcentajes de hueso neoformado dentro de los aloinjertos implantados en las ratas del grupo control y experimental fueron de 17 ± 7% de neoformación ósea en el grupo control y de 10 ± 4% en el experimental (Figs. 3 y 4). No se encontró alteración morfológica de la mucosa gástrica de los animales ni en el grupo control ni en el experimental.
Figura 2. Estudio digitalizado de implante óseo que cuantifica el área de calcificación del mismo.
Figura 3. Abscisas: casos control. Ordenadas: hueso neoformado: micras cuadradas.
Figura 4. Abscisas: casos estudio. Ordenadas: hueso neoformado: micras cuadradas.
Discusión
Los estudios con experimentación animal han conseguido reproducir OH mediante hipoxia por ligadura arterial, traumatismos musculares y tendinosos, trasplantes de epitelios osteoinductores y trasplante de diferentes componentes del hueso.1,7 En nuestro estudio se ha intentado reproducir la formación de OH mediante el implante de aloinjertos. Algunos trabajos aislados han recomendado métodos locales orientados a la prevención del crecimiento óseo, interponiendo grasa entre los extremos de las osteotomías o utilizando metilmetacrilato o silicona para evitar el cierre del cartílago fisario, por ejemplo. Sin embargo, estos métodos no se aceptan en la prevención de OH en la cirugía protésica de cadera dado que la implantación de materiales no reabsorbibles induciría una inflamación crónica y facilitaría la infección.4
Puede afirmarse que en la prevención de las OH sólo se han recomendado dos tipos de medidas con base científica: la radioterapia y la profilaxis medicamentosa. Se conoce que la radioterapia previene la proliferación y posterior diferenciación de las células mesenquimales pluripotenciales hacia estirpes condroblásticas y osteoblásticas, evitando así la formación de las OH. Es efectiva para la prevención de las OH cuando se administra de forma precoz, generalmente en la primera semana postoperatoria, sobre todo entre el segundo y el cuarto día después de la intervención. La dosis recomendada es muy variable; de forma fraccionada, la media es de 3 Gy y en 4 días y en exposición única entre 5 ó 7 Gy tras la cirugía. En general, la terapia con radiaciones ionizantes no está indicada de forma general para la prevención de las OH secundaria a artroplastia de cadera, ya que se precisa una infraestructura compleja, sin olvidar el riesgo potencial de inducir neoplasias, sobre todo de tipo sarcomatoso. Parece, no obstante, que cuando la dosis total es menor de 30 Gy dicho riesgo es mínimo. Puede aceptarse que la radioterapia sólo estaría indicada en pacientes de alto riesgo en los que se ha contraindicado la profilaxis con otras técnicas.16
Como profilaxis medicamentosa se ha recomendado la utilización de difosfonatos, sustancias similares a los pirofosfatos que actúan inhibiendo la precipitación del fosfato cálcico en hidroxiapatita. Aunque parece que los difosfonatos inhiben la formación de OH, se cree que tal efectividad disminuye cuando los estudios se hacen a largo plazo. Además tras la retirada de los difosfonatos sucede la mineralización del tejido osteoide y la progresión de las OH. Existen estudios en los que no se encuentran diferencias de presentación de OH entre los casos tratados y los no tratados con difosfonatos en pacientes intervenidos por artroplastia de cadera y se han encontrado graves efectos secundarios como nefropatías y desmineralización ósea. Por ello tampoco es una terapéutica recomendada generalmente para la prevención de la OH.17 En cuanto a los AINE, la indometacina fue el primer fármaco que se experimentó para la prevención de las OH tras las artroplastias de cadera, y en la actualidad constituye una alternativa válida y confirmada para aquellos pacientes con alto riesgo de OH. Se cree que el efecto de los AINE sobre la prevención de las OH está relacionado con la inhibición de la síntesis de prostaglandinas a nivel celular, impidiendo la proliferación y diferenciación de las células mesenquimales a osteoblastos. Se han empleado otros AINE a distintas dosis y en períodos de tiempo diferentes con el fin de inhibir la formación de OH tras la artroplastia de cadera. Así se han recomendado el ibuprofeno, flurbiprofén, piroxicam, naproxeno, diclofenaco o el ácido acetilsalicílico. Por otra parte también se han demostrado útiles los AINE en la prevención de OH en niños con traumatismos encefálicos y en la cirugía de la luxación congénita de cadera. Actualmente existe acuerdo en que los antiinflamatorios para que sean efectivos deben ser administrados precozmente, recomendándose que se haga a partir del primer día del período postoperatorio,7-9,12 pero también hay que reconocer que existen estudios en la bibliografía donde no se ha conseguido prevenir la presencia de OH en artroplastias de cadera con el empleo de estos fármacos.15
Las imágenes histológicas de la OH en sus estudios iniciales son bien conocidas y muy valiosas para realizar el diagnóstico diferencial con procesos malignos. El hallazgo microscópico fundamental es «el efecto zona», que refleja diferentes grados de maduración de la osificación, siendo ello evidente a partir de la tercera semana desde su aparición. Según este «efecto zona» hay una porción central de la lesión compuesta por tejido fibroblástico inmaduro, con textura laxa y abundante vascularización, semejante al tejido de granulación. Las células son fundamentalmente del tipo fibroblástico, con moderado pleomorfismo celular y una actividad mitótica elevada. Estas células están mezcladas con un número variable de macrófagos y células gigantes multinucleadas y también suele aparecer una notable proliferación endotelial, con focos de hemorragia focal. Limitando con este área central hay una zona intermedia en donde las células se condensan en trabéculas, que son mezcla de fibroblastos, osteoblastos y cantidades variables de tejido osteoide. También pueden aparecer islotes de tejido condroide. En la zona más periférica de la osificación el tejido osteoide se va calcificando y evoluciona hacia hueso lamelar maduro. Este hueso está separado del tejido muscular circundante por una zona de tejido fibroso mixoide laxo. No siempre se observa este patrón zonal, como, por ejemplo, aquellas OH que asientan en el tejido celular subcutáneo o en los músculos de la mano.2,5,18
En nuestro trabajo, y específicamente en el grupo b, se estudiaron las diferentes fases del mecanismo de osteoinducción. Observamos que en la primera, y en menor grado durante la segunda semana tras el trasplante, se observaba una marcada reacción inflamatoria alrededor del aloinjerto, con células en muchos casos positivas para la vimentina. Hay controversia en relación con el tipo de célula sobre la que actúa la BMP para posteriormente transformarse en condroblasto y osteoblasto. Esta controversia procede ya por la falta de acuerdo en el origen de la célula ósea. De todas las múltiples teorías que se han publicado sobre el tema parece que la más aceptada es aquella que postula que los osteoblastos derivan de los fibroblastos y los osteoclastos de los monocitos.14,19
Hemos comprobado al revisar nuestro resultados en la evolución histológica del aloinjerto que en la primera semana existía alrededor del aloinjerto una gran reacción de tipo inflamatorio que persistía hasta la segunda semana. Al analizar técnicas inmunohistoquímicas empleando el anticuerpo antivimentina se comprobó que había un gran número de células vimentín-positivas tanto en la primera como en la segunda semana del trasplante. Con la técnica de actina-miosina sólo se marcaron los pericitos de los vasos, no apareciendo positividad en otras células extracapilares. Tanto el pericito como el fibroblasto pueden mostrar positividad con el marcaje de vimentina, pero parece demostrado que la técnica inmunohistoquímica de la actina-miosina sólo marcará pericitos y no fibroblastos. En el trabajo que hemos expuesto hemos comprobado que con la actina-miosina sólo aparecía positividad en el endotelio vascular y no alrededor del implante como se ha publicado en otros trabajos.1
De otro lado, las células presentes en las primeras fases de la osteoinducción del aloinjerto son las vimentín-positivas, es decir, fundamentalmente fibroblastos, por lo que podrían ser la diana de la BMP de acuerdo también con otros autores.2,10 En los aloinjertos implantados puede verse a partir de la tercera semana una invasión del aloinjerto por frentes condroblásticos. Por ello el condroblasto que procede del fibroblasto presenta un citoesqueleto positivo para la vimentina.
Por último, en lo que respecta a nuestros resultados en el trabajo preliminar, y dados los hallazgos expuestos, no se puede afirmar si la presencia de osteoblastos y condroblastos es concomitante o si son los condroblastos los que posteriormente se transforman en osteoblastos.19 A favor de esta teoría está el hecho de que a medida que transcurre el período de evolución del aloinjerto ya no aparecen condroblastos y los que se encuentra es formación de tejido osteoide y luego tejido óseo maduro y médula ósea. Ello es similar a lo que aparece en las OH en la clínica humana, donde en las primeras fases es frecuente encontrar condroblastos y tejido cartilaginoso y a medida que madura la osificación va apareciendo el tejido cartilaginoso para dar paso al óseo; no obstante, en la clínica humana hay una entidad conocida como miositis osificante, donde el tejido predominante es el cartilaginoso.1
En el estudio definitivo de nuestro trabajo apreciamos que la cantidad de hueso maduro neoformado era mayor a las 6 semanas y no a las 4 como indican otros estudios experimentales. Probablemente esto se deba a la purificación del aloinjerto; a mayor purificación habría un menor tiempo de respuesta, pues la BMP se difundiría con mayor rapidez. Para cuantificar la formación de hueso maduro se decidió utilizar un proceso digital de imágenes, pues es la forma más efectiva para valorar el corte histológico completo, pudiendo excluir zonas que no pertenezcan al injerto propiamente dicho. La utilización de métodos gammagráficos se desechó porque su valoración depende sobre todo de la vascularización del injerto.
Al analizar los resultados tras la cuantificación de la formación de hueso maduro hemos comprobado que el diclofenaco a la dosis de 6 mg/kg/día durante 5 días consigue inhibir de forma muy significativa la cantidad de hueso maduro neoformado dentro de los aloinjertos, siendo la media del área de osificación de 17 ± 7% en el grupo control y de 10 ± 4% en el grupo tratado con diclofenaco, hallazgo concordante con el empleo de otros AINE como la indometacina en trabajos similares al nuestro. Todos los cortes histológicos estudiados tanto en el grupo control como en el experimental presentaron formación ósea en mayor o menor cuantía. Solamente dos aloinjertos del grupo control con signos histológicos de infección no mostraron formación ósea. Parece según este hallazgo que la presencia de infección demostrada por visión microscópica inhibe la inducción ósea, hallazgo que sería superponible en la clínica humana, donde la infección de un injerto óseo desencadena su fracaso.
Conclusiones
1.a El pericito no es una célula diana de la BMP.
2.a El diclofenaco disminuye la neoformación ósea en el aloinjerto descalcificado implantado en animales de experimentación.
Bibliografía
1.Ahrengart, L: Trauma Induced Heterotopic Bone Formation. Clinical Studies on Patients Undergoing Total Hip Replacement and Experimental Studies in the Rabbit. Tesis doctoral. Karolinska Institute, 1989.
2.Anderson, HC: Mechanism of mineral formation in bone. Lab Invest, 60: 320-330, 1989.
3.Brooker, AF; Bowerman, JW; Robinson, RA, y Reilly LM Jr: Ectopic ossification following total hip replacement. Incidence and method of classification. J Bone Joint Surg, 55A: 1629-1632, 1973.
4.De Lee, JP; Ferrari, A, y Charnley J: Ectopic bone formation following low friction arthroplaty of the hip. Clin Orthop, 121: 53-59, 1976.
5.Eastell, R; Delmas, PD; Hodgson, SF; Eriksen, EF; Mann, KG, y Riggs, BL: Bone formation rate in older normal women: Concurrent assessment with bone histomorphometry, calcium kinetics, and biochemical markers. J Clin Endocrinol Metab, 67: 741-748, 1988.
6.Fernández Fernández, JM; Olay Gayoso, MJ, y Hernández Vaquero, D: Osificaciones heterotópicas periarticulares en artroplastias totales de cadera. Relación con la vía de abordaje y el tipo de artrosis primaria. Rev Ortop Traumatol, 42: 273-276, 1998.
7.Finerman, GAM, y Stover, SL: Heterotopic ossification following hip replacement or spinal cord injury. Two clinical studies with EHDP. Bone, 4: 337-342, 1981.
8.Gebuhr, P; Soelberg, M; Orsnes, T, y Wilbek, H: Naproxen prevention of heterotopic ossification after hip arthroplasty. Acta Orthop Scand, 62: 226-229, 1991.
9.Hernández Vaquero, D, y Uruñuela de la Rica, A: Las calcificaciones periarticulares en las artroplastias de cadera. Prevención con antiinflamatorios. Rev Ortop Traumatol, 37: 186-191, 1993.
10.Hierton, C; Blomgren, G, y Lindgren, U: Factors associated with heterotopic bone formation in cemented total hip prostheses. Acta Orthop Scand, 54: 698-702, 1983.
11.Hoikka, V; Lindholm, TS, y Eskola A: Flurbiprofen inhibits heterotopic bone formation in total hip artrhoplasty. Arch Orthop Trauma Surg, 109: 224-226, 1990.
12.Knelles, D; Barthel, T; Karrer, A; Krauss, U, y Eulert, O: Prevention of heterotopic ossification after total hip replacement. J Bone Joint Surg, 79B: 596-602, 1997.
13.Morrey, BF; Adams, RA, y Cabanela, ME: Comparison of heterotopic bone after anterolateral, transtrochanteric and posterior approaches for total hip arthroplasty. Clin Orthop, 188: 160-167, 1984.
14.Owen M: The origin of bone cells in the postnatal organism. Arthr Rheum, 23: 1073-1080, 1980.
15.Reis, HJ; Küsswetter, W, y Schellinger, T: The suppression of heterotopic ossification after total hip arthroplasty. Int Orthop, 16: 140-145, 1992.
16.Seegenschmiedt, MH; Martus, P, y Goldmann AR: Preoperative versus postoperative prevention of heterotopic ossification. Int J Radiat Oncol Biol Phys, 30: 63-73, 1994.
17.Thomas, BJ, y Amstutz, HC: Results of administration of diphosphonate for prevention of heterotopic ossification after total hip arthroplasty. J Bone Joint Surg, 67A: 400-403, 1985
18.Urist, MR; Delange, RJ, y Finerman GAM: Bone cell differentiation and growth factors: Induced activity of chondro-osteogenetic DNA. Science, 220: 680-686, 1983.
19.Urist, MR; Nilsson, OS; Hudak, R; Hou, YK, y Rasmussen, J: Immunologic evidence of a bone morphogenetic protein in the milieu interieur. Ann Biol Clin, 433: 755-766, 1985.