La artroplastia invertida se está convirtiendo en una herramienta útil para afecciones muy variadas en el hombro. Un defecto óseo importante de la glena puede afectar a la fijación del componente glenoideo. El propósito de nuestro estudio es evaluar a medio plazo los resultados de la artroplastia invertida de hombro asociados a una glenoplastia.
Material y métodosSe realizó un estudio retrospectivo de 5 pacientes de nuestro hospital con defectos glenoideos de distinta etiología que fueron tratados mediante artroplastia invertida de hombro asociada a glenoplastia.
ResultadosEl seguimiento mínimo de estos pacientes fue de un año (con una media de 30,4 meses). Todos los injertos estaban radiológicamente integrados, sin observarse signos de resorción o necrosis. A los 12 meses el test de Constant era de 66,75 de media y el EVA medio era de 1.
DiscusiónLa glenoplastia es una intervención de alta demanda técnica que consigue restaurar el remanente óseo en pacientes con defectos estructurales, permitiendo así implantar una artroplastia invertida. De esa forma podemos mejorar la función y la clínica en pacientes con diversas afecciones glenohumerales, proporcionándoles una solución.
Reverse shoulder arthroplasty is becoming a useful tool for many diseases of the shoulder. Any severe glenoid bone defect may affect the fixing of the glenoid component. The aim of this paper is to evaluate the medium-term outcomes of reverse shoulder arthroplasty associated with a glenoplasty.
Materials and methodsA retrospective study was conducted on 5 patients from our hospital, selected due to glenoid defects of different etiology. All of them where treated with reverse shoulder arthroplasty associated with glenoplasty with bone graft.
ResultsThe minimum follow-up was one year (mean 30.4 months). All grafts were radiologically integrated, with no signs of resorption or necrosis being observed. At 12 months, the Constant score was 66.75 and the mean EVA score was 1.
DiscussionGlenoplasty surgery is technically demanding for restoring original bone size in patients with glenoid structural defects, enabling a reverse shoulder arthroplasty to be implanted. Thus improving both the function and clinical outcomes in selected patients with glenohumeral pathology and providing them with a solution.
La artroplastia de hombro, tanto anatómica como invertida, ha experimentado un auge de sus indicaciones en diferentes procesos patológicos1,2 (artritis postraumática, artritis reumatoide, artropatía de manguito rotador, fractura en 4 fragmentos en ancianos…). La artroplastia mejora el dolor y la función en estos pacientes3. A la dificultad técnica inherente a la implantación de la prótesis deben añadirse los defectos óseos de la glena, ya que la falta de remanente óseo impide la adecuada fijación del implante, aumentando la posibilidad de fracaso de la intervención quirúrgica4.
El objetivo de este artículo es presentar la evaluación de resultados clínicos, radiológicos y funcionales a medio plazo en 5 pacientes operados mediante una artroplastia invertida de hombro con glenoplastia asociada y, asimismo, evaluar la integración del injerto óseo utilizado.
Material y métodosHemos realizado un estudio transversal retrospectivo de 5 pacientes (2 hombres y 3 mujeres), con una media de edad de 72,6 años (rango 64-85) intervenidos entre diciembre de 2009 y febrero de 2013. Todos presentaban defectos glenoideos importantes de diferente etiología: 2 recambios protésicos (prótesis parcial previa con desgaste glenoideo que experimentó una fractura periprotésica y un recambio por movilización séptica de prótesis invertida previa), una fractura luxación anterior en 4 fragmentos (bankart óseo no sintetizable por excesiva conminución) y 2 luxaciones inveteradas (una anterior y otra posterior). En todos ellos se realizó una glenoplastia (3 de ellos con autoinjerto de cabeza humeral y 2 con aloinjerto de banco de tejidos) junto con artroplastia invertida de hombro tipo Delta XTENDTM Reverse Shoulder System (DePuy Orthopaedics Inc, a Johnson & Johnson company, Warsaw, EE. UU.). El tiempo mínimo de seguimiento ha sido de 12 meses (media 30,4 meses).
La valoración funcional se realizó mediante la evaluación de la movilidad pasiva y activa del hombro intervenido y del codo homolateral mediante el test de Constant-Murley ponderado5,6, realizado a los 12 meses de seguimiento. La puntuación del test se agrupó según intervalos, definiendo varias categorías, desde «excelente», con una puntuación mayor o igual a 80 puntos, pasando por resultado «bueno», «regular» o «malo», cuando la puntuación fue igual o inferior a 50 puntos. Para evaluar la fuerza se utilizó el test de Constant avalado por la Sociedad Española de Hombro y Codo en el que la fuerza (máximo 25 puntos) se calcula, en ausencia de un dinamómetro isométrico, mediante la abducción repetida en 3 ocasiones de un peso (hasta 12,5kg) y multiplicando ese peso por 2.
Para la valoración de la osteointegración del injerto se realizó una TC de control a todos los pacientes. Un radiólogo especialista en imagen musculoesquelética y un cirujano ortopédico ajeno al estudio confirmaron la ausencia de resorción, líneas radiotransparentes o hundimiento del injerto. La valoración subjetiva se realizó mediante la escala visual analógica (EVA score) y mediante un test de satisfacción personal.
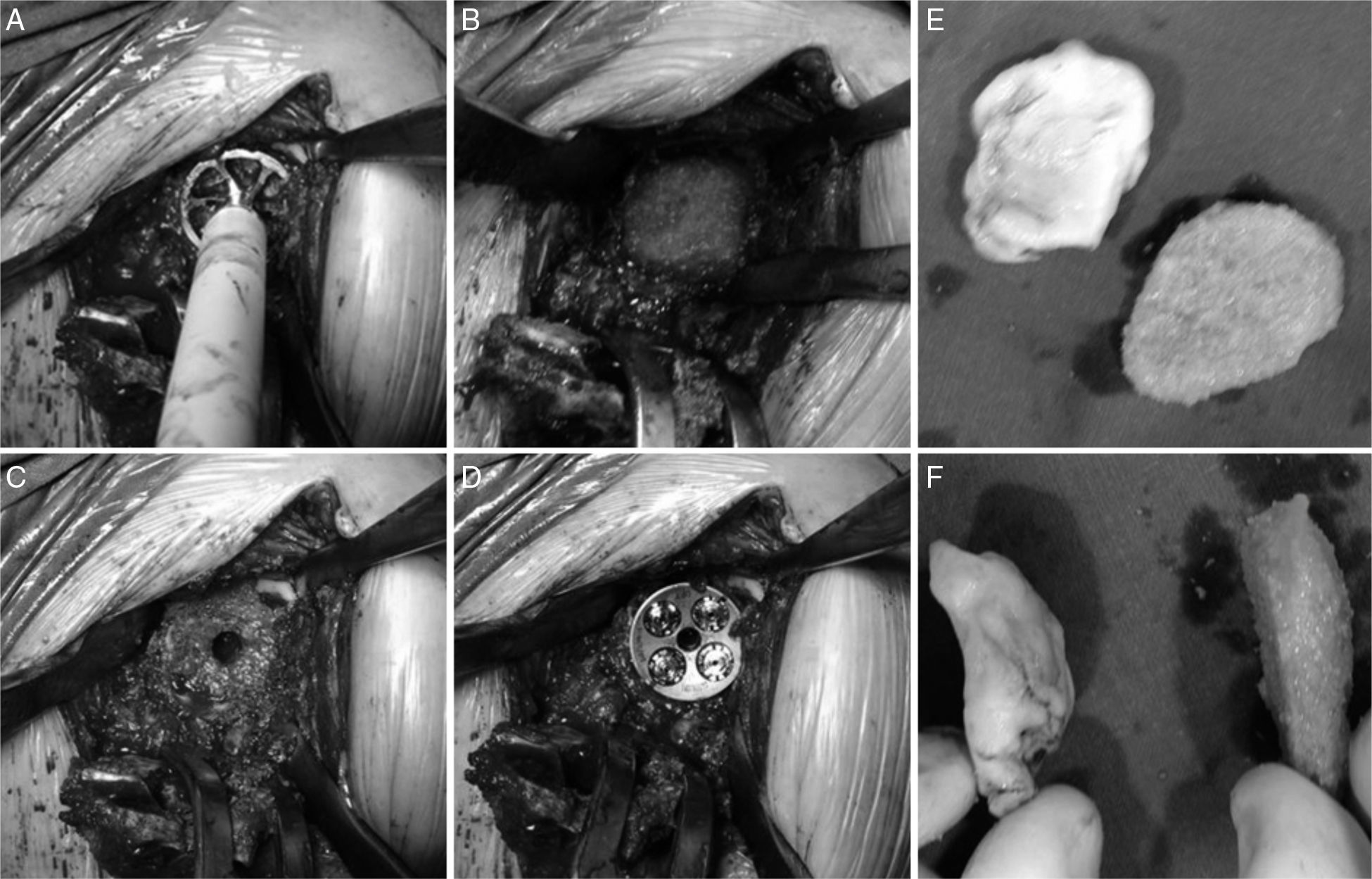
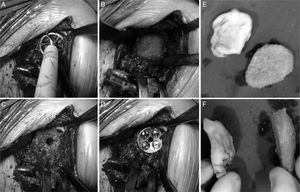
Todos los pacientes se intervinieron con anestesia general en posición de hamaca de playa y mediante un abordaje deltopectoral al hombro7. El primer paso fue preparar el húmero, seccionando la cabeza humeral en aquellos casos que la conservaban y retirando la prótesis previa en los demás. Una vez hecho esto se tuvo visualización completa de la glena y del defecto glenoideo. Se fresó el remanente glenoideo así como el defecto a cubrir hasta que se obtuvo un lecho adecuado (fig. 1A y B).
Tras esto se preparó el injerto siguiendo la técnica de Iannotti et al.8. Se aplicó cemento PMMA en estado maleable sobre el defecto para obtener un molde; cuando empezó a fraguar y antes de endurecerse por completo se retiró. Se utilizó una regla para marcar las referencias que sirvieran como guía para tallar el injerto con la forma adecuada, dependiendo de la disponibilidad, cabeza humeral resecada en 3 casos y aloinjerto de banco de tejidos en 2 casos (fig. 1E y F).
Para ello se utilizó una sierra oscilante pequeña y una fresa cilíndrica. A continuación se colocó el injerto en la zona del defecto a cubrir y se fijó con tornillos de cortical de 2,4mm a compresión (2 o 3 según cada caso). En los defectos centrales contenidos (Walch A2) no es necesario el uso de dichos tornillos ya que estos se fijan fácilmente al anclar la metaglena. Sin embargo, en los defectos periféricos (Walch B2) consideramos que sí deben ser utilizados para mejorar la fijación del injerto y evitar que este se desplace durante el fresado y colocación de la metaglena.
A la hora de implantar dichos tornillos hay que tener en cuenta la posición que ocuparán el tetón central y los tornillos de fijación de la metaglena e intentar colocar, en el espacio que estos dejan entre sí, los tornillos de fijación del injerto.
Una vez realizada la glenoplastia, se fresa la neoglena y se broca el agujero para el tetón de la metaglena (en nuestra serie tetón largo en un caso), colocando e impactando esta inmediatamente después. Se introducen los tornillos, todos ellos mixtos (de compresión y bloqueo) procurando que atraviesen el injerto y se anclen en la escápula (fig. 1C y D).
A continuación se coloca la glenoesfera. Una vez listo el componente glenoideo se prepara el componente humeral, fresando el canal, impactando el vástago (cementado en todos los casos y largo en un caso) y colocando el polietileno correspondiente.
Tras la intervención quirúrgica, el brazo fue protegido mediante un cabestrillo durante 4 semanas. Como norma general, se permitió la movilidad activa de codo y muñeca en el postoperatorio inmediato. Se instruyó al paciente para realizar ejercicios pasivos, que se permitieron entre las 48 h y las primeras 2 semanas. Se permitieron movimientos activos entre la 4.ª y 6.ª semanas, y ejercicios de contrarresistencia a las 12 semanas de la intervención quirúrgica. El Servicio de Rehabilitación del hospital supervisó la necesidad de fisioterapia adicional.
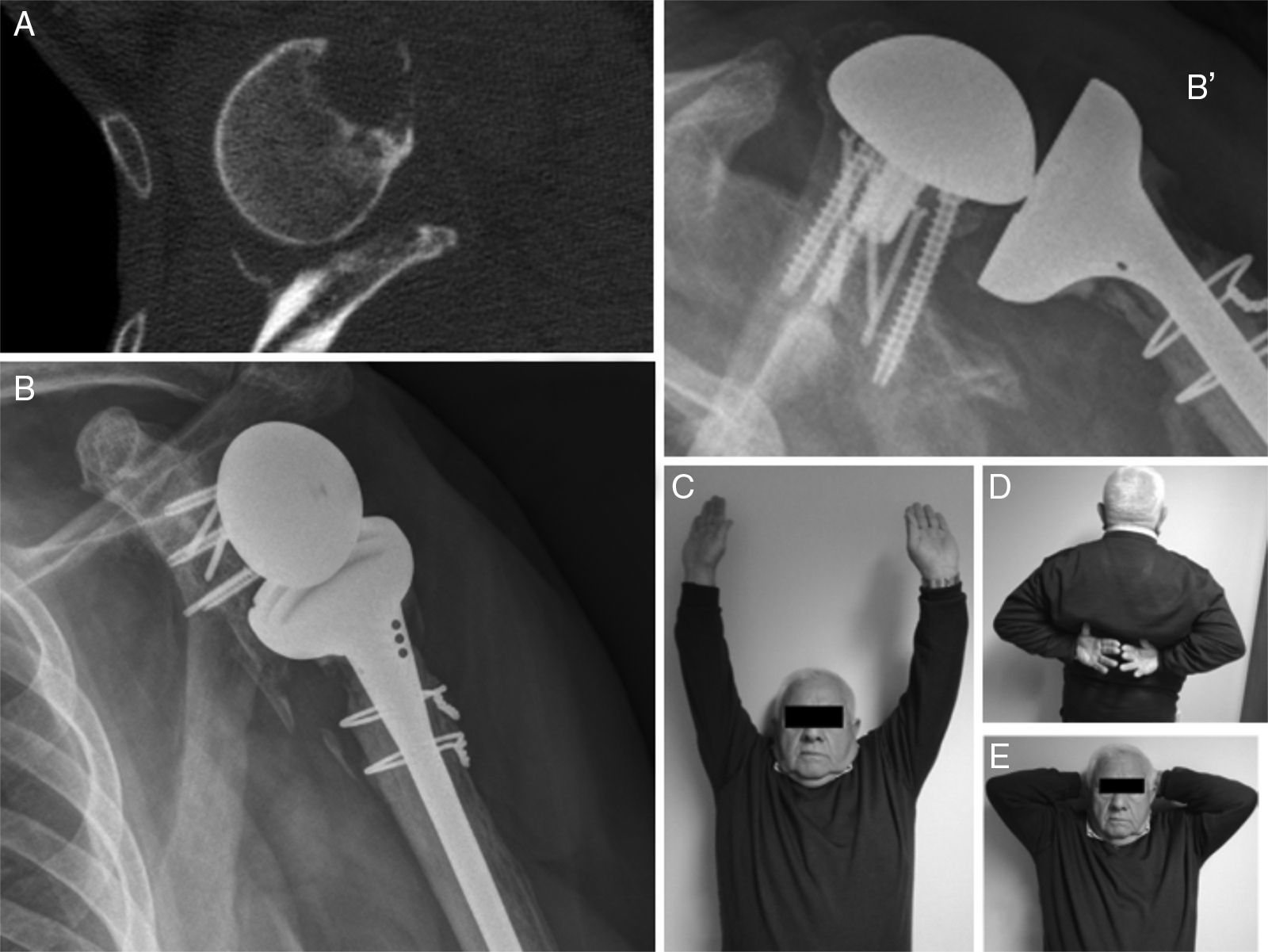
ResultadosLos principales resultados vienen reflejados en la tabla 1. Destacamos que el test de Constant ponderado medio de los hombros intervenidos fue de 66,75 puntos, perteneciente a la categoría de «buenos resultados». Dos de los pacientes presentaban un resultado excelente (81,5 y 85,5). Dos pacientes tenían resultados menores de 65 puntos, formando parte del grupo de resultados regulares. Solo un paciente presentaba un resultado por debajo de los 50 puntos (mal resultado) perteneciente al caso de la movilización séptica de prótesis invertida.
| Paciente | Sexo | Edad | Patología | Lateralidad | Dominancia | Posición del defecto | Tamaño del defecto (%) | Tipo de injerto | Seguimiento (meses) | Constant ponderado | Codfield y Antuña | Walch | EVA postoperatorio |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | F | 74 | Luxación inveterada | Izq | Izq | Posterior | 40 | Autólogo | 33 | 60 | Peripheral posterior severe | B2 | 2 |
| 2 | M | 72 | Luxación inveterada | Izq | Der | Anterior | 40 | Autólogo | 45 | 85,5 | Peripheral anterior severe | B2 | 0 |
| 3 | F | 85 | Fractura luxación | Izq | Der | Anterior | 30 | Autólogo | 48 | 81,5 | Peripheral anterior severe | B2 | 0 |
| 4 | M | 68 | Recambio | Izq | Der | Total | 90 | Banco | 14 | 47,25 | Severe combined | A2 | 3 |
| 5 | F | 64 | Recambioa | Der | Der | Total | 90 | Banco | 12 | 59,5 | Severe combined | A2 | 0 |
| Media | 72,6 | 30,4 | 66,75 | 1 |
Der: derecho; F: femenino; Izq: izquierdo; M: masculino.
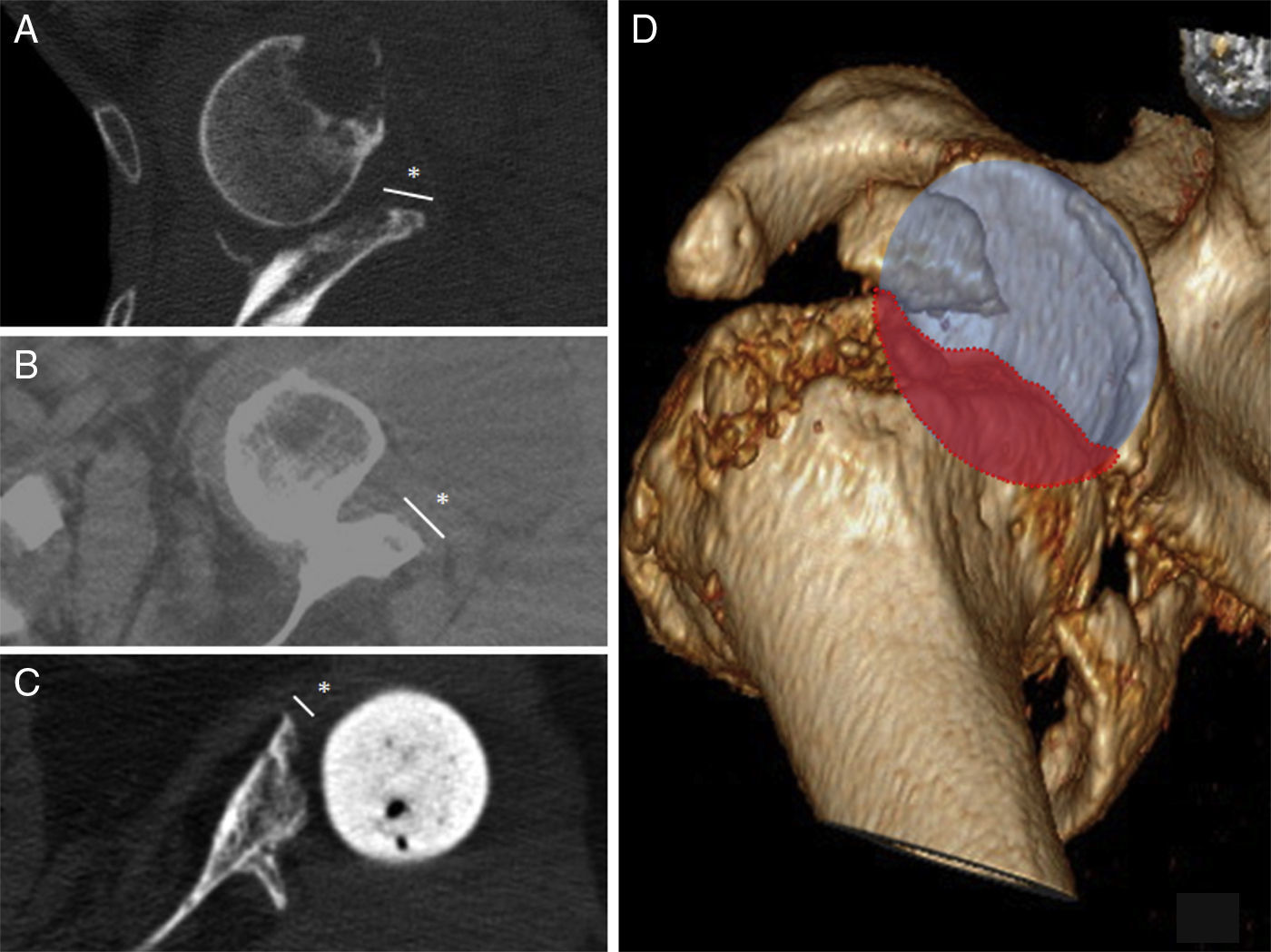
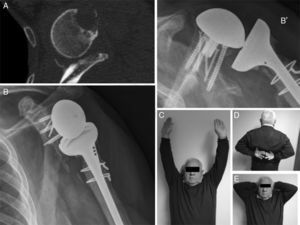
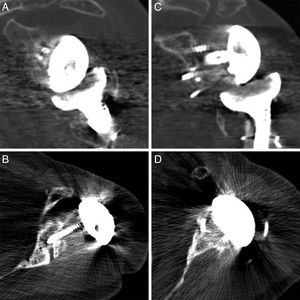
En las TC de control realizadas, los informes radiológicos refieren que todos los injertos, tanto los auto- como los aloinjertos, están integrados. No se observó resorción o colapso de los mismos y no se han presentado complicaciones durante el postoperatorio (fig. 2).
El EVA medio fue de 1 a los 12 meses (cero en 3 pacientes), y todos ellos, excepto uno, refieren estar muy satisfechos por la cirugía. El paciente intervenido por movilización séptica refiere estar moderadamente satisfecho.
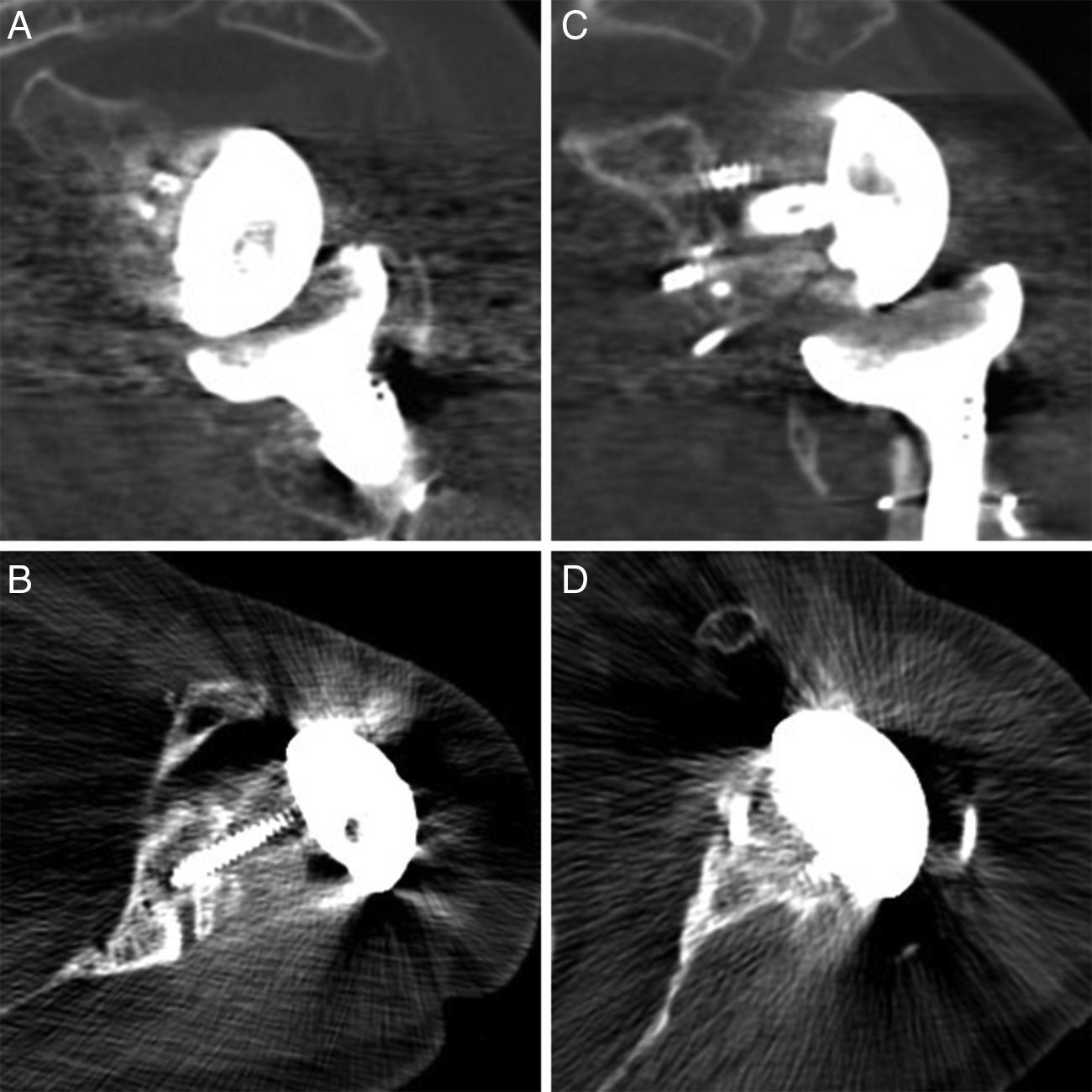
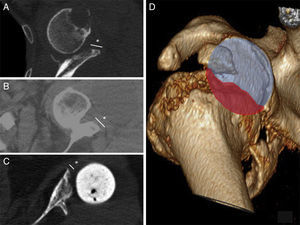
DiscusiónLos defectos óseos glenoideos hacen que disminuya el área de fijación para los tornillos y por lo tanto favorecen una colocación deficitaria del implante9. Se han propuesto diferentes clasificaciones que ayuden en la localización y el manejo de los defectos glenoideos como la clasificación de Codfield y Antuña10, Williams et al.11, Frankle et al.12 o la de Walch et al.13. Quizás esta última sea la clasificación más sencilla, reproductible y orientativa para el tratamiento. Walch divide los defectos en 3 tipos según sean centrales, marginales o totales. Aunque el defecto puede ocurrir en cualquier zona, la mayoría se sitúan en la región posterior o superior de la glena14. Nuestra muestra tiene un defecto posterior, 2 defectos anteriores y 2 defectos totales (correspondientes a los recambios). El tamaño del defecto pudo ser valorado preoperatoriamente gracias a la TC en 3 pacientes (fig. 3). Del resto de defectos sin TC, uno corresponde a un hallazgo intraoperatorio y el otro al recambio por la fractura periprotésica con erosión de la glena.
Los defectos glenoideos son un hallazgo a veces frecuente en pacientes con afección glenohumeral (osteoartritis, artritis reumatoide, artritis postraumática…) así como en recambios protésicos12.
Para abordar estos defectos tenemos varias opciones que pueden utilizarse de forma aislada o en combinación15. La primera y más frecuentemente utilizada es el fresado de la glena, con el inconveniente de que estamos perdiendo remanente óseo y medializando el centro de rotación16. Otra opción es recurrir a componentes de mayor tamaño, opción actualmente en estudio y todavía sin resultados concluyentes17. La última opción es la utilización de injerto óseo para cubrir los defectos glenoideos. La glenoplastia puede considerarse la técnica más adecuada para defectos severos ya que restaura el centro de rotación original, permite conservar un remanente óseo adecuado y evita un fresado excesivo18. A pesar de ello la indicación de utilizar injerto es escasa (mayor en el caso de los recambios), aproximadamente del 1 al 3% según algunos autores19.
En prótesis primarias lo más indicado según la bibliografía es utilizar autoinjerto de la cabeza humeral18 (realizado en 3 de nuestros pacientes). Sin embargo, en los recambios hay autores que defienden el uso de injerto de cresta ilíaca20 y otros el injerto de banco de tejidos21,22. Las ventajas de la cresta ilíaca son su mejor disponibilidad y que es hueso autógeno. Sin embargo es un injerto estrecho que en la mayoría de los casos no cubre la totalidad del defecto. Además suele ser de baja calidad en este tipo de pacientes, a lo que se añade la morbilidad de la zona donante. El injerto de banco tiene las ventajas de ser más resistente y de permitir cubrir defectos más amplios, aunque tiene un alto riesgo de no integrarse correctamente, e incluso de reabsorberse. En lo que respecta a nuestra serie de casos, todos los injertos muestran una integración satisfactoria según las imágenes de la TC (fig. 4).
El objetivo de toda artroplastia, en casos de defectos glenoideos importantes, es crear una base estable que permita la colocación de los componentes de forma segura, mejorando así la función y el dolor del hombro. La utilización de injerto óseo para cubrir defectos masivos es una técnica poco usada pero muy útil que permite incluso la implantación de una prótesis invertida, aumentando el suelo de la glena y, en aquellos casos en los que el defecto es total, lateralizando el centro de rotación de la articulación23.
Muchos autores consideran que la lateralización del centro de rotación aporta grandes ventajas como la mejora de la rotación interna y externa (al reclutar más fibras anteriores y posteriores del deltoides), el retensado del los restos de manguito rotador que incrementa la estabilidad así como el aumento del voladizo humeral u «offset» que permite disminuir la tasa de melladura o «notch» infraescapular24.
Algunos autores señalan que esa lateralización del centro de rotación puede tener también inconvenientes ya que aumenta las fuerzas tensionales sobre la interfase hueso-prótesis, incrementando el riesgo de aflojamiento y fallo del implante25.
Nuestra técnica de artroplastia invertida asociada a glenoplastia con injerto permite dicha lateralización en aquellos defectos totales secundarios a una revisión protésica, recuperando así la superficie y posición original de la glena. Sin embargo, una vez que el injerto se ha integrado en el hueso nativo, estas fuerzas disminuyen considerablemente, al contrario que la lateralización que se produce en las prótesis anatómicas18.
Mientras los implantes aumentados se desarrollen y demuestren su eficacia, la glenoplastia con injerto sigue siendo la técnica recomendada por muchos autores26-28 para tratar los defectos óseos importantes. Las indicaciones para el mismo actualmente son: un desgaste irregular o un defecto que no pueda ser corregido con pequeños cambios en la versión de los componentes o que el remanente óseo sea insuficiente para apoyar la metaglena.
La técnica más adecuada para la colocación del injerto todavía no está definida como tal, pero hay autores que defienden que mientras se favorezca una buena fijación (y por lo tanto se asegure la osteointegración) no hay contraindicación para la artroplastia invertida en estos casos29.
Nuestra técnica de glenoplastia y resultados es similar a algunas que aparecen en la bibliografía más reciente30. Pese a que nuestra serie es limitada en el número de casos, la adecuada osteointegración del injerto en todos ellos nos indica que esta, pese a la alta demanda técnica, puede ser una alternativa adecuada para conseguir una mejora de la función del hombro y de la calidad de vida en estos pacientes.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Los autores quieren agradecer al Dr. D. Rafael Montero Pérez-Barquero, radiólogo especialista en imagen musculoesquelética, su desinteresada colaboración en este trabajo. Asimismo, quieren agradecer a la Dra. María Teresa Urbano Luque sus recomendaciones estadísticas y su apoyo durante todo el proceso científico y de corrección.