Los recubrimientos de hidroxiapatita (HA) en las prótesis articulares ejercen una función de aceleración del proceso de formación ósea al estar formados por un fosfato de calcio de prácticamente la misma relación de calcio y fósforo que el hueso humano. Esta capa de material inorgánico acelera, mediante los procesos convencionales de señalización celular, la adsorción de proteínas de la matriz extracelular, para después producirse la adhesión, proliferación y diferenciación de osteoblastos alrededor del material.
Además del efecto bioactivo de esta capa, tiene otros efectos secundarios que mejoran el comportamiento del metal ante el medio fisiológico, evitando o disminuyendo la liberación de iones al medio y reduciendo el peligro de corrosión.
En este tipo de prótesis recubiertas de HA se utiliza el metal, debido a la resistencia mecánica y tenacidad de éste (acero inoxidable, aleaciones de titanio o aleaciones de cromo-cobalto) con función específicamente estructural, y la capa bioactiva en la que la función es la aceleración de la fijación biológica de la prótesis.
Los implantes metálicos recubiertos de HA vienen utilizándose desde finales de los años 80 y numerosos trabajos se han dedicado a su estudio. Podemos dividir estos trabajos entre los que tratan las ciencias básicas y los estudios clínicos. En estos últimos, aparecen descritos una serie de parámetros y datos referentes a los trabajos que podemos denominar como dedicados a las ciencias básicas, que pueden definir muy bien desde el punto de vista científico el tipo de materiales que se ha utilizado. Pero estos datos a menudo son pasados por alto al leerlos un clínico, ya que al utilizar un implante son pocos los que entienden realmente qué significan las características técnicas con las que se comercializa.
Se han estudiado muchos tipos de recubrimiento de HA aplicados sobre los metales con diversas técnicas y utilizando diferentes clases y proporciones de sales de calcio. El comportamiento de estos recubrimientos dentro del tejido vivo presenta diferencias. Por ello, al hablar de un implante recubierto de HA cabe plantearse la pregunta ¿qué HA?
RECUERDO HISTÓRICO
Los primeros implantes recubiertos de HA fueron desarrollados para su utilización en implantología dental. En pacientes sin piezas dentales en las que sujetar los implantes, la única solución era la fijación de vástagos metálicos en los maxilares. Estos implantes presentaban aflojamientos con el tiempo, y una de las estrategias utilizadas para mejorar la fijación en el hueso fue el recubrimiento con fosfatos cálcicos. Posteriormente se observó que estos implantes también se aflojaban debido al medio séptico de la cavidad oral. Pero la idea fue utilizada en implantes colocados en zonas absolutamente estériles como las articulaciones. En esta localización, los estudios clínicos ya ofrecen resultados de mantenimiento de la fijación de casi 15 años1.
CONCEPTOS BÁSICOS DE LOS IMPLANTES DE HIDROXIAPATITA
Las características del recubrimiento de HA que se acostumbra citar en los artículos publicados son rugosidad, grosor, proporción de sales cálcicas o pureza, porosidad, cristalinidad y método de aplicación del recubrimiento. Otras características referidas al diseño del implante son la localización del recubrimiento, la aleación metálica sobre la que se aplica y las características de la superficie del metal (liso, mallado, microparticulado, etc.).
La capa bioactiva depositada debe tener una serie de características:
Estabilidad química
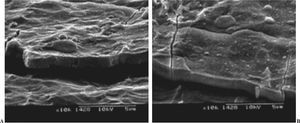
El recubrimiento no se debe disolver con el medio fisiológico en corto tiempo ni reaccionar con el metal del substrato. La reacción con el metal puede tener resultados catastróficos, ya que los productos de reacción, en general, son citotóxicos y las propiedades mecánicas del material disminuyen hasta el punto de hacer peligrar la integridad mecánica del mismo (fig. 1). La capa no debe cambiar la composición química y ésta debe ser homogénea en toda la estructura2.
Figura 1. Productos de corrosión en una prótesis recubierta con material bioactivo. Corrosión producida en un acero inoxidable 316L que fue recubierto por una capa de fosfato de calcio con presencia de silicio. Se formaron compuestos silicio-cromo que afectaron al comportamiento biológico de la prótesis, ya que son intolerables para el organismo.
Estabilidad mecánica
El recubrimiento debe presentar una buena adherencia con el substrato, para que cuando el cirujano introduzca la prótesis no se afecte la integridad estructural de la capa bioactiva. Asimismo, esta capa no debe presentar agrietamientos que fragilicen la capa3-5.
Los métodos para producir el recubrimiento de la capa son varios: método de plasma-spray, ablación láser, sol-gel, compactación isostática en caliente, proyección térmica a alta velocidad, mediante haz de iones, etc., siendo las primeras las más utilizadas en la actualidad.
El método más habitual de recubrimiento de fosfato de calcio es el plasma spray, que se basa en producir plasma de fosfato de calcio mediante potentes fuentes energéticas y proyectar el plasma (temperaturas superiores de 9.000 oC) sobre el substrato metálico (fig. 2). Este proceso se puede realizar al aire o al vacío. El fosfato de calcio se deposita sobre el metal sin unión química, es decir, sin enlace covalente o iónico, que sería el caso de mayor adhesión, sino con fuerzas de interacción y mediante anclajes mecánicos. Esta unión no es muy fuerte y por tanto en ocasiones la capa de fosfato de calcio salta ante un esfuerzo de cizalladura.
Figura 2. Esquema del plasma spray. Un campo eléctrico proyecta las partículas fosfocálcicas a gran velocidad sobre la superficie metálica del implante.
En general, los implantes son arenados con partículas abrasivas, dando una rugosidad superficial que será muy importante para la fijación mecánica del hueso. Después se produce la proyección de fosfato de calcio que recubre el implante rugoso, lo que dará la fijación biológica.
El material del recubrimiento no es una hidroxipatita cristalizada, ya que la velocidad de enfriamiento desde tan altas temperaturas hasta la temperatura ambiente se realiza en un pequeño intervalo de tiempo, que no es suficiente para formar una estructura ordenada en una estructura cristalográfica tan sofisticada como es la HA en todo su recubrimiento. Por tanto, en gran parte del recubrimiento se tendrá un fosfato de calcio amorfo sin ordenamiento cristalino. Debe tenerse en cuenta que este material amorfo es más soluble que la HA y tendrá propiedades diferentes de la fase cristalina.
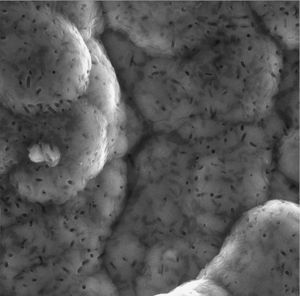
Asimismo, se debe tener en cuenta que esta velocidad tan rápida de formación del recubrimiento de fosfato de calcio produce grietas en la capa debido al pobre choque térmico que presentan los materiales cerámicos (fig. 3). Como es bien conocido, los materiales cerámicos son frágiles y no son capaces de absorber energía en su estructura, este hecho hace que los cambios de volumen y tensiones internas producidos en la solidificación del fosfato de calcio no puedan ser absorbidos y se generen grietas en la superficie del material. Este hecho hace aumentar la fragilidad del recubrimiento.
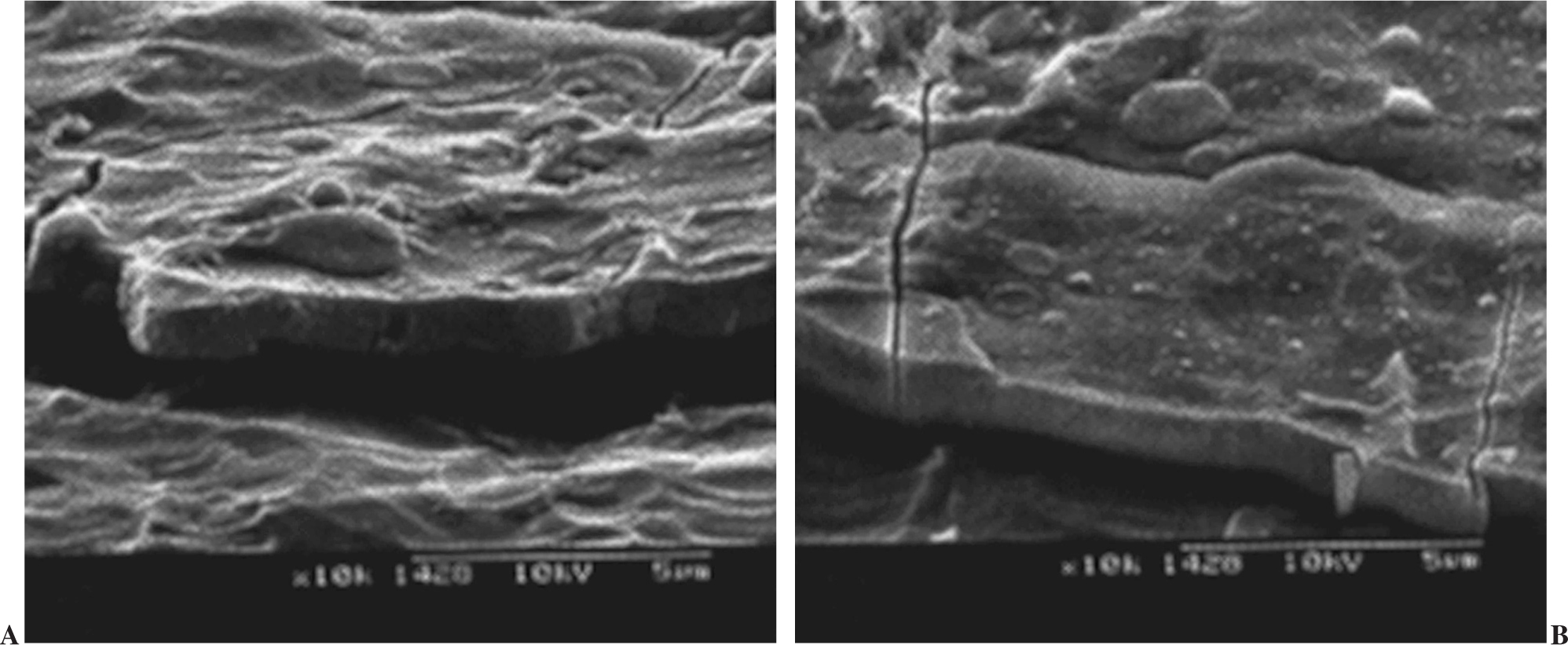
Figura 3. Zonas de falta de unión entre el fosfato de calcio y el substrato (A) y (B). Se pueden observar grietas en la superficie de fosfato de calcio.
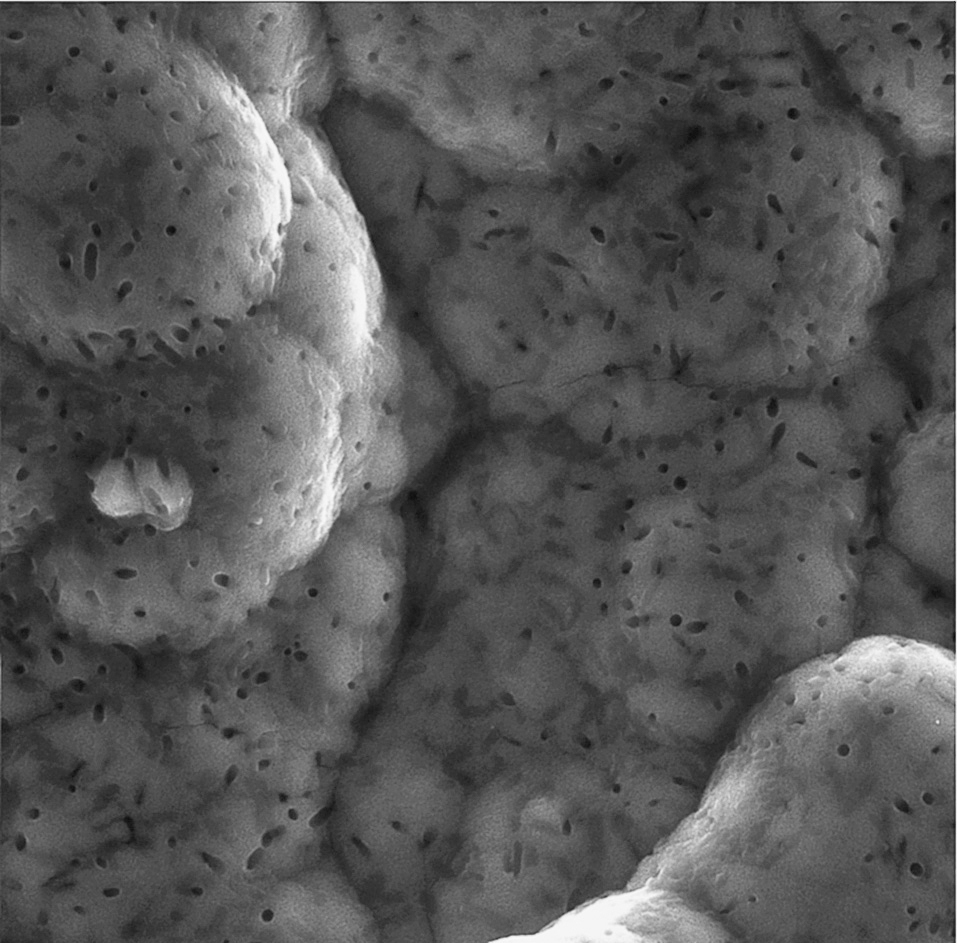
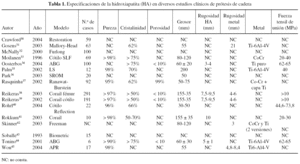
Otra de las consideraciones que debe hacerse es que, entre el metal y el recubrimiento, hay zonas de vacío, ya que no existe una unión química. Estas zonas de desunión son zonas donde puede haber colonización bacteriana y propagarse por los vacíos entre el metal y el recubrimiento, como puede observarse en la figura 3 y la colonización bacteriana en la figura 4. Este hecho es importante, sobre todo en los implantes dentales, pero mucho menos en las prótesis articulares.
Figura 4. Colonización bacteriana en la capa de fosfato de calcio.
El proceso de fijación de la HA al implante metálico, especialmente la velocidad de enfriamiento, determinará la proporción de sales amorfas e HA cristalina y la cristalinidad.
Otras técnicas de aplicación de la HA son técnicamente más complicadas y caras, pero pueden permitir controlar mejor las características del recubrimiento de HA, como la ablación con láser.
Estos factores deben ser tenidos en cuenta para su aplicación clínica. Cada día las empresas fabricantes mejoran los recubrimientos y nuevas tecnologías están apareciendo para mejorar su comportamiento biológico y mecánico.
¿CÓMO ACTÚA?
La implantación de elementos extraños al hueso que deben actuar transmitiendo cargas hacen necesaria una fijación muy fuerte del material para evitar su movilización. El punto débil en la transmisión de cargas es la interfaz entre el implante y el hueso. Los recubrimientos de HA consiguen que el hueso fije el implante como si de un injerto se tratara.
La HA es biocompatible, osteoconductora6,7, bioactiva y biorreabsorbible. Estas propiedades estimulan la interacción entre el implante y el hueso para acelerar e inducir la integración de la prótesis.
El mecanismo por el que actúa no está claro, pero parece relacionado con la unión de células a la capa de HA, que se diferenciarán en osteoblastos y empezarán a crear matriz ósea. Ésta crecerá desde la superficie del implante hacia el hueso huésped. Una vez rellenado este espacio, la matriz ósea madurará a hueso lamelar creando una unión ósea entre implante y hueso huésped sin interposición de tejido fibroso8.
DISCUSIÓN
En un estudio con perros, Bragdon9 demostró un crecimiento óseo sobre prótesis de cadera recubiertas de HA un 20% superior respecto al mismo modelo con recubrimiento poroso después de tres semanas. Pero pasadas seis semanas no se apreció una diferencia entre ambos grupos de animales. Este estudio no cita ninguna característica de la HA utilizada, excepto que fue empleado el método de plasma spray.
Un estudio autópsico de 58 prótesis de cadera comparando un mismo modelo de vástago con tres recubrimientos diferentes mostraba un mayor crecimiento óseo en el grupo en que se utilizó HA10.
Las sales de calcio amorfas se reabsorben con mayor rapidez que la HA cristalina11. Un recubrimiento de un metal rico en estas sales reaccionará rápidamente con su entorno óseo, pero quizá a una velocidad superior a la que es capaz de integrar el implante. Una disolución demasiado rápida de recubrimiento de HA puede dar lugar a un anclaje fibroso del implante. El trifosfato cálcico se disuelve en un medio con pH neutro más rápidamente que la HA cristalina, y la velocidad aumenta cuanto más amorfa sea. Un recubrimiento muy rico en HA cristalina tardará más en reabsorberse y, por tanto, la integración de ese implante también será más lenta. Por lo tanto, es necesaria una proporción adecuada de sales cálcicas amorfas e HA para permitir una integración rápida y duradera del implante12.
Generalmente se acepta que la pureza de la HA debería ser lo más alta posible (superior al 90%), con una relación calcio/fósforo de 1,67. Pero no existe consenso respecto a su grado de cristalinidad, que varía del 50 al 90% en los diferentes tipos de implantes disponibles en el mercado.
Una modificación de la técnica del plasma spray permitiría crear un gradiente de estructura. Esto significa que la capa más externa del recubrimiento sería rica en sales amorfas de disolución rápida, y en profundidad existiría una mayor proporción de HA cristalina que permitiría una mejor integración en el hueso. Así, la capa más superficial produciría una unión rápida al hueso y la más profunda una unión de buena calidad y larga duración13.
El grosor de la capa de recubrimiento de HA va a tener unas consideraciones similares a su composición. Una capa demasiado delgada se reabsorberá a mayor velocidad y sin permitir un sobrecrecimiento óseo suficiente a su alrededor. En cambio, una capa demasiado gruesa puede ser más friable y por tanto desprenderse durante la implantación quirúrgica. Los recubrimientos de 25-100 μm presentan una buena estabilidad, mientras a partir de 150 μm son más frágiles14. La mayoría de los implantes comercializados tienen una capa de HA de un grosor entre 50 y 70 μm.
La microestructura de los recubrimientos de HA depende de la técnica utilizada en su fabricación. En este proceso, las partículas de HA son proyectadas a gran velocidad y temperatura. Al impactar en el implante podrán adoptar una forma esferoidal más o menos aplanada según la técnica utilizada. Estas formas determinarán la porosidad de la capa de recubrimiento de HA. La porosidad representa la presencia de pequeños huecos por donde pueden proliferar los osteoblastos para integrar el implante15.
Las características de la superficie del metal determinarán la superficie de contacto entre el implante y el hueso, y a mayor irregularidad, tanto macroscópica como microscópica, mayor superficie de contacto existirá entre el implante y el hueso circundante mejorando su fijación a largo plazo. La irregularidad de la superficie a nivel microscópico se define con la rugosidad. En implantes recubiertos de titanio y de HA in vitro, una rugosidad media y alta produce una mayor reacción celular, mientras que una rugosidad ultra alta produce una proliferación menor16. La rugosidad va a determinar una mayor o menor velocidad de crecimiento del hueso circundante hacia el implante para integrarlo.
La presencia de más o menos zonas de vacío entre la capa de recubrimiento y el implante determinará la mayor o menor fragilidad a la delaminación de la capa de HA, que se puede producir especialmente durante la implantación quirúrgica al crearse fuerzas de cizallamiento importantes al impactar un componente protésico sobre una superficie ósea. Las diferentes técnicas de recubrimiento de implantes dan una mayor o menor unión entre el metal y la capa de HA. También la cristalinidad es un factor determinante. Tras la implantación e integración de la prótesis, uno de los factores que podrían influir en la delaminación de la HA en prótesis bien integradas podría ser la diferente eslasticidad entre el hueso y el elemento metálico, produciéndose micromovimientos durante la carga. En estas circunstancias la lámina de HA debería quedar adherida al hueso neoformado y dejar un espacio libre entre el metal y la HA17. Posteriormente, los procesos de remodelación podrían volver a ocupar ese espacio, quedando la prótesis estable6. En un modelo animal con corderos, este proceso de remodelado se completó a los 200 días, aunque las prótesis aparecieron fijadas de forma estable a los 90 días18. Sin embargo, en aquellas localizaciones más próximas a la articulación, en contacto directo con la cavidad articular, pueden acumularse partículas de polietileno y metal, que parecen favorecer o acelerar la degradación celular de la HA19 sin afectar el comportamiento clínico del implante. Se están desarrollando nuevas técnicas para disminuir el fenómeno de delaminación, por ejemplo interponiendo una capa de óxido de titanio20.
Tras la implantación quirúrgica de un implante protésico recubierto de HA se inicia un proceso de integración en el hueso huésped de forma comparable a lo que ocurre en una fractura, apareciendo trabéculas óseas entre los dos extremos fracturarios (o entre el hueso huésped y la HA del implante) y una posterior remodelación de todo el tejido a lo largo de los años. Quedaría así creado un estuche óseo íntimamente en contacto con el implante metálico estabilizándolo6,7,10,21. Si el implante presenta irregularidades en su superficie se aumentará su estabilidad, mientras que si es completamente liso, puede producirse una movilización dentro de ese «estuche», que progresivamente destruirá la microestructura trabecular en contacto con el implante, presentándose una situación comparable a una pseudartrosis. Estaríamos ante un aflojamiento aséptico de un componente protésico que inicialmente había conseguido una buena integración22,23.
La aparición de una membrana fibrosa entre implante y hueso parece más relacionada con la micromovilidad9 que con el tipo de fijación (HA o implante poroso).
El punto débil de las prótesis recubiertas de HA puede ser la unión mecánica entre el metal y la capa de HA. Parece ser que la técnica de plasma spray, al realizarse a alta temperatura y con enfriado rápido, puede alterar tanto la composición química como la estructura cristalina de la HA, dando como resultado un componente fosfocálcico amorfo y más soluble. También el grado de rugosidad de la superficie del implante influye en la unión mecánica entre el implante y la HA por una parte, y entre la HA y el hueso por otra24. La industria intenta mejorar estas características investigando nuevas técnicas de aplicación de los componentes bioactivos tanto del plasma spray20,25 como con nuevos métodos de recubrimiento como la técnica de precipitación, que pueden proporcionar una capa de HA más cristalina aplicada a temperatura ambiente26 y la técnica de aleación superficial con láser27. Otra línea de investigación es la que incorpora sustancias bioactivas a los recubrimientos de HA para aumentar la adhesión celular y el crecimiento óseo a su alrededor28.
En estos momentos, la tecnología más utilizada para recubrir las prótesis de cadera de HA es la inyección de plasma. Parece ser que otras tecnologías podrían mejorar las características de la unión de esta capa fosfocálcica hasta un grado de unión química mediante varias capas de aposición (técnica de T. Kokubo)29, pero estas técnicas aún deben ser perfeccionadas y resultar más baratas. Se puede aplicar el plasma spray en aire o al vacío. La técnica al vacío ofrece la posibilidad de variar la rugosidad y porosidad del implante. Esto nos permitirá obtener implantes con un recubrimiento que presente una unión más sólida al implante y un sobrecrecimiento óseo que fije rápidamente el implante al hueso.
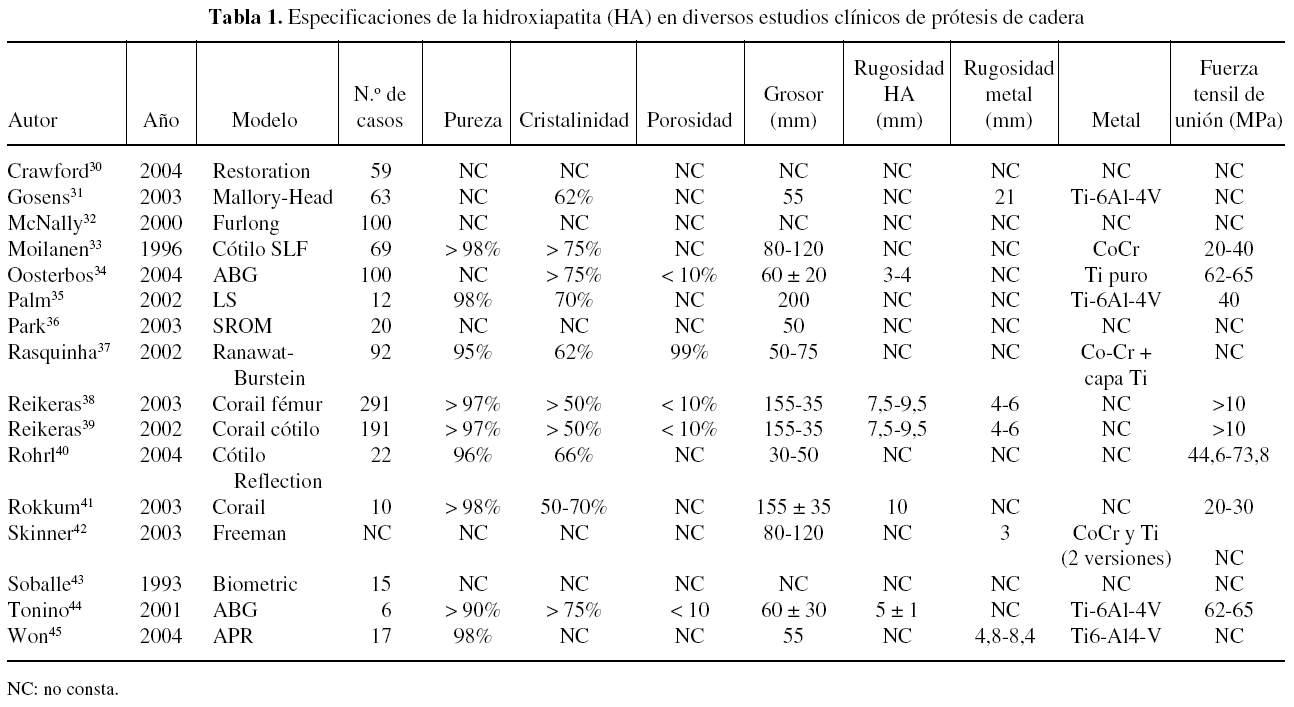
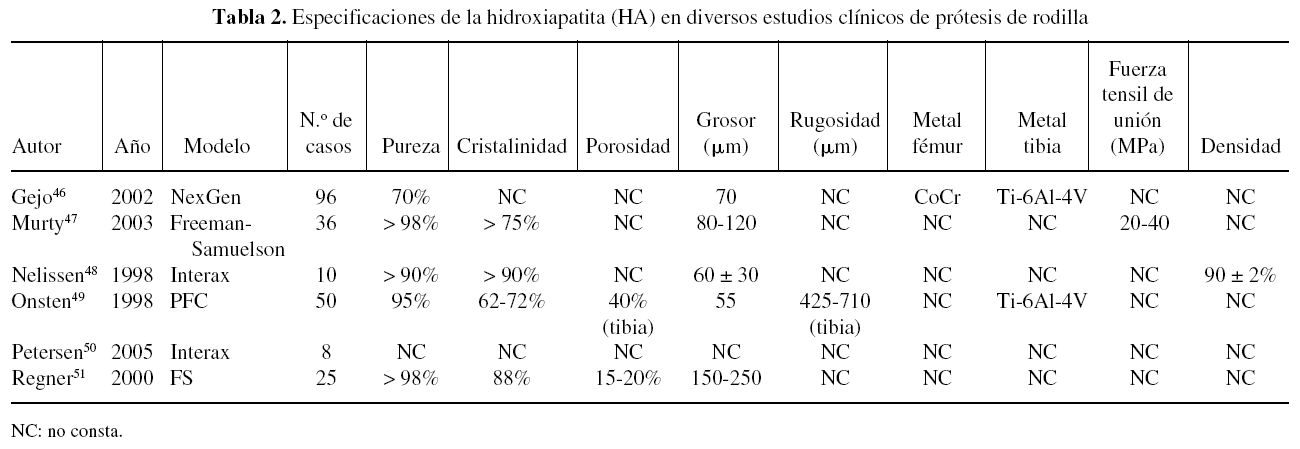
Una revisión de las especificaciones de la HA en diferentes implantes utilizados en algunos estudios clínicos muestra que existen diferencias entre ellas pero, especialmente, que muchos estudios no citan estas características (tabla 1). Todos los estudios citados en la tabla se refieren a implantes recubiertos por plasma spray, aunque la mayoría no especifican si se realiza en aire o al vacío. Las diferencias en las especificaciones de la HA entre los implantes son muy difíciles de correlacionar con sus resultados clínicos, puesto que son muchos los factores que intervienen. Los estudios clínicos en implantes de cadera superan ya los 10 años, con un número de estudios más extenso que en implantes de rodilla (tabla 2) y tobillo (tabla 3).
Los estudios clínicos sobre los resultados de las prótesis recubiertas de HA son mayoritariamente optimistas respecto a su duración a largo plazo. Sin embargo, existen discrepancias en los resultados entre los estudios que comparan este tipo de implantes con prótesis no cementadas y cementadas56. Probablemente, en el origen de estas discrepancias pueda existir una diferencia en las características del recubrimiento de HA, en las características de la población de pacientes estudiados y en las diferencias en los diseños de las prótesis.
Los estudios clínicos de prótesis de cadera recubiertas de HA muestran una supervivencia mayor de los vástagos femorales respecto a los cotilos32-47. La supervivencia de los primeros se sitúa en el 99-100% a los 10 años, bajando al 92% en un modelo de diseño defectuoso35. La de los cotilos está en el rango del 80-100% a los 10 años. Este hecho se atribuye a la diferencia en la forma de transmitir la carga de ambos componentes.
También se está extendiendo el uso de los recubrimientos de HA en las prótesis totales de rodilla, con tan buenos resultados como en la cadera, aunque escasean los estudios clínicos.
La utilización de los recubrimientos de HA se va generalizando en las prótesis de tobillo. En esta localización los estudios clínicos muestran una supervivencia mayor de estos implantes comparados con los basados en otras técnicas de fijación al hueso54.
La utilización de los implantes recubiertos de HA, a diferencia de las prótesis cementadas, obliga al cirujano a un ajuste lo más perfecto posible en el lecho óseo para permitir la estabilidad primaria y la pronta integración. Por ello, el material de corte debe ser preciso.
El diseño de las prótesis articulares determina su funcionamiento tras la integración en el hueso. Por lo tanto, no hay que confiar la integración y estabilidad a largo plazo solamente a los recubrimientos de HA, aunque ayuda a subsanar pequeños errores técnicos respecto a la adaptación de los implantes al lecho óseo57. Sin embargo, el recubrimiento de HA se ha demostrado útil para compensar defectos de diseño del implante35.
CONCLUSIONES
El recubrimiento de HA de las prótesis puede desaparecer por resorción osteoclástica durante el proceso de remodelación ósea, disolución química, delaminación por disminución de la adherencia mecánica al metal y abrasión mecánica por falta de estabilidad primaria6. Sin embargo, ello no implica el aflojamiento del implante, sino que se inscribe en el proceso fisiológico de remodelación del hueso.
Las características físico-químicas del recubrimiento de HA de las prótesis articulares influyen en su integración en el hueso y son factores a tener en cuenta en la valoración clínica de los implantes. De la misma manera que no podemos considerar este tipo de implantes solamente como prótesis no cementadas, sin otro adjetivo, las diferentes características de la HA deben constar en los artículos publicados sobre las prótesis con este recubrimiento.
Los recubrimientos de HA en las prótesis articulares ayudan a acelerar y mejorar su fijación en el hueso gracias a sus propiedades bioactivas de osteoconducción.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia:
J. Faig Martí.
Hospital San Rafael.
Pg. Vall d'Hebron 107-117.
08035 Barcelona.
Correo electrónico: 29070jfm@comb.es
Recibido: agosto de 2006.
Aceptado: diciembre de 2006.