REVISTA DE ORTOPEDIA Y TRAUMATOLOGÍA
Volumen 42, pp 76-85
© 1996 EDITORIAL GARSI
Métodos de valoración pronóstica del osteosarcoma
mediante Talio-201 y RM dinámica. Estudio comparativo*
J. RIBES IBORRA*, L. MARTÍ-BONMATÍ**, C. VALVERDE MORDT***, M.a J. MARTÍNEZ GARCÍA**,
J. GARCÍA LAGUARTA*** y J. FENOLLOSA GÓMEZ*
Servicios de *.Cirugía Ortopédica y Traumatología y **.Radiología. Hospital Dr. Peset. Valencia.
***.Servicio de Cirugía Ortopédica y Traumatología. Hospital Arnau de Vilanova. Valencia.
Correspondencia:
Dr. J. RIBES IBORRA.
Servicio COT.
Hospital Dr. Peset.
Avda. Gaspar Aguilar, 90.
46017 Valencia.
*.II Premio Solvay Pharma 1996.
RESUMEN: Se ha realizado un estudio retrospectivo sobre 12 casos de osteosarcoma con la intención de valorar la utilidad pronóstica de dos métodos de imagen: el rastreo óseo isotópico con Talio-201 y los estudios dinámicos con RM y gadolinio i.v. En ocho casos clínicos se realizó estudio de captación con Talio-201 y en seis se llevó a cabo estudio dinámico de RM. Ambas pruebas se efectuaron antes y después de la quimioterapia neoadyuvante. Se comprobó la capacidad de predicción que ambos métodos tienen respecto a la efectividad de la quimioterapia preoperatoria, valorando ésta mediante la cuantificación de la necrosis tumoral (mayor o menor del 90%). La captación de Talio-201 presentó una correlación significativa con la necrosis tumoral
(p < 0,05). La interpretación de los cambios dinámicos en la RM pre y postquimioterapia permitió identificar a los pacientes con buena y mala respuesta. La utilidad clínica de estos métodos de valoración es triple: planificar mejor la cirugía (pudiendo ser más conservadores en los límites de resección si la respuesta ha sido favorable), introducir cambios de forma precoz en la quimioterapia si antes de concluir el protocolo neoadyuvante se comprueba que hay una mala respuesta tumoral y disponer de una razonada valoración pronóstica en el osteosarcoma.
PALABRAS CLAVE: Osteosarcoma.
METHODS OF ASSESSING PROGNOSIS IN OSTEOSARCOMA BY THALLIUM-201 AND DYNAMIC MRI.
COMPARATIVE STUDY
ABSTRACT: A retrospective study was made of 12 cases of osteosarcoma for the purpose of evaluating the prognostic value of two imaging methods: isotopic bone scan with Thallium-201 and dynamic studies with MRI and IV gadolinium. In 8 cases, an uptake study was made with Thallium-201 and in 6, a dynamic MRI study. Both studies were carried out before and after adjuvant chemotherapy. The predictive value of these methods in relation to the effectiveness of preoperative chemotherapy was confirmed. The effectiveness of chemotherapy was evaluated by quantifying tumoral necrosis (more or less than 90%). Thallium-201 uptake correlated significantly with tumoral necrosis (p < 0.05). The interpretation of the dynamic MRI changes before and after chemotherapy allowed patients with a good and poor response to be identified. The clinical usefulness of these methods of evaluation apparent in three points: by improving surgical planning (more conservative resection margins were possible if response was favorable), by enabling early changes to be made in chemotherapy if poor tumoral response is observed before concluding the neoadjuvant protocol, and by providing a rational prognostic assessment for osteosarcoma.
KEY WORDS: Osteosarcoma. Prognostic evaluation.
En los últimos años se han realizado avances importantes en la quimioterapia adyuvante, mejorando sustancialmente la supervivencia de los pacientes afectos de osteosarcoma (OS).2,6,7,9,14,19,21,36 A este incremento de la supervivencia también han contribuido las nuevas técnicas de resección-reconstrucción que han permitido que la cirugía con preservación del miembro sea una alternativa segura a la amputación del mismo.4,27Esta mayor supervivencia ha motivado la búsqueda de métodos de valoración pronóstica que ayuden a distinguir con antelación qué tumores evolucionarán favorablemente y cuáles no. En la actualidad se admite que la respuesta histológica a la quimioterapia preoperatoria es el mejor método de valoración pronóstica,1,2,15,16,28,30,41 la cual se evalúa tras el estudio histológico de la pieza de resección; la extensión de la necrosis tumoral observada en esa pieza de resección es una variable directamente relacionada con la mayor supervivencia libre de enfermedad.26,30 Una valoración de la respuesta tumoral al tratamiento quimioterápico antes de la cirugía de exéresis nos permitiría comprobar la efectividad del protocolo, planificar mejor la cirugía y emitir un pronóstico.
En este sentido no existen métodos clínicos satisfactorios para determinar la respuesta tumoral a las drogas citotóxicas; la reducción en el volumen tumoral no refleja exactamente la extensión de la necrosis.11 Así, los métodos de imagen utilizados habitualmente para valorar la respuesta tumoral a la quimioterapia, radiografía simple,37 angiografía5 y TAC22 no ofrecen una cuantificación precisa de la necrosis tumoral postquimioterapia; su apreciación está basada sólo en la reducción del volumen tumoral y no en la cantidad de tumor viable. Recientemente, dos técnicas de imagen, la escintigrafía ósea con Talio-201 y los estudios dinámicos con RM tras administrar un medio de contraste, están permitiendo conocer la respuesta tumoral a la quimioterapia mediante la comparación del estudio pre y postquimioterapia. A su vez, el estudio comparativo entre los resultados de dichas pruebas y la necrosis tumoral acontecida (mayor o menor del 90%) nos permitirá saber el grado de correlación y de capacidad de predicción de estos métodos.
A la luz de los resultados obtenidos en estas pruebas deberíamos diseñar un tratamiento «a la medida» planificando con mayor fundamento la cirugía de resección; esto permitirá, si los resultados obtenidos son favorables, ser más conservadores e incluso pasar de una cirugía radical a una cirugía amplia. Asimismo permitirá introducir cambios precoces en los protocolos de quimioterapia si se comprueba que éstos no están siendo totalmente efectivos e identificar antes de la cirugía de exéresis cuáles son los casos que pueden tener mal pronóstico.
El presente estudio está basado en pacientes diagnosticados de osteosarcoma a los que se les ha realizado pruebas de valoración pronóstica (Talio-201 y RM dinámica) estableciendo una correlación con la necrosis tumoral evaluada tras la división en cuadrícula (mapa) de la pieza de resección en bloque y mediante estudio de las zonas viables y no viables del tumor tal como describiesen Picci y cols. en 198528 y como han divulgado posteriormente Raymond y Ayala.30 Se trata, pues, de valorar dos métodos que pueden aportar una «monitorización» de la respuesta de la lesión primaria a la quimioterapia neoadyuvante.
Material y Método
Pacientes
Se estudiaron 12 pacientes con diagnóstico histológico de osteosarcoma. Los tipos histológicos fueron: osteoblástico (ocho casos), condrobástico (dos casos) y fibroblástico (dos casos). La media de edad en el momento del diagnóstico fue de 14 años; respecto al sexo, siete eran hombres y cinco mujeres. La localización tumoral fue: extremo distal del fémur (siete casos), extremo proximal de la tibia (tres casos), diáfisis femoral (un caso) y extremo proximal del húmero (un caso). Todos ellos se clasificaron como estadio IIB de Enneking y todos fueron tratados con quimioterapia neoadyuvante durante 9 semanas. La cirugía de resección se llevó a cabo, como promedio, a los 3 meses del diagnóstico; los tratamientos quirúrgicos realizados fueron: homoinjerto más prótesis (siete casos), homoinjerto intercalar (dos casos), homoinjerto articular (un caso) y desarticulación (un caso). El estudio mediante Talio se realizó en nueve pacientes y los estudios dinámicos con RM en seis.
Quimioterapia
Los pacientes siguieron el protocolo T-10 de Rosen y cols.,33 que consiste en metotrexate a altas dosis más cisplatino, ifosfamida y adriamicina. En los casos de buena respuesta a la quimioterapia neoadyuvante, tras la intervención quirúrgica se siguió con el protocolo adyuvante.
Necrosis tumoral postquimioterapia neoadyuvante
El examen de la pieza de resección fue el elemento objetivo que informó acerca de la respuesta a la quimioterapia. Para ello se dibujó un mapa constituido por cuadrículas sobre una sección completa de la pieza de resección cortada en bloque, buscando en los especímenes tumorales la ausencia de células con matriz residual intacta (desierto celular) (Fig. 1), sobre todo en la cortical (subcortical, intracortical y pericortical), el cartílago (placa fisaria y superficie articular), la interfase médula-tumor y el periostio. Las preparaciones histológicas se fijaron y tiñeron de forma habitual y un patólogo examinó cada una de las laminillas, estableciendo el porcentaje de necrosis. Siguiendo a Rosen y cols.33,35se dio un valor para cada uno de los porcentajes de necrosis: entre 0 y 19%, Grado 1; entre 20 y 79%, Grado 2; entre 80 y 89%, Grado 3, y entre 90 y 99%, Grado 4.
Figura 1. Preparación histológica procedente de la resección tumoral en un caso de osteosarcoma después de la quimioterapia neoadyuvante.
Obsérvese la ausencia de células (desierto celular) y la presencia de matriz ósea intacta residual. (HE, 100*.)
Sólo los índices de necrosis mayores del 90% se consideron buenas respuestas. El material histológico se obtuvo entre 1 y 17 días (media de 9,5 días) después de la última exploración mediante Talio o RM. Durante este intervalo de tiempo no se administró ninguna droga quimioterápica, y entre la última dosis de quimioterapia y la resección quirúrgica pasaron entre 12 y 38 días (media de 22 días).
Rastreo óseo isotópico con Talio-201
Ocho pacientes fueron evaluados mediante imagen computarizada de captación de Talio-201 (Siemens Orbiter® gamma camera). La escintigrafía ósea se llevó a cabo 24 horas después de la administración i.v. de 2-3 milicurios de Talio-201. La prueba se practicó antes y después de la quimioterapia y siempre comparando el lado afecto con el lado sano (Fig. 2). La gradación de la captación se expresó de forma semicuantitativa entre cero y dos (Fig. 3), mediante un ordenador conectado directamente al equipo detector (gammacámara). En función de nuestra experiencia y en relación a las variaciones de captación se establecieron unos patrones de respuesta que permitieron establecer cuatro categorías asociadas a un pronóstico distinto:32 1.a) aumento en la captación o descenso entre 0 y 0,10 = valor 1 (mala respuesta); 2.a) descenso en el índice entre 0,11 y 0,20 = valor 2 (respuesta moderada); 3.a) descenso en el índice entre 0,21 y 0,30 = valor 3 (buena respuesta), y 4.a) descenso en el índice mayor de 0,30 = valor 4 (excelente respuesta).
Figura 2. Gammagrafía con Talio-201 en un caso de osteosarcoma en tercio distal femoral. Se selecciona un área de interés sobre la zona tumoral en el miembro afecto y otra de igual tamaño sobre el lado sano contralateral, estableciéndose estudio comparativo de la captación en ambos miembros.
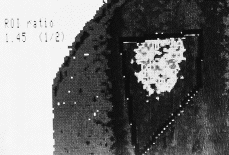
Figura 3. Gammagrafía con Talio-201 en un paciente afecto de osteosarcoma en tercio proximal de húmero. Los valores de la ratio de captación del área de interés vienen expresados de forma semicuantitativa mediante un número exacto entre 0 y 2.
Estudios dinámicos con RM
Los estudios dinámicos de RM se llevaron a cabo con un equipo superconductor de 0,5 teslas (Philips Gyroscan S5®). Los tumores se estudiaron mediante imágenes de RM con administración de contraste paramagnético basado en el gadolinio (Gd-DTPA-BMA). Los pacientes se introdujeron en el equipo con una vía antecubital mediante una cánula del número 22 y una infusión. La resolución espacial de los pixels fue en todas las imágenes de 1,5 mm. Las técnicas utilizadas fueron al menos tres: a) imágenes estáticas potenciadas en T1, secuencia de pulso SE (TR/TE, 500/20 mseg); se obtenían 15 imágenes antes y de nuevo después de la administración i.v. de gadolinio; b) técnica dinámica multinivel, también potenciada en T1 (SE, 300/20 mseg); se obtenían tres imágenes al mismo tiempo y se repetían cinco veces con una resolución temporal de 2 min. para cada grupo de tres imágenes, y c) imagen simple dinámica potenciada en T1 (GRE, TR/TE, 50/13 mseg, ángulo 65°); se obtenía una imagen durante 10 seg. y se repetía cada otros 10 seg. hasta completar 15 imágenes.
Para los estudios dinámicos el gadolinio se administraba en bolo tras haber completado la primera imagen del estudio, la cual servía como imagen patrón sobre la que establecer las comparaciones. Después de completar las secuencias se exportaron todas las imágenes en un formato ACR-NEMA a un PC-compatible y se convirtieron a formato BMP (Bit Mapped Picture®) con 256 tonos de grises. Las imágenes se analizaron mediante un paquete de software desarrollado especialmente para el trabajo (ASYMED 3.0, Valencia, España) escrito en Microsoft Visual C++ y capaz de analizar imágenes agrupadas en secuencias. Estas secuencias podían estar ordenadas espacial o temporalmente.
Se generaron dos secuencias de imágenes ordenadas temporalmente. Una (secuencias con captación) se obtuvo por sustracción, pixel por pixel, donde la imagen patrón sin contraste se sustraía de cualquier otra imagen de la secuencia dinámica. La otra (secuencia velocidad) se obtuvo por sustracción a cada imagen de la previa. En la secuencia de velocidad el brillo expresa el ratio de cambio de intensidad.
El volumen tumoral se calculó sumando los pixels identificados como tumor mediante segmentación supervisada de las imágenes RM estáticas antes y después de la administración de contraste. La segmentación se llevó a cabo mediante histograma multiespectral23 y un radiólogo fijó los límites espaciales entre las estructuras captadoras y no captadoras. El número de pixels en esta imagen segmentada se cuantificó sobre regiones de interés definidas manualmente, excluyendo pixels segmentados como estructuras captantes que estuviesen en área anatómica externa al tumor (Fig. 4).
Figura 4. Análisis de histograma multiespectral a partir de imágenes de RM estática en un osteosarcoma extremo distal femoral. La captación tumoral permite cuantificar el volumen tumoral. Arriba izquierda, sin captación de contraste. Arriba derecha, con captación de gadolinio. Inferior izquierda, fijación de los límites espaciales entre las estructuras captadoras y no captadoras. Este cluster hipercaptante se identifica a partir de los pixels que se alejan de la acumulación diagonal de pixels en el espacio. Los pixels en esta diagonal corresponden a estructuras no captadoras. Inferior derecha, reconstrucción de la imagen correspondiente al cluster hipercaptante.
El análisis de perfusión se realizó mediante imágenes paramétricas, las cuales se obtuvieron a partir de la secuencia temporal de las imágenes dinámicas en relación con las características de las curvas de captación-tiempo (Fig. 5). La información relevante contenida en todas las imágenes secuenciales es condensada en una sola imagen paramétrica computarizada. En el análisis de las curvas de captación se seleccionaron los parámetros de la curva de máxima captación y velocidad máxima para reconstruir la imagen factor. Cada uno de estos parámetros generó un valor para cada pixel, creando una imagen en la cual el valor del pixel representa ese determinado parámetro en ese punto de la imagen. Los valores farmacocinéticos se midieron con tres regiones de interés y se promediaron para cada valor. Sólo los pixels captantes se usaron para los cálculos; éstos se seleccionaron combinando la imagen paramétrica original con una máscara obtenida mediante umbrales de intensidad (imagen «umbralizada») (Fig. 6). Todas las medidas se relativizaron a la intensidad de señal de la imagen precontraste y se expresaron como porcentaje.
Figura 5. Proceso de obtención de la imagen paramétrica. Se obtiene a partir de la secuencia temporal de las imágenes dinámicas, relacionándolas con las características de las curvas de captación-tiempo.
Figura 6. Mediante el análisis de las curvas de captación ciertos parámetros de la curva (máxima captación y velocidad máxima) son seleccionados para reconstruir la imagen factor. A la izquierda, imagen «umbralizada». En el centro, imagen correspondiente a la captación máxima, y a la derecha, la correspondiente a la velocidad máxima de captación.
Los resultados postquimioterapia sirvieron para identificar la cantidad de tumor viable residual en esta prueba de imagen y se correlacionaron, al igual que en la prueba del Talio, con la necrosis tumoral en la pieza de resección expresada en forma de porcentaje.
Análisis estadístico
La correlación entre el resultado histológico como variable dependiente y los valores obtenidos en el estudio de Talio y RM dinámica como variables independientes se estableció a partir de una prueba de diferencias entre medias, obteniéndose el coeficiente de correlación lineal de Pearson (análisis regresión lineal = correlación). Se utilizó como paquete estadístico el programa SPSS para Windows. Se llevó a cabo un análisis de discriminación para determinar la independencia predictiva de la reducción del tamaño tumoral respecto a los estudios dinámicos con RM, considerando significativa una p ¾ 0,05.
Resultados
Talio-201
Cuatro pacientes en este grupo alcanzaron una necrosis mayor del 90%. Un paciente presentó una mala respuesta con una necrosis menor del 20%. Solamente hubo dos pacientes (Casos 5 y 8) que tuvieron un descenso mayor de 0,31 en la captación de Talio, y en ambos aconteció una necrosis mayor del 90% (Tabla 1 y Fig. 7). Hubo cinco pacientes con respuesta entre 0,11 y 0,30. En un paciente (Caso 6) hubo un ascenso de 0, 37 (Fig. 8), lo que significa que la captación fue mayor tras la quimioterapia que antes de la misma y por tanto una ausencia de respuesta y un comportamiento agresivo del tumor. Efectivamente, en ese paciente, como ya se ha comentado, la necrosis fue menor del 20% y la supervivencia fue corta, falleciendo el paciente antes del año del diagnóstico. La captación de Talio se correlacionó significativamente con el porcentaje de necrosis (regresión simple, p < 0,05, r2 = 0,47). Los pacientes con buena respuesta tuvieron una diferencia pre-post mayor (0,31 ± 0,08; media ± error estándar) que los de mala respuesta (0,11 ± 0,16). Aunque esta diferencia no es significativa (p = 0,2), probablemente por el pequeño tamaño de la muestra, sí explica el hecho de la disminución marcada de la vascularización tumoral en los de buena respuesta. En el Caso 12 hubo una correlación deficitaria, pues a una necrosis del 99% correspondió una disminución del índice de captación sólo de 0,17.
A
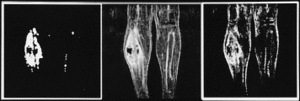
BFigura 7. Gammagrafía con Talio-201 en un paciente afecto de osteosarcoma en tercio proximal de tibia izquierda. Los descensos en el estudio comparativo (A: prequimioterapia; B: postquimioterapia) demuestran una respuesta favorable a la terapia neoadyuvante con disminución de la cantidad de tumor viable.
A
BFigura 8. Estudio gammagráfico con Talio-201 (A: prequimioterapia;
B: postquimioterapia neoadyuvante) en un paciente afecto de osteosarcoma en tercio distal femoral. La imagen obtenida tras la terapia neoadyuvante (B) demostró un ascenso de la captación (mala respuesta). El porcentaje de necrosis tumoral valorado tras el estudio anatomopatológico fue también muy bajo (Caso 6).
RM dinámica
El análisis dinámico con imágenes paramétricas permite la diferenciación entre estructuras no tumorales, edema no neoplásico y tumor viable. Tanto el tumor viable como las estructuras infiltradas muestran una intensidad de señal alta dada su captación mayor y precoz. Las áreas necróticas y el edema peritumoral presentan un bajo y más gradual aumento en la intensidad de señal que los tejidos neoplásicos adyacentes. Los valores de máxima captación y máxima velocidad están relacionados con la agresividad del tumor. Las curvas gráficas de intensidad de señal con respecto al tiempo pueden darnos, por tanto, información sobre la actividad tumoral y la respuesta a la quimioterapia.
| Tabla 1. Relación de captación de Talio antes y después de la quimioterapia preoperatoria. | ||||
| Casos | Prequimioterapia | Postquimioterapia | Diferencia | Necrosis |
| 1 | 1,45 | 1,22 | 0,23 | 4 |
| 2 | 1,17 | 0,89 | 0,28 | 3 |
| 3 | 1,91 | 1,69 | 0,22 | 2 |
| 4 | 1,5 | 1,21 | 0,29 | 2 |
| 5 | 1,2 | 0,88 | 0,32 | 4 |
| 6 | 1,42 | 1,79 | 0,37 | 1 |
| 8 | 1,34 | 0,8 | 0,54 | 4 |
| 12 | 1,31 | 1,24 | 0,17 | 4 |
| Los valores (+) reflejan descenso en la captación y viceversa. | ||||
Aunque en el presente estudio el número de pacientes con exámenes dinámicos seriados no es alto, el aumento o la ausencia de cambios en el captación tumoral y los factores de velocidad permitieron identificar a los pacientes con buena respuesta (Fig. 9) o con ausencia de respuesta (Fig. 10).
A
B
Figura 9. Estudio dinámico de RM en un caso de osteosarcoma en fémur distal. Comparando las imágenes umbralizadas de la figura A (prequimioterapia) y de la figura B (postquimioterapia) se puede comprobar la disminución de los pixels de captación tumoral y, por tanto, de la cantidad de tumor viable (buena respuesta).
A
B
Figura 10. Imagen de RM dinámica en un caso de osteosarcoma en tibia proximal. No existen diferencias apreciables entre la imagen prequimioterapia (A) y postquimioterapia (B) (mala respuesta). La terapia neoadyuvante no ha conseguido reducir ostensiblemente la cantidad de tumor viable.
Discusión
La determinación de la necrosis tumoral es esencial para la valoración de la efectividad de la quimioterapia preoperatoria. Este criterio de valoración manifestado inicialmente por Rosen y cols.33 ha sido posteriormente apoyado por la opinión de otros autores,28,30 aunque su expresión de forma estandarizada en porcentaje no está exenta de problemas. El primero de ellos consiste en que esta gradación va a depender de la experiencia personal del anatomopatólogo, cuya subjetividad puede llevar a diferencias intra e interobservadores.34 Por otra parte, el cálculo del porcentaje correcto de necrosis está basado en el estudio de algunas preparaciones que obviamente siempre serán una parte del tumor (análisis a partir de una sección de 4 mm). De cualquier forma, y aunque se admite que la necrosis tumoral como respuesta a la quimioterapia neoadyuvante es el mejor método de valoración pronóstica, se están intentando validar métodos de imagen que nos informen sin esperar al estudio anatomopatológico.
Las pruebas de imagen que se utilizan habitualmente (radiografía simple, TAC) proporcionan una inestimable información sobre la localización y tamaño del tumor, pero no ofrecen una valoración correcta de la efectividad de la quimioterapia neoadyuvante. Sus observaciones están basadas en signos indirectos de reducción del volumen del tumor o en una mejor delimitación de éste y no en una verdadera visualización directa del tumor activo, por lo que no se correlaciona totalmente con el pronóstico. Los estudios convencionales de RM han permitido un análisis detallado de la extensión tumoral en las partes blandas circundantes, así como de la extensión tumoral dentro de la cavidad medular, contribuyendo también a la detección de micrometástasis (skip metástasis), aunque tampoco permiten una valoración pronóstica fiable.
Ha sido en la década de los noventa cuando los rastreos óseos isotópicos con Talio-201, y sobre todo las pruebas dinámicas mediante RM, han desarrollado estudios serios acerca de la respuesta del tumor primitivo a la quimioterapia y sobre la posibilidad de predicción del comportamiento tumoral.11,24,29,34,39,40 En efecto, Menéndez y cols.24 en un estudio con Talio-201 llevado a cabo de forma cualitativa y posteriormente Rosen y cols.34en un trabajo en el que ya distingue tres categorías en la respuesta a la captación de Talio-201 comenzaron a establecer la correlación entre la medición de la efectividad de la quimioterapia y la necrosis tumoral, permitiendo de esta forma una valoración pronóstica.
Como señalan Vanel y cols.39 se necesitan ciertas condiciones rigurosas para que la gammagrafía sea efectiva: el estudio debe ser bilateral y se deben establecer medidas comparativas, lo cual se cumple en este trabajo y además expresa estas medidas no de forma cualitativa, sino semicuantitativa, ofreciendo una capacidad de predicción cercana al 80%.34 De hecho, en los ocho casos de osteosarcomas en los que se basó esta parte del estudio se encontró una correlación en siete y falló parcialmente en uno, coincidiendo, por tanto, nuestros resultados con los expresados por Menéndez y cols.24
En lo que se refiere a la RM, las iniciales apreciaciones pesimistas respecto a su capacidad para constatar los efectos de la quimioterapia neoayuvante1,4 se han modificado con la introducción de los medios de contraste y el uso de estudios dinámicos de captación para la evaluación de los tumores musculoesqueléticos. Aunque Holscher y cols. en 19928 todavía informaban que la RM no era útil en la valoración de la necrosis postquimioterapia, Vanel y cols.39 señalaban más recientemente que los estudios dinámicos mediante RM son el método de valoración pronóstica más actual.
Aunque el papel de estos estudios dinámicos para diferenciar entre tumores óseos malignos y benignos es controvertido,10,23 lo que sí parece más evidente es que ofrecen una valiosa información sobre el volumen y la necrosis tumoral.39,40 La prueba se fundamenta en que el gadolinio se distribuye tras su administración en el espacio intravascular, alcanzando rápidamente el espacio extravascular intersticial y rellenando de forma prematura las porciones de masa tumoral más vascularizadas. La intensidad de señal en la RM se incrementará más lentamente en el tejido necrótico que en el tejido tumoral activo, estableciendo la diferencia.10 Esta técnica permite una valoración cuantitativa y constituye una medida fiable de la respuesta tumoral.11,13
El volumen tumoral captante puede cuantificarse con el análisis de histograma multiespectral a partir del análisis estático. Esta cuantificación es necesaria para evaluar la respuesta a la quimioterapia, pero este signo no es suficientemente sensible como para discriminar entre las buenas y las malas respuestas tumorales a la quimioterapia. El tumor viable, el edema no neoplásico y el tejido de granulación altamente vascularizado son difíciles de diferenciar mediante esta técnica.20 Además tanto las áreas necróticas, el tejido fibrótico y el componente tumoral esclerótico muestran una baja intensidad de señal tras la administración de contraste,10 por lo que se necesita una resolución temporal (estudios dinámicos multicorte).
En el análisis dinámico las imágenes paramétricas permiten la diferenciación entre estructuras no tumorales, edema no neoplásico y tumor viable; tanto el tumor viable como las estructuras infiltradas muestran una intensidad de señal alta. Las áreas necróticas y el edema peritumoral presentan un bajo y más gradual aumento en la intensidad de señal.
Parece, pues, a la vista de los resultados preliminares de este trabajo y coincidiendo con Hanna y cols.17 y Bonnerot y cols.3 que las técnicas de corta resolución temporal pueden analizar mejor la respuesta de los tumores malignos a la quimioterapia neoadyuvante antes de la cirugía de resección.
Para Erlemann y cols.11 y Fletcher y cols.12 la precisión de la RM dinámica es superior al 80%, con un alto grado de sensibilidad, mientras para Reddick y cols.31 la fiabilidad predictiva en relación con los resultados anatomopatológicos se estableció en un 89,5% (75,7-100%), la especificidad para la ausencia de respuesta fue del 85,7% (67,4-100%) y la sensibilidad para las respuestas positivas fue del 100%. Es una opinión extendida que el estudio dinámico mediante RM potenciado en T1 y con captación de gadolinio supera a los estudios potenciados en T2, a los estudios estáticos con captación de gadolinio potenciados en T1, a las escintigrafías óseas en tres fases y a cualquier medida basada en el cambio del tamaño tumoral.12
El rastreo óseo con Talio-201 y los estudios dinámicos de RM son las dos pruebas de imagen más comúnmente aceptadas y las disponibilidades de cada centro de trabajo marcarán, con mucha probabilidad, la elección de uno u otro método; los resultados obtenidos con ellos pueden influir en la decisión quirúrgica de ser más o menos conservadores en la resección,4 y si han sido favorables pueden sentar la indicación de cirugía amplia frente a una cirugía radical. Por el contrario, si ha habido una mala respuesta quimioterápica pueden hacer mandatoria una cirugía radical con ablación del miembro en un paciente que inicialmente se había considerado como candidato a cirugía con conservación del mismo. En otras ocasiones los resultados pueden indicar el adelantar la cirugía o de no prolongar más el protocolo de quimioterapia previo a la misma si en uno o dos estudios dinámicos de RM se observa que no hay aumento de la necrosis después de transcurridas las primeras fases de la terapia neoadyuvante.38
La efectividad de los protocolos de quimioterapia preoperatoria y la consiguiente respuesta tumoral han permitido seleccionar o modificar los protocolos postoperatorios,33,35 y como señala Mirra25 el informe anatomopatológico debe incluir siempre si el porcentaje de necrosis ha sido mayor o menor de 95%, añadiendo si existen o no áreas aparentes de tumor viable mayores de 1 mm, lo que indica que hay áreas resistentes a la quimioterapia preoperatoria y que, por tanto, se debe cambiar el protocolo postoperatorio. Cada vez más se considera un tratamiento de quimioterapia como inadecuado si el protocolo postoperatorio no tiene en cuenta la efectividad de la quimioterapia neoadyuvante.2 Los estudios de imagen que se han venido estudiando en este trabajo pueden ayudar a optimizar los protocolos de quimioterapia tanto neoadyuvante como adyuvante, no sólo introduciendo cambios precoces para incrementar su efectividad, sino también para evitar la selección de clones celulares resistentes a dichas drogas.38
Bibliografía
1. Bell, RS, y Davis, A: Diagnosis, survival and options for surgical care in osteosarcoma. Curr Opinion Orthop, 3: 792-797, 1992.
2. Benjamín, RS: Chemotherapy for osteosarcoma. En: Unni, KK (Ed): Bone Tumors. New York. Churchill Livingstone, 1988, 149-156.
3. Bonnerot, V; Charpentier, A; Frouin, F; Kalifa, C; Vanel, D, y Di Paola, R: Factor analysis of dynamic magnetic resonance imaging in predicting the response of osteosarcoma to chemotherapy. Invest Radiol, 27: 847-855, 1992.
4. Brown, KLB: Tumors. Editorial overview. Curr Opinion Orthop, 3: 767-769, 1992.
5. Carrasco, CH; Charsangavej, C, y Raymond, AK: Osteosarcoma: Angiographic assessment of response to preoperative chemotherapy. Radiology, 170: 839-842, 1989.
6. Cortes, EP; Holland, JF; Wang, JJ; Sinks, LF; Blom, J; Senn, H; Bank, A, y Glidewell, O: Amputation and adriaycin in primary osteosarcoma. New Engl J Med, 291: 998-1000, 1974.
7. Dahlin, DC, y Coventry MB: Osteogenic sarcoma: A study of six hundred cases. J Bone Joint Surg, 49A: 101-110, 1967.
8. De Baere, T; Vanel, D; Shapeero, LG; Charpentier, A; Terrier, P, y Di Pola, M: Osteosarcoma after chemotherapy: Evaluation with contrast material-enhanced substraction MR imaging. Radiology, 185: 587-592, 1992.
9. Eilber, F; Giuliano, A; Eckardt, J; Patterson, K; Moseley, S, y Goodnight, J: Adjuvant chemotherapy for osteosarcoma: A randomized prospective trial. J Clin Oncol, 5: 21-26, 1987.
10. Erlemann, R; Reiser, MF, y Peters, PE: Musculoskeletal neoplasms: Static and dynamic Gd-DTPA-enhanced MR imaging. Radiology, 171: 767-773, 1989.
11. Erlemann, R; Sciuk, J, y Bosse, A: Response of osteosarcoma and Ewing sarcoma to preoperative chemotherapy: Assesment with dynamic and static MR imaging and skeletal scintigraphy. Radiology, 175: 791-796, 1990.
12. Fletcher, BD; Hanna, SL; Fairclough, DL, y Gronemeyer, SA: Pediatric musculoskeletal tumors: Use of dynamic contrast-enhanced MR imaging to monitor response to chemotherapy. Radiology, 184: 243-248, 1992.
13. Fletcher, BD; Hanna, SL, y Gronemeyer, SA: Pediatric musculoskeletal tumors: Use of dynamic, contrast-enhanced MR imaging to monitor response to chemotherapy. Radiology, 184: 243-248, 1992.
14. Friedman, MA, y Carter, SK: The therapy of osteogenic sarcoma: Currente status and thoughts for the future. J Surg Oncol, 4: 482-510, 1972.
15. Glasser, DB; Phil, M, y Lane, JM: Stage IIB osteogenic sarcoma. Clin Orthop, 270: 29-39, 1991.
16. Glasser, DB; Lane, JM; Huvos, AG; Marcove, RC, y Rosen, G: Survival, prognosis and therapeutic response in osteogenic sarcoma. Cancer, 69: 698-708, 1992.
17. Hanna, SL; Reddick, WE; Parham, DM; Gronemeyer, SA; Taylor, JS, y Fletcher, BD: Automated pixel-by-pixel mapping of dynamic contrast enhanced MR images for evaluation of osteosarcoma response to chemotherapy: Preliminary results. J Magn Reson Imag,
3: 849-853, 1993.
18. Holscher, HC; Bloem, JLD, y Vanel, D: Chemotherapy-induced at MR imaging. Radiology, 182: 839-844, 1992.
19. Jaffe, N; Frei, E III; Traggis, D, y Bishop, Y: Adjuvant methotrexate and citrovorum-factor treatment of osteogenic sarcoma. New Engl J Med, 291: 994-997, 1974.
20. Lang, P; Honda, G; Roberts, T; Vahlensieck, M; Johnston, JO; Rosenau, W; Mathur, A; Peterfy, Ch; Gooding, ChA, y Genant, HK: Musculoskeletal neoplasm: Perineoplastic edema versus tumor on dynamic postcontrast MR images with spatial mapping of instantaneous enhancement rates. Radiology, 197: 831-839, 1995.
21. Link, MP; Goorin, AM, y Miser, AW: The effect of adjuvant chemotherapy on relapse-free survival in patients with osteosarcoma of the extremity. N Engl J Med, 314: 1600-1606, 1986.
22. Mail, JT; Cohen, MD; Mirkin, LD, y Provisor, AJ: Response of osteosarcoma to preoperative intravenous high-dose methotrexate chemotherapy: CT evaluation. AJR, 144: 89-93, 1985.
23. Martí-Bonmatí, L; Martínez, MJ; Vega, M; Ribes, J; Casillas, C, y Masiá, L: Enhancement of skeletal tumors: Computer strategies for image analysis. En: Lemke, HU (Ed): Computer Assisted Radiology. Elsevier Science B. V., 1996, 996.
24. Menéndez, LR; Bradley, MF, y Mirra, J: Thallium-201 scanning for the evaluation of osteosarcoma and soft-tissue sarcoma. J Bone Joint Surg, 75A: 526-531, 1993.
25. Mirra, JM (Ed): Bone Tumors. Philadelphia. Lea & Febiger, 1989, 45.
26. Oberlin, O; Patte, C, y Demeocq, F: The response to initial chemotherapy as a prognostic factor in localized Ewing''s sarcoma. Eur J Cancer Clin Oncol, 21: 463-467, 1985.
27. Oghihara, Y; Sudo, A; Fujinami, S; Satok, K, y Miurat, T: Current management, local management and survival statistics of high-grade osteosarcoma. Experience in Japan. Clin Orthop, 270: 72-78, 1991.
28. Picci, P; Bacci, G, y Campanacci, M: Histologic evaluation of necrosis in osteosarcoma induced by chemotherapy. Regional mapping of viable and non viable tumor. Cancer, 56: 1515-1521, 1985.
29. Ramanna, L; Waxman, A; Binney, G; Waxman, S; Mirra, J, y Rosen, G: Thallium-201 scintigraphy in bone sarcoma: Comparison with Gallium-67 and Technetium-MDP in the evaluation of chemotherapeutic response. J Nucl Med, 31: 567-572, 1990.
30. Raymond, AK, y Ayala, AG: Specimen management after osteosarcoma chemotherapy. En: Unni, K (Ed): Bone Tumors. Churchil Livingstone, 1988, 157-181.
31. Reddick, WE; Bhargava, R; Taylor, JS; Meyer, WH, y Fletcher, BD: Dynamic contrast-enhanced MR imaging evaluation of osteosarcoma response to neoadjuvant chemotherapy. J Magn Reson Imag, 5: 689-694, 1996.
32. Ribes, J; Valverde, C, y Borges, T: Sequential Thallium-201 scintigraphy for the evaluation of osteosarcoma and Ewing sarcoma. J Bone Joint Surg, 77B (suppl II): 208, 1995.
33. Rosen, G; Caparros, B; Huvos, AG; Koslof, C; Nirenberg, A; Cacavid, A; Marcove, R; Lane, J; Mehta, B, y Urban, C: Prepoperative chemotherapy for osteogenic sarcoma: Selection of postoperative adjuvant chemotherapy based on the response of the primary tumor to preoperative chemotherapy. Cancer, 49: 1221-1230, 1982.
34. Rosen, G; Loren, GJ; Brien, EW; Ramana, L; Waxman, A; Lowenbraun, S; Eckardt, JJ; Eilber, F; Menéndez, L, y Mirra, JM: Serial thallium-201 scintigraphy in osteosarcoma: Correlation with tumor necrosis after preoperative chemotherapy. Clin Orthop, 293: 302-306, 1993.
35. Rosen, G; Marcove, RC; Caparros, B; Nirenberg, A; Kasloff, C, y Huvos, AG: Primary osteogenic sarcoma: Selection of postoperative adjuvant chemotherapy based on the response of the primary tumor to preoperative chemotherapy. Cancer, 43: 2163-2177, 1979.
36. Simon, MS; Azchliman, MA; Thomas, N, y Mankin, HJ: Limb salvage treatment versus amputation for osteosarcoma of the distal end of the femur. J Bone Joint Surg, 68A: 1131-1137, 1986.
37. Smith, J; Heelan, RT; Huvos, AG; Caparros, B; Rosen, G; Vrmacher, C, y Caravelli, JF: Radiographic changes in primary osteogenic sarcoma following intensive chemotherapy. Radiology, 143: 355-360, 1982.
38. Van der Woude, HJ; Bloem, JL; Schipper, J; Hermans, J; Van Eck-Smit, BLF; Van Oostayen, J; Nooy, MA; Taminiau, AHM; Holscher, HC, y Hogendoorn, PCW: Changes in tumor perfusion induced by chemotherapy in bones sarcomas: Color Doppler flow imaging compared with contrast-enhanced MR imaging and three-phase bone scintigraphy. Radiology, 191: 421-431, 1994.
39. Vanel, D; Contesso, G; Spielmann, M, y Genin, J: Comment apprécier par l''imagerie la réponse des tumeurs osseuses primitives à la chimiothérapie. Rev Chir Orthop, 80, 1994.
40. Verstraete, KL; De Deene, Y; Roels, H; Dierick, A; Uyttendaele, D, y Kunnen, M: Benign and malignant musculoskeletal lesions: Dynamic contrast-enhanced MR imaging-parametric «First-Pass» images depict tissue vascularization and perfusion. Radiology, 192: 835-843, 1994.
41. Winkler, K; Beron, G; Delling, G, y Heise, U: Neoajuvant chemotherapy of osteosarcoma results of a randomized cooperative trial (COSS-82) with salvage chemotherapy based on histologic tumor response. J Clin Oncol, 6: 329-337, 1988.