Analizar un modelo murino adulto de lesión osteocondral crítica (LOC) que sea reproducible y de bajo costo para estudios de experimentación.
Material y métodoSe desarrolló un trabajo experimental en 20 ratones BKS, de 15 semanas, realizando una LOC en el surco troclear de 0,5 mm de diámetro. Diez animales fueron sacrificados a los 7 y 14 días tras la cirugía. Para evaluar la capacidad de reparación o regeneración del modelo, se realizó un análisis histológico, mediante tinción de hematoxilina-eosina y safranina-O, evaluando con la escala ICRS-II. Se comparó la zona de lesión con áreas de cartílago sano del mismo animal (zonas control). Las puntuaciones obtenidas (promedios) en cada grupo se compararon entre sí determinándose diferencias significativas.
ResultadosEn la evaluación en los días 7 y 14 se encontró una diferencia significativa entre la zona de la LOC y las zonas control, sin existir diferencias entre los 2 períodos evaluados.
ConclusiónEl modelo murino adulto de LOC crítica, en la tróclea femoral, es altamente reproducible. La potencialidad de regeneración innata del animal secundaria a la presencia de fisis durante la vida adulta no logró reparar adecuadamente la lesión producida sobre el cartílago articular. Este modelo permitirá la realización de nuevos estudios orientados a obtener mejores tratamientos para las patologías condrales.
To report a reproducible and inexpensive model of critical osteochondral lesion (LOC) in adult mice for experimental studies
Material and methodAn experimental study was conducted on 20 BKS mice of 15 weeks old, in which a LOC of 0.5mm in diameter was made in the trochlear groove. Ten animals were sacrificed at day 7, and the other 10 animals at day 14 of follow up. To assess the ability of the animal to repair/regenerate, a histological analysis was performed using hematoxylin-eosin and safranin-O stains, and the results were evaluated by the ICRS scale using areas of healthy cartilage from the same joint as control. The Mann-Whitney U test was used for the statistical analyses of scores (averages).
ResultsSignificant differences were found in days 7 and 14 between the LOC area and control areas, but no differences were found between the day 7 and day 14.
ConclusionThis model of LOC in the trochlear groove of adult mice is highly reproducible, and could be used in further studies to obtain better treatments for chondral pathologies.
Las patologías que afectan al cartílago articular como son las lesiones condrales y osteondrales (LOC), precursoras de la artrosis (osteoarthritis [OA]), han ocupado un alto número de publicaciones en la bibliografia internacional debido a la baja capacidad de reparación de este tejido y por falta de tratamientos óptimos disponibles1. Esto ha ocasionado un creciente interés en el desarrollo de estrategias experimentales capaces de generar conocimientos fisiopatológicos para evaluar, adecuadamente, los nuevos tratamientos. Por ello, el desarrollo de modelos animales de experimentación es fundamental en los trabajo de investigación para desarrollar estrategias terapéuticas innovadoras, entre las que actualmente se encuentran la utilización de plasma rico en plaquetas2, el implante autólogo de condrocitos asociados a membrana y, más recientemente, algunas experiencias con células mesenquimales pluripotenciales3, reafirmando la importancia de este tipo de modelos experimentales.
En la bibliografía se recogen múltiples modelos animales en las investigaciones relativas a LOC4–7, entre los que destacan los modelos con animales medianos (conejos y perros) y grandes (ovejas y caballos). Sin embargo, hay pocas evaluaciones de los modelos de roedores para el estudio de patologías osteocondrales, pese a que por sus bajos costos, altas tasas de reproducción y facilidades de manutención son modelos altamente deseables. La principal crítica planteada a estos animales es su alta tasa de reparación espontánea de las LOC, siendo utilizados fundamentalmente en estudios sobre alteraciones genéticas para generar una OA espontánea7,8. Sin embargo, reparación potencial de las LOC en modelos de ratones adultos no se ha validado en ningún estudio publicado. El objetivo del presente trabajo es analizar un modelo murino adulto de LOC crítica que sea reproducible y de bajo costo para estudios de experimentación.
Material y métodoAnimalesPrevia aprobación del comité de bioética de nuestra institución, 20 ratones hembra de cepa BKS de 15 semanas fueron obtenidos del bioterio de nuestra institución de acuerdo con las normas de manejo animal del Animal Care of the US National Institutes of Health9.
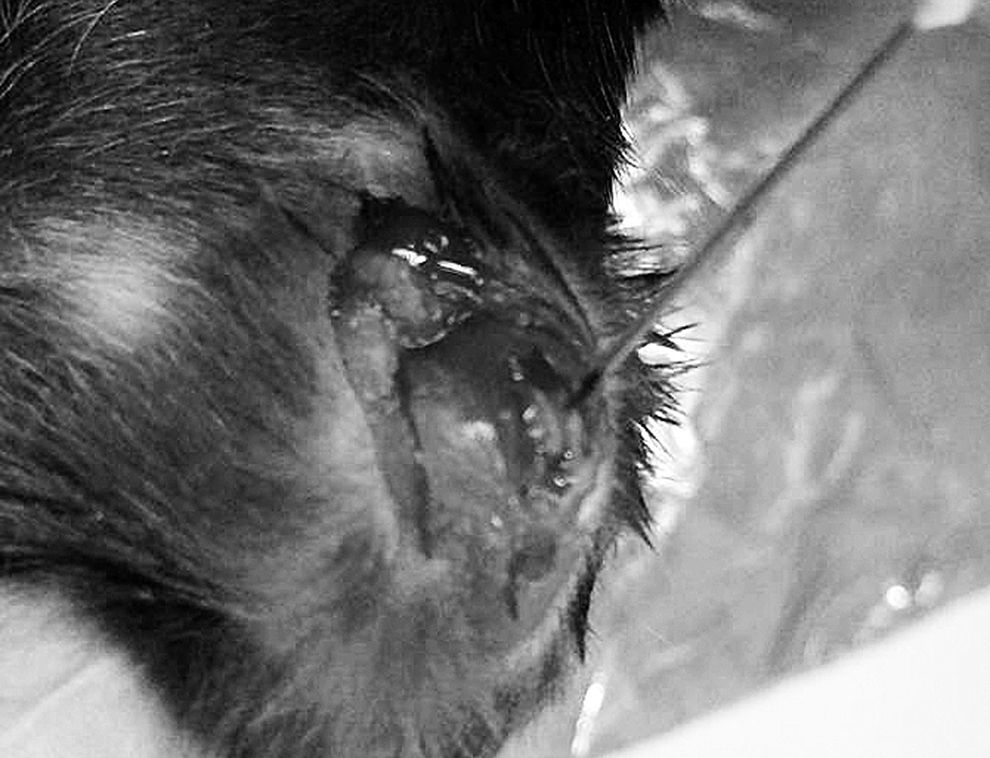
Modelo quirúrgico de lesión osteocondralLos animales fueron anestesiados inhalatoriamente con una mezcla de sevoflurano/oxígeno en relación 3%/32%. En ambas rodillas del animal, se realizó el mismo procedimiento quirúrgico. Con un bisturí número 15 se efectuó un abordaje longitudinal parapatelar medial en extensión de las extremidades inferiores hasta exponer el aparato extensor. Posteriormente se procedió a una artrotomía parapatelar medial luxando digitalmente hacia lateral la patela, dejando expuesto de esta forma los cóndilos y la tróclea femoral. Mediante visualización con lupas quirúrgicas, se identificó el surco troclear y, con un aguja 25 G (0,5mm diámetro), se realizó una LOC única en la región central, penetrando hasta atravesar el hueso subcondral (fig. 1). Bajo visualización directa, se realizó la reducción del aparato extensor, confirmándose la adecuada movilidad de la articulación patelo-femoral. El cierre de la artrotomía parapatelar medial y del abordaje de piel se realizó con 2 planos de prolene 6.0 con punto corrido. Se finalizó la anestesia inhalatoria y se administró 10mg/kg de tramadol sublingual para analgesia. A los animales se les permitió movilidad ad libitum inmediatamente finalizada la cirugía. No hubo complicaciones quirúrgicas, sobreviviendo todos los animales. Los animales, una vez despertados de la anestesia, no presentaron dificultades mayores a la deambulación con sus 4 extremidades (tabla 1).
Escala histológica semicuantitativa de la reparación del cartílago articular de la International Cartilage Repair Society
| Categoría | Puntuación |
|---|---|
| Porcentaje de llenado del defecto | |
| 100 | 4 |
| 75 | 3 |
| 50 | 2 |
| 25 | 1 |
| 0 | 0 |
| Continuidad de la superficie articular | |
| Suave y continuo | 3 |
| Rugoso pero continuo | 1 |
| Discontinuo | 0 |
| Restauración de la arquitectura osteocondral | |
| Claramente diferenciado | 4 |
| No claro (heterogéneo) | 2 |
| Pobre (compartimentalización óseo-condral) | 1 |
| No existente | 0 |
| Integración del tejido reparativo | |
| Completo | 3 |
| Parcial | 1 |
| Pobre | 0 |
| Morfología celular del tejido regenerativo del cartílago articular | |
| Hialino con arquitectura zonal | 5 |
| Hialino sin arquitectura zonal | 3 |
| Cartílago híbrido fibrohialino | 2 |
| Fibrocartílago | 1 |
| Tejido fibroso | 0 |
| Tinción de matriz (metacromasia) | |
| Normal (comparado con cartílago adyacente) | 3 |
| Levemente reducida | 2 |
| Marcadamente reducida | 1 |
| Sin tinción metacromática | 0 |
Diez animales fueron sacrificados al séptimo día y otros 10 animales el día 14 tras la cirugía mediante una inyección intraperitoneal de pentobarbital sódico, a dosis de 100mg/kg. Se repitió el abordaje quirúrgico ya explicado, exponiéndose el aparato extensor hasta el tercio medio del muslo. Se seccionó la musculatura flexora y extensora de la rodilla, liberándola de sus inserciones óseas de proximal a distal, logrando de esta forma el desplazamiento por delante de todo el aparato extensor y dejando expuesta la zona de los cóndilos femorales. Con apoyo de lupas quirúrgicas, se procedió a desarticular cuidadosamente la región proximal de la rodilla, evitando dañar el cartílago articular durante el procedimiento. Al obtener las piezas quirúrgicas, se produjo la fractura de los cóndilos femorales en una rodilla del grupo de 7 días y en una rodilla en el grupo de 14 días. Las muestras así obtenidas fueron fijadas en paraformaldehído al 4%, durante 48 h, previo a su inclusión en parafina.
Análisis histológicoDe las muestras incluidas en parafina, se realizaron cortes histológicos de 5μm los cuales fueron teñidos con hematoxilina-eosina y safranina-O. Para evaluar la reparación o regeneración producidas en las lesiones inducidas, se utilizó la escala semicuantitativa para la reparación del cartílago articular de la International Cartilage Repair Society II. Esta escala mediante un análisis de 6 variables (porcentaje de llenado del defecto, continuidad de la superficie articular, restauración de la arquitectura osteocondral, integración del tejido reparatorio, morfología celular del tejido regenerativo condral y metacromasia) ofrece una puntuación que indica la calidad de la reparación obtenida10.
Análisis estadísticoSe realizó una estadística descriptiva de los valores obtenidos y para evaluar diferencias significativas (p<0,05), entre los grupos, se utilizó el test de U de Mann-Whitney para muestras continuas.
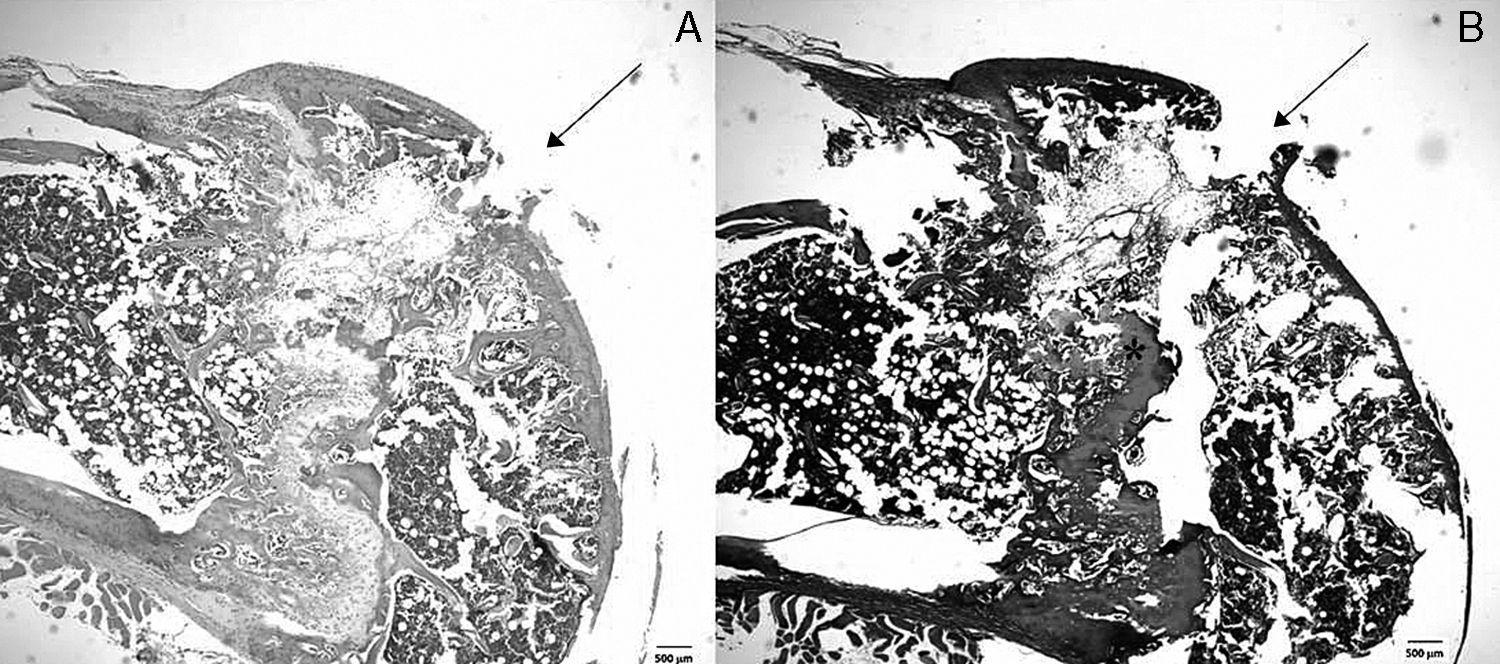
ResultadosEn las 38 rodillas evaluadas (19 rodillas por cada período), las LOC fueron visibles macroscópicamente y microscópicamente tanto al día 7 como al día 14. Al realizar el análisis microscópico, se detectó una solución de continuidad en la superficie condral compatible con el instrumental utilizado para la realización de la LOC de 0,5mm de diámetro en todas las muestras analizadas. Por su parte, la profundidad de la lesión en todos los casos comprometió al menos hasta la fisis del animal (fig. 2 A y B).
Análisis histológico de la LOC producida. Se muestra un corte sagital de la región troclear de un animal sacrificado a los 7 días representativo de la muestra completa. A) Tinción de hematoxilina-eosina en la cual se aprecia la solución de continuidad de la superficie articular. B) Tinción de safranina-O; se logra identificar la LOC y la profundidad que compromete hasta la fisis (*).
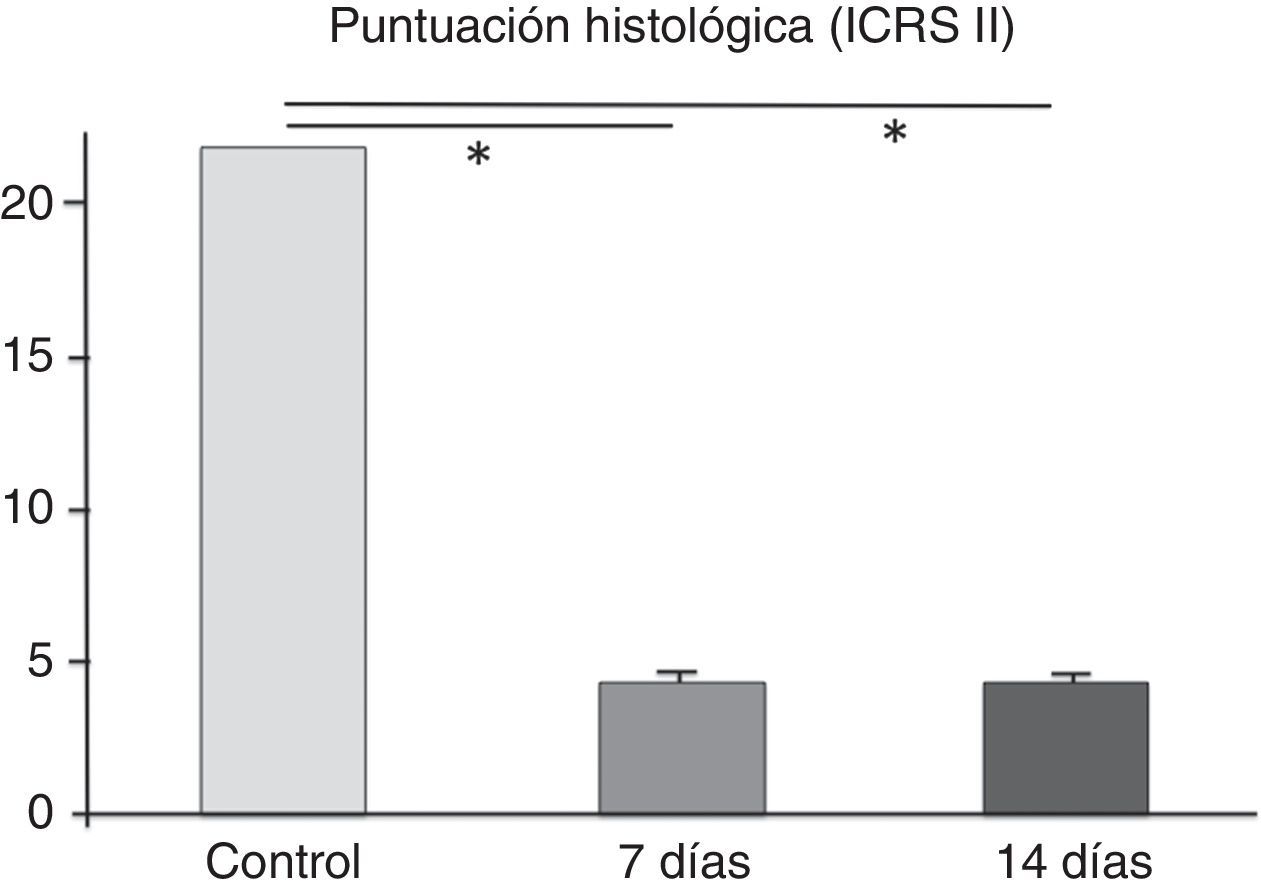
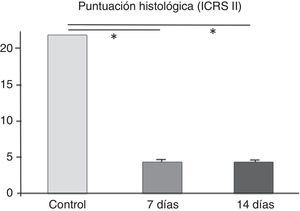
Al analizar los cortes histológicos a los 7 días, se encontró un tejido conectivo reparativo de características inflamatorias, sin observar la presencia de condrocitos en la región dañada (fig. 2 A). En la tinción con safranina-O se observó que, pese a este intento de reparación, las características de la matriz extracelular en la zona de la lesión fueron claramente diferentes de las del tejido condral circundante, con una notable disminución en la cantidad de glucosaminoglicanos. La puntuación histológica obtenida fue de 4,2 ± 0,29, mostrando diferencias significativas con la región control (cartílago normal, 22 puntos, p < 0,001).
En el grupo de animales evaluados a los 14 días, los resultados histológicos fueron similares a los descritos, destacando una menor presencia de células inflamatorias. En una rodilla se determinó un cuadro compatible con una osteomielitis aguda en comunicación con la LOC inducida. Al analizar la puntuación histológica obtenida, esta fue de 4,1±0,33, existiendo diferencias significativas con la región control (p<0,001). Al comparar los resultados obtenidos entre los 2 tiempos evaluados, estos no mostraron diferencias significativas (fig. 3).
DiscusiónSe han planteado diferentes modelos animales para el estudio de la fisiología y la fisiopatología condral, destacando la utilización de animales menores, como conejos y perros, y mayores, como ovejas y caballos. Sin embargo, las complejidades en la utilización de este tipo de animales han generado que la disponibilidad de estos modelos sea limitada, en especial para estudios en los que se está iniciando la transferencia de conocimientos desde modelos in vitro. Los animales menores, entre los que se encuentran los roedores, presentan ventajas comparativas para el desarrollo de la investigación médica, destacando sus bajos costos de manutención, alta tasa de reproducción, corto tiempo experimental y reproducibilidad de sus resultados, además de existir animales atímicos, transgénicos y knockout para ciertas patologías, por lo que son una alternativa atractiva como primer modelo animal8.
Entre las principales desventajas atribuidas a los modelos experimentales con roedores se describe el pequeño tamaño de la articulación, el bajo grosor del cartílago articular y la alta tasa de regeneración o reparación espontánea que mantendrían durante su vida adulta debido a la persistencia de la fisis, lo cual pudiera influir negativamente en el momento de evaluar terapias11. Sin embargo, al revisar la bibliografía disponible, no hemos encontrado publicaciones de modelos en ratones adultos en que se describa esta regeneración o reparación espontánea de las lesiones condrales u osteocondrales, existiendo solo una publicación de LOC enfocado en ratones jóvenes (8 semanas), en los cuales se demostró parcialmente esta capacidad reparativa intrínseca12. De manera similar, en animales que comparten gran parte de las características descritas con nuestro modelo, como son las ratas, se han desarrollado adecuados estudios de alternativas terapéuticas para el estudio de las LOC13.
Nuestros resultados fueron consistentes tanto a los 7 como a los 14 días en la capacidad de generar LOC reproducibles y de un tamaño crítico que, si bien inducen un proceso reparativo por parte del organismo, como se puede apreciar por la llegada de células inflamatorias, no logran ser adecuadamente recubiertas por neotejido condral, lo cual se vio reflejado en los puntajes histológicos.
Si bien se reconoce que las células progenitoras derivadas de la fisis en los murinos tienen la potencialidad de reparar los daños a nivel articular, al igual que lo que ocurre en el ser humano, los procesos moleculares e histológicos por el que se produce esta reparación no están del todo aclarados14. Conocido es que la embriogénesis del cartílago articular es temprana en los murinos, pudiendo identificarse el cartílago articular a las 2 semanas de desarrollo embrionario15, lo cual induce a pensar que el tiempo necesario para regenerar el cartílago dañado debiera estar en este orden de magnitud. Por ello, los tiempos evaluados en el presente trabajo (7 y 14 días de evolución natural de la LOC) permiten determinar la potencialidad de reparación innata del animal adulto, siendo a nuestro juicio estos cortos tiempos de seguimiento requeridos una fortaleza de nuestro modelo propuesto. Lo anterior además se apoya en la disminución en la respuesta reparativa inicial, caracterizándose por una disminución del componente celular de células inflamatorias vista a los 14 días, fenómeno similar al publicado en modelos de LOC de otras especies animales13. La baja puntuación histológica obtenida en los 2 tiempos evaluados es concordante con la baja capacidad de los animales adultos de reparar esta lesión crítica generada independiente de la persistencia de la fisis y nos parece fundamental, ya que demuestra que nuestro modelo quirúrgico permitirá observar mejoras significativas en relación con la capacidad regenerativa de ciertos tratamientos.
Dentro de las limitaciones específicas de nuestro modelo está el hecho de que el modelo animal propuesto no corresponde a las LOC clásicas que se aprecian en la práctica clínica, tanto por mecanismo causal como por la zona en la que estas se producen. En humanos, las LOC se presentan principalmente en los cóndilos femorales, los cuales, al ser zona de carga, tienen un comportamiento diferente en relación con su potencialidad de reparación. Por lo anteriormente expuesto, el modelo murino adulto de LOC crítica a nivel de la tróclea femoral mostrado en este estudio es altamente reproducible. En nuestros resultados, la potencialidad de regeneración innata del animal secundaria a la presencia de fisis durante la vida adulta no logró reparar adecuadamente la lesión producida quirúrgicamente sobre el cartílago articular. Este modelo permitirá la realización de nuevos estudios orientados a obtener mejores tratamientos para las patologías condrales.
Nivel de evidenciaNivel de evidencia i.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónPara la realización de este estudio se contó con el apoyo de fondos concursables de investigación de la Universidad del Desarrollo (proyecto 23.400.099) y de la Sociedad Chilena de Ortopedia y Traumatología, sin que estos recursos hayan generado conflictos de interés que declarar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a la Universidad del Desarrollo y a la Sociedad Chilena de Orto9pedia y Traumatología por proporcionar los fondos con los que se realizó el trabajo.