Uno de los conceptos que hace deseable el desgaste mínimo de las superficies articulares es el de umbral de osteólisis. Un desgaste mayor de 0,2 mm por año es capaz de ocasionar con frecuencia una osteólisis secundaria al número de partículas producido, mientras que por debajo de 0,1 mm por año ésta es infrecuente1,2. Lo que hay que hacer es buscar materiales, con buenas características tribológicas, que disminuyan ese desgaste con relación al par cobalto cromo (CoCr)/polietileno de ultra alto peso molecular (UHMWPE) que sigue siendo el más utilizado3.
En la presente revisión presentamos los materiales de mayor utilidad así como las nuevas incorporaciones en el desarrollo de las prótesis de cadera, tanto en el cotilo como en el vástago femoral. Analizaremos los polietilenos, los composites o materiales compuestos, las cerámicas, los materiales metálicos y el tratamiento y recubrimiento de las superficies protésicas. Todo ello convierte el diseño y fabricación de las artroplastias en un mundo complejo con muchas posibles combinaciones que deben ser estudiadas e investigadas en el laboratorio antes de ser implantadas en pacientes.
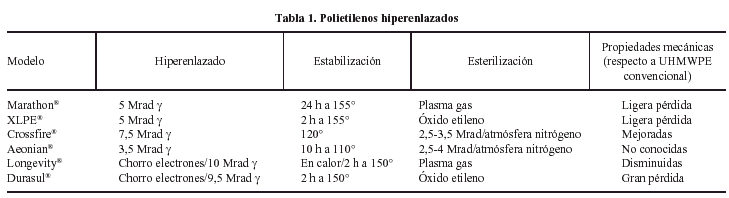
POLIETILENO HIPERENLAZADO
Desde hace tiempo se sabe que el UHMWPE tratado químicamente4 o irradiado5,6 experimenta una rotura de moléculas con la aparición de radicales libres. En ausencia de oxígeno esos radicales tienden a formar enlaces entre sí, acelerando el calor esa reacción de recombinación, pudiendo llevarla hasta la extinción de los radicales libres. Este material es resistente a la oxidación y su desgaste es un 90% menor que el del UHMWPE convencional debido a la reordenación tridimensional de la superficie.
Para conseguir eso hay varios procedimientos que se revelan eficaces siendo difícil decir cuál es el óptimo. Es complicado definir el nivel óptimo de irradiación7,8. Con 5 Mrad se logra una disminución del desgaste del 85%. Esta cifra puede aún mejorarse llegando con 10 Mrad, para no encontrar ventaja significativa a partir de ahí. El problema es que los diferentes procesos pueden alterar las propiedades mecánicas del polietileno8,9.
Analizando los datos suministrados por los fabricantes (tabla 1) y por la literatura10,11 hay que distinguir un polietileno hiperenlazado mediante irradiación de 5 Mrad a temperatura ambiente, estabilizado por fusión a 155°, durante 2 horas (XLPETM), o durante 24 horas (MarathonTM). Esa dosis relativamente baja de radiación reduce el desgaste en un 85% respecto al polietileno convencional. El mecanizado se hace en frío a partir de la parte central de la barra, eliminando el posible material oxidado de la superficie, y la esterilización subsiguiente es en óxido de etileno o en gas respectivamente. Al llegar aquí hay que señalar que al calentar el polietileno por encima de su temperatura de fusión desaparece su estructura cristalina reformándose los cristales durante el enfriamiento ulterior.
Después de este proceso pueden apreciarse cambios en su estructura con una disminución de la cristalinidad y del tamaño del cristal, con la consiguiente alteración de las propiedades mecánicas. Así, por ejemplo, el UHMWPE hiperenlazado Marathon exhibe una cristalinidad del 12% menor del convencional, un límite elástico un 4% mayor, es decir es mas rígido, y un decremento de la resistencia en tracción de un 4%, de la elongación a la rotura del 10%, y de la resistencia al impacto del 11%12.
Para evitar los inconvenientes de la fusión se ha producido el Crossfire®, sometiendo el UHMWPE a 7,5 Mrad de radiación gamma a temperatura ambiente, recociéndolo a 120°, mecanizándolo, empaquetándolo y esterilizándolo con 2,5-4 Mrad de radiación gamma, en atmósfera libre de oxígeno. Sumando ambas dosis el hiperenlazado conseguido es el correspondiente a 10-11 Mrad, otorgando una reducción del desgaste del 90%. Además, al no fundirlo, su estructura cristalina es similar a la del UHMWPE base, es decir, con una cristalinidad alrededor del 55% y un tamaño del cristal de 40-70 nm. La resistencia y el módulo elástico no se ven alterados y la fluencia es un 20% menor que la del UHMWPE convencional, lo que representa la ventaja de una menor deformabilidad del componente una vez en servicio13. Hay que remarcar que existe una cierta discrepancia entre el 30% de incremento de la tenacidad registrado por esos autores13 y la disminución del 30% de la resistencia al impacto referida por Bauer12. De todas formas el punto débil de este procedimiento es la persistencia de radicales libres aunque la oxidación es limitada por la esterilización y empaquetado en atmósfera de nitrógeno, y no se han podido apreciar efectos deletéreos con el tiempo13. En este grupo hay que incluir al Aeonian®, poco estudiado todavía, elaborado por irradiación gamma de 3,5 Mrad a temperatura ambiente, recocido a 110° durante 10 horas, esterilizado con 2,5-4 Mrad mientras se empaqueta en nitrógeno11.
En otro grupo hay que considerar al Longevity®, fabricado mediante radiación de 10 Mrad por chorro de electrones y fundido a 150°, durante unas 2 horas. Con ello se consigue la eliminación de los temidos radicales libres y una reducción del desgaste del 89%. La irradiación con chorro de electrones tiene la ventaja de que el proceso es 2.500 veces más rápido que con rayos gamma, pero es difícil asegurar un hiperenlazado uniforme de toda la masa de polietileno irradiada. Este material tiene una resistencia reducida y una absorción de energía a la rotura similar al UHMWPE irradiado con una dosis similar pero recocido y no fundido tras la irradiación, aunque en general exhibe unas propiedades mecánicas equibiaxiales superiores al material de base y también al material irradiado a 2-4 Mrad en atmósfera inerte14.
El Durasul® es un intento para obviar la reducción de la elongación a la rotura y de la tenacidad del material obtenido por el procedimiento anterior15, se ha efectuado la irradiación con chorro de electrones, con 9,5 Mrad, a 125° y fusión, durante 2 horas, a 150°. Sin embargo, este método modifica su estructura cristalina con cristalinidad del 45% y una talla del cristal de 20-40 nm. A pesar de que su comportamiento frente al desgaste es muy bueno, con una reducción de más del 95% del mismo, sus propiedades mecánicas se ven comprometidas. Su resistencia a la tracción es un 45% menor que la del UHMWPE convencional, su límite elástico un 17% menor, su fluencia un 50% más grande, y su tenacidad y resistencia a la fatiga también disminuyen sensiblemente, por debajo del UHMWPE convencional y del irradiado en vacío con dosis convencionales12-14.
Probablemente, a esa distorsión en la microestructura, con una cristalinidad del 70% y grandes cristales de 250-450 nm de tamaño, se deba la inconsistencia observada en los resultados clínicos del Hylamer®, un polietileno de cadena larga, conseguido mediante fusión y recristalización a presión elevada13.
Como conclusión de este apartado cabe decir que el polietileno hiperenlazado ha demostrado comportarse bien frente al desgaste en laboratorio, incluso en el peor de los supuestos, con cabeza de gran diámetro y grosor mínimo del componente acetabular13 o en condiciones altamente abrasivas16. Clínicamente el seguimiento es corto y se puede uno preguntar qué pasará en el futuro con un polietileno cuyas propiedades mecánicas, sobre todo en fatiga, son reducidas.
MATERIALES COMPUESTOS
Los materiales compuestos («composites») son materiales multifásicos constituidos por una matriz y un relleno de la misma por fibras, que suelen ser complementarios en cuanto a sus propiedades. Reúnen los atributos positivos de ambos sin sus defectos. Las propiedades mecánicas de un material compuesto dependen en gran medida de la unión que se logre entre la matriz y las fibras17.
Las posibilidades de estos materiales son ilimitadas y se está intentando aplicar este dominio al mundo de las prótesis articulares. Se han ensayado las fibras de carbono18-21 o de poliaramida21,22, y como matriz resinas de polietileno18,19 o de epoxi23, o termoplásticos como la polisulfona20,21, la poli-aril-éter-cetona (PEK), la poli-éter-cetona-cetona (PEKK)24 o la poli-éter-éter-cetona (PEEK)21,25.
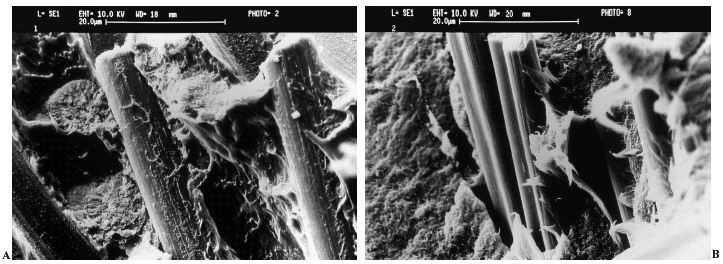
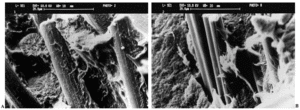
Ante los resultados cuestionables de otros materiales en la constitución de compuestos para superficies articulares protésicas23,26, se han elaborado componentes acetabulares con un 30% de fibra de carbono (FC) grafítico troceado y un 70% de PEEK como matriz, por su buen comportamiento químico27-29, biocompatibilidad30,31, propiedades mecánicas21, y la facilidad de su procesado. En efecto, la PEEK es un polímero semicristalino que funde a 343° C y que presenta una amplia gama de viscosidades. Se ha seleccionado la viscosidad más baja para trabajar el compuesto FC/PEEK mediante un proceso de extrusión, mezclándose íntimamente la PEEK en polvo y las fibras antes de la fusión. Así se consigue una distribución regular de las fibras en la matriz, que las «moja» adhiriéndolas específicamente (fig. 1). Esa magnífica compatibilidad mecánica entre las dos fases del material está probablemente en la base de su excelente comportamiento frente al desgaste, superior al del UHMWPE en los ensayos realizados32. El desgaste lineal registrado era 40 veces menor que el de éste frente a cabezas de zirconia, en tanto que el volumétrico era sólo el 1% del mismo.
Figura 1. Materiales compuestos: A: la matriz de poli-éter-éter-cetona (PEEK) se adhiere íntimamente a las fibras de carbono, constituyendo un auténtico compuesto B: el polietileno de ultra alto peso molecular (UHMWPE) no se adhiere a las fibras de carbono, por lo que el material resultante no es un verdadero compuesto.
Es un verdadero compuesto y no una mezcla que es lo que resulta ser en realidad el Poly-218. En éste el UHMWPE mantiene un comportamiento térmico viscoelástico, alcanzando un estado de goma blanda de viscosidad alta, siendo imposible mezclarla correctamente con las fibras de carbono (fig. 1). El mayor problema es la escasa resistencia de la unión entre fibras y matriz, no existiendo entre ellas adhesión específica33.
En cuanto a la investigación de la biocompatibilidad del compuesto, no se manifestaron mutaciones o aberraciones cromosómicas, lisis celular, irritación o toxicidad local, ni mortalidad o evidencia de toxicidad sistémica. Tampoco se consideró pirógeno, o causó hemólisis, ni hubo sensibilización dérmica. Los análisis histológicos de los tejidos en los que fue implantado el material o los tejidos periarticulares sometidos a la presencia de partículas provenientes del desgaste de las superficies protésicas no mostraron reacciones macroscópicas significativamente diferentes a los controles y microscópicamente fue clasificado como no irritante32.
CERAMICAS
La alúmina fue usada como par articular en los años setenta34,35 por su excelente comportamiento frente al desgaste, sus buenas propiedades mecánicas y biocompatibilidad ya que es químicamente estable e inerte, con alta tensión superficial, rígida y dura, 5 veces más que el CoCr y 30 veces más que el UHMWPE. Con un coeficiente de fricción de 0,06, exhibe un bajo par de rozamiento y un desgaste mínimo. Es 30-40 veces más resistente al rayado que el CoCr y la tasa anual de desgaste es de 0,01-0,02 mm, 40 veces menor que la del metal/metal y 2.000-5.000 veces menor que la del CoCr/UHMWPE36.
Los fallos observados durante su primera época37,38 fueron debidos al diseño de los componentes protésicos y a la precaria calidad del material. La alúmina ha cambiado y se ha mejorado su composición química. También su talla de grano se ha reducido de las 50 μm iniciales a menos de 2,5 μm y su pureza está por encima del 99,5%, lo que ha incrementado su resistencia y mejorado su acabado superficial36,39,40.
El comportamiento del par alúmina/alúmina es muy sensible a la finura del acabado superficial, a la esfericidad de las superficies articulares, la tolerancia entre ellas y a la orientación de los componentes36,39-42. Sin embargo, el material también es susceptible de fractura por fatiga si su encaje en los componentes metálicos es irregular o no sigue una adecuación de dimensiones perfecta42,43 y, también, si se calienta o enfría bruscamente44. Observando todos esos postulados el índice de fracturas ha descendido por debajo del 0,02%42,44.
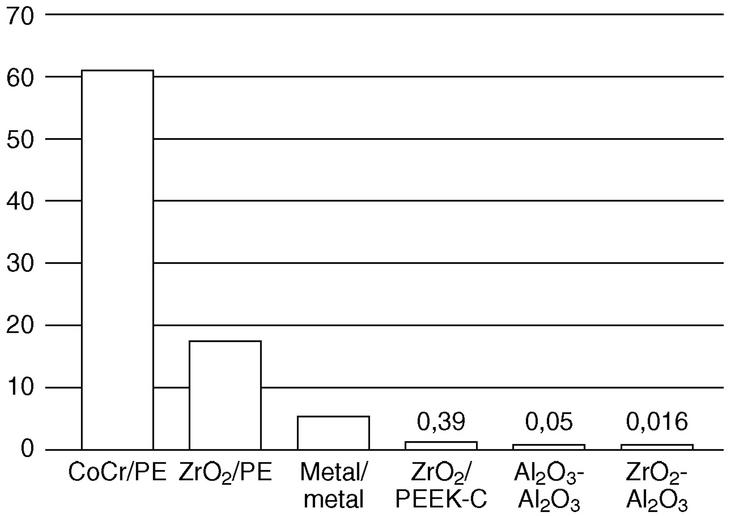
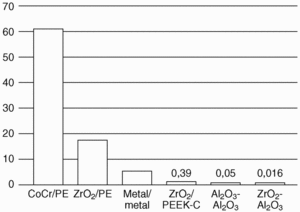
A este respecto el óxido de zirconio o zirconia presenta algunas ventajas respecto a la alúmina al doblar su resistencia43 y presentar un magnífico comportamiento frente al desgaste45. Los malos resultados observados en el laboratorio con pares zirconia/zirconia o zirconia/alúmina46,47 pueden ser debidos a trabajar con materiales poco apropiados o a la degradación de los mismos con transformación progresiva de los policristales tetragonales en granos monoclínicos11,45. Lo mismo cabe suponer respecto a las fracturas de cabezas femorales de zirconia observadas recientemente. Han pasado de una tasa de roturas del 0,01% al 11,69%, con 179 fracturas en 1.431 componentes, de dos series de fabricación. Sin olvidar otros factores como el control estricto de la densidad, el tamaño de grano, el contenido de óxido de itrio o la relación de fases tetragonal/monoclínica que permiten ver próximo el empleo de pares alúmina/zirconia (fig. 2) o zirconia/zirconia45,46. Desde el punto de vista biológico tampoco se han apreciado problemas con las partículas desprendidas de la zirconia46.
Figura 2. Desgaste volumétrico (mm3/106 ciclos) de diferentes pares articulares. Cr: cromo; Co. cobalto; PE: polietileno; PEEK: poli-éter-éter-cetona; Zr: zirconio; Al: aluminio; O: oxígeno.
Parece ser la vía a seguir dada la amplia experiencia clínica adquirida y los avances realizados en la fabricación de cerámicas. Se ha comenzado a mezclar diferentes proporciones de zirconia y alúmina, combinando la gran resistencia de la zirconia con la estabilidad térmica de la alúmina, pero a pesar de haberse informado buenos resultados47 no pasa de ser una aproximación experimental.
MATERIALES METALICOS
En este campo las diferencias están más en el diseño, fabricación, mecanizado y terminación de los implantes que en el desarrollo de nuevos materiales.
El CoCr forjado tiene una microestructura más homogénea y resistente, con 4 veces menos carbono que el fundido. Un alto contenido en carbono confiere una mayor resistencia al desgaste48, por lo que se ha adaptado el proceso termomecánico para conseguir un CoCr forjado con un contenido en carbono por encima del 0,2%, similar al fundido, y una dispersión homogénea de los carburos de 2-3 μm de tamaño.
Los carburos firmemente adheridos a la matriz circundante son 5 veces más duros que la fase austenítica de éste aunque pueden ser un punto débil frente a la corrosión fatiga si bien no se ha podido confirmar un efecto positivo con este tratamiento49.
TRATAMIENTOS Y RECUBRIMIENTOS DE SUPERFICIE
Se intenta mejorar el comportamiento de las superficies de los componentes metálicos mediante la implantación de iones o recubriéndolas con una capa de otro material, pero las referencias de los diferentes intentos son escasas y suelen limitarse al propio autor de la idea, con los sesgos que ello conlleva.
Los tratamientos de superficie, como la implantación iónica, la pasivación oxidativa o la nitruración, han sido utilizados para incrementar la dureza de las superficies y la resistencia a la corrosión tanto del CoCr como del titanio (Ti), y reducir el desgaste del UHMWPE contrapuesto50.
El comportamiento del titanio nitrurado es en este sentido tan bueno como el del CoCr51 aunque el espesor alcanzado por la capa no suele ser mayor de 100 nm y la duración de sus efectos beneficiosos no va mas allá de unos pocos millones de ciclos52.
Las superficies articulares pueden recubrirse de multicapas, más o menos gruesas, de diferentes cerámicas como el nitruro de cromo o de titanio53, la alúmina o la zirconia, el carbono o el diamante amorfo52 o policristalino54, con resultados prometedores, y el desgaste del polietileno frente a cabezas así constituidas es entre 10 y 50 veces menor y con un par diamante/diamante el desgaste es todavía mucho menor y su coeficiente de fricción el más bajo de todos los pares comparados52.
MATERIALES PARA LA FIJACIÓN
El segundo problema que puede obligar la revisión de una artroplastia es el fallo de la fijación del implante al hueso que requiere una aceptación biológica y mecánica por parte del hueso circundante del elemento artificial insertado.
Cementos
A pesar de sus inconvenientes como material heterogéneo, relativamente frágil, poco tenaz, susceptible al envejecimiento y a la fatiga e incapaz de ser integrado por los tejidos vecinos, el clásico polimetilmetacrilato (PMMA) continúa siendo el «cemento» por excelencia, sin que ninguna de las múltiples modificaciones lo haya mejorado55-57. De hecho, la mayor parte de las propuestas no han pasado de ser trabajos de laboratorio que no han tenido repercusión en clínica. Lo que ha mejorado es el método de cementación, aumentando la expectativa de supervivencia de las prótesis.
Los llamados «cementos biológicos» han presentado una alternativa seductora al ser, teóricamente, bien tolerados y capaces de incorporarse al sustrato óseo que los albergue. Sin embargo, la tarea es más complicada de lo que aparenta ya que la masa tiene que fraguar en un tiempo limitado por razones operativas y debe gozar de unas características mecánicas resistivas adecuadas a las cargas que ha de soportar. Eso ha hecho que habitualmente no se hayan utilizado en el campo de las artroplastias aunque hayan tenido éxito en otras indicaciones.
Yamamuro et al58 presentaron un «cemento» en pasta y otro inyectable, fabricado a partir del polvo cristalino secundario a la fusión de una vitrocerámica de óxido de calcio, silicio, fósforo y magnesio, tratado con γ-metacriloxi-propil-trimetoxi silano, añadiendo benzoil peróxido, bisfenol-a-glicidil-metacrilato, trietileno-glicol dimetacrilato y N,N-dimetil-p-toluidina. El fraguado se logra en 7 minutos, la temperatura en superficie de la masa es de unos 35° C, y su resistencia 220-270 MPa en compresión, 50 MPa en tracción y 120-135 MPa en flexión, superiores a las del PMMA. Su tenacidad a la fractura es de 1,6 MPa1/2 y la resistencia de la unión hueso-«cemento» de 2,6 ± 1,4 Mpa; al mes, 3,2 ± 1,5 Mpa; a los tres meses y 4,7 ± 1 MPa a los seis meses, siendo muy superior a la del PMMA-hueso, sin observarse efectos adversos.
Recubrimientos bioactivos
Esta línea comenzó en los años setenta59, siendo el material más empleado, dentro del sin número de formulaciones y compuestos, biocerámicas y biovidrios, la hidroxiapatita (HA), de la que se tiene ya una perspectiva clínica de casi 10 años60.
Es un campo lleno de incógnitas: la cristalinidad y la pureza del material, el grosor y la porosidad del recubrimiento, la forma de aplicarlo, el crecimiento óseo y su perdurabilidad. En general, se acepta que la pureza del material debe ser del 95%-97%61 y la cristalinidad alrededor del 70% ya que si es mayor condiciona una menor bioactividad. Por debajo de esta cifra la HA es mucho más bioactiva pero puede disgregarse o disolverse con rapidez60.
El espesor óptimo del recubrimiento para promover el crecimiento óseo, sin que se produzca una reabsorción, es de 30 μm61. La porosidad de la capa de HA disminuye su resistencia y acelera su reabsorción, pero al mismo tiempo la hace más bioactiva, así la HA densa es muy estable y poco reabsorbible con un comportamiento poco activo.
Para una fijación rápida es necesaria una cierta degradación de la hidroxiapatita hacia formas deficientes en calcio y carbonatadas. La formación de una capa rica en fosfato cálcico, una apatita carbonatada pobremente cristalizada, estimula la osteogénesis. Paradójicamente, la implantación de apatita carbonatada no tiene ese efecto62. En los biovidrios, compuestos de carbonato sódico, cálcico, pentóxido de fósforo y sílice, ocurre algo semejante para que su superficie sea activa. Para que se produzca la precipitación en superficie de una apatita biológica equivalente, el material tiene que gozar de una buena solubilidad62.
Los procedimientos de deposición de la hidroxiapatita sobre el sustrato metálico de la prótesis, deposición por electroforesis y sinterizado, chorro de plasma o chorro inflamado, provocan cambios en la hidroxiapatita produciéndose una mezcla de oxihidroxiapatita y fosfato tricálcico y tetracálcico62.
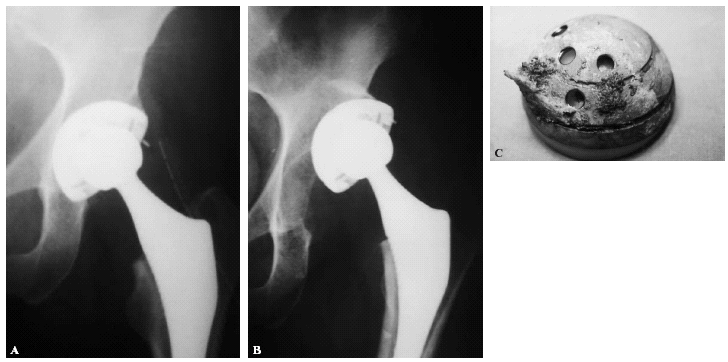
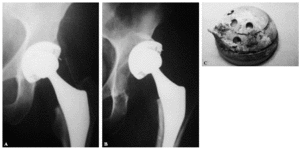
Se ha comprobado que el hueso crece no sólo en la superficie sino que también penetra en la hidroxiapatita63. El efecto osteoinductor se inicia rápidamente tras la implantación, observándose mayor crecimiento óseo y resistencia en sistemas porosos recubiertos con hidroxiapatita respecto a la misma estructura no recubierta64 (fig. 3). El promedio de superficie osteointegrada en relación al total de superficie activa es del 60%60, disminuyendo el grosor de la capa unas 15 μm en el primer año de la implantación61, siendo la supervivencia del recubrimiento evidente al menos durante 10 años60,61,63.
Figura 3. Fijación de una prótesis ABG II recubierta de hidroxiapatita. A: la prótesis recién colocada. B: a los tres meses el paciente sufrió un accidente de tráfico. C: el componente acetabular se arrancó con un fragmento óseo adherido al mismo.
Materiales constitutivos del sustrato estructural
La intrusión en el hueso de un cuerpo de propiedades mecánicas totalmente diferentes provoca una alteración de la distribución de las solicitaciones fisiológicas sobre el mismo. Aparecen picos tensionales y zonas de apantallamiento de tensiones que motivan una reacción adaptativa del hueso a la nueva situación que no siempre se logra ni resulta beneficiosa para la perdurabilidad del montaje.
La utilización general de prótesis no cementadas, prescindiendo del PMMA como elemento de ajuste con propiedades mecánicas intermedias a las de los dos elementos entre los que se colocaba interpuesto, obliga a afinar el diseño morfológico y las dimensiones de los componentes protésicos además de optimizar los materiales constitutivos. La obtención de una mayor o menor rigidez del implante radica en un compromiso entre la forma y el material.
Este problema se presenta ya en la superficie de las artroplastias no cementadas con los recubrimientos porosos con los que se las dota. Para obviar esas diferencias entre el implante y el hueso se ha empleado el tantalio, un material que constituye a la vez el sistema poroso y el sustrato estructural del implante. El tantalio se puede fabricar con una estructura similar al hueso trabecular, una porosidad del 75%-80% y una red de poros, de unas 500 μm de diámetro, interconectados.
La resistencia en compresión del tantalio es de 50-80 MPa, mientras que la del hueso cortical es de 130-150 MPa, el trabecular entre 10 y 50 MPa y otros metales porosos entre 20 y 150 MPa. Su módulo elástico, es decir su rigidez, es de unos 3 GPa, entre los 15 GPa del hueso cortical, los 2 GPa del hueso subcondral y los 0,1 GPa del hueso trabecular, mucho más «fisiológica» que los 210 GPa del CoCr o los 110 Gpa del titanio65.
La ventaja de este sistema, con una buena biocompatibilidad química y mecánica, es que el hueso crece en su interior, rellenando el 75% del volumen con hueso nuevo, y se remodela, ofreciendo esta fijación biológica el doble de resistencia que los sistemas porosos convencionales65. La experimentación realizada a este respecto no tiene por el momento una referencia en la que se plasmen resultados clínicos con los implantes cotiloideos que se han construido así, formando la malla de tantalio el continente metálico hemiesférico en el que se inserta el componente de UHMWPE.
Para terminar, señalar que desde hace unos años se sustituyen las aleaciones metálicas clásicas de los vástagos protésicos por otros materiales de módulo elástico más afines al hueso, como por ejemplo el titanio βaleado con molibdeno, zirconio y hierro Ti-12Mo-6Zr-2Fe, o empleando exclusivamente polímeros como el poliacetal66, o compuestos polímero-fibra de carbono67 o fibra de carbono en matriz de carbono68. Los resultados han sido insatisfactorios con alguno de los materiales citados por no lograr el módulo elástico apropiado, siendo los implantes excesivamente flexibles69,70, aunque otros materiales han dado resultados esperanzadores y se emplean satisfactoriamente en clínica, como es el caso de la aleación de titanio citada con la que se fabrica la parte proximal de los vástagos del sistema de prótesis de cadera no cementada ABG II® o la prótesis Epoch® con un vástago constituido por un alma de CoCr forjado, una capa de PEK y una superficie porosa de fibras de titanio. Así consiguen una rigidez en flexión similar a la del fémur y mucho menor que la de un vástago correspondiente de titanio o de CoCr71.
Se está recorriendo un camino iniciado hace más de 30 años y aunque el tipo de material es una parte muy importante de las prótesis articulares su resultado no depende únicamente de sus características mecánicas sino de la suma y combinación de múltiples factores. Un buen resultado en laboratorio no siempre se sigue de un buen resultado clínico. Hoy por hoy, entre las superficies articulares el par CoCr/UHMWPE sigue siendo el patrón de referencia y, después de muchas investigaciones, el cemento por excelencia sigue siendo el polimetilmetacrilato.
En conclusión, la utilización en clínica de un nuevo biomaterial debe ir precedida de un profundo y minucioso estudio experimental del mismo, y sólo debe implantarse cuando las supuestas ventajas superen los posibles inconvenientes, y éstos no supongan riesgo para el paciente, pues a corto plazo casi todo funciona, no así con el transcurso del tiempo. Los buenos resultados de hoy pueden ser los recambios del mañana, para lo cual se requiere un seguimiento prolongado.