La reparación de los defectos óseos cavitarios constituye uno de los problemas con los que se enfrenta la cirugía ortopédica. El tratamiento se realiza habitualmente con hueso trabecular obtenido del propio paciente. Los aloinjertos óseos también han sido ampliamente utilizados debido a la gran disponibilidad, gracias a los donantes multiorgánicos, y a su conservación en bancos de huesos o liofilizados1,2, aunque plantean el riesgo remoto de transmisión de enfermedades víricas3-5.
Se han desarrollado un gran número de materiales como sustitutivos óseos que se pueden clasificar según su origen en naturales o sintéticos6. Los materiales de origen natural consisten en hueso, homólogo o heterólogo, derivados óseos y polímeros naturales, como el colágeno. Los materiales sintéticos consisten en ciertos metales, los fosfatos cálcicos sintéticos (hidroxiapatita, Collapat, Pyrost), los fosfatos cálcicos de origen natural (coral) y los polímeros sintéticos bioabsorbibles7.
Los polímeros sintéticos bioabsorbibles son macromoléculas compuestas por la unión de múltiples unidades repetidas, los monómeros, obtenidos a través de procesos de esterificación, a partir de los alfahidroxiácidos. El ácido poliláctico (PLA) y el ácido poliglicólico (PGA) son dos alfahidroxipoliésteres que han sido investigados para la producción de homopolímeros y copolímeros bioabsorbibles para su uso como materiales de implante y en la reparación de tejidos blandos y lesiones óseas 8-13. Son materiales biocompatibles que presentan la propiedad de degradarse, un cierto tiempo después de su implantación, en productos no tóxicos que son eliminados del organismo o metabolizados en su interior14,15.
El proceso de bioabsorción in vivo de los alfahidroxipoliésteres es principalmente por escisión hidroelectrolítica no específica. El ácido láctico que se genera con la degradación del PLA se incorpora en el ciclo del ácido tricarboxílico y es excretado por el pulmón en forma de dióxido de carbono y por el riñón en forma de agua16-18.
Para la utilización de estos polímeros como sustitutivos óseos se requiere una rápida reabsorción del implante que permita su sustitución gradual por hueso sin interferir en la neoformación ósea. Estas propiedades las poseen los polímeros con más bajo peso molecular y con proporciones de formas isoméricas adecuadas19,20. El objetivo de este trabajo es estudiar la regeneración ósea provocada por polímeros de PLA con peso molecular de 30.000 y 60.000 Daltons, y con proporciones de isómeros ópticos de L/D láctico del 80/20 y 50/50.
MATERIAL Y MÉTODO
Como animal de experimentación se utilizaron conejos albinos machos de raza Nueva Zelanda, con un peso entre 3,5 y 4,5 kg y una edad entre los 4 y los 6 meses de vida con un promedio de 5 meses. Como modelo experimental empleamos la prueba de esponjosa en conejos descrita por Katthagen21 que consiste en la creación de un defecto de 6 mm en el cóndilo femoral del conejo.
Se estudiaron 4 tipos de homopolímeros de ácido láctico (PLA) con dos pesos moleculares distintos (30.000 y 60.000 Daltons) y con dos proporciones de isómeros ópticos L/D diferentes (80/20 y 50/50) (Laboratorio PHUSIS, Le Versoud, Francia).
Todos los compuestos son sólidos a temperatura ambiente, presentándose en forma de gránulos con un tamaño de gránulo entre 0,5 mm y 1 mm. La esterilización de los compuestos se realizó mediante radiación gamma.
Los animales se agruparon en 4 grupos formados por 10 conejos a los que se ha realizado un implante con homopolímero de PLA. El grupo 5 o grupo control estuvo constituido por 10 conejos, en los que no se ha practicado ningún implante. Los conejos fueron sacrificados en número de dos a las 3 y 6 semanas, y en número de 6 a las 12 semanas.
Para la valoración de los resultados realizamos un estudio histológico, un análisis histomorfométrico con técnica de hueso no decalcificado y un control radiográfico. La valoración de los resultados siguió la metodología de un estudio doble ciego.
Las mediciones de los datos histomorfométricos se efectuaron de forma semicuantitativa obteniendo los siguientes parámetros: superficie de implante, profundidad de crecimiento trabecular intraimplante, área trabecular total, área del implante ocupada por trabéculas y área de polímero no reabsorbido. Para la valoración radiológica hemos utilizado la escala de Lane y Sandhu22 para conocer el porcentaje de formación ósea en el defecto a las 12 semanas.
Los resultados de las mediciones histomorfométricas se presentan como media ± desviación estandar. La normalidad de las variables cuantitativas se verificó con las pruebas de Kolmogorov-Smirnov y Shapiro-Wilk, aceptándose el supuesto de normalidad si p >= 0,05. Para la comparación de dichos resultados se utilizó el análisis de la varianza (ANOVA), realizándose un establecimiento de contrastes mediante el método de Bonferroni en los casos con resultados estadísticamente significativos. Se aceptó una significación estadística si p ¾ 0,05.
Se empleó el coeficiente de correlación de Pearson como medida de la asociación lineal entre los resultados histomorfométricos y radiológicos. Todos los análisis estadísticos se realizaron con el programa SPSS Windows 9.0.
RESULTADOS
Resultados histológicos
En el grupo control observamos que en todos los períodos de evolución, el orificio tenía bordes esclerosos y estaba relleno de médula ósea con abundantes células grasas. No se observaron trabéculas óseas.
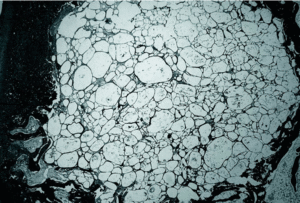
En los grupos PLA 80/20 (30.000) (fig. 1), PLA 80/20 (60.000) (fig. 2) y PLA 50/50 (60000) (fig. 3) se observó escasa neoformación ósea con abundante material polimérico con pocos signos de reabsorción a las 12 semanas y tejido fibrótico intraimplante y periimplante entre los gránulos de polímero, con presencia de células gigantes multinucleadas.
Figura 1. Imagen correspondiente al grupo de ácido poliláctico (PLA) 80/20 30.000 a las 12 semanas, mostrando escasa neoformación ósea, abundantes gránulos de polímero y esclerosis ósea periimplante (Tric.,x10).
Figura 2. Grupo PLA 80/20 60.000 a las 12 semanas. Escasa neoformación ósea y abundantes gránulos de polímero (Tric.,x10).
Figura 3. Grupo PLA 50/50 60.000 a las 12 semanas. Escasa neoformación ósea y abundantes gránulos de polímero (Tric.,x10).
En el grupo PLA 50/50 (30.000) (fig. 4) se observó la formación de trabéculas óseas que invadían el implante de forma centrípeta. En estas trabéculas se apreció una gran actividad osteoblástica, con abundantes frentes de osteoblastos que en algunos casos llegó a ocupar la totalidad del defecto óseo creado a las 12 semanas. Se apreciaron células gigantes multinucleadas. Se observaron restos de polímero pero en menor cantidad que en los tres grupos previos.
Figura 4. Grupo PLA 50/50 30.000 a las 12 semanas. Abundante neoformación ósea trabecular centrípeta (Tric.,x10).
Resultados del análisis histomorfométrico
Los datos de las mediciones histomorfométricas realizadas en los 4 grupos de estudio se exponen en la tabla 1. El grupo PLA 50/50 (30.000) es el que indujo una mayor neoformación trabecular en comparación con el resto de grupos con diferencias estadísticamente significativas (p < 0,05). No encontramos diferencias entre los otros tres grupos de polímeros entre sí.
El porcentaje de área trabecular fue en el grupo PLA 50 (30.000) de 31,45% (DE 12,2) de trabécula ósea en el defecto, diferencias que fueron estadísticamente significativas al compararlas con los otros tres grupos de polímeros (p < 0,05).
En todos los implantes observados la neoformación ósea fue centrípeta, desde los bordes del defecto óseo creado al centro del mismo. En el grupo PLA 50/50 (30.000) la profundidad media de crecimiento fue de 1,21 mm. Las diferencias con los otros tres grupos fueron estadísticamente significativas (p < 0,001).
El área de polímero no reabsorbido fue un indicador de la velocidad de absorción del polímero. En el grupo PLA 50 (30.000), a las 12 semanas de evolución, existía un 68,55% de polímero sin reabsorber, porcentaje que aumentó hasta un 90% en el resto de grupos, diferencias que fueron estadísticamente significativas (p < 0,001).
Resultados del estudio radiográfico
En el grupo PLA 50/50 (30.000), observamos que el 100% de los casos presentaron signos de neoformación ósea en el 50% o más del defecto óseo creado, mientras que en el resto de grupos la neoformación ósea fue de un 25% o menos, diferencias que fueron estadísticamente significativas (p < 0,001).
Encontramos una correlación lineal positiva entre el parámetro área trabecular total, determinada por histomorfometría, y la neoformación ósea observada en la radiología (Rxy = 0,856, p < 0,001); una correlación lineal positiva entre el parámetro profundidad de crecimiento trabecular y la neoformación ósea observada en la radiología (Rxy = 0,794, p < 0,001), y una correlación lineal negativa entre el parámetro área de polímero no reabsorbido y la neoformación ósea observada en la radiología (Rxy = 0,832, p < 0,001).
DISCUSIÓN
Los estudios de regeneración ósea en defectos óseos metafisarios, particularmente en el conejo, son siempre criticados, ya que estos animales tienen una gran capacidad osteoformadora. Nizard23 y Katthagen21 describieron la prueba de esponjosa en conejos. Estos defectos óseos en los cóndilos femorales de conejos no presentan regeneración, incluso a los 8 meses21,23. Nuestros hallazgos reafirman la validez de este modelo experimental y aseguran que la regeneración ósea que se produce al colocar un implante no es debida al lecho receptor sino al implante.
Para la utilización los homopolímeros de ácido láctico como sustitutivos óseos se requiere una tasa de absorción del implante rápida, que permita una sustitución gradual por hueso, no interfiriendo la neoformación ósea. Estas propiedades las poseen los polímeros con más bajo peso molecular y con proporciones de isómeros ópticos adecuadas.
La tasa de bioabsorción de un homopolímero depende de su peso molecular medio, a mayor peso molecular más lenta es la reabsorción; de la relación molar de formas isoméricas; de la porosidad del implante, a mayor porosidad, mayor tasa de absorción, y de la vascularización del lecho receptor, a mayor vascularización más rápida es la reabsorción del implante18,24-26 mientras que el proceso de degradación es directamente proporcional al contenido de formas D. Al año los implantes de PLA 100 permanecen sin degradar, mientras que los de PLA 50 han desaparecido prácticamente en su totalidad19.
Los polímeros de alto peso molecular presentan una tasa de absorción del implante muy lenta, superior a los dos años27. La utilización de polímeros de PLA de bajo peso molecular, por debajo de 9.000 Dalton, plantea problemas pues son compuestos viscosos a temperatura ambiente. En algunos estudios se ha observado necrosis tisular28, debido a que se metabolizan rápidamente a ácido láctico, siendo las concentraciones elevadas de este ácido lo que provocaría la necrosis tisular. Los polímeros con peso molecular de 30.000-60.000 Dalton son sólidos a temperatura ambiente, lo que permite su utilización como material de relleno en defectos óseos.
Las propiedades de estos polímeros vienen condicionadas por su peso molecular medio y por el isomerismo óptico de los monómeros constituyentes del polímero. Existen dos isómeros ópticos del ácido láctico, el D y el L. La proporción de D/L láctico también influye en la reabsorción del producto y por lo tanto favorecerá o impedirá la neoformación ósea. Los polímeros con proporciones del 50% de cada una de las formas se reabsorben con mayor celeridad19.
La utilización de la radiación de alta energía para la esterilización de los implantes poliméricos en lugar de la esterilización con óxido de etileno evita que los restos de este producto alteren la respuesta inflamatoria de los polímeros20,29,30.
El proceso de incorporación a nivel de un defecto óseo, de los copolímeros de PLA/PGA, se produce desde la periferia hacia el centro acompañándose de una aposición ósea de forma centrípeta8, que forman inicialmente bandas de colágeno maduro alrededor del implante25. A medida que el implante se va fragmentado, fundamentalmente por hidrólisis, penetran pequeños capilares y se produce la llegada de células gigantes a cuerpo extraño y macrófagos y la formación de fibras colágenas31. En los espacios creados dentro del implante se observa una progresiva formación de puentes corticales, que van reemplazando el polímero a medida que éste es reabsorbido. Los restos de polímero aparecen rodeados de células mononucleadas y células gigantes32.
En los 4 grupos con implantes de polímero que forman nuestro estudio observamos que, a las tres semanas, se produce una desestructuración del tejido óseo que rodea el polímero y una invasión por células de la médula ósea. En el grupo de conejos con implantes de PLA 50/50 (30.000) aparece, además, tejido osteoide inmaduro en las áreas más próximas al hueso que es sustituido por trabéculas óseas entre las 6 y 12 semanas.
Estas trabéculas óseas invaden el implante de forma centrípeta, presentando una gran actividad osteoblástica, como han demostrado otros autores8,33.
En los grupos con implantes de PLA 80/20 (60.000), PLA 80/20 (30.000) y PLA 50/50 (60.000) no se produce esta respuesta ósea, objetivándose, entre las 6 y 12 semanas la existencia de la formación de un tejido fibrótico con escasos signos de degradación y una reacción ósea con engrosamiento trabecular en el borde próximo al implante. La encapsulación de los polímeros bioabsorbibles también ha sido descrita en la bibliografía6,8,19,24,25.
Esta mayor respuesta ósea observada en el grupo PLA 50/50 (30.000) se ve confirmada en el estudio histomorfométrico con cifras más altas en las variables área trabecular total y porcentaje de área trabecular. Katthagen obtuvo unos datos de porcentaje de área trabecular, con el hueso esponjoso autólogo, del 34,15% a las 4 semanas del implante21. Fernández de Retana, utilizando el mismo modelo experimental, obtuvo unos resultados en el porcentaje de área trabecular del grupo con hueso esponjoso autólogo del 16% a los dos meses del implante34.
La respuesta inflamatoria a los polímeros bioabsorbibles viene mediada por células gigantes multinucleadas, que actuarían en el proceso de fagocitosis de restos de material residual. Estas células se observan en todos los implantes a partir de la tercera semana. Por su parte, la intensidad de las respuestas tisulares locales y de la actividad de los macrófagos ante los implantes poliméricos absorbibles está determinada por varios factores, como son la biocompatibilidad del polímero absorbible y de los productos de degradación del polímero, la velocidad de degradación del polímero, la forma del implante, la masa y estructura física, la pureza del polímero utilizado y las solicitaciones a las que está sometido20,35.
En nuestro estudio en los 4 polímeros analizados no existen diferencias en cuanto a biocompatibilidad del producto ni a la pureza, pues todos son homopolímeros puros de PLA, ni tampoco en la forma y estructura física, ni el lugar de la implantación. La respuesta tisular observada depende exclusivamente de la velocidad de reabsorción de los distintos polímeros.
En los dos grupos con implantes de polímeros de PLA 80/20 de nuestro estudio, que presentan una menor tasa de reabsorción que los polímeros de PLA 50/50, se muestra una escasa reacción inflamatoria a las 6 y 12 semanas de la implantación. Para muchos autores una respuesta moderada a cuerpo extraño desencadenada por los polímeros bioabsorbibles es considerada como una respuesta biológica normal6,19, 31.
La utilización de la radiología para la valoración de la incorporación de los implantes plantea una serie de inconvenientes como son la subjetividad del observador y la calidad radiográfica. En nuestro estudio el material implantado es un material radiotransparente y todo el hueso que hallemos dentro del implante será hueso neoformado. Nuestros resultados han mostrado una correlación entre los hallazgos histológicos y las observaciones radiográficas, así como entre los datos histomorfométricos, referidos a área trabecular y profundidad de crecimiento óseo intraimplante, y los datos radiológicos han demostrado que existe una correlación lineal, estadísticamente significativa, entre ambos.
Todos los homopolímeros estudiados se comportan como sustancias osteoconductivas, encontrando mayor neoformación ósea y, por lo tanto, la mayor reabsorción de polímero en los homopolímeros de PLA con una proporción de isómeros L/D del 50/50 y con un peso molecular de 30.000 Dalton. Así, la respuesta inflamatoria, mediada por células gigantes multinucleadas, es mayor en el grupo que presenta una mayor tasa de reabsorción.
*Premio Fundación Mapfre 2002.