REVISTA DE ORTOPEDIA Y TRAUMATOLOGÍA
Volumen 42, pp 211-218
© 1996 EDITORIAL GARSI
Osteosarcoma: Correlación de la citometría de flujo
con los parámetros clínicos
T. BAS*, J. O''CONNOR**, P. BAS*, C. IRANZO***, M. PRIETO*** y C. ESPINOSA*
*.Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario La Fe. Valencia.
**.Departamento de Bioquímica y Biología Molecular. Facultad de Medicina. Universidad de Valencia.
***.Servicio de Anatomía Patológica. Hospital Universitario La Fe. Valencia.
Correspondencia:
Dra. T. BAS.
Colón, 12, 12.
46004 Valencia.
En Redacción: Enero de 1997.
RESUMEN: Numerosos estudios han señalado el valor potencial de la citometría como indicador de la malignidad y el comportamiento biológico de los tumores, incluyendo el osteosarcoma. Se han analizado mediante citometría de flujo el contenido de DNA en 50 osteosarcomas, determinando la ploidía (índice de DNA) y la progresión a través del ciclo celular (índice de proliferación). Estas valoraciones se han correlacionado con parámetros clínicos, histológicos y radiológicos. El análisis de la ploidía antes de la quimioterapia muestra un mayor número de osteosarcomas aneuploides cuya proporción disminuyó tras la quimioterapia, sugiriendo una mayor sensibilidad de los tumores aneuploides al tratamiento. El análisis del índice de proliferación en los tumores diploides indica que tras la quimioterapia disminuye la capacidad proliferativa, indicando el efecto del tratamiento. El índice de DNA por sí solo no es capaz de diferenciar grupos de pacientes con distintos parámetros clínicos, radiográficos, histológicos y demográficos. Sin embargo, sí existe una tendencia a que los tumores aneuploides ocurran en pacientes jóvenes, tengan mayor tamaño y más recidivas. Las variables que muestran una relación significativa con la supervivencia son: estadio tumoral, recidiva, aparición de metástasis e índice de proliferación postquimioterapia. Estos resultados apoyan el valor del análisis del DNA en el estudio del osteosarcoma, ya que ayudan al diagnóstico diferencial, a la determinación del comportamiento biológico y a la evaluación de la eficacia del tratamiento.
PALABRAS CLAVE: Tumor óseo. Citometría de flujo. Osteosarcoma.
OSTEOSARCOMA AND FLOW CYTOMETRY: CORRELATION WITH CLINICAL PARAMETERS
ABSTRACT: Many studies indicate the potential value of cytometry as an indicator of tumoral malignancy and biological behavior, including osteosarcoma. A flow cytometry analysis was made of the DNA content of 50 osteosarcomas to determine ploidy (DNA index) and progression in the cell cycle (proliferation index). These evaluations were correlated with clinical, histological, and radiological parameters. Analysis of ploidy before chemotherapy disclosed more aneuploid osteosarcomas, but their proportion decreased after chemotherapy, suggesting that aneuploid tumors were more sensitive to treatment. Analysis of the proliferation index in diploid tumors indicated that proliferative capacity decreased after chemotherapy, which reflected the effect of treatment. The DNA index per se did not permit groups of patients with different clinical, radiographic, histological, and demographic parameters to be differentiated. However, there was a tendency toward aneuploid tumors in young patients which were larger and more recurrent. The variables that were significantly related with survival were tumor stage,
recurrence, metastases, and postchemotherapy proli-feration rate. These results support the value of DNA analysis in the study of osteosarcomas because it helps in the differential diagnosis, determination of biological behavior, and evaluation of the effectiveness of treatment.
KEY WORDS: Bone tumor. Flow cytometry. Osteosarcoma.
Dada la escasa frecuencia y la variabilidad histológica del osteosarcoma, el estudio de los factores que influyen sobre la supervivencia es compleja. Como resultado de un amplio número de estudios clínicos se utilizan en la actualidad una serie de características clínicas consideradas de valor pronóstico, como la extensión de la enfermedad en el momento del diagnóstico, la histología del tumor y su localización primaria.3,4,11,13,14,17,24,25,36 Sin embargo, estos parámetros pueden ser de utilidad limitada, ya que la mayoría de los pacientes se presentan con características clínicas muy similares. Por otra parte, tras la administración de quimioterapia postquirúrgica hasta un 50% de los pacientes llegan a desarrollar metástasis, siendo este subgrupo indistinguible en principio de los que no lo hacen. De todo ello surge el interés de aportar nuevos factores que permitan predecir el comportamiento y la resistencia quimioterápica de los tumores cuando no bastan los criterios clínicos usuales.
Desde la introducción de la citometría de flujo se han publicado muchos trabajos que analizan el valor de la capacidad de proliferación celular (Fig. 1) como parámetro predictivo en el estudio de carcinomas de diferentes tipos.21,35,41,42 Sin embargo, por el limitado número de estudios especializados, la utilidad de la citometría como factor pronóstico aislado en el osteosarcoma y otros tumores óseos no ha sido aún clarificada.5-10,12,15,18,26,28,31,32,38,40,51
Figura 1. Representación del ciclo celular. (Panel superior muestra las variaciones del contenido del DNA a lo largo del ciclo celular; panel inferior derecho e izquierdo: Muestra la valoración del contenido DNA para el estudio de la proliferación celular y la ploidía.)
Se han analizado los hallazgos citométricos con parámetros clínicos establecidos para analizar los factores pronósticos en cuanto a la respuesta a la quimioterapia y a la supervivencia global en 50 pacientes con osteosarcoma.
Material y Método
Se han revisado 46 osteosarcomas convencionales y cuatro de superficie tratados consecutivamente entre 1983 y 1995. Se realizó un estadiaje preoperatorio de todos los tumores según la valoración de Enneking y cols.19 El diagnóstico de la lesión se realizó por punción biopsia en 40 casos y por biopsia abierta en 10. Una vez confirmada la naturaleza del tumor se inició el protocolo de Rosen y cols.44,45 con quimioterapia neoadyuvante en 39 casos y adyuvante en el resto. Se valoró el tipo de tratamiento quirúrgico y sus complicaciones, la aparición de recidivas locorregionales y de metástasis.
Las características histológicas del tumor se evaluaron dividiéndolas en macroscópicas y microscópicas. Estas últimas, a su vez, se clasificaron en tres grupos, según correspondieran a la histopatología del tumor, a los márgenes quirúrgicos o al porcentaje de necrosis postquimioterapia.24,25 La supervivencia se constató en Diciembre de 1995.
Para el estudio citométrico se analizaron 44 muestras tisulares fijadas e incluidas en parafina, y seis tumores en fresco conservados a 70° C hasta su análisis. La obtención de suspensiones nucleares a partir de material fijado se realizó mediante tres cortes sucesivos en cada bloque, de 4,50 y 4 mm, comprobándose la existencia de tumor en los dos marginales. Para el estudio por citometría de flujo de estos tumores se ha utilizado la técnica de Hedley y cols.27 En los tumores congelados las suspensiones nucleares se obtuvieron descongelando éstos rápidamente por inmersión en PBS a 37° C para posteriormente obtener cubos de 1 a 3 mm de lado que fueron disgregados mecánicamente sobre portaobjetos. Una vez obtenida una masa homogénea se procedió al filtrado a través de una malla de 50 micras de diámetro. La suspensión resultante fue centrifugada 10 minutos a 2.000 rpm. Para el presente estudio se ha utilizado fundamentalmente el citómetro de flujo EPICS Elite y los citómetros de flujo EPICS Profile II y EPICS XL.
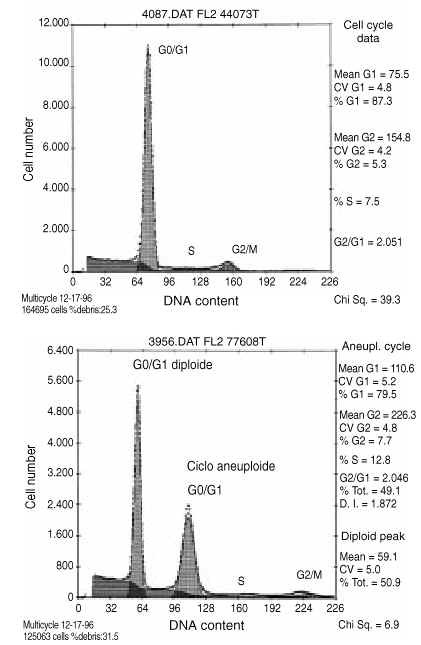
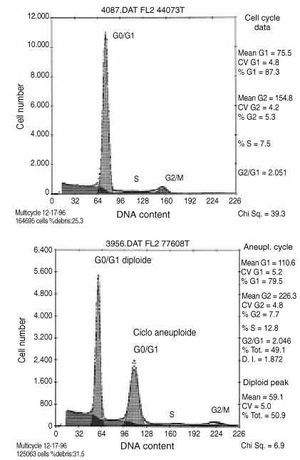
Para cada muestra se adquirieron los datos correspondientes a 10.000 núcleos, almacenados en el ordenador del citómetro en forma de histogramas monoparamétricos en los que se representa la concentración de DNA en núcleos individuales frente al número de núcleos. Estos histogramas se utilizan para el análisis de la ploidía del ciclo celular (Fig. 2).
Figura 2. Histogramas monoparamétricos de DNA de osteosarcoma de fémur distal. A: Tumor diploide prequimioterapia. B: Tumor aneuploide postquimioterapia.
Una vez obtenidos los datos clínicos, histológicos y citométricos de cada tumor se procedió a efectuar un análisis estadístico incluyendo los siguientes apartados: estadística descriptiva y análisis univariante, bivariante y multivariante según el modelo de regresión de Cox.16 Se analizó la supervivencia a 5 años con las curvas de Kaplan-Meier30 para cada uno de los parámetros analizados.
Resultados
Demografía
La edad media de los pacientes estudiados fue de 18,5 ± 8 años (mínimo: 10 y máximo: 41 años). La distribución por edades muestra que el 90% de los casos se encuentran por debajo de los 31 años de edad, con un predominio de los pacientes de menor edad entre los del sexo masculino (Tabla 1).
| Tabla 1. Parámetros del estudio demográfico y radiográfico de la serie. | |
| Parámetros | Categorías |
| Demográficos | |
| Edad | 18,5 |
| Sexo | 25 varones/ 25 mujeres |
| Radiográficos | |
| Localización anatómica | Proximales (16%) Distales (30%) Femorales (54%) |
| Localización ósea | Metafisaria (82%) Diafisaria (10%)* |
| Lado | Derecho (54%)/ izquierdo (46%) |
| Respuesta a la quimioterapia (Rosen 52) | 74% (I, II) 28% (III, IV) |
| *.El 8% que falta corresponde a las localizaciones en hueso plano, sacro y vertebrales. | |
Radiología
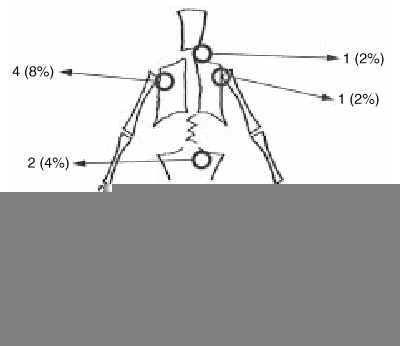
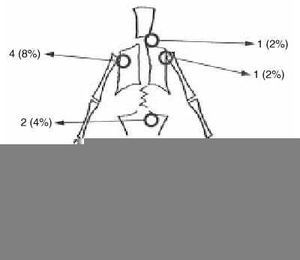
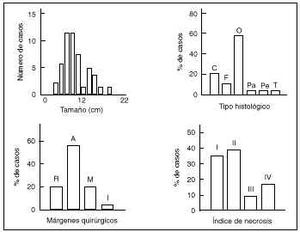
La localización más frecuente fue distal del fémur con 27 pacientes, seguida de la tibia con nueve y el húmero con cuatro. Se encontraron también tumores localizados en la escápula, raquis cervical y sacro (Fig. 3). La extensión a la epífisis se produjo en un 3% de los casos. El patrón radiológico fue fundamentalmente osteoblástico en 45 casos (90%), mientras que en cinco ha sido de predominio osteolítico. Se objetivó reacción perióstica en el 84% de los pacientes (42 casos) (Tabla 1).
Figura 3. Localización esquelética de los osteosarcomas en los 50 pacientes.
Clínica
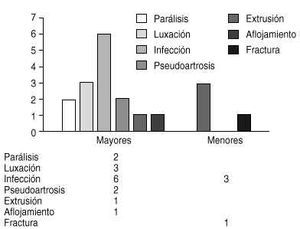
La duración media de la sintomatología fue de 86 semanas (mínimo: 1 y máximo: 420 semanas). Entre los síntomas de presentación el más frecuente fue el dolor en el 93% de los pacientes estudiados, seguido por la aparición de tumoración en un 76% de los casos. Tras la primera consulta, el 86% de los pacientes fueron incluidos en el estadio IIB de Enneking. En el 26% de los pacientes de la serie se realizó una cirugía ablativa y en el 74% una cirugía de resección. Dentro de este último grupo de pacientes se realizó cirugía conservadora de miembros, con procedimientos reconstructivos en el 68% (21 prótesis y cinco artrodesis) al excluirse de este recuento dos tumores de sacro y el tumor de raquis cervical. Un 38% de los pacientes presentaron complicaciones (Tabla 1): en 12 pacientes existió recidiva; de ellos, seis acudieron con algún tratamiento local antes de entrar en el protocolo y en los otros seis la cirugía fue marginal. La media de aparición de la recidiva fue de 8,6 meses (mínimo: 1 y máximo: 24 meses). En el 50% de los pacientes aparecieron metástasis a distancia.
En tres pacientes, además de observarse metástasis pulmonares, el tumor metastatizó a nivel vertebral y en el sacro. El tratamiento de los pacientes con metástasis dependió del número y la posibilidad de resecabilidad de las mismas, realizando toracotomía en 12 pacientes, de los cuales viven con enfermedad cinco casos, con una media de supervivencia de 4 años (mínimo: 2 y máximo: 7 años). En 21 casos se siguió el protocolo estándar de quimioterapia preoperatoria y postoperatoria. En tres pacientes no se administró quimioterapia al ser casos de osteosarcoma de bajo grado, uno paraostal y dos periostales.
En el momento de la última revisión de la serie el 44% de los pacientes habían fallecido, el 46% vivían libres de enfermedad con una media de 5 años (mínimo: 1 y máximo: 12 meses) y el 10% viven con la enfermedad, incluyendo pacientes con metástasis intervenidas y pacientes con recidivas. La supervivencia global de la serie es del 56% a los 5 años.
Cuando se valora la respuesta a la quimioterapia los pacientes refractarios al tratamiento (Grados I y II de necrosis) tienen una supervivencia global del 73% y una supervivencia libre de enfermedad del 56%. Los pacientes con buena respuesta a la quimioterapia (Grados III y IV de necrosis) tienen una supervivencia global del 66%, al igual que supervivencia libre de enfermedad.
Histología
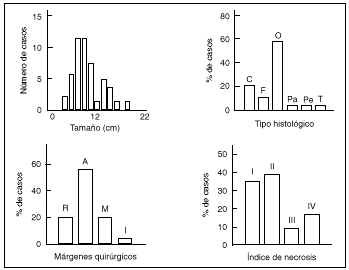
En la serie estudiada el tipo histológico más frecuente ha sido el osteoblástico (n = 29). El tamaño medio ha sido de 8 ± 4,2 cm de diámetro máximo (mínimo: 2,5 y máximo: 22 cm).
Microscópicamente se valoraron los márgenes de la cirugía según los criterios de Enneking y cols.,19 siendo la resección radical en el 20% de los casos, amplia en el 56%, marginal en el 20% e intralesional en el 4%. La respuesta histológica a la quimioterapia fue en un 35% un Grado I de Rosen y cols.,29,46 en un 3% un Grado II, en un 9% un Grado III y en un 17% un Grado IV (Fig. 4).
Figura 4. Resultado de los parámetros histológicos de la serie. C: Condroblastoma; F: Fibroblástico; O: Osteoblástico; Pa: Paraostal; Pe: Periostal; T: Telangiectásico; R: Radical; A: Amplio; M: Marginal; I: Intralesional.
Parámetros citométricos
Ploidía nuclear
De los 50 tumores fue posible analizar el contenido nuclear de DNA en 17 piezas obtenidas antes de la quimioterapia. De los 39 pacientes sometidos a quimioterapia se pudo analizar el contenido nuclear de DNA en muestras postquimioterápicas en 38 casos. De esta forma se pudo disponer de datos citométricos antes y después de la quimioterapia en 17 casos. El resto de muestras analizadas no pudieron ser incluidas al no presentar picos reconocibles en el histograma de DNA, generalmente por la elevada necrosis de la muestra o porque el CV del pico G0 fue superior al 10%. Esto imposibilita la detección de posibles picos aneuploides cercanos.
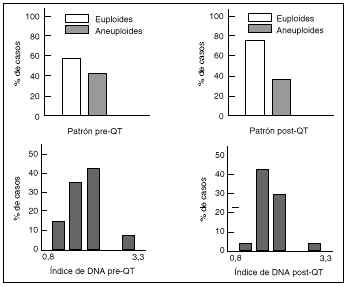
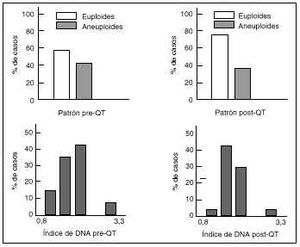
En el estudio de las muestras obtenidas antes de la quimioterapia el 43% de los tumores fueron euploides (36% diploides y 7% tetraploides) y el 57% aneuploides. Dentro del grupo de tumores aneuploides, el 8% fueron multiploides, es decir, presentaron más de una línea aneuploide. Tras la quimioterapia el porcentaje de tumores aneuploides disminuyó ligeramente hasta el 53% (Fig. 5). El índice de DNA medio de los tumores aneuploides de la serie analizada antes de recibir quimioterapia fue de 1,63 ó 0,46. En los tumores aneuploides de la serie analizada tras quimioterapia el índice de DNA medio fue de 2,35 ó 0,25, significativamente mayor que en las muestras estudiadas antes del tratamiento quimioterápico.
Figura 5. Resultado de los parámetros citométricos alcanzados. Todos los valores se han analizado antes y después de la quimioterapia.
Índice de proliferación
Se calcula mediante el cómputo del porcentaje de núcleos que se encuentran en las fases S+G2+M del ciclo celular. El índice de proliferación pudo ser calculado para el 100% de los casos diploides, mientras que en los tumores aneuploides no se determinó debido a una excesiva superposición de los ciclos diploide y aneuploide en el mismo tumor. En los tumores diploides de la serie estudiada antes de la quimioterapia el índice de proliferación medio fue de 34 ± 11 (mínimo: 18 y máximo: 51). En los tumores diploides de la serie analizada tras la quimioterapia el índice de proliferación medio fue ligeramente menor que en los anteriores, 27 ± 14 (mínimo: 6 y máximo: 50). La distribución de los valores individuales de proliferación fue heterogénea tanto para muestras pre como postquimioterapia. Sin embargo, la distribución en las muestras postquimioterápicas se encuentra más desplazada hacia valores de proliferación menores que en las muestras prequimioterápicas.
Discusión
En los parámetros biológicos que se han evaluado como posibles factores pronósticos se encuentra el contenido de DNA en células tumorales individuales.1,48 Este tipo de estudios, que ha permitido evaluar el papel pronóstico de la ploidía (índice de DNA) y de la progresión a través del ciclo celular (índice de proliferación) se ha aplicado repetidamente a la práctica totalidad de tipos de tumores sólidos y hematológicos en estudios de tipo prospectivo o retrospectivo.6 Por la menor incidencia del osteosarcoma los estudios en este sentido son escasos.7-10,17,40,43 Los parámetros clínicos de la serie de osteosarcomas descrita en este trabajo son similares a los de la literatura.5,8-10,34,40 La distribución de tumores euploides y aneuploides en la serie coincide bien con las descritas en las series de referencia,5,8-10,23,34,40 con una mayor abundancia relativa de tumores aneuploides. La elevada frecuencia de tumores aneuploides entre los osteosarcomas ha sido una de las características más destacadas en los análisis citométricos publicados.20,49Sin embargo, estudios posteriores26,39 mostraron que los osteosarcomas de alto grado de malignidad podían ser diploides, aunque siempre el porcentaje de aneuploidía es muy elevado.
En el presente estudio el análisis de la proliferación celular se ha restringido a los tumores euploides por la dificultad en aplicar los programas infomáticos de ajuste del ciclo celular a las poblaciones tumorales mixtas. En los tumores diploides de la presente serie la elevada proliferación tumoral antes de la quimioterapia es un factor de buen pronóstico. Este hecho está de acuerdo con una mayor susceptibilidad de las poblaciones proliferantes frente al tratamiento con un agente antineoplásico como es el metotrexato, que interfiere específicamente con la síntesis activa de DNA.2,37
La ploidía tumoral antes del tratamiento no fue un parámetro predictivo estadísticamente significativo, pero mostró una ligera tendencia en el sentido de que los tumores aneuploides presenten mejor supervivencia con respecto a los tumores euploides. Este dato estaría de acuerdo con una mayor sensibilidad a la quimioterapia de los tumores aneuploides a tenor con la observación de que el porcentaje de tumores aneuploides disminuye tras la quimioterapia. El mejor pronóstico de los tumores aneuploides visto en esta serie es infrecuente y se ha observado en algunas neoplasias infantiles, como el neuroblastoma, y para los osteosarcomas, que muestran la presencia de un pico aneuploide por citometría de flujo.6,14,22,40
La recidiva ha sido un factor pronóstico importante tanto en otras series5,8-10,34,50 como en ésta, que se apreció casi exclusivamente entre los pacientes sometidos a cirugía previa. Estos datos confirman la importancia de un adecuado tratamiento quirúrgico en el osteosarcoma, ya que es evidente que una elevada frecuencia de recidiva se asocia con unos márgenes quirúrgicos inadecuados. Todo ello refuerza la idea de tratar el osteosarcoma desde el principio en centros especializados.
En la serie en estudio la localización proximal tiende a indicar peor supervivencia,5,8-10 siendo un factor pronóstico del tiempo de supervivencia libre de enfermedad.24 El tamaño mostró un valor pronóstico en el grupo de pacientes estudiado, siendo peor en tumores de mayor diámetro. Otros autores5,8-10,14,33 han puesto de relevancia que este parámetro, a pesar de no tener valor pronóstico por sí mismo, está relacionado con la localización tumoral.
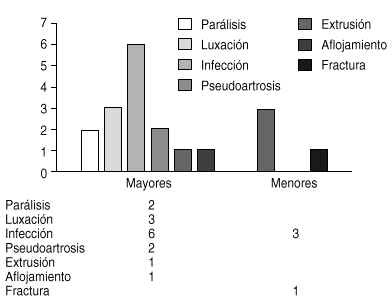
Figura 6. Análisis de las complicaciones quirrgicas de la serie en estudio. Se dividen las mismas segn Rugger y cols.47 en mayores (precisan de cirugía para resolverse) y menores (no precisan cirugía).
Conclusiones
1.a El análisis citométrico del osteosarcoma permite conocer sus características biológicas.
2.a La proliferación del tumor (índice de proliferación) está relacionado con la respuesta al tratamiento.
3.a El estudio multivariante del valor pronóstico de los diferentes parámetros muestra que las variables con relación significativa con el tiempo de supervivencia son el estadio, la recidiva, la metástasis y el índice de proliferación prequimioterapia.
4.a La citometría de flujo puede ser una herramienta útil en el estudio clínico del osteosarcoma, aplicable al diagnóstico, pronóstico y al seguimiento de la quimioterapia.
Agradecimientos
Los autores agradecen la colaboración del Servicio de Anatomía Patológica del Hospital Universitario La Fe de Valencia, al Departamento de Bioquímica de la Facultad de Medicina de Valencia (doctores Concha García, Gloria Juan, Ana Triguero y José Manuel Pelayo) y al doctor Javier Muñoz, sin cuya ayuda no se hubiera podido realizar este trabajo.
Bibliografía
1. Atkin, NB, y Kay, R: Prognostic significance of modal DNA value and other factors in malignant tumours, based on 1465 cases. Br J Cancer, 40: 210-221, 1979.
2. Baldini, N; Gebhardt, MC; Springfield, DS; Litwak, GJ, y Mankin, HJ: Effect of preoperative chemotherapy on cellular DNA content on human osteosarcoma. Trans Orthop Res Soc, 15: 195-202, 1990.
3. Barlogie, B; Johnston, DA, y Smallwood, L: Prognostic applications of ploidy and proliferative activity in human solid tumors. Cancer Genet Cytogenet, 6: 17-28, 1980.
4. Barlogie, B; Raber, MN; Schuman, J; Johnston, DA; Drewinko, B, y Swartzendruber, DE: Flow cytometry in clinical cancer research. Cancer Res, 43: 3982-3997, 1983.
5. Bauer, HCF: DNA cytometry of osteosarcomas. Acta Orthop Scand, 59 (suppl 228): 3-39, 1988.
6. Bauer, HCF: Current status of DNA cytometry in osteosarcoma. Cancer Treat Res, 62: 151-161, 1993.
7. Bauer, HCF; Kreicbergs, A, y Tribukait, B: DNA microspectrophotometry of bone sarcomas in tissue sections as compared to imprint and flow DNA analysis. Cytometry, 7: 544-550, 1986.
8. Bauer, HCF; Kreicbergs, A; Silfverswrd, C, y Tribukait B: DNA analysis in the differential diagnosis of osteosarcoma. Cancer, 61: 1430-1436, 1988.
9. Bauer, HCF; Kreiscbergs, A; Silfverswrd, C, y Tribukait, B: Ploidy and morphology in osteosarcoma. Anal Quant Cytol Histol, 11: 96-103, 1989.
10. Bauer, HC; Kreicbergs, A, y Silfversward, C: Prognostication including DNA analysis in osteosarcoma. Acta Orthop Scand, 60: 353-360, 1989.
11. Bentzen, SM; Poulsen, HS, y Kaae S: Prognostic factors in osteosarcomas: A regression analysis. Cancer, 62: 194-202, 1988.
12. Bsing, T; Roessner, A; Hidemann, W; Mellin, W, y Grundmann, E: Cytostatic effects on osteosarcomas as detected by flow cytometric DNA analysis after pre-operative chemotherapy according to the COSS 80/82 protocol. J Cancer Res Clin Oncol, 113: 369-375, 1987.
13. Brostrm, LA; Aparisi, T; Ingimarsson, S; Lagergren, C; Nilsonne, U; Strander, H, y Soderberg, G: Can historical controls be used in current clinical trials in osteosarcoma? Analysis of prognostic factors in a historical and a contemporary group. Int J Rad Oncol Phys, 6: 1711-1715, 1980.
14. Brostrm, L-A; Strander, H, y Nilsonne, U: Survival in osteosarcoma in relation to tumor size and location. Clin Orthop, 167: 250-254, 1985.
15. Buchner, T; Hiddemann, W; Wormann, B; Kleinemerier, B; Schumann, J; Gohde, W; Ritter, J; Muller, KM; VonBassewitz, DB, y Roessner, A: Differential pattern of DNA-aneuploidy in human malignancies. Pathol Res Pract, 179: 310-320, 1985.
16. Cox, DR: Regression models and life-tables. J R Stat Soc, 34: 187-220, 1972.
17. Dahlin, DC, y Coventry, MB: Osteogenic sarcoma: A study of six hundred cases. J Bone Joint Surg, 49A: 101-110, 1967.
18. El-Naggar, AK; Hurr, K; Nora Tu, Z; Teague, K; Raymond, KA; Ayala, AG, y Murray, J: DNA and RNA content analysis by flow cytometry in the pathobiologic assessment of bone tumors. Cytometry, 19: 256-262, 1995.
19. Enneking, WF; Spanier, SS, y Goodman, MA: A system of staging musculoskeletal neoplasms. Clin Orthop, 153: 106-120, 1980.
20. Fodisch, HJ; Mikuz, G, y Walter, N: Zytophotometrische untersuchungen an knochenges schwulsten. Verh Dtsch Ges Pathol, 58: 425-429, 1974.
21. Frankfurt, OS; Arbuck, SG, y Chin, JL: Prognostic applications of DNA flow cytometry for human solid tumors. Ann NY Acad Sci, 468: 276-290, 1986.
22. Friedlander, ML; Hedley, DW, y Taylor, JW: Clinical and biological significante of aneuploidy in human tumours. J Clin Pathol, 37: 961-974, 1984.
23. Gebhardt, MC; Lew, RA; Bell, RS; Baldini, N; Litwak, G, y Mankin, HJ: DNA ploidy as a prognostic indicator in human osteosarcoma. Chir Organi Mov, 75: 18-21, 1990.
24. Glasser, DB; Lane, JM; Huvos, AG; Marcove, RC, y Rosen, G: Survival, prognosis, and therapeutic response in osteogenic sarcoma. The Memorial Hospital experience. Cancer, 69: 698-708, 1992.
25. Harvei S, y Solheim, O: The prognosis in osteosarcoma: Norwegian national data. Cancer, 48: 1719-1723, 1981.
26. Helin, H; Karaharju, E, y Nordling, A: Flow cytometric determination of DNA content in malignant and benign bone tumours. Cytometry, 6: 165-171, 1985.
27. Hedley, DW; Friedlander, ML, y Taylor, IW: Method for analysis of paraffin-embedded pathological material using flow cytometry&