Los procedimientos de Cirugía Ortopédica y Traumatología están asociados a pérdidas de sangre importantes que implican la necesidad de transfundir concentrados hemáticos y derivados de sangre homóloga al paciente1. Merecen ser destacadas las artroplastias de cadera y de rodilla, las artrodesis raquídeas complejas y las intervenciones para la exéresis de tumores2-5. Uno de los objetivos principales en el manejo de los pacientes sometidos a este tipo de cirugía es la reducción de pérdidas sanguíneas y la disminución consiguiente de la necesidad de transfundir sangre alogénica6.
A pesar de los progresos realizados no deja de ser importante la cantidad de complicaciones que pueden asociarse a las transfusiones (transmisión de agentes infecciosos, reacciones inmunológicas inmediatas, reacciones inmunológicas tardías y otros tipos de reacciones no inmunológicas)7,8. Se deben aplicar técnicas que permitan un menor empleo de hemoderivados homólogos, tanto disminuyendo el sangrado perioperatorio como maximizando el aprovechamiento de los hemoderivados administrados. Estas medidas pueden afectar a diferentes niveles, integrando tanto un replanteamiento de las indicaciones de transfusión, como programas de transfusión autóloga, técnicas de hipotensión controlada, sistemas de recuperación de sangre o empleo de diferentes fármacos para minimizar las pérdidas sanguíneas. Uno de estos fármacos es la aprotinina8,9.
La aprotinina es una sustancia inhibidora de las proteasas de amplio espectro, con gran variedad de efectos sobre el sistema de la coagulación, función plaquetaria e inflamación10. Se encuentra en los mastocitos de los mamíferos, y en muchas otras especies animales. El mecanismo exacto mediante el cual la aprotinina ejerce su función hemostática no es del todo conocido, y presenta múltiples interrogantes difíciles de responder en la actualidad10,11.
La aprotinina está indicada para reducir la hemorragia y las necesidades transfusionales durante el perioperatorio de intervenciones de cirugía cardíaca en particular12,13, y en general en pacientes con alto riesgo de pérdida hemática importante. La utilización de la aprotinina no está exenta de riesgos o efectos secundarios, y su utilización persigue un objetivo que quizás podría obtenerse mediante la aplicación de métodos alternativos más seguros14. Los efectos adversos más importantes atribuidos a la aprotinina son la posibilidad de desencadenar fenómenos tromboembólicos2,13,15, alteraciones de la función renal5 y reacciones alérgicas16-18. Generalmente se tolera bien, pero al administrarse por una vía periférica se puede producir ocasionalmente tromboflebitis local.
El objetivo de este estudio es evaluar el efecto de la utilización de la aprotinina sobre el sangrado postoperatorio de la prótesis total de cadera (PTC).
MATERIAL Y MÉTODO
Selección de pacientes
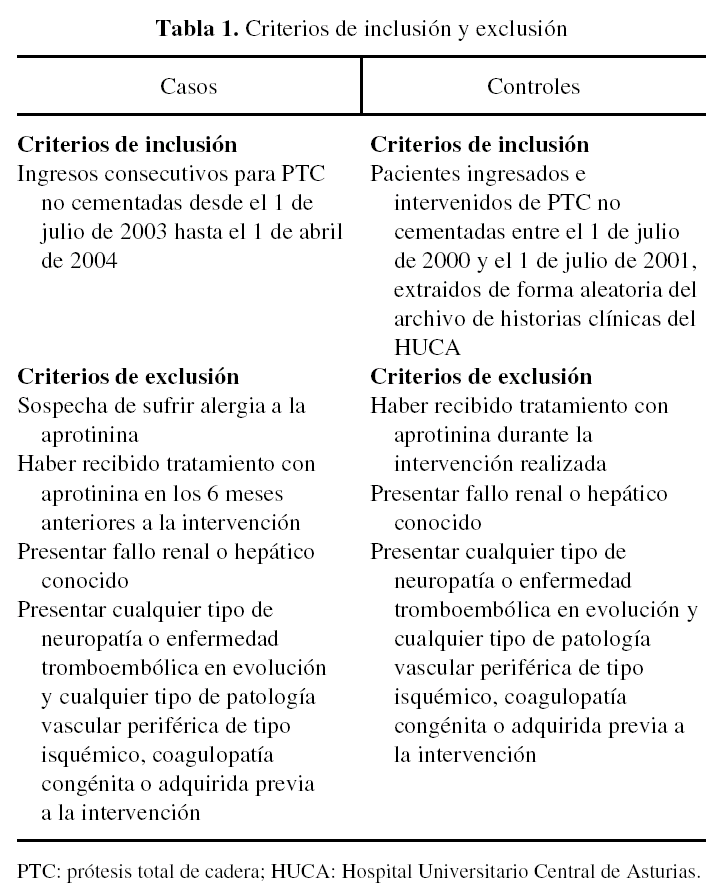
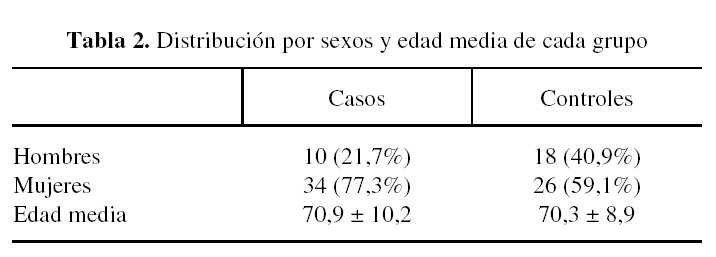
Se contó con un grupo de 88 pacientes, 28 hombres y 60 mujeres de edades comprendidas entre los 50 y los 92 años a los que se realizó una artroplastia total primaria de cadera. De esta muestra 44 pacientes (34 mujeres [77,3% del grupo] y 10 hombres [22,7% del grupo]), constituyeron el grupo de casos a los que se les administró el fármaco. Éstos tenían una media de edad de 70,9 ± 10,2 años, con un rango de 50 a 92 años. Los pacientes del grupo de casos se obtuvieron a partir de los ingresos consecutivos que se produjeron en nuestro centro para la realización de una PTC a partir del 1 de julio de 2003 hasta el 1 de abril de 2004, según los criterios de inclusión previamente establecidos que se resumen en la tabla 1. Los restantes 44 pacientes fueron el grupo control (26 mujeres [59,1% del grupo] y 18 hombres [40,9% del grupo]). En el grupo control la media de edad fue de 70,3 ± 8,9 años, con un rango de 54 a 84 años. Estos pacientes se extrajeron de forma aleatoria del archivo de historias clínicas del hospital entre los intervenidos de PTC desde el 1 de julio de 2000 hasta el 1 de julio de 2001. Los criterios de inclusión de pacientes en el grupo de controles se resumen en la tabla 1. No se encontró significación estadística para la diferencia de edades y sexos entre ambos grupos (tabla 2).
Administración de aprotinina
La técnica anestésica fue de tipo locorregional en 12 casos (27,3% de los casos) y 19 controles (43,2% de los controles) y general en 32 casos (72,7% de los casos) y 25 controles (56,8% de los controles). La diferencia en cuanto al tipo de anestesia que se practicó a cada paciente en uno y otro grupo fue pequeña y no resultó estadísticamente significativa. Sin embargo es sabido que debido a la vasoplejia secundaria a la anestesia regional de los miembros inferiores, el sangrado quirúrgico puede verse algo disminuido respecto al que se produce en una anestesia general. Esta circunstancia podría haber favorecido al grupo de controles, aunque como veremos, este hecho no alteró las conclusiones finales.
Tras la anestesia comenzó a administrarse el fármaco al grupo de casos: 10 minutos antes de iniciar la dosis terapéutica de aprotinina se procedió a inyectar vía intravenosa una dosis de prueba de 1 ml equivalente a 10.000 unidades de inhibición de kalicreína (KIU), con la finalidad de descartar la aparición de reacciones adversas al fármaco. A continuación, y una vez comprobado que no se produjeron reacciones adversas a los 10 minutos de administrar al paciente la dosis de prueba, se inició la administración de la dosis terapéutica de aprotinina, consistente en 2.000.000 KIU en inyección intravenosa lenta. Acabada esta dosis los pacientes no recibieron más cantidad de aprotinina en el tiempo que duró la intervención y su estancia en el hospital. El grupo control no recibió ninguna dosis del fármaco.
El empleo de aprotinina en cirugía ortopédica mayor (COM) se introdujo en nuestro hospital en julio de 2001 por iniciativa del Servicio de Anestesiología, tras ser valoradas con el equipo de cirujanos del Servicio de Cirugía Ortopédica y Traumatología del centro sus posibles aportaciones a nuestro campo, así como los posibles riesgos de los que se hace mención en la bibliografía. Actualmente se administra aprotinina a todos los pacientes a los que se les realiza una artroplastia de cadera o de rodilla, y recientemente se ha introducido para su utilización en intervenciones de columna vertebral. Las contraindicaciones para el empleo de aprotinina en COM se corresponden con los criterios de exclusión que asumimos para la incorporación de pacientes a nuestro estudio (tabla 1).
Todos los pacientes fueron informados acerca del tipo de intervención que se les iba a realizar, de la anestesia que se les iba a practicar, así como de la utilización de aprotinina, descartando previamente la presencia de alguno de los factores que contraindica su utilización.
El tiempo quirúrgico medio en el grupo de casos fue de 90,7 ± 25 (150 50) minutos. El tiempo quirúrgico medio en el grupo de controles fue de 94,8 ± 23 (155 60) minutos. No se apreciaron diferencias estadísticamente significativas en el tiempo quirúrgico entre uno y otro grupo.
Profilaxis antitrombótica y enfermedad tromboembólica
Todos los pacientes incluidos en el estudio, casos y controles, recibieron como tratamiento profiláctico frente a la enfermedad tromboembólica una dosis diaria de 40 mg de enoxaparina, administrada mediante inyección subcutánea en el abdomen desde el momento del ingreso 12 horas antes de la intervención, hasta pasadas 4 semanas desde la misma. El tratamiento con aprotinina no ha ocasionado necesidad de modificar el protocolo de profilaxis del tromboembolismo de nuestro centro respecto a lo que se tiene establecido para el resto de pacientes a los que se les realiza una artroplastia total de cadera sin la participación de este fármaco. Todas las incidencias postoperatorias relativas a la aparición síntomas y signos de flebitis o enfermedad tromboembólica fueron registradas diariamente en el curso clínico de la historia clínica de cada paciente (inflamación o incremento del diámetro de la pierna y muslo, dolor a la palpación, enrojecimiento local de la piel). Sólo se solicitó exploración con eco-doppler en aquellos pacientes con sospecha clínica de estar desarrollando esta patología. A los pacientes que cursaron con un postoperatorio sin incidencias no se les realizó ninguna otra prueba accesoria. Todos los pacientes del estudio fueron revisados al mes y a los tres meses de la intervención, y a los controles revisados en esas citas se les interrogó y exploró para descartar nuevamente esta afección.
Intervención
El diagnóstico que motivó la intervención fue mayoritariamente coxartrosis (39 casos [88,6% del grupo] y 40 controles [90,9% del grupo]). Otros diagnósticos fueron fractura de cuello femoral (tres casos [6,8% del grupo] y dos controles [4,5% del grupo]), necrosis avascular de cabeza de fémur (un caso [2,3% del grupo] y un control [2,3% del grupo]) y artritis reumatoidea (un caso [2,3% del grupo] y un control [2,3% del grupo]).
La vía de abordaje empleada mayoritariamente fue la anterolateral con el paciente en decúbito supino en 35 casos (79,5% de los casos) y 40 controles (90,9% de los controles). El resto de los pacientes fueron intervenidos por vía posterolateral con el paciente en decúbito lateral (9 casos [20,5% de los casos] y 4 controles [9,1% de los controles]). Las diferencias en cuanto al tipo de vía utilizada no fueron estadísticamente significativas. Todos los componentes de las prótesis implantadas se fijaron sin cementar.
Parámetros analizados
Para el estudio se consideraron los valores de hemograma, hematocrito y plaquetas obtenidos en cada paciente en 4 momentos diferentes. La primera muestra fue la extracción preoperatoria; la segunda muestra se extrajo en la sala de reanimación, en la que el equipo de anestesiología mantuvo los pacientes en observación durante las primeras horas del postoperatorio hasta decidir el traslado a la planta de hospitalización. El siguiente hemograma se obtuvo a la llegada a planta de hospitalización entre las 6 y las 12 horas tras la intervención. La última muestra se extrajo a las 24 horas de la intervención. Nuestra intención al comparar estos hemogramas era comprobar si existían diferencias entre los valores de hemoglobina y hematocrito postoperatorios obtenidos en uno y otro grupo.
Se contabilizó la cantidad de concentrados de hematíes administrada a cada paciente. Los criterios para la realización de transfusiones a los pacientes intervenidos fueron los habituales para pacientes quirúrgicos del Servicicio de Cirugía Ortopédica y Traumatología, de acuerdo con las indicaciones generales del Servicio de Hematología de nuestro centro, que se resumen como una combinación de los siguientes aspectos:
1. Concentración de hemoglobina postoperatoria por debajo de 9 g/dl.
2. Situación hemodinámica del paciente.
3. Relación entre el valor de hemoglobina postoperatoria respecto al preoperatorio.
4. Volumen de sangre y exudado recogido en los drenajes de Redón durante las primeras 12 horas superior a 500 cc.
5. Situación basal del paciente y procesos patológicos concomitantes.
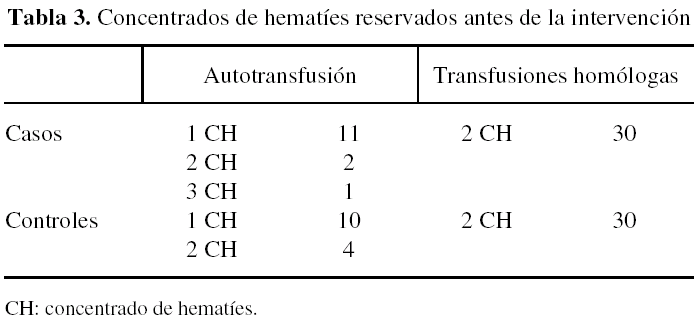
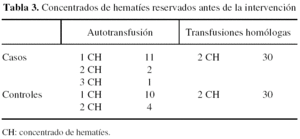
De los 88 pacientes estudiados, 14 casos y 14 controles contaban con concentrados de hematíes autólogos por haber sido incluidos en el programa de autotransfusiones del Servicio de Hematología para intervenciones de Cirugía Ortopédica. De los 14 casos en programa de autotransfusiones 11 tenían reservado 1 concentrado, dos tenían reservados 2 concentrados y uno tenía reservados 3 concentrados de sangre autóloga. De los 14 pacientes del grupo de controles 10 tenían reservados 1 concentrado y 4 tenían reservados 2 concentrados de sangre autóloga. Los restantes 60 pacientes (30 casos y 30 controles) contaban con reserva de hemoderivados homólogos del programa convencional para este tipo de cirugía (tabla 3).
También se contabilizaron los volúmenes de sangre y exudados recogidos en los drenajes de Redón.
Para el estudio estadístico se empleó el paquete informático SPSS 11.01 para Windows. Se realizó una estadística descriptiva de todas las variables analizadas. Las variables cualitativas se compararon mediante tablas de contingencia aplicando la prueba χ2 y exacto de Fischer. Para las variables numéricas se aplicó la prueba de la «t» de Student de muestras relacionadas. Para comparar grupos se utilizaron las pruebas de Kruskal-Wallis y Mann-Whitney. Se establecieron como significativos los valores de p < α = 0,05.
RESULTADOS
Hemoglobina, hematocrito y plaquetas
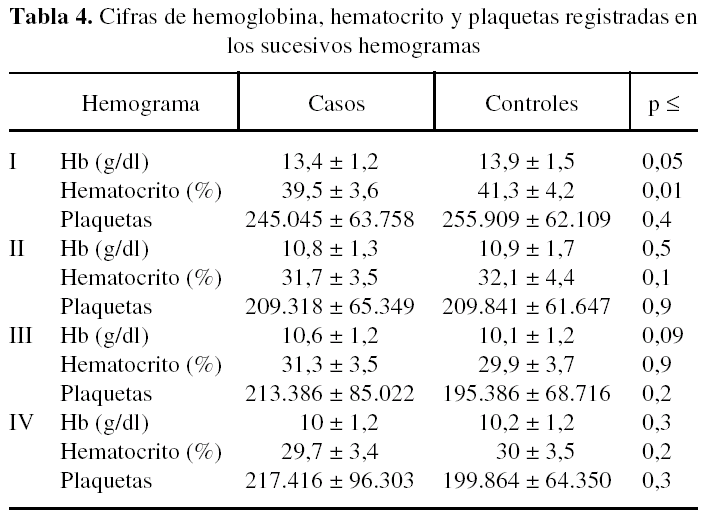
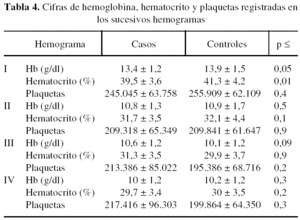
El hemograma preoperatorio del grupo de casos mostraba una cifra de hemoglobina media de 13,4 ± 1,2 g/dl [11,1-16,5], con un hematocrito medio de 39,5 ± 3,6% [32,5-48,5] y una cifra media de plaquetas de 245.045 ± 63.758. En el grupo de controles el hemograma preoperatorio presentaba una cifra de hemoglobina media de 13,9 ± 1,5 g/dl [10,4-17], un hematocrito medio de 41,3 ± 4,2% [31,9-50,1] y una cifra media de plaquetas de 255.909 ± 62.109. No se encontró significación estadística para las diferencias de hemoglobina (p ≤ 0,05) y plaquetas (p ≤ 0,4) del hemograma preoperatorio entre los dos grupos. La diferencia entre los hematocritos del preoperatorio fue significativa para p ≤ 0,02, siendo mayor el valor de hematocrito en el grupo de controles respecto al de casos (tabla 4). Atribuimos esta diferencia a que en el grupo de controles el número de pacientes varones (10 pacientes [22,7% del grupo]) fue algo superior que en el de casos (18 pacientes [40,9% del grupo]). Dado que la comparación de las diferencias entre sexo y valores de hemoglobina no resultó estadísticamente significativa, consideramos ambas muestras comparables desde este punto de vista.
En el hemograma realizado cuando el paciente llega a la sala de reanimación después de la intervención, el grupo de casos presentaba una hemoglobina media de 10,8 ± 1,3 g/dl [7,7-13,5], con un hematocrito medio de 31,7 ± 3,5% [236,4-38,2] y unas plaquetas de 209.318 ± 65.349. Este mismo hemograma de los controles presentaba una hemoglobina media de 10,9 ± 1,7 [7,8-16,7] g/dl, un hematocrito medio de 32,1 ± 4,4% [23,2-40,8] y una cifra media de plaquetas de 209.841 ± 61.647. No se encontró significación estadística para los hemogramas obtenidos en esta fase del estudio en relación con el valor de hemoglobina (p ≤ 0,5), hematocrito (p ≤ 0,1) o número de plaquetas (p ≤ 0,9) (ta-bla 4).
En el hemograma realizado cuando el paciente llega a la planta de hospitalización entre 6 y 12 horas después de la intervención, el grupo de casos tenía una cifra media de hemoglobina de 10,6 ± 1,2 g/dl (8,6-14,3), un hematocrito medio de 31,3 ± 3,5% (24,9-41,6) y una cifra media de plaquetas de 213.386 ± 85.022. Los resultados obtenidos en este mismo hemograma realizado al grupo de controles reflejaron una hemoglobina media de 10,1 ± 1,2 g/dl (7,7-12,7), con un hematocrito medio de 29,9 ± 3,7% (22,6-36,9) y una cifra media de plaquetas de 195.386 ± 68.716. No se encontraron diferencias estadísticamente significativas para los valores de hemoglobina (p ≤ 0,09), hematocrito (p ≤ 0,9) y plaquetas (p ≤ 0,2) obtenidos en este hemograma (tabla 4).
El último hemograma se realizó pasadas las primeras 24 horas de la intervención. En el grupo de casos se obtuvo un valor medio de hemoglobina de 10 ± 1,2 g/dl (7,6-13,2) con un hematocrito de 29,7 ± 3,4% (22,4-39) y un número de plaquetas de 217.416 ± 96.303. En el grupo de controles la hemoglobina media para este hemograma fue de 10,2 ± 1,2 g/dl (7,5-12,3) con un hematocrito medio de 30 ± 3,5 (22,1-35,8) y un número de plaquetas de 199.864 ± 64.350. No encontramos significación estadística en las diferencias recogidas entre los dos grupos para este hemograma (he-moglobina p ≤ 0,3; hematocrito p ≤ 0,2; plaquetas p ≤ 0,3) (tabla 4).
Drenajes
En todos los pacientes se dejaron drenajes de aspiración por vacío de tipo Redón. El primero de ellos subfascial, mientras que el segundo se dispuso entre el panículo adiposo del muslo y la propia fascia lata.
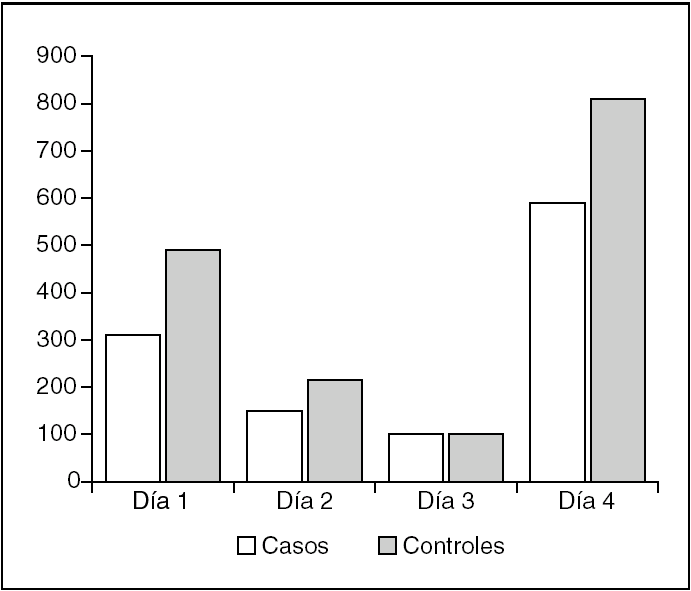
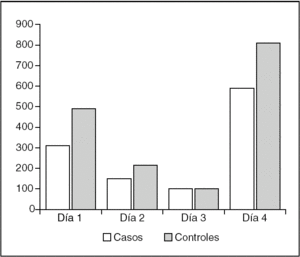
El volumen medio recogido en los drenajes del primer día del grupo de casos fue 326,7 ≤ 161 cc (40-800). El volumen medio recogido el primer día para el grupo de controles fue 490,2 ± 271,2 cc (0-1270). Se encontró diferencia estadísticamente significativa entre los resultados de ambos grupos con un nivel de significación de p ≤ 0,001. El segundo día se recogieron 155 ± 94,5 cc (0-440) como media en el grupo de casos, y 223,8 ≤ 264,5 cc (0-1300) en el grupo de controles. La diferencia hallada no fue estadísticamente significativa, aunque las pérdidas resultaron mayores en el grupo de controles. El tercer día el volumen medio recogido en los drenajes del grupo de casos fue 100,4 ± 97,5 cc (0-350) y en el grupo de controles esa misma medida fue 98,7 ± 70,8 cc (0-250). La diferencia entre los volúmenes drenados por ambos grupos el tercer día no resultó estadísticamente significativa. El volumen medio total recogido en los drenajes durante los días que permanecieron en los pacientes del grupo de casos fue 582,7 ± 272,9 cc (220-1450). En el grupo de controles el volumen medio recogido fue 815,1 ± 437,5 cc [0-1930]. La diferencia entre ambos volúmenes fue significativa para p ≤ 0,004 (fig. 1).
Figura 1. Volúmenes registrados en los drenajes de aspiración.
Concentrados de hematíes
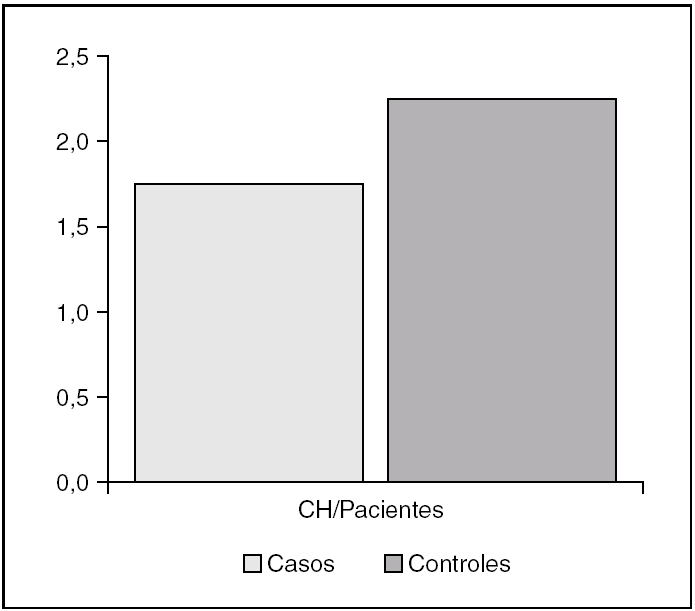
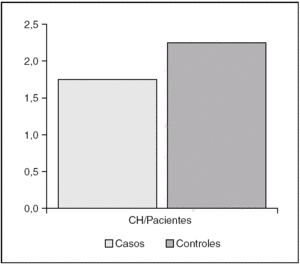
En el grupo de casos fue necesario transfundir a 31 pacientes (70,45% del grupo). Hubo 13 pacientes (29,54%) que no precisaron ser transfundidos. El número medio de concentrados de hematíes transfundidos por paciente en este grupo fue 1,3 ± 1,2. En el grupo de controles se transfundieron 40 pacientes (90,9% de los controles) y sólo 4 (9,1%) no precisaron transfusiones. El número medio de concentrados por paciente que recibió el grupo de controles fue 2,3 ± 1,4. La diferencia encontrada entre el número de concentrados de hematíes transfundidos por paciente en uno y otro grupo resultó significativa para p ≤ 0,001 (fig. 2).
Figura 2. Número medio de concentrados de hematíes (CH) transfundidos por cada paciente a lo largo del estudio.
Considerando de forma aislada las transfusiones autólogas, se transfundieron los 14 pacientes de cada grupo que estaban en el programa de autotransfusión, recibiendo los 18 concentrados que tenían reservados en total. La media de transfusiones autólogas del grupo de casos fue de 0,4 ± 0,7 concentrados de hematíes por paciente, igual que en el grupo de controles, que también recibieron una media de 0,4 ± 0,7 concentrados de hematíes por paciente.
En el grupo de casos, 21 pacientes (47,7%) recibieron transfusiones de hematíes homólogos mientras que 23 de los pacientes de este grupo (52,27%) no precisaron este tipo de transfusiones. En el grupo de controles hubo 35 pacientes que precisaron transfusiones homólogas (79,54%) frente a sólo 9 que no requirieron ser transfundidos con este tipo de hemoderivados (20,45% de los pacientes del grupo de control).
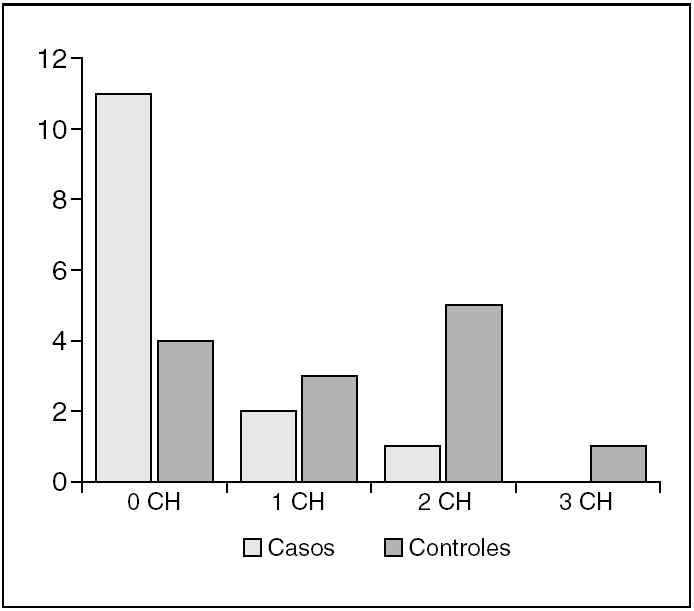
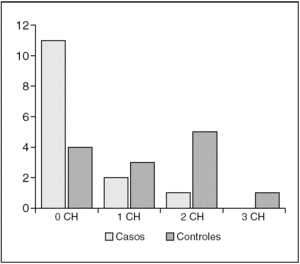
Considerando de forma aislada los 14 pacientes de cada grupo que estaban incluidos en programas de autotransfusión, hubo 11 pacientes del grupo de casos que no precisaron transfusiones homólogas accesorias (78,6% de los pacientes del grupo de casos en programa de autotransfusión) y tres de este grupo que precisaron transfusiones homólogas (21,42% de este grupo). De estos tres pacientes, dos fueron transfundidos con un concentrado homólogo y uno con dos concentrados homólogos adicionales a los de la autotransfusión. De los 14 pacientes del grupo de controles que se encontraban dentro del programa de autotransfusión, 10 (71,4% de los pacientes del grupo de controles en programa de autotransfusión) tuvieron que ser transfundidos con concentrados homólogos, y sólo 4 (28,57% de estos pacientes) no precisaron transfusiones accesorias. De los 10 pacientes del grupo de controles que precisaron transfusiones homólogas además de las autólogas, tres pacientes recibieron un concentrado, 6 recibieron 2 concentrados y uno fue transfundido con 3 concentrados de hematíes homólogos, además de los concentrados de autotransfusión (fig. 3).
Figura 3. Relación de concentrados homólogos (CH) transfundidos a pacientes incluidos en el programa de autotransfusión.
Momento en que se realiza la transfusión
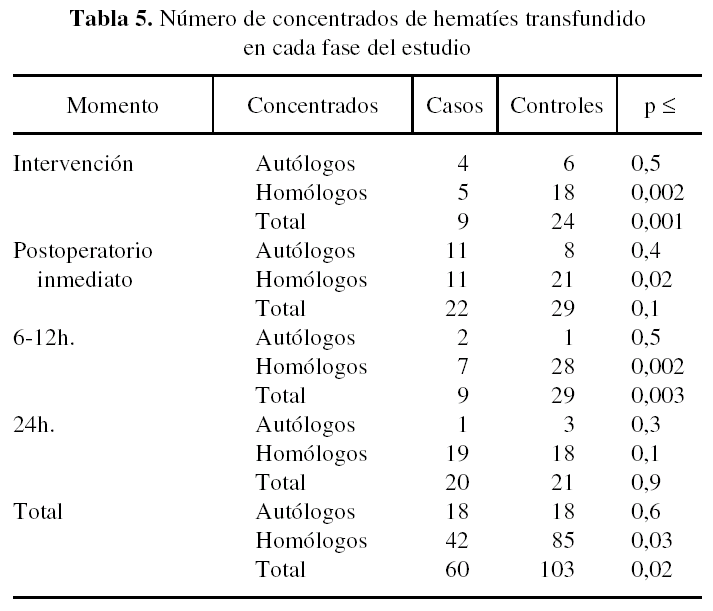
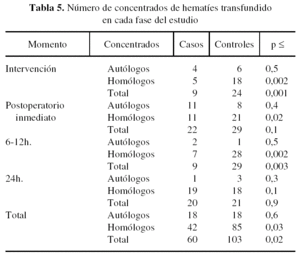
Respecto al momento en que se realiza la transfusión, durante la intervención quirúrgica y hasta la primera extracción de sangre postoperatoria en la sala de reanimación, en el grupo de casos se transfundieron 4 concentrados de autotransfusión y 5 concentrados homólogos (total: 9 concentrados de hematíes) mientras que en el grupo de controles se habían transfundido 6 concentrados autólogos y 18 homólogos (total: 24 concentrados de hematíes). La diferencia entre el número de concentrados de hematíes autólogos transfundidos no resultó estadísticamente significativa (p ≤ 0,5). Se obtuvo significación estadística para la diferencia entre el número de concentrados homólogos transfundida (p ≤ 0,002) y para el total de concentrados de hematíes transfundidos en este período (p ≤ 0,001) (tabla 5).
En el tiempo transcurrido entre la primera extracción de sangre postoperatoria en la sala de reanimación y la extracción de la segunda muestra en la planta de hospitalización, a las 6-12 horas de finalizada la intervención, se transfundieron 22 concentrados de hematíes al grupo de casos (11 concentrados autólogos y 11 homólogos) y 29 al grupo de controles (8 autólogos y 21 homólogos). No se encontraron diferencias estadísticamente significativas respecto al número de concentrados de hematíes autólogos (p ≤ 0,4) y totales (p ≤ 0,1) transfundidos en este período. Se encontró significación estadística respecto al número de concentrados de hematíes homólogos transfundidos (p ≤ 0,02) (tabla 5).
Entre la segunda extracción de sangre y la realizada a las 24 horas de la intervención, se transfundieron 9 concentrados de hematíes al grupo de casos (2 autotransfusión y 7 homólogos) y 29 al grupo de controles (1 concentrado autólogo y 28 homólogos). No se encontraron diferencias estadísticamente significativas respecto al número de concentrados de hematíes autólogos (p ≤ 0,5) transfundidos en este período. Se obtuvo significación estadística para la diferencia entre el número de concentrados homólogos transfundida (p ≤ 0,002) y para el total de concentrados de hematíes transfundidos en este período (p ≤ 0,003) (tabla 5).
Después de las 24 horas desde la intervención, y hasta el alta del paciente, se registraron 20 concentrados de hematíes transfundidos al grupo de casos (1 autólogo y 19 homólogos) frente a otros 21 transfundidos al grupo de controles (3 autólogos y 18 homólogos). No se encontraron diferencias estadísticamente significativas respecto al número de concentrados de hematíes autólogos (p ≤ 0,3), homólogos (p ≤ 0,1) y totales (p ≤ 0,9) transfundidos en este período (tabla 5).
DISCUSION
El sangrado perioperatorio es una preocupación para el cirujano durante la intervención, y también en el postoperatorio inmediato. Ésta preocupación es particularmente mayor en aquellas intervenciones en las que el riesgo de hemorragia es potencialmente más elevado, tales como las artroplastias en Cirugía Ortopédica1,8,19.
Existe una tendencia a disminuir el empleo de sangre homóloga mediante la utilización de técnicas diversas que van desde la predonación de sangre autóloga a la administración de fármacos hemostáticos, pasando por la aplicación de los más rigurosos criterios a la hora de decidir si la realización de una transfusión es realmente necesaria o no, incluso llegando a la aceptación de unas cifras menores de hemoglobina y hematocrito como válidas antes que proceder a trasfundir7,8,10.
La utilización de medicamentos como la aprotinina y otros agentes hemostáticos pueden contribuir a que este sangrado sea menor o más fácil de controlar, pero eso no supone que el cirujano esté por ello autorizado a descuidar la intervención, puesto que es bien sabido que la pérdida de sangre perioperatoria depende además de otros factores, como la experiencia del cirujano, su habilidad, la técnica quirúrgica empleada y el tipo de prótesis utilizada14.
No son muchas las referencias en la bibliografía acerca del empleo de aprotinina en intervenciones de cirugía ortopédica, y dentro de los que hay, la metodología aplicada en cada uno de ellos difiere, de modo que no es fácil hacer una comparación entre los resultados de aquellos, y los obtenidos en el presente trabajo. Encontramos algunas aportaciones sobre utilización de aprotinina en cirugía de rodilla8,16,20, cirugía de resección tumoral y en artroplastias de cadera4,5.
Hemoglobina y hematocrito
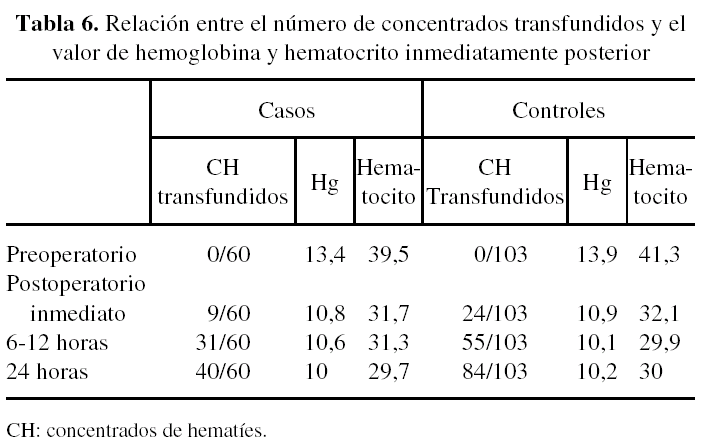
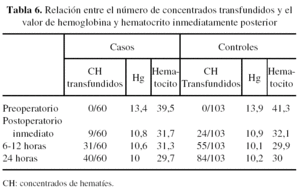
A lo largo de las primeras 24 horas del postoperatorio ambos grupos mantuvieron unos valores de hemoglobina y hematocrito comparables en cada uno de los hemogramas realizados. Encontramos diferencias sin embargo en cuanto al número de concentrados de hematíes que los pacientes recibieron previamente a la obtención cada hemograma. De este modo, antes del primer hemograma postoperatorio se había transfundido al grupo de controles un 62,5% más que al grupo de casos (tabla 6). Antes de la muestra que se extrajo entre las 6 y las 12 horas posteriores a la intervención se había transfundido un 24,1% más al grupo de casos frente al de controles (tabla 6). Y antes de extraerse el último hemograma, realizado a las 24 horas de la intervención, se había transfundido hasta un 68,9% más en el grupo control frente al grupo de casos (tabla 6).
Con estos datos, consideramos que la aprotinina tuvo un efecto sobre la preservación de la hemoglobina y hematocrito en el postoperatorio, necesitando los pacientes que recibieron este medicamento un menor número de transfusiones que el grupo control, para obtener unos valores finales semejantes. Este efecto debe producirse en función de la propiedad hemostática que se le atribuye al fármaco, que está presente desde que se inicia su administración, hasta pasadas las primeras 6-12 horas del postoperatorio7,10,11,15. Los resultados son comparables a los obtenidos por otros autores como Murkin et al.4 en revisiones de artroplastia total de cadera o artroplastia bilateral de cadera y Janssens et al.5, que estudió el efecto hemostático de la aprotinina aplicado a pacientes intervenidos de artroplastia total de cadera. Ambos apreciaron que las concentraciones de hemoglobina postoperatoria de los casos se mantuvieron en valores semejantes o incluso superiores respecto a los controles, con unos requerimientos transfusionales menores en el grupo que recibió la aprotinina.
Plaquetas
Una de las propiedades atribuídas a la aprotinina en la bibliografía es la de ejercer un cierto papel protector frente a la degradación de las plaquetas que se desencadena en situaciones de hipercoagulabilidad10. Este efecto no se ha podido identificar sin embargo en el ámbito de la cirugía ortopédica, pero sí en otras disciplinas como la cirugía cardíaca, en la que las plaquetas se ven sometidas al contacto con las paredes de los aparatos de circulación extracorpórea, y en donde sí es muy importante lograr una preservación de la función y número de plaquetas10,12. Con los resultados aquí obtenidos no podemos hacer ninguna conjetura a este respecto, pero hemos encontrado un número de plaquetas al final del estudio sensiblemente mayor en el grupo de casos.
Drenajes de Redón
Las diferencias en cuanto a volumen de exudados y sangre perdido en el postoperatorio fueron mayores durante las 24 primeras horas. El resto de días ambos grupos presentaron volúmenes poco significativos tanto desde el punto de vista clínico, como estadístico (como ya se apuntó en el apartado de resultados), aunque el segundo día postoperatorio el grupo de casos perdió hasta un 30,1% menos.
El uso de la aprotinina está muy extendido en cirugía cardíaca y en los trasplantes y resecciones hepáticos donde se utiliza para disminuir el sangrado y las necesidades transfusionales. Se han publicado diversos estudios aleatorizados en los que se demuestra una reducción en las pérdidas de sangre de los drenajes torácicos (cifrada según la bibliografía consultada entre el 35 y el 81%), de la cantidad total de sangre que es necesario trasfundir (reducciones estimadas entre el 35 y el 97%) y de la proporción total de pacientes que precisan de dicha transfusión (entre el 40 y el 88%) en el postoperatorio de intervenciones de cirugía torácica y del hígado2,11,14.
Concentrados de hematíes
Los resultados obtenidos en nuestro estudio nos ponen de manifiesto un efecto de la administración de aprotinina sobre la reducción de necesidades transfusionales globales del grupo de casos respecto al de controles. Los resultados obtenidos se encuentran en la línea de los reflejados en otras publicaciones4,5,21,22, en los que además se insiste en que los menores requerimientos transfusionales del grupo de casos respecto al de controles no resulta en anemia, dado que durante todo el postoperatorio las cifras de hemoglobina y hematocrito son siempre mayores en los pacientes que fueron medicados con aprotinina. Este hecho se pone también de manifiesto en nuestro estudio, en el que en todo momento se han mantenido unos valores de hemoglobina y hematocrito semejantes entre los dos grupos a pesar de las diferencias en el número de concentrados de hematíes transfundidos.
Otro aspecto importante es el relativo a la combinación de aprotinina con otros procedimientos encaminados al ahorro de sangre. En nuestro caso, incluimos en el estudio un grupo de pacientes del Programa de Autotransfusión del Servicio de Hematología de nuestro hospital. Se trataba de un grupo reducido, pero representativo de la proporción de pacientes que se someten actualmente a intervenciones de COM con programas de autodonación. Actualmente se acepta para estos pacientes que los criterios para prescribir la transfusión de sangre autóloga deben ser más permisivos, y no tan restrictivos como los que se emplean para las transfusiones de sangre homóloga. El motivo es que las complicaciones asociadas a la transfusión de sangre del propio paciente son en proporción insignificantes en relación a las que potencialmente puede provocar la transfusión alogénica6-9.
Teníamos el mismo número de pacientes, y en conjunto el mismo número de concentrados de hematíes autólogos reservados en los dos grupos. No encontramos diferencias entre los dos grupos respecto a las transfusiones autólogas (se transfundieron los 18 concentrados en los dos grupos). Sí que encontramos diferencias sin embargo en cuanto al número de concentrados homólogos transfundidos a este conjunto de pacientes y consideramos que es una parte especialmente interesante del estudio, puesto que esto demuestra que son los pacientes que más pueden beneficiarse del empleo de aprotinina.
Considerando el conjunto de pacientes que estaban incluidos en programa de autotransfusión sólo un 21,42% de los casos de este conjunto de pacientes fueron transfundidos con sangre alogénica, además de la autóloga mientras que un 71,4% de los pacientes del grupo de controles tuvieron que ser transfundidos con concentrados homólogos.
La aprotinina debe considerarse como un complemento para otras medidas encaminadas al ahorro de sangre y la reducción de las transfusiones alogénicas en el postoperatorio de los pacientes quirúrgicos. Una de las terapias a las que complementa de forma adecuada es la de los programas de autotransfusión, en la que se dispone de un número limitado de concentrados de sangre autóloga. Slappendel et al23 proponen un algoritmo para reducir la utilización de sangre alogénica, en el cual consideran indicada la administración de aprotinina cuando las expectativas de pérdidas sanguíneas están por encima de 1,5l. Nosotros no hemos ponderado las pérdidas totales intra y postoperatorias, pero sin duda puede considerarse que en una PTC estan en torno a 1l y en todo caso por debajo de 1,5l. Hemos encontrado beneficios en la utilización de aprotinina en estas circunstancias, pero eso no quiere decir que no se pueda delimitar de forma más precisa sus indicaciones en COM.
Complicaciones
Durante la realización del estudio y seguimiento de los casos no se notificaron complicaciones graves o efectos adversos atribuibles a la administración del fármaco.
Complicaciones vasculares
No se dieron casos de trombosis venosa profunda ni tromboembolismo clínicamente valorable en ninguno de los dos grupos. No se solicitaron estudios accesorios en ningún paciente del estudio. Son varias las referencias en la bibliografía en las que encontramos sistematizado el estudio con ultrasonografía de los miembros inferiores en pacientes tratados con aprotinina durante el postoperatorio de intervenciones de COM, sin hallazgos de lesión subclínica1,4,10. Nosotros no hemos considerado necesario realizar sistemáticamente este procedimiento. Tampoco se presentaron casos de tromboflebitis en las zonas próximas a las vías de administración intravenosa de medicación.
En uno de los trabajos publicados en los que se estudiaba el efecto de la aprotinina en la artroplastia total de rodilla (Thorpe et al13), los autores interrumpieron el estudio porque en un paciente con antecedentes de enfermedad vascular periférica se dio una trombosis arteriovenosa con isquemia aguda del miembro intervenido que precisó la amputación de la extremidad afecta. Aunque no se logró establecer una relación causa-efecto entre la administración de la aprotinina, el tipo de cirugía realizada y la complicación que se presentó, dados los antecedentes de ese paciente, los autores del artículo recomendaron precaución cuando se aplica un torniquete de isquemia en combinación con este tipo de medicación antifibrinolítica2,13.
Es muy importante alcanzar un nivel adecuado de aprotinina en plasma para disminuir el riesgo de aparición de esta tendencia trombótica. Es conocido que las concentraciones plasmáticas necesarias para inhibir la tripsina, la plasmina o la calicreína son diferentes (desde 50 KIU/ml para la plasmina hasta 200 KIU/ml para la kalicreína)11. Si administramos dosis por las que únicamente se alcancen valores inhibidores de la plasmina, la acción de la aprotinina será exclusivamente antifibrinolítica; si las dosis son mayores y los valores sanguíneos del fármaco suficientes, se producirá una inhibición de la kalicreína que bloqueará el sistema de contacto, y por tanto inhibirá la vía intrínseca de la coagulación actuando de esta manera como protector frente al riesgo de desarrollar una trombosis venosa profunda2,15,22.
Función renal
No se registraron alteraciones significativas de la función renal en ninguno de los pacientes incluidos en el estudio. Algunas publicaciones hacen referencia a posibles interferencias de la aprotinina con la función del riñón. Se trata de un efecto transitorio y reversible de escasa importancia clínica en pacientes en los que la función renal está conservada previamente, pero que puede ser importante en otros casos con nefropatías, como por ejemplo la diabética10. En nuestro caso, todos los pacientes estudiados tenían una función renal normal antes de iniciarse el estudio, y ninguno de los pacientes a los que se les administró aprotinina presentó valores de función renal fuera de lo aceptable para la normalidad al finalizar el mismo.
Reacciones alérgicas
La forma de presentación clínica más frecuente de reacción alérgica tras la administración de aprotinina es el prurito o el rash cutáneo. En ocasiones se identifican estos síntomas tras administrar la dosis test de aprotinina, por lo que se suspende la administración del medicamento. La forma más grave de presentación es el shock anafiláctico.
El porcentaje de complicaciones registradas y atribuibles a la utilización de aprotinina en el conjunto de intervenciones del Servicio de Cirugía Ortopédica y Traumatología de nuestro centro se corresponde con lo que se refleja en la bibliografía, que establece un 1% para el conjunto de complicaciones alérgicas (incluyendo desde el rash cutáneo hasta el shock anafiláctico) y en un 0,1% para la reacción tipo shock anafiláctico16-18.
En ninguno de los pacientes de nuestro estudio se produjo reacción alérgica atribuible a la administración de la dosis de prueba de aprotinina ni a la administración de la dosis terapéutica de la misma10,14. Tampoco hubo en el estudio pacientes a los que se hubiera administrado este fármaco en alguna ocasión anterior, susceptibles de haber presentado alguna complicación anafiláctica al administrarles el medicamento16-18.
Costes derivados de la utilización de aprotinina
Un aspecto importante para decidir la utilización de una nueva terapia es la valoración de los costes que puede suponer para el sistema sanitario. En el caso de la aprotinina podemos hacer una aproximación de estos costes sobre los resultados obtenidos en nuestro estudio. El precio de mercado de un frasco de 50 ml (500.000 KIU) de aprotinina es de aproximadamente 36 euros. Según la pauta de administración de este fármaco en nuestro hospital se precisan 4 frascos de 50 ml para el tratamiento completo de un paciente del grupo de casos (36 × 4 = 144 euros por tratamiento). La cuantificación del valor económico de un concentrado de hematíes es más compleja y viene a ser más bien una estimación, puesto que el coste real es incalculable y varía entre hospitales. En nuestro centro se estima que un concentrado de hematíes homólogo puede valorarse en 200 euros, incluyendo todos los gastos de procesamiento. El precio de un concentrado de hematíes autólogo es aproximadamente de 100 euros. Si tenemos en cuenta que cada paciente del grupo de casos recibió una media de 0,9 concentrados de hematíes homólogos (aproximadamente 180 euros/paciente) y una media de 0,4 concentrados autólogos (aproximadamente 40 euros/paciente) más 144 euros del tratamiento con aprotinina, el coste por paciente del grupo de casos vino a ser de unos 364 euros. En el grupo de controles se trasfundió una media de 1,9 concentrados de hematíes homólogos (con un coste aproximado de 380 euros/paciente) y 0,4 concentrados autólogos (aproximadamente 40 euros/paciente). Según esto, el coste aproximado por paciente en el grupo de controles habría sido de 420 euros.
Una alternativa a la aprotinina es el ácido tranexámico. No tenemos experiencia con su utilización en nuestro servicio. Sin embargo, las referencias bibliográficas revisadas muestran resultados contradictorios, unos presentando una reducción importante del sangrado postoperatorio en los pacientes tratados con ácido tranexámico como Ekback et al24, y otros en los que no se muestra un efecto diferente al del grupo placebo en cuanto a las pérdidas sanguíneas o requerimientos transfusionales, como Garneti et al25.
CONCLUSIONES
Las conclusiones que obtenemos del presente estudio son:
1. La administración de aprotinina en la artroplastia total de cadera se asoció a una disminución de las necesidades transfusionales globales respecto a un grupo control.
2. Los menores requerimientos transfusionales del grupo que recibió la aprotinina no supuso unos valores medios inferiores de hemoglobina, hematocrito o plaquetas postoperatorios respecto al grupo control, sino que por el contrario se mantuvieron en unas cifras semejantes en los dos grupos.
3. Los pacientes en programa de autotransfusión a los que se administró la aprotinina recibieron menos transfusiones de sangre alogénica que los del grupo control.
4. Los pacientes tratados con aprotinina sufrieron menores pérdidas de sangre y exudados en los drenajes que los pacientes a los que no se les administró el medicamento.
AGRADECIMIENTOS
A E. Fernández Bustillo del Departamento de Estadística del Hospital Universitario Central de Asturias; a C. Díaz Fernández, J. Fernández Fernández, C. García García y MJ. Rodríguez Dintén del Servicio de Anestesiología y Reanimación del Hospital Universitario Central de Asturias.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.
Correspondencia:
E. López-Anglada Fernández.
C/ Leopoldo Alas, 4. 1.o C.
33008 Oviedo. Asturias.
Correo electrónico: elanglada@terra.es
Recibido: diciembre de 2004.
Aceptado: septiembre de 2005.