Conocer la utilización de recursos sanitarios y los costes asociados al diagnóstico y tratamiento de la trombosis y sangrado en pacientes intervenidos de artroplastia primaria total de cadera (ATC) o rodilla (ATR), durante 3 meses de seguimiento.
Pacientes y métodoEstudio observacional de carácter multicéntrico y retrospectivo, realizado a partir de los registros médicos de pacientes pertenecientes a 3 centros hospitalarios-públicos españoles (año 2010). Se consideraron aleatoriamente 3 grupos de pacientes: a) control (sin complicaciones hospitalarias); b) sangrado, y c) trombosis. Se incluyeron variables generales, de utilización de recursos y sus costes. Análisis estadístico: regresión logística y ANCOVA, p<0,05.
ResultadosSe incluyeron pacientes ≥ 40 años y que hubieran recibido profilaxis anticoagulante. Se incluyó un total de 141 pacientes (control: 60; sangrado: 60; y trombosis: 21). La edad media fue de 68,7 (DE: 10,4) años y el 68,1% fueron mujeres. La ATR fue la técnica más frecuente (71,6%). El riesgo de sangrado se relacionó con la edad (OR=1,1) y el de trombosis con la EPOC (OR=1,8), p<0,05. El promedio de días de estancia de los grupos de trombosis, sangrado y control fue de 13,9; 11,5 y 7,4 días, respectivamente, p<0,001). Los costes totales fueron: 10.484,3 €; 8.766,4 €, y 6.496,1 €, respectivamente, p<0,05. Todos los resultados agrupados fueron comparables entre ellos según el hospital analizado y el tipo de artroplastia.
ConclusionesLos costes más elevados se producen en los pacientes que habían desarrollado una trombosis y sangrado, respectivamente. Los costes se relacionaron con la prolongación de los días de estancia y las infecciones intrahospitalarias.
To determine the use of healthcare resources and costs associated with the diagnosis and treatment of thrombosis and bleeding patients who have undergone elective hip or knee replacement surgery, in routine clinical practice conditions.
Patients and methodsThis multicentre observational and retrospective study extracted data from the medical records of three Spanish public hospitals (2010). Patients ≥ 40 years who had received prophylaxis-anticoagulation were included. They were randomised into three groups: a) control (no hospital complications), b) bleeding, and c) thrombosis. General variables, use of resources and costs were analysed. Statistical analysis: logistic regression and ANCOVA for model correction, (P<.05) was included.
ResultsA total of 141 patients (control: 60; bleeding: 60; and thrombosis: 21), with a mean age 68.7 (SD: 10.4) years, and 68.1% females were identified. Hip arthroplasty was more frequent (71.6%). The bleeding risk was associated with age (OR=1.1) and thrombosis with COPD (OR=1.8); P<.05). The average length of stay for the thrombosis, bleeding and control groups was 13.9, 11.5 and 7.4 days, respectively; P<.001). The total costs for each group were €10,484.3; €8,766.4 and €6,496.1 respectively; P<.05. All grouped results were comparable between them according to the hospital analysed and the type of replacement.
ConclusionsCosts were higher for thrombosis and bleeding patients, respectively. Costs were associated with length of stay and hospital-acquired infections.
La trombosis venosa profunda (TVP) y la tromboembolismo pulmonar (TEP) son denominadas genéricamente con el término de enfermedad tromboembólica venosa (ETV) y constituyen un importante problema de salud pública, ya que cada año afectan a varios millones de personas en el mundo1,2. Ambas enfermedades son relativamente frecuentes en pacientes hospitalizados, tanto médicos como quirúrgicos, y también en pacientes que han sido dados de alta recientemente3,4. Los datos disponibles en nuestro país, basados en los registros del Grupo de Estudio de Tromboembolismo Venoso y del Registro Informatizado de Pacientes con Enfermedad Tromboembólica, indican que la incidencia de TVP es de unos 116 casos por cada 100.000 habitantes5. Otros estudios nos indican que la mortalidad de pacientes con TVP es del 2,2% a los 3 meses, y del 7,8% en el caso de la TEP6. La estancia media hospitalaria de los pacientes que desarrollan un episodio de TEP es superior a 11 días y 8 días en los pacientes con TVP7.
Uno de los grupos con mayor riesgo de desarrollar un episodio de TVP/TEP lo constituyen los sujetos sometidos a cirugía ortopédica o pélvica (traumatología, urológica y ginecológica)8. La cirugía ortopédica incluye la artroplastia de cadera (ATC), la artroplastia de rodilla (ATR) y la cirugía por fractura de cadera. La incidencia de TVP sin profilaxis oscila entre el 40-60% (el 10-30% corresponde a TVP proximal). Respecto a la incidencia de TEP, se ha descrito que el 3-28% de los pacientes presenta TEP en las gammagrafías practicadas en las 2 semanas siguientes a la cirugía9,10. Por ello, la profilaxis en este tipo de cirugía está sistemáticamente establecida en la mayoría de los pacientes11,12. En general, se considera profilaxis adecuada cuando se efectúa en pacientes mayores de 21 años, con cualquier tipo de heparina (no fraccionada [HNF] o de bajo peso molecular [HBPM]), se utilizan dosis adecuadas para pacientes de alto riesgo, y se mantiene al menos durante 21 días, comenzando el día de la intervención quirúrgica13,14. No obstante, la búsqueda del anticoagulante ideal es uno de los campos de investigación más activos en los últimos años en diferentes situaciones clínicas. A pesar de la profilaxis, se sigue produciendo algún episodio de TVP, que necesita ser tratado para evitar complicaciones mayores4,9,15–17.
Existe escasa información sobre los costes originados por la TVP/TEP: en global se ha estimado un gasto aproximado para prevenir o tratar la TEV de 1.300 millones de dólares en los países occidentales. En España, la hospitalización por TEP supone un gasto de 20 millones de euros al año5. Por otro lado, muchos individuos pueden ver reducida su capacidad laboral, generando importantes costes indirectos a la sociedad. Ante este escenario, será necesario desarrollar estrategias encaminadas a la prevención de poblaciones de alto riesgo, así como políticas activas locales y nacionales que fomenten el conocimiento del problema y la adherencia a las guías clínicas de consenso internacional18.
La evidencia disponible en cuanto al impacto, manejo y seguimiento de los pacientes con TVP en situación de práctica clínica habitual en nuestro país es incierta; además, la información disponible acerca de variables clínicas y utilización de recursos en su conjunto es muy limitada, por lo que la realización de este estudio puede ser relevante. En este aspecto, no disponemos en nuestro país de ninguna evidencia de cuál es la utilización de recursos y los costes asociados al tratamiento de cada episodio de TVP y sangrado en pacientes intervenidos de cirugía ortopédica que han recibido profilaxis con anticoagulantes. El objetivo principal de este estudio fue conocer la utilización de recursos sanitarios y los costes asociados derivados del diagnóstico y tratamiento de cada episodio de TVP y sangrado en pacientes intervenidos de cirugía ortopédica de cadera o rodilla, durante 3 meses de seguimiento, en el ámbito español y en condiciones de práctica clínica habitual. Como objetivo secundario se analizaron los factores determinantes y/o posibles variables explicativas de dicha utilización de recursos y costes asociados en ambas complicaciones (TVP y sangrado).
Pacientes y métodosDiseño y población de estudioSe realizó un estudio observacional, no intervencionista de carácter multicéntrico, a partir de la revisión retrospectiva de los registros médicos (bases de datos informatizadas o de historias clínicas) de pacientes en régimen ambulatorio y hospitalario pertenecientes a 3 centros hospitalarios españoles. Los registros se obtuvieron a partir de los datos disociados de la historia clínica, el informe de alta y/o la propia base de datos del centro. En el estudio se diferenciaron 3 grupos de pacientes: a) pacientes operados de ATC o ATR que hubieran recibido profilaxis con anticoagulantes y en los que no hubo ningún episodio de TVP ni de sangrado (grupo control) durante la hospitalización: b) pacientes operados de ATC o ATR que hubieran recibido profilaxis con anticoagulantes, y en los que apareció algún episodio de sangrado de cualquier gravedad, y c) pacientes operados de ATC o ATR que habiendo recibido profilaxis con anticoagulantes tuvieran algún episodio de TVP.
La población de estudio estuvo formada por pacientes pertenecientes al Hospital Municipal de Badalona, al Hospital Universitario Puerta de Hierro Majadahonda y al Hospital de Alzira. Cada investigador debía seleccionar aleatoriamente a 60 pacientes (20 en cada uno de los grupos citados con anterioridad) que fueran intervenidos de ATC o ATR en su hospital. La búsqueda de los pacientes se realizó a partir de los registros de alta hospitalaria de los servicios de Admisiones, Documentación Médica y/o Traumatología; siempre a partir de los procedimientos quirúrgicos principales codificados según la Clasificación Internacional de Enfermedades (9.ª revisión), Modificación Clínica (CIE-9-MC).
Criterios de inclusión y exclusiónSe incluyeron todos los pacientes intervenidos de ATC o ATR primarias (reemplazamiento total de carácter programado; códigos de la CIE-9-MC 81.51 y 81.54, respectivamente) entre el 1 de enero de 2010 y el 31 de diciembre de 2010 y que reunieran las siguientes características: a) edad ≥ 40 años; b) que hubieran recibido profilaxis anticoagulante un mínimo de 21 días; c) que acudieran a las citas programadas para el seguimiento evolutivo de la intervención; d) dispusieran de registros de calidad de las historias clínicas; e) reemplazo primario de una prótesis no cementada para un diagnóstico de osteoartrosis, y f) intervenciones quirúrgicas de carácter programado (no urgente). Fueron excluidos aquellos pacientes con: a) contraindicación absoluta de anticoagulación (diátesis hemorrágicas graves, procesos hemorrágicos activos, hipertensión arterial grave no controlable, hemorragia intracraneal reciente, aneurisma cerebral o aórtico disecante); b) paciente con contraindicaciones relativas de anticoagulación (tendencia hemorrágica actualmente no activa, pericarditis o derrame pericárdico, cirugía reciente, especialmente oftálmica o neurocirugía, parto reciente, traumatismo importante); c) pacientes que en el ingreso se encontraban anticoagulados con dosis profilácticas o terapéuticas, o que requerían dosis terapéuticas durante el ingreso hospitalario; d) ATC primarias parciales de cadera (CIE-9-MC: 81.52) por considerar que se trata de una población diferente, ya que este tipo de intervenciones se lleva a cabo mayoritariamente en casos de fractura y en personas de edad más avanzada, y e) pacientes reintervenidos por complicaciones intrahospitalarias derivadas de la colocación de la prótesis. El seguimiento evolutivo de los pacientes, a partir de la fecha de la intervención fue de 3 meses para las principales medidas del estudio (TVP, sangrado y utilización de recursos).
Cabe destacar que debido al bajo número de pacientes encontrado en el grupo TVP/TEP, se decidió ampliar el periodo de reclutamiento durante 4 años más. No se consideró ampliar más este periodo de tiempo, ya que más allá de estos 4 años los casos podrían ser poco comparables con el estilo de práctica clínica actual.
Cálculo del tamaño muestralEl cálculo del tamaño muestral ofreció ciertas dificultades metodológicas, puesto que no se encontraron datos relativos a costes derivados del diagnóstico y tratamiento de TVP y sangrado en nuestro país. No obstante, en función de una prevalencia esperada máxima de complicaciones del 8,5%, (TVP y sangrado) y asumiendo un error aleatorio del 5% y una precisión estimada inferior al 4% se pretendió seleccionar a un mínimo de 180 pacientes (60 en cada grupo de estudio). La potencia estadística para el modelo fue del 80%. La selección de pacientes en cada grupo, y en especial en el grupo control (pacientes operados de ATC o ATR sin evidencia de TVP o sangrado), se efectuó por un muestreo probabilístico aleatorio simple de todos los casos disponibles.
Variables sociodemográficas y de morbilidadLas principales variables de estudio fueron: a) identificador de paciente (disociado); b) identificador de hospital; c) sociodemográficas, y d) comorbilidad. Entre estas figuraron la edad (continua y por rangos [18-44, 45-64, 65-74 y ≥ 75 años]), sexo y situación laboral (activo, pensionista y otros). Se cuantificaron los antecedentes clínicos: hipertensión arterial; diabetes mellitus; dislipidemia; obesidad; tabaquismo; alcoholismo; insuficiencia cardiaca, renal o hepática; cardiopatía isquémica; accidente vascular cerebral; enfermedad pulmonar obstructiva crónica (EPOC); asma bronquial; demencias o trastornos de memoria; enfermedades neurológicas (enfermedad de Parkinson, epilepsia, esclerosis múltiple); psicosis afectiva; síndrome depresivo; neoplasias malignas; varices de extremidades inferiores, y osteoporosis (según criterios de la CIE-9-MC). Como variable resumen de la comorbilidad general por paciente intervenido, se utilizó el índice de comorbilidad de Charlson19.
Grupos de estudio y otras variables analizadasLos grupos de trombosis y sangrado se obtuvieron durante el proceso de hospitalización de los pacientes. La información se obtuvo a partir de la codificación siguiente: TVP (CIE-9-MC: 451x-453x), y hemorragia o sangrado post-operatorio (CIE-9-MC: 998x). Todas las altas hospitalarias se revisaron por un médico documentalista, quien validó la información (especialmente los cursos clínicos, reintervenciones o pruebas diagnósticas/terapéuticas), siguiendo el criterio del personal facultativo. Además, en todos los pacientes incluidos en el estudio se realizó un seguimiento exhaustivo en las historias clínicas para no inducir un sesgo de selección. La presencia de TVP se definió a criterio clínico y en función de un diagnóstico establecido20; mientras que el sangrado se definió como un exudado recogido en los drenajes de redón durante las primeras 12 h superior a 500 ml21,22. Durante los 3 meses posteriores a la intervención (seguimiento ambulatorio), a criterio del traumatólogo se informó de la presencia de TVP (criterios de Wells)20 o sangrado (criterios de Nelson et al. y GEEEAAC)21,22.
Además se obtuvo información sobre el lugar de procedencia (hogar, centro geriátrico), la fecha de la intervención quirúrgica, el tipo de anticoagulante (principio activo) para profilaxis, los días de tratamiento hospitalario y ambulatorio (HBPM; seguimiento a partir de los cursos clínicos), los días de ingreso hospitalario (diferencia entre la fecha de alta y la fecha de ingreso), el motivo del alta hospitalaria (curación, traslado, fallecimiento, otras causas), la mortalidad hospitalaria (hasta 30 días posteriores al alta), el reingreso hospitalario (hasta 30 días posteriores al alta), la infección intrahospitalaria (según criterios SENIC)23, y otras complicaciones (respiratorias, cardiacas, motilidad, etc.).
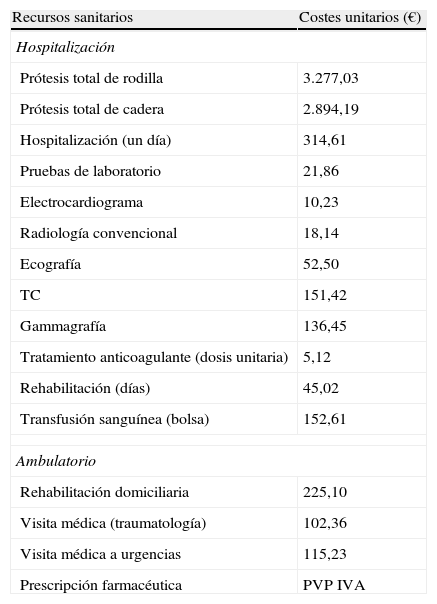
Utilización de recursos y modelo de costesSe consideraron como costes directos sanitarios los relacionados con la actividad asistencial efectuadas por los profesionales. El coste se expresó como coste medio (PVP-IVA) por paciente atendido desde el ingreso del paciente hasta los 3 meses de seguimiento en los 3 grupos de estudio (control, sangrado y trombosis). Los costes unitarios de las diferentes variables de estudio se detallan en la tabla 1 (correspondientes al año 2009). Las diferentes tarifas se obtuvieron a partir de la contabilidad analítica del Hospital Municipal de Badalona. Las prescripciones ambulatorias se cuantificaron según el precio de venta al público por envase en el momento de la prescripción.
Detalle de los costes unitarios utilizados
| Recursos sanitarios | Costes unitarios (€) |
| Hospitalización | |
| Prótesis total de rodilla | 3.277,03 |
| Prótesis total de cadera | 2.894,19 |
| Hospitalización (un día) | 314,61 |
| Pruebas de laboratorio | 21,86 |
| Electrocardiograma | 10,23 |
| Radiología convencional | 18,14 |
| Ecografía | 52,50 |
| TC | 151,42 |
| Gammagrafía | 136,45 |
| Tratamiento anticoagulante (dosis unitaria) | 5,12 |
| Rehabilitación (días) | 45,02 |
| Transfusión sanguínea (bolsa) | 152,61 |
| Ambulatorio | |
| Rehabilitación domiciliaria | 225,10 |
| Visita médica (traumatología) | 102,36 |
| Visita médica a urgencias | 115,23 |
| Prescripción farmacéutica | PVP IVA |
PVP: precio de venta al público.
Fuente de los recursos sanitarios: contabilidad analítica procedente del Hospital Municipal de Badalona. Valores expresados en euros (2011).
Se respetó la confidencialidad de los registros marcada por la Ley Orgánica de Protección de Datos (15/1999, de 13 de Diciembre), mediante la disociación de los datos. El estudio fue clasificado por la Agencia Española de Medicamentos y Productos Sanitarios (como no-EPA) y posteriormente aprobado por el Comité Ético de Investigación Clínica de cada hospital, actuando como centro coordinador el del Hospital Universitario Germans Trias i Pujol de Badalona.
Análisis estadísticoSe efectuó un análisis estadístico descriptivo-univariante e intervalos de confianza (IC) del 95%; y se comprobó la normalidad de la distribución con la prueba de Kolmogorov-Smirnov. En el análisis bivariante se utilizaron las pruebas de la t de Student, ANOVA, ji al cuadrado y correlación lineal de Pearson. Se efectuó un análisis de regresión logística para las variables categóricas (TVP y sangrado), para determinar variables asociadas (variables dependientes), con procedimiento enter (estadístico: Wald). La comparación del coste ambulatorio y hospitalario se realizó según las recomendaciones de Thompson y Barber24 mediante el análisis de la covarianza (ANCOVA), con el sexo, la edad y el índice de Charlson como covariables (procedimiento: estimación de medias marginales; ajuste de Bonferroni; con significación p<0,0125). Se calculó el IC del 95% de los costes promedio generados a través de la técnica del re-muestreo (bootstrapping). Para predecir los factores asociados al coste sanitario total (variable dependiente) se utilizó un modelo de regresión lineal múltiple (procedimiento: pasos sucesivos; se obtienen los coeficientes β como una medida de asociación). Se utilizó el programa SPSSWIN versión 17 (empresa IBM, USA), estableciendo una significación estadística para valores de p<0,05.
ResultadosSe incluyeron 141 pacientes (control: 60; sangrado: 60; trombosis: 21) de los 680 sujetos ≥ 40 años intervenidos de ATR o ATC en los 3 hospitales potencialmente iniciales. Ningún paciente presentó un TEP. De los 141 pacientes analizados desde el día de ingreso hasta los 3 meses posteriores, no falleció ningún paciente y no hubo pérdidas de seguimiento.
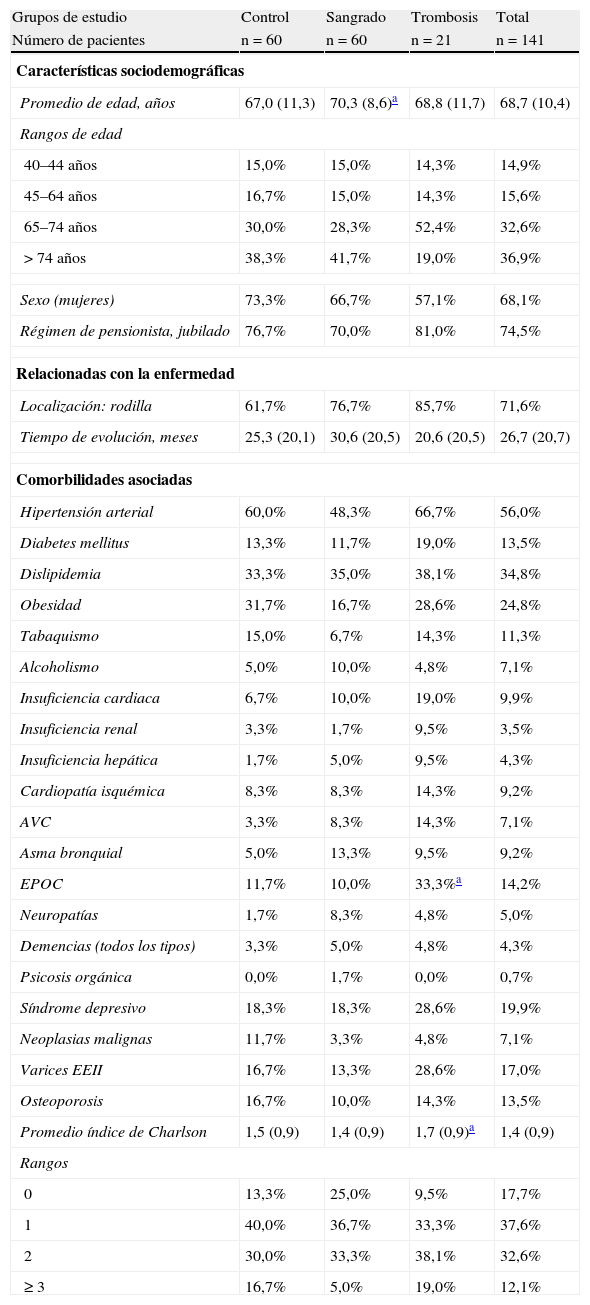
En la tabla 2 se describen las características generales y las comorbilidades asociadas de los pacientes según la serie estudiada. La edad media fue de 68,7±10,4 años y el 68,1% fueron mujeres. La artroplastia más frecuente fue la de rodilla (71,6%). El grupo con trombosis en comparación con el control mostró un mayor porcentaje de EPOC (33,3 frente al 11,7%; p=0,023) y de comorbilidad general (1,7 frente a 1,5 puntos en la escala de Charlson; p=0,036). El grupo de sangrado comparado con el control no mostró diferencias estadísticamente significativas en las variables analizadas. En el modelo logístico, la edad mostró un mayor riesgo de padecer un sangrado (OR=1,1; IC: 1,0-1,2; p<0,05); mientras que la EPOC (OR=1,8; IC: 1,6-2,1; p<0,05) lo fue de la trombosis.
Características generales de la serie estudiada
| Grupos de estudio | Control | Sangrado | Trombosis | Total |
| Número de pacientes | n=60 | n=60 | n=21 | n=141 |
| Características sociodemográficas | ||||
| Promedio de edad, años | 67,0 (11,3) | 70,3 (8,6)a | 68,8 (11,7) | 68,7 (10,4) |
| Rangos de edad | ||||
| 40–44 años | 15,0% | 15,0% | 14,3% | 14,9% |
| 45–64 años | 16,7% | 15,0% | 14,3% | 15,6% |
| 65–74 años | 30,0% | 28,3% | 52,4% | 32,6% |
| > 74 años | 38,3% | 41,7% | 19,0% | 36,9% |
| Sexo (mujeres) | 73,3% | 66,7% | 57,1% | 68,1% |
| Régimen de pensionista, jubilado | 76,7% | 70,0% | 81,0% | 74,5% |
| Relacionadas con la enfermedad | ||||
| Localización: rodilla | 61,7% | 76,7% | 85,7% | 71,6% |
| Tiempo de evolución, meses | 25,3 (20,1) | 30,6 (20,5) | 20,6 (20,5) | 26,7 (20,7) |
| Comorbilidades asociadas | ||||
| Hipertensión arterial | 60,0% | 48,3% | 66,7% | 56,0% |
| Diabetes mellitus | 13,3% | 11,7% | 19,0% | 13,5% |
| Dislipidemia | 33,3% | 35,0% | 38,1% | 34,8% |
| Obesidad | 31,7% | 16,7% | 28,6% | 24,8% |
| Tabaquismo | 15,0% | 6,7% | 14,3% | 11,3% |
| Alcoholismo | 5,0% | 10,0% | 4,8% | 7,1% |
| Insuficiencia cardiaca | 6,7% | 10,0% | 19,0% | 9,9% |
| Insuficiencia renal | 3,3% | 1,7% | 9,5% | 3,5% |
| Insuficiencia hepática | 1,7% | 5,0% | 9,5% | 4,3% |
| Cardiopatía isquémica | 8,3% | 8,3% | 14,3% | 9,2% |
| AVC | 3,3% | 8,3% | 14,3% | 7,1% |
| Asma bronquial | 5,0% | 13,3% | 9,5% | 9,2% |
| EPOC | 11,7% | 10,0% | 33,3%a | 14,2% |
| Neuropatías | 1,7% | 8,3% | 4,8% | 5,0% |
| Demencias (todos los tipos) | 3,3% | 5,0% | 4,8% | 4,3% |
| Psicosis orgánica | 0,0% | 1,7% | 0,0% | 0,7% |
| Síndrome depresivo | 18,3% | 18,3% | 28,6% | 19,9% |
| Neoplasias malignas | 11,7% | 3,3% | 4,8% | 7,1% |
| Varices EEII | 16,7% | 13,3% | 28,6% | 17,0% |
| Osteoporosis | 16,7% | 10,0% | 14,3% | 13,5% |
| Promedio índice de Charlson | 1,5 (0,9) | 1,4 (0,9) | 1,7 (0,9)a | 1,4 (0,9) |
| Rangos | ||||
| 0 | 13,3% | 25,0% | 9,5% | 17,7% |
| 1 | 40,0% | 36,7% | 33,3% | 37,6% |
| 2 | 30,0% | 33,3% | 38,1% | 32,6% |
| ≥3 | 16,7% | 5,0% | 19,0% | 12,1% |
EPOC: enfermedad pulmonar obstructiva crónica.
Valores expresados en porcentaje o media (DE: desviación estándar).
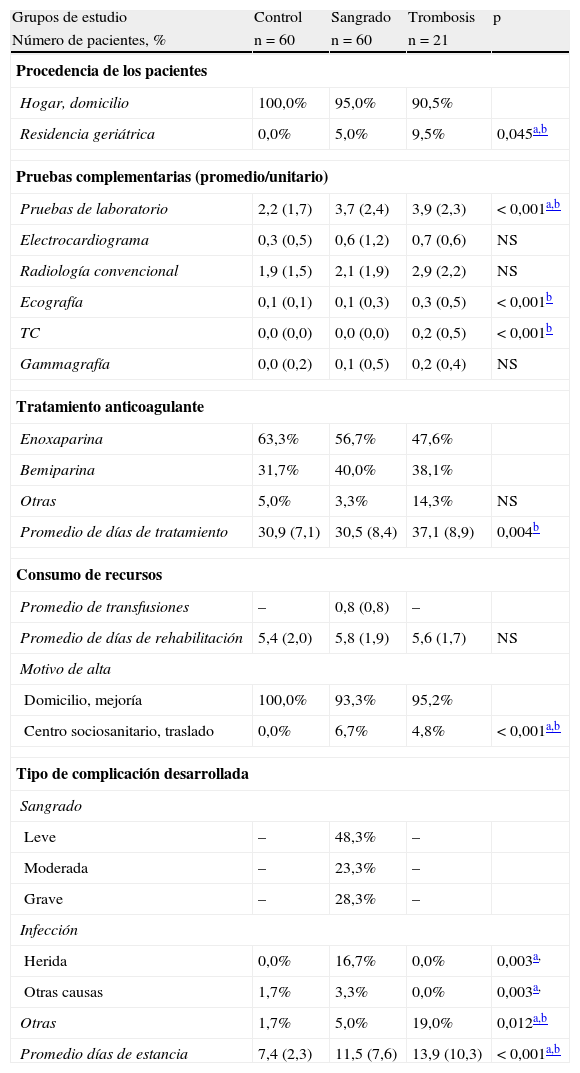
Las variables generales, los recursos y las complicaciones sucedidas durante la hospitalización se muestran en la tabla 3 para cada grupo de estudio. De todos los pacientes estudiados, el 3,5% procedían de una residencia geriátrica (trombosis: 9,5%) y al 58,2% se les administró tratamiento anticoagulante con enoxaparina. Del grupo de pacientes que sufrieron sangrado, al 55,0% se les realizó alguna transfusión sanguínea (una: 26,7%; dos o más: 28,3%) y el 20,0% presentó una infección intrahospitalaria. Otras complicaciones desarrolladas fueron: reacción alérgica/adversa a medicamentos (3), dolor intenso (3) y arritmia cardíaca (2). El promedio de días de estancia en los grupos de sangrado y trombosis fue superior al del grupo control (11,5±3,5 y 13,9±3,8 frente a 7,4±2,3 días, respectivamente, p<0,001). Sin embargo, no hubo diferencias destacadas entre los pacientes intervenidos de ATR o ATC. A modo de ejemplo el promedio de estancia hospitalaria fue de 10,5±3,1 frente a 9,1±3,6 días, respectivamente.
Variables generales, uso de recursos y complicaciones sucedidas durante la hospitalización
| Grupos de estudio | Control | Sangrado | Trombosis | p |
| Número de pacientes, % | n=60 | n=60 | n=21 | |
| Procedencia de los pacientes | ||||
| Hogar, domicilio | 100,0% | 95,0% | 90,5% | |
| Residencia geriátrica | 0,0% | 5,0% | 9,5% | 0,045a,b |
| Pruebas complementarias (promedio/unitario) | ||||
| Pruebas de laboratorio | 2,2 (1,7) | 3,7 (2,4) | 3,9 (2,3) | < 0,001a,b |
| Electrocardiograma | 0,3 (0,5) | 0,6 (1,2) | 0,7 (0,6) | NS |
| Radiología convencional | 1,9 (1,5) | 2,1 (1,9) | 2,9 (2,2) | NS |
| Ecografía | 0,1 (0,1) | 0,1 (0,3) | 0,3 (0,5) | < 0,001b |
| TC | 0,0 (0,0) | 0,0 (0,0) | 0,2 (0,5) | < 0,001b |
| Gammagrafía | 0,0 (0,2) | 0,1 (0,5) | 0,2 (0,4) | NS |
| Tratamiento anticoagulante | ||||
| Enoxaparina | 63,3% | 56,7% | 47,6% | |
| Bemiparina | 31,7% | 40,0% | 38,1% | |
| Otras | 5,0% | 3,3% | 14,3% | NS |
| Promedio de días de tratamiento | 30,9 (7,1) | 30,5 (8,4) | 37,1 (8,9) | 0,004b |
| Consumo de recursos | ||||
| Promedio de transfusiones | – | 0,8 (0,8) | – | |
| Promedio de días de rehabilitación | 5,4 (2,0) | 5,8 (1,9) | 5,6 (1,7) | NS |
| Motivo de alta | ||||
| Domicilio, mejoría | 100,0% | 93,3% | 95,2% | |
| Centro sociosanitario, traslado | 0,0% | 6,7% | 4,8% | < 0,001a,b |
| Tipo de complicación desarrollada | ||||
| Sangrado | ||||
| Leve | – | 48,3% | – | |
| Moderada | – | 23,3% | – | |
| Grave | – | 28,3% | – | |
| Infección | ||||
| Herida | 0,0% | 16,7% | 0,0% | 0,003a, |
| Otras causas | 1,7% | 3,3% | 0,0% | 0,003a, |
| Otras | 1,7% | 5,0% | 19,0% | 0,012a,b |
| Promedio días de estancia | 7,4 (2,3) | 11,5 (7,6) | 13,9 (10,3) | < 0,001a,b |
Valores expresados en porcentaje o media (DE: desviación estándar); p: significación estadística; NS: no significativo.
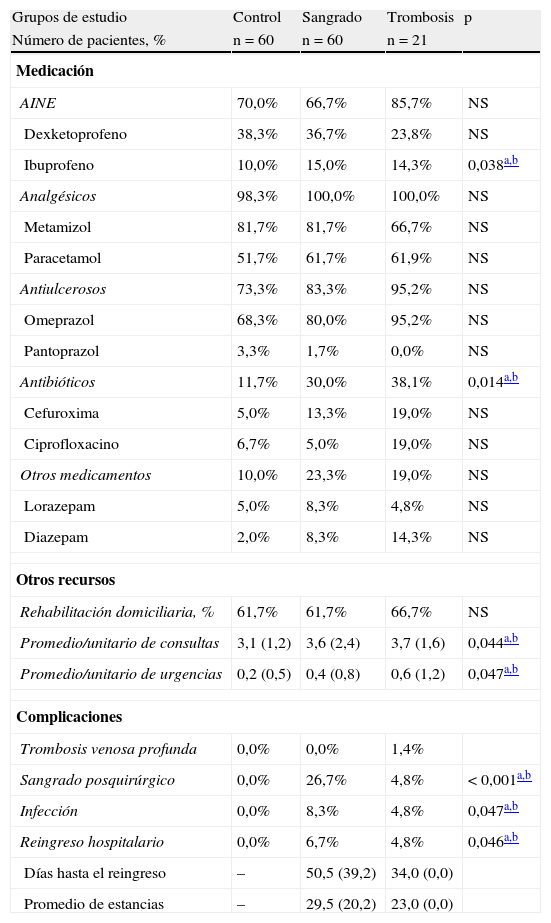
En la tabla 4 se detalla la medicación administrada, el uso de recursos y las complicaciones desarrolladas durante el periodo de seguimiento ambulatorio (post-hospitalización, 3 meses). En los grupos de sangrado y trombosis en comparación con el grupo control hubo un mayor uso de medicamentos (30,0% y 38,1% frente al 11,7%; p=0,014), visitas ambulatorias (3,6 y 3,7 frente a 3,1%; p=0,044) y visitas en el servicio de urgencias (0,4% y 0,6% frente a 0,2%; p=0,047), respectivamente. En el grupo de sangrado, el 26,7% desarrollaron hematomas/sangrado de la herida quirúrgica; 4 de estos pacientes reingresaron. En el grupo de trombosis, 2 pacientes manifestaron una nueva TVP; y de éstos uno reingresó. Las infecciones de la herida quirúrgica u otras (urinarias: 2) fueron tratadas ambulatoriamente (total: 5,1%). No hubo diferencias destacadas entre los pacientes intervenidos de ATR o ATC.
Medicación administrada, uso de recursos y complicaciones sucedidas durante el periodo de seguimiento ambulatorio (post-hospitalización, 3 meses)
| Grupos de estudio | Control | Sangrado | Trombosis | p |
| Número de pacientes, % | n=60 | n=60 | n=21 | |
| Medicación | ||||
| AINE | 70,0% | 66,7% | 85,7% | NS |
| Dexketoprofeno | 38,3% | 36,7% | 23,8% | NS |
| Ibuprofeno | 10,0% | 15,0% | 14,3% | 0,038a,b |
| Analgésicos | 98,3% | 100,0% | 100,0% | NS |
| Metamizol | 81,7% | 81,7% | 66,7% | NS |
| Paracetamol | 51,7% | 61,7% | 61,9% | NS |
| Antiulcerosos | 73,3% | 83,3% | 95,2% | NS |
| Omeprazol | 68,3% | 80,0% | 95,2% | NS |
| Pantoprazol | 3,3% | 1,7% | 0,0% | NS |
| Antibióticos | 11,7% | 30,0% | 38,1% | 0,014a,b |
| Cefuroxima | 5,0% | 13,3% | 19,0% | NS |
| Ciprofloxacino | 6,7% | 5,0% | 19,0% | NS |
| Otros medicamentos | 10,0% | 23,3% | 19,0% | NS |
| Lorazepam | 5,0% | 8,3% | 4,8% | NS |
| Diazepam | 2,0% | 8,3% | 14,3% | NS |
| Otros recursos | ||||
| Rehabilitación domiciliaria, % | 61,7% | 61,7% | 66,7% | NS |
| Promedio/unitario de consultas | 3,1 (1,2) | 3,6 (2,4) | 3,7 (1,6) | 0,044a,b |
| Promedio/unitario de urgencias | 0,2 (0,5) | 0,4 (0,8) | 0,6 (1,2) | 0,047a,b |
| Complicaciones | ||||
| Trombosis venosa profunda | 0,0% | 0,0% | 1,4% | |
| Sangrado posquirúrgico | 0,0% | 26,7% | 4,8% | < 0,001a,b |
| Infección | 0,0% | 8,3% | 4,8% | 0,047a,b |
| Reingreso hospitalario | 0,0% | 6,7% | 4,8% | 0,046a,b |
| Días hasta el reingreso | – | 50,5 (39,2) | 34,0 (0,0) | |
| Promedio de estancias | – | 29,5 (20,2) | 23,0 (0,0) | |
AINE: antiinflamatorios no esteroideos; NS: no significativo; p: significación estadística.
Valores expresados en porcentaje o media (DE: desviación estándar).
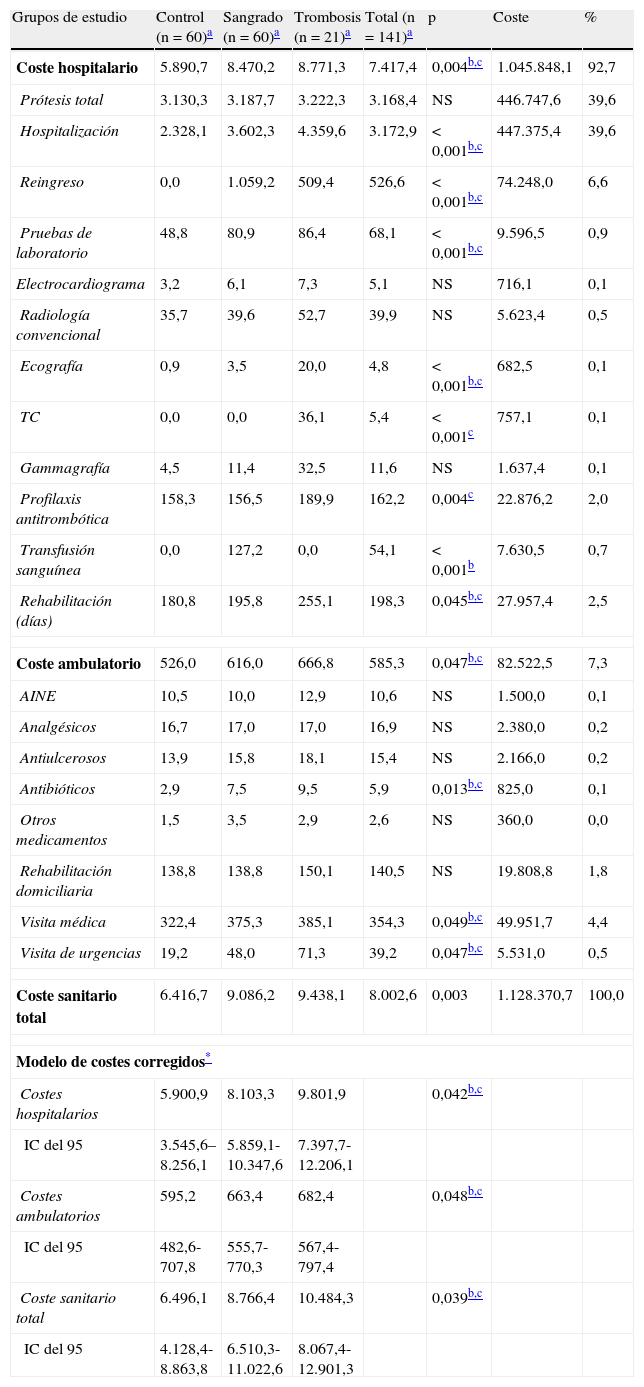
El modelo de costes brutos y corregidos asociados a la artroplastia total primaria por grupos de estudio se describe en la tabla 5. El coste sanitario total de la atención de los pacientes ascendió a 1.128.371 €. El coste medio por paciente fue de 8.003±4.875 € (ambulatorio: 585±267 €; hospitalario: 7.417±4.808 €). Los costes más importantes generados en atención especializada correspondieron a los días de hospitalización y a la colocación de la prótesis, siendo ambos el 39,6% del coste total. En el modelo multivariante corregido por edad, sexo y comorbilidad, los costes medios fueron superiores en el grupo con trombosis (total: 10.484 €; hospitalarios: 9.802 €; ambulatorios: 682 €), seguidos del de sangrado (total: 8.766 €; hospitalarios: 8.103 €; ambulatorios: 663 €), en comparación con el grupo control (total: 6.496 €; hospitalarios: 5.901 €; ambulatorios: 595 €), resultados estadísticamente significativos en todos los casos.
Modelo de costes asociados a la artroplastia total primaria por grupos de estudio
| Grupos de estudio | Control (n=60)a | Sangrado (n=60)a | Trombosis (n=21)a | Total (n=141)a | p | Coste | % |
| Coste hospitalario | 5.890,7 | 8.470,2 | 8.771,3 | 7.417,4 | 0,004b,c | 1.045.848,1 | 92,7 |
| Prótesis total | 3.130,3 | 3.187,7 | 3.222,3 | 3.168,4 | NS | 446.747,6 | 39,6 |
| Hospitalización | 2.328,1 | 3.602,3 | 4.359,6 | 3.172,9 | < 0,001b,c | 447.375,4 | 39,6 |
| Reingreso | 0,0 | 1.059,2 | 509,4 | 526,6 | < 0,001b,c | 74.248,0 | 6,6 |
| Pruebas de laboratorio | 48,8 | 80,9 | 86,4 | 68,1 | < 0,001b,c | 9.596,5 | 0,9 |
| Electrocardiograma | 3,2 | 6,1 | 7,3 | 5,1 | NS | 716,1 | 0,1 |
| Radiología convencional | 35,7 | 39,6 | 52,7 | 39,9 | NS | 5.623,4 | 0,5 |
| Ecografía | 0,9 | 3,5 | 20,0 | 4,8 | < 0,001b,c | 682,5 | 0,1 |
| TC | 0,0 | 0,0 | 36,1 | 5,4 | < 0,001c | 757,1 | 0,1 |
| Gammagrafía | 4,5 | 11,4 | 32,5 | 11,6 | NS | 1.637,4 | 0,1 |
| Profilaxis antitrombótica | 158,3 | 156,5 | 189,9 | 162,2 | 0,004c | 22.876,2 | 2,0 |
| Transfusión sanguínea | 0,0 | 127,2 | 0,0 | 54,1 | < 0,001b | 7.630,5 | 0,7 |
| Rehabilitación (días) | 180,8 | 195,8 | 255,1 | 198,3 | 0,045b,c | 27.957,4 | 2,5 |
| Coste ambulatorio | 526,0 | 616,0 | 666,8 | 585,3 | 0,047b,c | 82.522,5 | 7,3 |
| AINE | 10,5 | 10,0 | 12,9 | 10,6 | NS | 1.500,0 | 0,1 |
| Analgésicos | 16,7 | 17,0 | 17,0 | 16,9 | NS | 2.380,0 | 0,2 |
| Antiulcerosos | 13,9 | 15,8 | 18,1 | 15,4 | NS | 2.166,0 | 0,2 |
| Antibióticos | 2,9 | 7,5 | 9,5 | 5,9 | 0,013b,c | 825,0 | 0,1 |
| Otros medicamentos | 1,5 | 3,5 | 2,9 | 2,6 | NS | 360,0 | 0,0 |
| Rehabilitación domiciliaria | 138,8 | 138,8 | 150,1 | 140,5 | NS | 19.808,8 | 1,8 |
| Visita médica | 322,4 | 375,3 | 385,1 | 354,3 | 0,049b,c | 49.951,7 | 4,4 |
| Visita de urgencias | 19,2 | 48,0 | 71,3 | 39,2 | 0,047b,c | 5.531,0 | 0,5 |
| Coste sanitario total | 6.416,7 | 9.086,2 | 9.438,1 | 8.002,6 | 0,003 | 1.128.370,7 | 100,0 |
| Modelo de costes corregidos* | |||||||
| Costes hospitalarios | 5.900,9 | 8.103,3 | 9.801,9 | 0,042b,c | |||
| IC del 95 | 3.545,6–8.256,1 | 5.859,1-10.347,6 | 7.397,7-12.206,1 | ||||
| Costes ambulatorios | 595,2 | 663,4 | 682,4 | 0,048b,c | |||
| IC del 95 | 482,6-707,8 | 555,7-770,3 | 567,4-797,4 | ||||
| Coste sanitario total | 6.496,1 | 8.766,4 | 10.484,3 | 0,039b,c | |||
| IC del 95 | 4.128,4-8.863,8 | 6.510,3-11.022,6 | 8.067,4-12.901,3 | ||||
AINE: antiinflamatorios no esteroideos; IC: intervalo de confianza; NS: no significativo; p: significación estadística.
Valores expresados en media (euros).
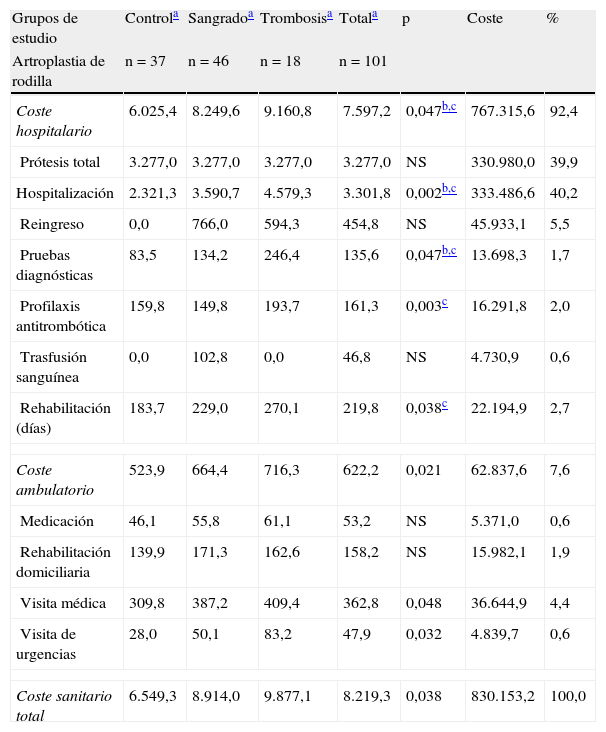
En la tabla 6 se detalla el modelo de costes brutos y corregidos asociados a ATR y ATC. La distribución de los costes por grupos de estudio y variables no muestra diferencias destacadas. En el modelo de ANCOVA en pacientes intervenidos de ATR, los costes totales fueron superiores en el grupo con trombosis (10.732 €) y sangrado (8.411 €) en comparación con el grupo control (6.571 €), p<0,05. En los pacientes con ATC el coste total del grupo control fue de 6.401 € y el de sangrado de 8.615 €; resultados similares a los de la ATR.
Modelo de costes brutos y corregidos asociados a la artroplastia total primaria de rodilla y cadera por grupos de estudio
| Grupos de estudio | Controla | Sangradoa | Trombosisa | Totala | p | Coste | % |
| Artroplastia de rodilla | n=37 | n=46 | n=18 | n=101 | |||
| Coste hospitalario | 6.025,4 | 8.249,6 | 9.160,8 | 7.597,2 | 0,047b,c | 767.315,6 | 92,4 |
| Prótesis total | 3.277,0 | 3.277,0 | 3.277,0 | 3.277,0 | NS | 330.980,0 | 39,9 |
| Hospitalización | 2.321,3 | 3.590,7 | 4.579,3 | 3.301,8 | 0,002b,c | 333.486,6 | 40,2 |
| Reingreso | 0,0 | 766,0 | 594,3 | 454,8 | NS | 45.933,1 | 5,5 |
| Pruebas diagnósticas | 83,5 | 134,2 | 246,4 | 135,6 | 0,047b,c | 13.698,3 | 1,7 |
| Profilaxis antitrombótica | 159,8 | 149,8 | 193,7 | 161,3 | 0,003c | 16.291,8 | 2,0 |
| Trasfusión sanguínea | 0,0 | 102,8 | 0,0 | 46,8 | NS | 4.730,9 | 0,6 |
| Rehabilitación (días) | 183,7 | 229,0 | 270,1 | 219,8 | 0,038c | 22.194,9 | 2,7 |
| Coste ambulatorio | 523,9 | 664,4 | 716,3 | 622,2 | 0,021 | 62.837,6 | 7,6 |
| Medicación | 46,1 | 55,8 | 61,1 | 53,2 | NS | 5.371,0 | 0,6 |
| Rehabilitación domiciliaria | 139,9 | 171,3 | 162,6 | 158,2 | NS | 15.982,1 | 1,9 |
| Visita médica | 309,8 | 387,2 | 409,4 | 362,8 | 0,048 | 36.644,9 | 4,4 |
| Visita de urgencias | 28,0 | 50,1 | 83,2 | 47,9 | 0,032 | 4.839,7 | 0,6 |
| Coste sanitario total | 6.549,3 | 8.914,0 | 9.877,1 | 8.219,3 | 0,038 | 830.153,2 | 100,0 |
| Artroplastia de cadera | n=23 | n=14 | n=3 | n=40 | p | Coste | % |
| Coste hospitalario | 5.673,9 | 9.195,0 | 6.434,0 | 6.963,3 | 0,023b | 278.532,6 | 93,4 |
| Prótesis total | 2.894,2 | 2.894,2 | 2.894,2 | 2.894,2 | NS | 115.767,6 | 38,8 |
| Hospitalización | 2.339,1 | 3.640,5 | 3.041,2 | 2.847,2 | 0,011b,c | 113.888,8 | 38,2 |
| Reingreso | 0,0 | 2.022,5 | 0,0 | 707,9 | NS | 28.314,9 | 9,5 |
| Pruebas diagnósticas | 108,7 | 165,5 | 166,3 | 132,9 | NS | 5.314,8 | 1,8 |
| Profilaxis antitrombótica | 155,8 | 178,5 | 167,3 | 164,6 | NS | 6.584,3 | 2,2 |
| Trasfusión sanguínea | 0,0 | 207,1 | 0,0 | 72,5 | NS | 2.899,6 | 1,0 |
| Rehabilitación (días) | 176,2 | 86,8 | 165,1 | 144,1 | NS | 5.762,6 | 1,9 |
| Coste ambulatorio | 529,5 | 456,9 | 369,9 | 492,1 | NS | 19.684,9 | 6,6 |
| Medicación | 44,8 | 47,3 | 56,0 | 46,5 | NS | 1.860,0 | 0,6 |
| Rehabilitación domiciliaria | 137,0 | 32,2 | 75,0 | 95,7 | NS | 3.826,7 | 1,3 |
| Visita médica | 342,7 | 336,3 | 238,8 | 332,7 | NS | 13.306,8 | 4,5 |
| Visita de urgencias | 5,0 | 41,2 | 0,0 | 17,3 | NS | 691,4 | 0,2 |
| Coste sanitario total | 6.203,4 | 9.652,0 | 6.803,9 | 7.455,4 | 0,037b | 298.217,4 | 100,0 |
| Modelo de costes corregidosd | |||||||
| Coste sanitario total (rodilla) | 6.571,1 | 8.410,6 | 10.731,8 | 0,047b,c | |||
| IC del 95 | 3.198,6–9.943,6 | 5.680,4–11.140,7 | 7.820,2–13.643,5 | ||||
| Coste sanitario total (cadera) | 6.401,2 | 8.614,7 | 7.533,4 | NS | |||
| IC del 95 | 4.721,3 - 8.080,9 | 4.386,4 - 12.843,1 | 4.520,4 - 10.546,2 | ||||
AINE: antiinflamatorios no esteroideos; IC: intervalo de confianza; NS: no significativo; p: significación estadística.
Valores expresados en media (euros).
En el modelo de regresión lineal, el coste sanitario total se asoció con número de estancias hospitalarias (β = 0,651), reingreso (β = 0,536), índice de Charlson (β = 0,185), la presencia de trombosis (β = 0,173) y la infección intrahospitalaria (β = 0,157), p<0,001. Todos los resultados grupales fueron comparables en los hospitales analizados (Hospital Municipal de Badalona, Hospital Universitario Puerta de Hierro y Hospital de Alzira). A modo de ejemplo, el promedio de edad (69,7±10,2; 68,2±10,7 y 69,1%±10,4% años; p=0,653), el porcentaje de mujeres (68,2; 67,9 y 71,2%; p=0,821) y el coste bruto total (8.287±4.954 €, 7.805±4.879 € y 8.123±4.997 €; p=0,333), respectivamente; no mostraron diferencias significativas.
DiscusiónEl estudio muestra la elevada utilización de recursos sanitarios y el coste medio asociado al diagnóstico y tratamiento de la de TVP y del sangrado, en pacientes intervenidos de ATC y/o ATR en comparación con un grupo control; durante 3 meses de seguimiento en un ámbito español (hospitalario y ambulatorio), en situación de práctica clínica habitual. Cabe destacar que sin una adecuada estandarización de la metodología en cuanto a las características de los pacientes, así como en el número y medida de las variables estudiadas, los resultados obtenidos deben interpretarse con prudencia obligándonos a ser cautelosos en la validez externa de los resultados.
Las posibles limitaciones del estudio inciden en el posible sesgo de clasificación de los pacientes, en el método de cálculo de los costes (atribuibles al sistema de información desarrollado en los hospitales) y al periodo de seguimiento realizado. La comparabilidad de los grupos puede estar afectada, puesto que en el grupo con trombosis se tuvo que ampliar el periodo de selección durante 4 años más (selección intencionada), al no disponer de los casos necesarios en función de los criterios de inclusión/exclusión del estudio. Aunque para el propósito del estudio su incidencia puede ser mínima. Otra posible limitación es la no inclusión de costes indirectos, por ejemplo el coste que supone para el paciente acudir todos los días a rehabilitación, los días de incapacidad laboral, etc.; o que no se tuvo en cuenta el tipo de técnica quirúrgica (tradicional, mínimamente invasiva) y de prótesis utilizada; no obstante, debido a la enorme diversidad de tipos de prótesis existentes resulta difícil establecer comparaciones de resultados entre ellas. También debemos considerar que el tiempo de seguimiento es corto y por tanto una parte de las posibles complicaciones aún no se habrán producido, aunque este hecho afecta de igual forma a todos los grupos de estudio. Por tanto, en el artículo se muestran las limitaciones propias de los estudios retrospectivos; como por ejemplo, el posible infrarregistro de algunas variables o la posible variabilidad de los profesionales. Además, el reducido tamaño muestral puede mostrar una escasa comparabilidad estadística entre los grupos. Otro aspecto a tener en cuenta es que los resultados observados no tiene más datos que la trombosis sintomática, por lo que es posible que no se evalúe correctamente la trombosis real de los pacientes. Cabe destacar que entre los métodos de prevención de la enfermedad tromboembólica venosa no figuran solo las heparinas o antitrombóticos orales; los métodos físicos, el proceso de rehabilitación (tiempo de movilización post-operatoria), el tipo de anestesia y/o el control del dolor, entre otros factores, no se consideraron entre los datos analizados; por lo que este aspecto debe interpretarse como una limitación del estudio. Otra de las limitaciones a reflexionar, consiste en que no nos fue posible diferenciar si los pacientes que sangraron fueron los que tuvieron más índice de infecciones, o si el sangrado era un signo de infección aguda; aunque en nuestra opinión seguramente sería la primera circunstancia. No obstante, a pesar de estas limitaciones, nuestro estudio puede tener su aplicación en los modelos de evaluación económica y en el conocimiento general de los costes de la enfermedad, puesto que incorpora una importante base de conocimiento poco explorada hasta el momento.
Recientes estudios han demostrado que la introducción de guías de práctica organizadas y consensuadas entre los distintos servicios clínicos encargados del diagnóstico y tratamiento de estos pacientes repercute en una disminución del tiempo de estancia media hospitalaria, permitiendo disminuir las complicaciones intrahospitalarias y el coste sanitario, reduciendo la variabilidad del proceso. En dichas guías se contempla la priorización de la artroplastia en función de criterios explícitos, la aplicación de tiempos de atención garantizados o la incorporación de estrategias para mejorar la indicación de la intervención25–27. Los resultados globales de nuestro estudio muestran un cierto grado de homogeneidad entre las variables estudiadas, por lo que las diferencias entre los 3 hospitales participantes pueden considerarse aceptables dentro de un contexto de práctica clínica y de reducción de la incertidumbre1,13.
Los resultados generales del estudio muestran que de todos los pacientes intervenidos de ATC o ATR el 8,8% tuvo algún tipo de sangrado (al 55,0% se les realizó una trasfusión sanguínea y al 0,9% una TVP). De los pacientes estudiados, el 5,1% presentaron alguna infección intrahospitalaria. Parece evidente que las complicaciones clínicas ocasionan un mayor consumo de recursos hospitalarios1,28.
El sangrado intraoperatorio es una de las complicaciones destacadas de la artroplastia1,16,17. En la bibliografía se han descrito algunos factores asociados, como la duración del procedimiento quirúrgico, el tipo de procedimiento, la optimización intraoperatoria del volumen intravascular, la edad, la cifra de plaquetas o algún tipo de enfermedad previa de los pacientes; situándose entre un 5-8% de las artroplastias. En nuestro estudio hemos encontrado una tasa de sangrado y de transfusión similares a las descritas por Cuenca29 o Swain30 y ligeramente superiores a las descritas por Singh31. Aunque estos resultados son de difícil comparación, puesto que se trata de artroplastias primarias totales, y además puede existir un sesgo de selección o de clasificación de los pacientes; ya que el objetivo propuesto fue la identificación de los costes en los 3 grupos de estudio analizados. En este aspecto, parece clara la relación existente entre el sangrado y la infección intrahospitalaria, ocasionando un incremento del coste sanitario.
La enfermedad tromboembólica está descrita como la complicación que presenta un mayor riesgo de mortalidad perioperatoria después de una artroplastia, por lo que las medidas profilácticas han pasado a ocupar un papel fundamental en el tratamiento del paciente quirúrgico, siendo la utilización de HBPM la más destacada14–17,22. Nuestros resultados son de difícil comparación debido a la dificultad de encontrar estudios similares. No obstante, en nuestro estudio se constata esta baja incidencia, ante la necesidad de alargar el periodo de inclusión de pacientes. Las evidencias disponibles muestran tasas inferiores al 2% en pacientes tratados con HBPM32. En la serie de casos de Rodríguez-Alonso33 se describen tasas del 1,7% de TVP con un 0,9% TEP. Resultados similares a los descritos por otros autores34. Destaca su asociación con la infección intrahospitalaria, ocasionando un mayor uso de los recursos tanto hospitalarios como ambulatorios35. Parece evidente que a pesar del tratamiento administrado, sigue siendo una complicación frecuente36. En función de los resultados, y a pesar de los esfuerzos profilácticos realizados para erradicar la TVP, parece que aún existe un cierto margen de mejora.
Nuestros resultados muestran que la infección es la complicación más importante, y asociada al grupo de pacientes con sangrado y trombosis; observándose un mayor consumo de antibióticos, que además puede suponer un riesgo adicional debido al desarrollo de resistencias bacterianas. En la bibliografía consultada su incidencia oscila en la ATC primaria entre el 0,4-5%, estando en consonancia con el estudio37–39. Cabe destacar que el procedimiento quirúrgico ha ido evolucionando, con lo que últimamente se están desarrollado técnicas mínimamente invasivas, en las que la incisión quirúrgica se reduce considerablemente. Es posible que al utilizar una incisión menor, disminuir la pérdida sanguínea, la duración de la intervención, el traumatismo quirúrgico, y una rápida rehabilitación, disminuya la estancia hospitalaria y la probabilidad de infección40. No obstante, en nuestro estudio no se ha podido cuantificar su impacto.
El promedio de días de estancia en los grupos de trombosis, sangrado y control fue de 13,9; 11,5 y 7,4 días, respectivamente; y los costes fueron de 10.484 €; 8.766 € y 6.496 €; respectivamente, siendo 8.003 € el coste medio general. El coste se asoció mayoritariamente al número de estancias hospitalarias (incluyendo reingresos), ocasionadas por las complicaciones intrahospitalarias, en especial la infección nosocomial. Estos resultados parecen fáciles de interpretar, aunque difíciles de comparar; dada la ausencia de estudios con metodología similar. En nuestro país, Martí-Valls et al.41 en una serie de 332 casos con reemplazo total de cadera describió un coste por proceso de 5.051 €, relacionado con los días de estancia y el coste de la prótesis; Navarro-Espigares y Hernández-Torres42 en una serie de 80 casos de ATC y ATR (40 por cada articulación) destacan un coste de 7.891 y de 6.866 €, respectivamente; y mostró que el estado funcional y la salud autopercibida mejoraron tras la intervención; Riu et al.43, en una serie en que describe el impacto asistencial de la puesta en funcionamiento de una unidad funcional de artroplastia de rodilla, obtuvo un coste global del proceso de 7.592 €. Estos resultados pueden interpretarse a nivel general, como similares a los hallados en nuestro estudio; aunque en nuestro caso se muestran diferencias entre los grupos de estudio analizados. Estas diferencias se deben a la probabilidad de desarrollar alguna complicación durante el seguimiento de los pacientes. Durante los últimos años, la utilización se recursos se ha vuelto más eficiente en la artroplastia, en parte motivados por el seguimiento de las guías de práctica clínica. A nivel internacional, el coste medio del proceso oscila entre los 5.500 € y los 12.500 €. Las variaciones encontradas se deben mayoritariamente a las variables incluidas, al método de la medida de los costes, al tipo de procedimiento quirúrgico desarrollado y al modelo de política sanitaria y organizativo utilizado44–48. Cabe destacar que en nuestro estudio se han usado el promedio/unitario de los costes, de manera que la valoración es independiente del momento del análisis. Esto significa que la variación de coste final se debe totalmente a cambios en el volumen de recursos sin incorporar cambios relacionados con la variación de precios de los factores de producción derivados de cambios organizativos ni de la gestión de recursos humanos. En relación con los reingresos hospitalarios, en la mayoría de los estudios revisados se mantienen en torno al 3-5%7; estos resultados están en consonancia con nuestro estudio, por lo que no debe ser considerada como una variable que maximice el coste sanitario.
Futuras investigaciones hacen necesario disponer de estudios de coste/efectividad49, de demora diagnóstica y de indicación del tratamiento quirúrgico; además de replicar el estudio en otras organizaciones sanitarias. Otro aspecto que se debe tener en cuenta sería cómo afectan los factores de riesgo de los pacientes en tener malos resultados quirúrgicos y complicaciones intrahospitalarias (el seguimiento ambulatorio tuvo poca repercusión), ocasionando una reducción de estancias y de costes. Cabe destacar que la amplia oferta de prótesis, la escasa información disponible sobre sus resultados a largo plazo y el impacto de la cirugía de revisión sobre la salud de los pacientes y los costes de la atención sanitaria ha llevado a algunos países a desarrollar registros de artroplastias. Dada la cantidad de alternativas existentes, sería adecuado consensuar una guía de toma de decisiones de cara a seleccionar el tipo de prótesis más adecuado en función del estado de salud y del diagnóstico previo del paciente. En definitiva, el establecimiento de programas de actuación organizados y consensuados, elaborados por equipos multidisciplinarios encargados del tratamiento de este tipo de enfermedad, debe permitir la reducción de la variabilidad50 y, por ello, del coste en su tratamiento.
En conclusión, las artroplastias primarias totales de cadera y rodilla son procedimientos quirúrgicos que generan un importante uso de recursos sanitarios hospitalarios. Estos costes son más elevados en los pacientes que han desarrollado una trombosis y sangrado respectivamente. Los costes están mayoritariamente relacionados con la prolongación de los días de estancia y las infecciones intrahospitalarias.
Nivel de evidenciaNivel de evidencia I.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEste estudio ha sido financiado conjuntamente por Pfizer S.L.U. y Bristol-Myers Squibb S.A. Marina de Salas es empleada de Pfizer S.L.U.; Irene Lizano era empleada de Pfizer S.L.U. en el momento de la elaboración del manuscrito; Lourdes Betegón es empleada de Bristol-Myers Squibb S.A. El resto de los autores no tiene ningún conflicto de intereses.
A los profesionales de los 3 hospitales participantes.