La compresión neurológica se presenta entre el 10-20% de los pacientes que desarrollan una metástasis vertebral. En la última década, la evolución de las técnicas diagnósticas y médicas oncológicas, el cambio de la radiación convencional externa a la radiocirugía y los nuevos instrumentales quirúrgicos, han hecho que el tratamiento de estos pacientes deba de ser indicado de forma personalizada y en consenso, de forma multidisciplinar, en comisiones específicas.
Hoy, el estado biológico del paciente, la presencia de inestabilidad mecánica, la valoración neurológica y el grado de compresión epidural, así como la mejor categorización pronóstica del tumor, se establecen como los factores de decisión previa a la indicación del tratamiento quirúrgico, tratamiento que ha pasado de un concepto «citorreductor» al de «separador» o «preparador» de la médula para asegurar una radiocirugía segura.
Neurological compression occurs in 10%-20% of patients who develop spinal metastases. In the last decade, the evolution of oncological diagnostic and medical techniques, the change from conventional external radiation to radiosurgery and the new surgical instruments have meant that the treatment of these patients must be indicated in a personalized manner and by consensus, multidisciplinary way, in specific commissions.
Today, the biological state of the patient, the presence of mechanical instability, the neurological assessment and degree of epidural compression, as well as the best prognostic categorization of the tumor, are established as decision factors prior to the indication of surgical treatment, treatment that has passed from a cytoreductive concept to that of a spinal cord release from tumor in order to ensure safe radiosurgery.
En cifras de 2018 de los EE. UU., hay un diagnóstico de 1,7 millones de nuevos diagnósticos de cáncer al año, de ellos, entre un 40 y un 70% desarrollarán metástasis (mx) vertebrales, siendo los más frecuentes en desarrollarlos el de mama (40%), pulmón (15%), próstata (10%) y renal (10%); y entre estos, alrededor de un 20% progresarán a una compresión medular. En un número no despreciable de ellos la presencia de clínica, manifestada como dolor o sintomatología neurológica implica un tratamiento quirúrgico que, desde el trabajo no demasiado lejano de Patchell et al.1, demostraron superioridad sobre la radioterapia sola en términos de mejora de los resultados neurológicos, de mejor calidad de vida y menor costo económico y social.
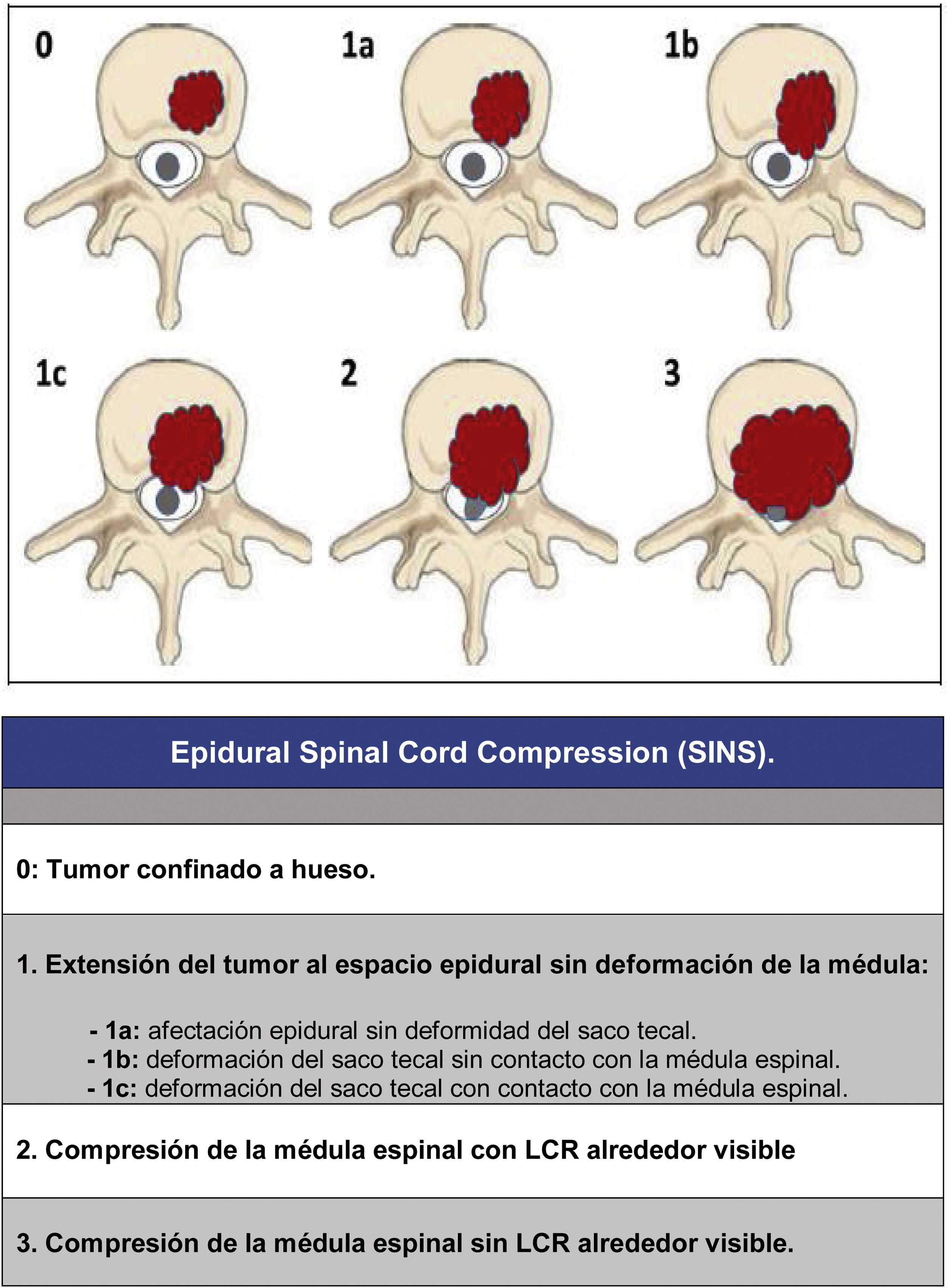
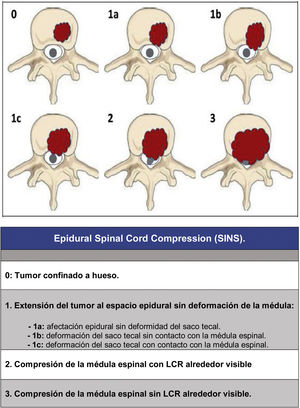
Desde entonces el cambio en el enfoque del tratamiento de estos pacientes excede a una visión única; el abordaje debe de hacerse valorando múltiples parámetros: calidad de vida, estado neurológico, tumor primario, extensión, estabilidad, etc., a fin de adecuar el tratamiento a las características clínicas de cada paciente. En este sentido queremos resaltar 3 trabajos, ya clásicos, pero que han permitido poder realizar una categorización consensuada de forma multidisciplinar, y con ello conseguir una mejor adecuación del tratamiento: la escala revisada de Tokuhashi et al., 20052 (tabla 1), para la valoración de la enfermedad tumoral y su carga metastásica, la escala Spinal Instability Neoplastic Score (SINS) 2010 en la valoración biomecánica3 (tabla 2) y la graduación de la compresión epidural Epidural Spinal Cord Compression (ESCC) de Bilsky et al., 20104 (fig. 1) para la valoración de la posibilidad de riesgo medular en el tratamiento radioterápico. La integración de estos conceptos da lugar al actual enfoque en el tratamiento de la patología metastásica, el algoritmo NOMS (Neurologic, Oncologic, Mechanical, Sistemic framework)5 base de trabajo de las actuales comisiones de metástasis vertebrales.
Escala pronóstica de Tokuhashi (revisada 2005)
| Escala de evaluación revisada para el pronóstico de las metástasis vertebrales | |
|---|---|
| Características | Puntuación |
| 1. Condición general (estado funcional): | |
| Pobre (EF 10-40%). | 0 |
| Moderada (EF 50-70%). | 1 |
| Buena (EF 80-100). | 2 |
| 2. Número de mx óseas extraespinales: | |
| ≥3 | 0 |
| 1-2 | 1 |
| 0 | 2 |
| 3. Número de mx óseas extraespinales: | |
| ≥3 | 0 |
| 1-2 | 1 |
| 0 | 2 |
| 4. Metástasis en órganos internos mayores: | |
| No resecables | 0 |
| Resecables | 1 |
| No metástasis | 2 |
| 5. Tumor primario: | |
| Pulmón, osteosarcoma, esófago, estómago, vejiga, páncreas | 0 |
| Hígado, no identificado | 1 |
| Otros | 2 |
| Riñón, útero | 3 |
| Recto | 4 |
| Tiroides, mama, próstata, tumor carcinoide | 5 |
| 6. Parálisis: | |
| Completa (Frankel A, B) | 0 |
| Incompleta (Frankel C, D) | 1 |
| No parálisis (Frankel E) | 2 |
| Criterios pronósticos según puntuación: | |
| 0-8<6 meses de sobrevida | |
| 9-11≥6 meses de sobrevida | |
| 12-15≥1 año de sobrevida | |
Spinal Instability Neoplastic Score
| Spinal Instability Neoplastic Score (SINS) | |
|---|---|
| Características | Puntuación |
| 1. Ubicación: | |
| Transicional (Occ-C2, C7-T2, T11-L1, L5-S1) | 3 |
| Columna vertebral móvil (C3-C6, L2-L4) | 2 |
| Columna vertebral semirrígida (T3-T10). | 1 |
| Columna vertebral rígida | 0 |
| 2. Dolor: | |
| Sí | 3 |
| Dolor ocasional pero no mecánico | 1 |
| Lesión sin dolor | 0 |
| 3. Lesión ósea: | |
| Lítico | 2 |
| Mixto | 1 |
| Blástico | 0 |
| 4. Alineación espinal radiográfica: | |
| Subluxación/traslación presente | 4 |
| Deformidad de novo (cifosis/escoliosis) | 2 |
| Alineación normal. | 0 |
| 5. Colapso del cuerpo vertebral: | |
| >50% de colapso | 3 |
| <50% de colapso | 2 |
| Sin colapso con >50% del cuerpo afectado | 1 |
| Ninguna de las anteriores | 0 |
| 6. Afectación de elementos posterolaterales: | |
| Bilateral | 3 |
| Unilateral | 1 |
| Ninguna de las anteriores | 0 |
| Criterios pronósticos según puntuación: | |
| 0-6: estable | |
| 7-12: indeterminado o inminente inestabilidad | |
| 13-18: inestable | |
| SINS 7-18: garantizar la interconsulta a cirugía | |
Hoy consideramos la previsión de supervivencia menor de 3 o 6 meses como el umbral a considerar para ofertar un tratamiento invasivo, pero, ¿cómo podemos denegar tratamientos a pacientes cuando no podemos asegurar con seguridad esta expectativa de vida? o ¿cómo podemos denegar el tratamiento a pacientes con dolor incapacitante o déficit neurológico progresivo porque su expectativa de vida es menor de 3 meses?
Esta visión, establecida sobre conocimientos y evidencias que podemos datar en la primera década de este siglo, está además cambiando con el desarrollo de los nuevos tratamientos oncológicos basados en la terapia génica y molecular (las escalas más utilizadas, Tomita o Tokuhashi no incluyen esta consideración), los cambios en los algoritmos de radioterapia basados en dosis únicas mayores dirigidas (Stereotactic Body RadioTherapy [SBRT], radiología estereotáxica extracraneal) o con protones que consiguen altos porcentajes (70-90%) de control local independientemente del primario6 o, en cirugía, el cambio del concepto de cirugía «excisional» a la cirugía de «separación» asociada a la radiocirugía (SBRT), quedando la primera sobre todo indicada en el tratamiento de los tumores radiorresistentes. Todos ellos están dando a los pacientes una mejor expectativa de vida, y a los oncólogos y cirujanos nuevas armas terapéuticas.
En este sentido de centrar el tratamiento quirúrgico en las expectativas y calidad de vida del paciente merece la pena valorar los resultados del trabajo de Dea et al.7 en que valoran una cohorte internacional de 466 pacientes, procedentes de países de distintas culturas, con un pronóstico de supervivencia menor de 3 meses. En sus resultados presentan que el 76,9% de los mismos se sintieron satisfechos con su tratamiento a las 6 semanas y ninguno refirió no recomendarlo. Sin embargo, como es esperable, encontraron un mayor número de efectos adversos en el grupo de pacientes de menor esperanza de vida frente a los de mayor esperanza, efectos que, al analizarlos, se presentaron no en el manejo intraoperatorio (no se asociaron a la «carga quirúrgica» medida en duración de la cirugía o pérdida de sangre), sino en el período postoperatorio.
Por todo ello concluyen, y en ello estamos de acuerdo, que debe ser más el estado basal clínico preoperatorio que la supervivencia esperada el determinante principal de la indicación quirúrgica, indicaciones que deben también valorar el concepto de eficiencia en el resultado, aconsejando la de menor agresividad posible.
Revisión de las escalas predictivasEsta mejora en la supervivencia de los pacientes tumorales con enfermedad metastásica, conseguida gracias a un mejor conocimiento y tratamiento de la biología de las metástasis, (mecanismo de asociación RANKL-RANK y el desarrollo de medicaciones que bloquean el mismo impidiendo el proceso de osteolisis como el denosumab), al progreso de las nuevos conocimientos en inmunogenética que han hecho realidad tratamientos con fármacos diana dirigidos contra las células tumorales que permiten mejores supervivencias en tumores clásicamente más agresivos como el pulmón, melanoma u ovario o el mejor conocimiento de la biomecánica raquídea en el contexto de la lesión metastásica en estos pacientes, ha dado lugar, en los últimos años, a numerosos trabajos de revisión de las escalas predictivas basadas en el análisis de acierto según la técnica del área bajo la curva (AUC). En los mismos se aprecian buenos resultados de predicción (discriminación «estadístico c: pacientes que sobreviven/mueren siendo el mejor resultado “1” y un resultado igual al azar “0,5”»).
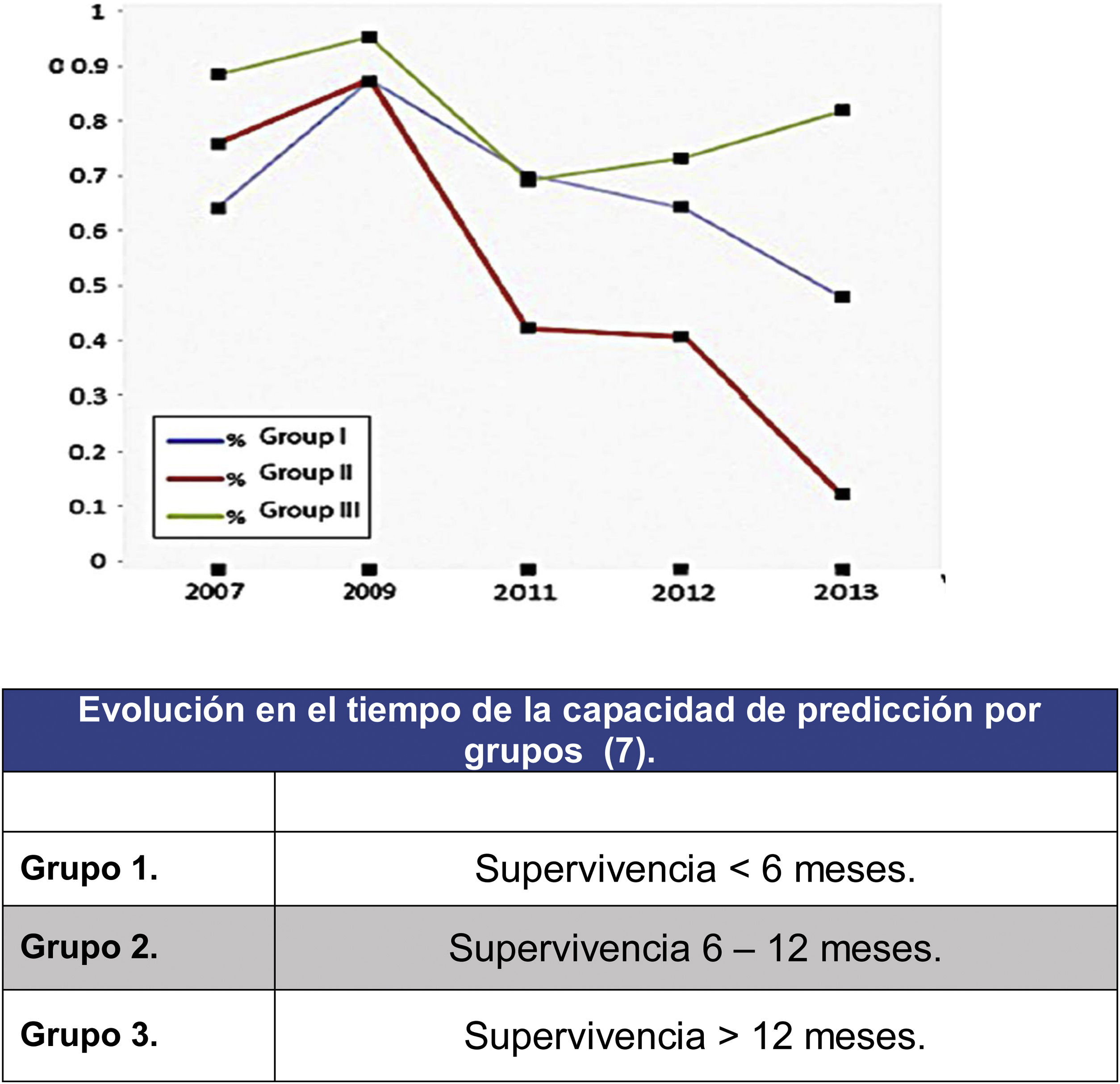
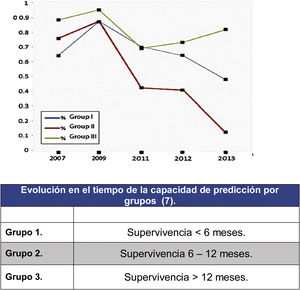
En este sentido señalar el análisis de los resultados predictivos de la escala de Tokuhashi realizado por Zoccali et al.8 en el que se analiza la fiabilidad en el pronóstico de supervivencia de la escala desde el año 2007 al 2013 (fig. 2). En este metaanálisis sobre los resultados de 10 trabajos que engloban 1.686 pacientes se analiza la predicción atendiendo a los 3 grupos que define la escala de Tokuhashi (grupo 1: supervivencia <6 meses, grupo 2: supervivencia 6-12 meses y grupo 3: supervivencia >12 meses) encontrando que si la precisión general de predicción de la escala era del 63% era muy distinta dependiendo del grupo siendo mayor para el grupo de mayor supervivencia (grupo 3: 77,21%), descendiendo para el grupo 1 (64,10%) y no mayor que el azar para el grupo 2 (55,12%). El descenso de predicción ha aumentado desde la aparición de la escala en 2005 hasta hoy, lo que traduce la falta de sensibilidad de los parámetros en los grupos de peor pronóstico que son los que más se han beneficiado del desarrollo de los tratamientos más actualizados.
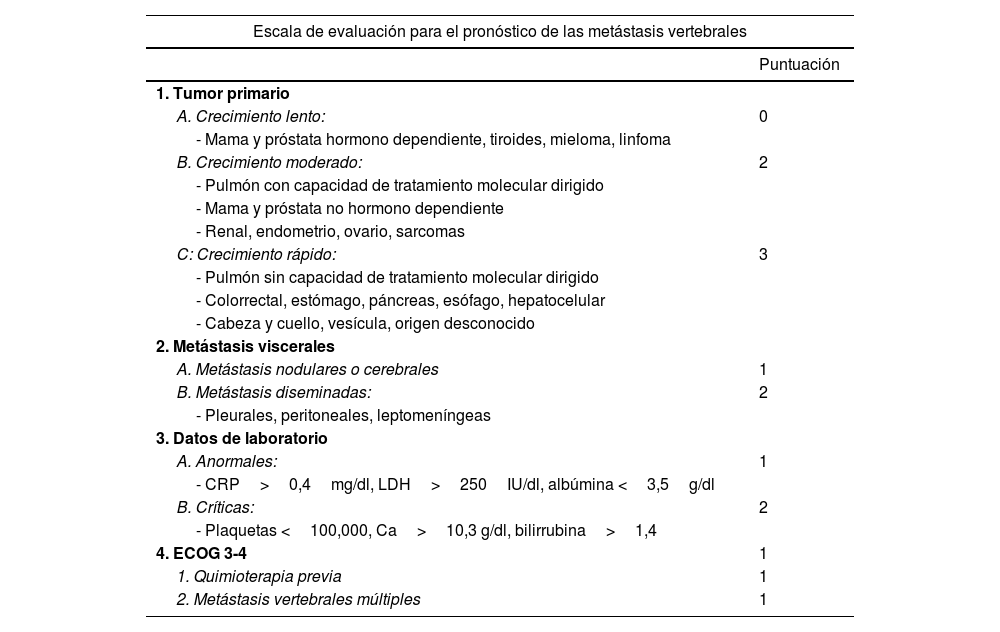
Nuevas escalas y parámetros se proponen para mejorar la fiabilidad de las predicciones en los grupos de mayor riesgo, un primer ejemplo de ellas es la realizada por el grupo de Katagiri et al.9 (tabla 3), por primera vez se establecen diferencias pronósticas dependiendo de la sensibilidad al tratamiento hormono dependiente en el caso de la mama o próstata o con fármacos diana específicos en el cáncer de pulmón, y se incluyen además en la valoración parámetros bioquímicos. La escala, con una puntuación entre 0 y 10, desde nuestro punto de vista mejora los resultados pronósticos (>0,75, <0,25) para los grupos de alta y baja supervivencia, así como en la supervivencia a 6 meses de los pacientes calificados como intermedios. De esta forma las recomendaciones para pacientes con puntuación 0-3, cuya expectativa de vida es mayor de un año en el 91%, el tratamiento con radiocirugía o asociada a cirugía separación sería la indicación. Sin embargo, para los pacientes con puntuación entre 7-10, con expectativas de supervivencia de 6 meses del 27% y solo del 6% en un año, la opción más indicada sería la radioterapia convencional asociada a fijación interna en caso de inestabilidad o progresión neurológica.
Escala pronóstica de Katagiri8
| Escala de evaluación para el pronóstico de las metástasis vertebrales | |
|---|---|
| Puntuación | |
| 1. Tumor primario | |
| A. Crecimiento lento: | 0 |
| - Mama y próstata hormono dependiente, tiroides, mieloma, linfoma | |
| B. Crecimiento moderado: | 2 |
| - Pulmón con capacidad de tratamiento molecular dirigido | |
| - Mama y próstata no hormono dependiente | |
| - Renal, endometrio, ovario, sarcomas | |
| C: Crecimiento rápido: | 3 |
| - Pulmón sin capacidad de tratamiento molecular dirigido | |
| - Colorrectal, estómago, páncreas, esófago, hepatocelular | |
| - Cabeza y cuello, vesícula, origen desconocido | |
| 2. Metástasis viscerales | |
| A. Metástasis nodulares o cerebrales | 1 |
| B. Metástasis diseminadas: | 2 |
| - Pleurales, peritoneales, leptomeníngeas | |
| 3. Datos de laboratorio | |
| A. Anormales: | 1 |
| - CRP>0,4mg/dl, LDH>250IU/dl, albúmina <3,5g/dl | |
| B. Críticas: | 2 |
| - Plaquetas <100,000, Ca>10,3 g/dl, bilirrubina>1,4 | |
| 4. ECOG 3-4 | 1 |
| 1. Quimioterapia previa | 1 |
| 2. Metástasis vertebrales múltiples | 1 |
| Criterios pronósticos según puntuación (95%) | |||
|---|---|---|---|
| Puntuación | 6 meses | 12 meses | 24 meses |
| 0-3 | 0,981 | 0,914 | 0,778 |
| 4-6 | 0,740 | 0,493 | 0,276 |
| 7-10 | 0,269 | 0,060 | 0,021 |
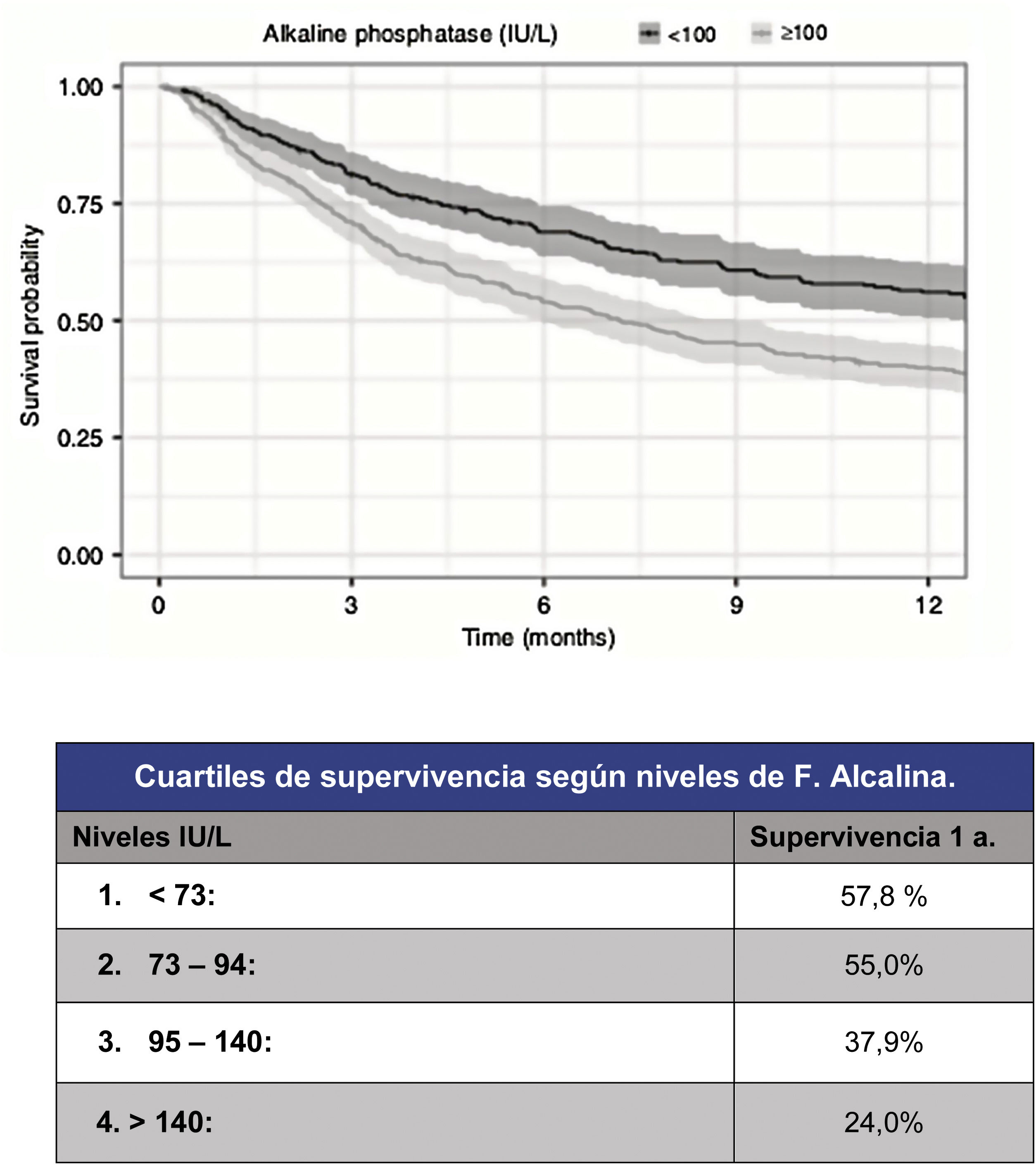
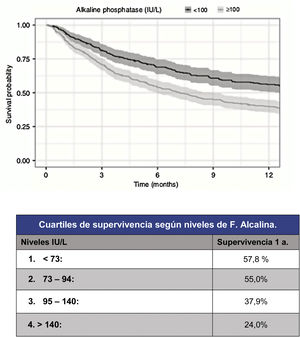
Sin embargo, si bien la capacidad predictiva de estas escalas han mejorado hasta alcanzar un estadístico c=0,78 para la predicción a un año, su capacidad de predicción para los pacientes más graves lo ha hecho en la misma medida. Así pues, se han propuesto para mejorar la fiabilidad en la predicción de la supervivencia, incluir nuevos parámetros, sobre todo bioquímicos. Como un ejemplo útil y simple, por ejemplo, Karhade et al.10 (fig. 3) proponen los niveles de fosfatasa alcalina sérica menores de 100 (c=0,75) como factor pronóstico independiente de supervivencia mayor de 6 meses y/o de carga tumoral metastásica.
Pronóstico según niveles de fosfatasa alcalina9.
La FA es una metaloenzima que se expresa en la superficie de los osteoblastos y cuyo nivel indica aumento de su actividad. En caso de lesiones osteolíticas se produce de forma secundaria en un intento de compensar la destrucción y en lesiones osteoblásticas por la estimulación directa. La FA es también un marcador de obstrucción de la vía biliar intrahepática por metástasis hepática.
En cuanto a la carga metastásica tumoral niveles >100UI/l se relacionan con diferencia estadísticamente significativa (p<0,001) para presencia de metástasis múltiples en columna (102UI/l), presencia de mx óseas extra espinales (105UI/l) o presencia de mx viscerales (105UI/l).
Finalmente, el papel pronóstico de la FA en paciente solo tratados con RT, QT o medidas paliativas no ha sido estudiado. Tampoco lo ha sido los cambios en FA en pacientes tratados con antirresortivos de forma previa o tras la cirugía.
Nuevas escalas basadas en algoritmosEn este intento de asegurar la predicción de supervivencia destaca la línea de trabajo del grupo de Paulino et al.11,12 del Massachusetts General Hospital que describe un primer algoritmo, «SORG normogram», basado en múltiples parámetros para alcanzar una predicción del 0,70 a los 30, 90 y 365 días.
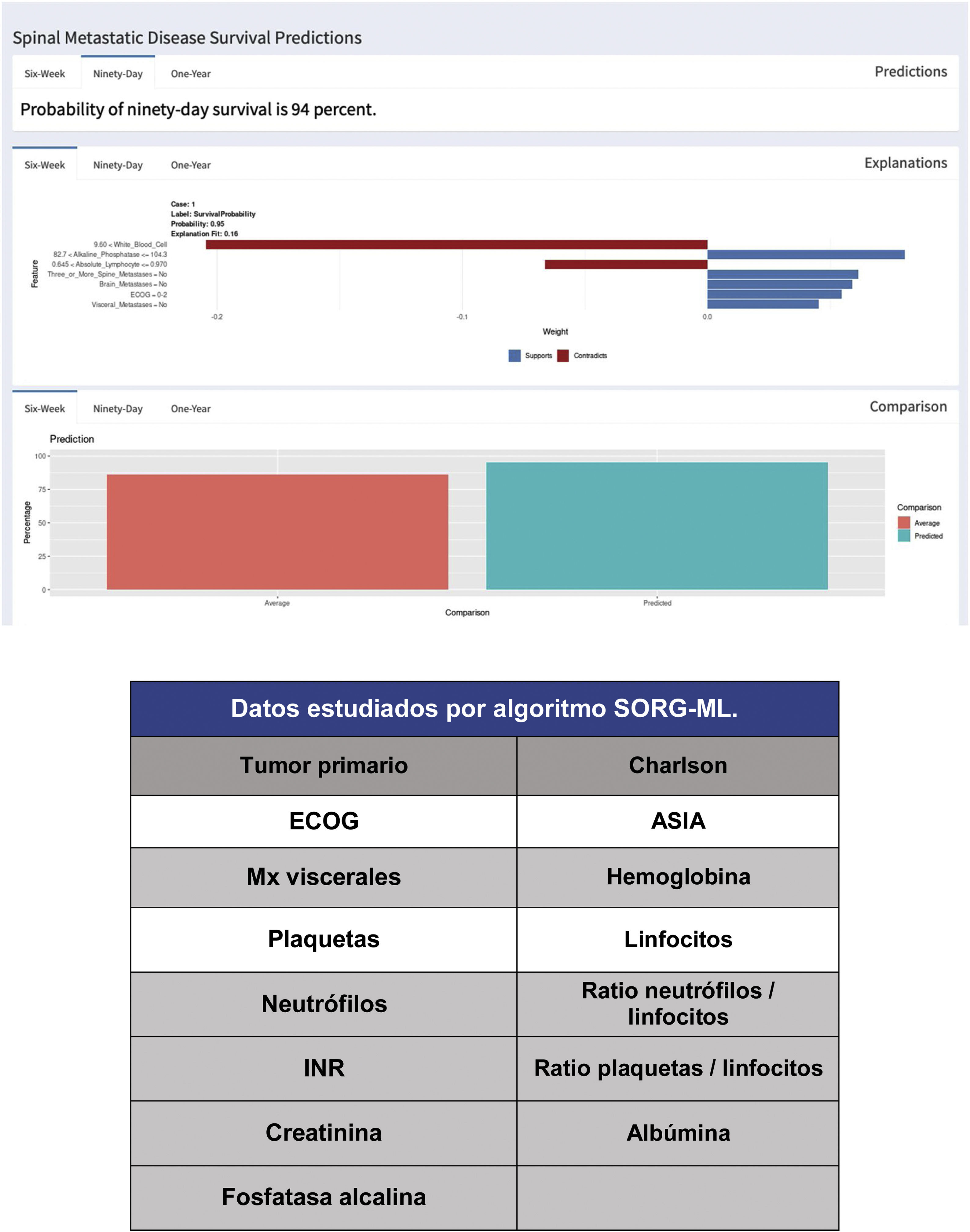
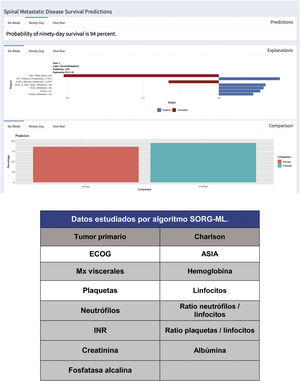
Desde la publicación de la estadificación del «SORG normogram» se ha seguido trabajando en algoritmos de decisión más completos y basados en las capacidades de la inteligencia artificial («machine learning»). Liderados por el grupo de Karhade, de la Harvard Medical School, y a los que se ha sumado el grupo de Sciubba, de la Johns Hopkins University School of Medicine13,14, crean el algoritmo de predicción de supervivencia «SORG Machine-Learning» (SORG-ML), algoritmo basado en 15 parámetros clínicos y bioquímicos que, introducidos en una base de datos informatizada, nos dan una predicción automatizada. Este algoritmo, validado de forma externa15, mejora los resultados en discriminación (c-estadístico 0,75-0,81 para los 90 días y 0,77-0,78 para un año), calibración, puntuación de Brier (diferencia media al cuadrado entre lo predicho por el modelo y lo observado) y curva de decisión.
Este estudio se basa en la metodología de detección antes descrita, y sobre el estudio de una muestra de 781 pacientes y 15 variables, tanto cualitativas (tumor primario, ECOG o escala de morbilidad de Charlson16,17, (tabla 4) como cuantitativas (niveles de F Alc., hemograma, etc.), creando un algoritmo informatizado de acceso libre que nos valora la supervivencia a 90 y 365 días sobre 15 parámetros de distintas características (https://sorg-apps.shinyapps.io/spinemetssurvival/ (fig. 4).
Escala de comorbilidades de Charlson
| Escala de comorbilidad de Charlson | |
|---|---|
| Características | Puntuación |
| - Infarto de miocardio o miocardiopatía congestiva | |
| - Enfermedad vascular periférica o aneurisma aórtico >6cm | |
| - Enfermedad cerebrovascular, demencia | |
| - Enfermedad pulmonar obstructiva crónica | 1 |
| - Enfermedades del tejido conectivo | |
| - Úlcera péptica o hepatopatía (sin hipertensión portal) | |
| - Diabetes sin afectación orgánica | |
| - Hemiplejia | |
| - Enfermedad renal moderada-severa | |
| - Diabetes con afectación orgánica (retinopatía, neuropatía....) | 2 |
| - Tumor no metastásico | |
| - Leucemia, linfoma | |
| - Enfermedad hepática moderada-severa | 3 |
| - Enfermedad metastásica | 6 |
| - Sida definido (no solo HIV positivo) | |
| Para cada década por encima de los 40 años se añade 1 punto al total. | |
HIV: virus de la inmunodeficiencia humana.
Respecto a la mortalidad a 90 días, la capacidad de predicción del algoritmo obtuvo una c=0,83 siendo las variables predictivas más importantes el tumor primario, la albúmina preoperatoria y el grado ECOG. Respecto a la mortalidad al año obtuvo un estadístico c=0,85.
Se ha realizado la validación externa del algoritmo SORG-ML comparada con 9 escalas pronósticas (Tokuhashi, revised Tokuhashi, Tomita, Bauer, revised Bauer, Katagiri, van der Linden, SORG classic y Sorg normogram) con la conclusión que presenta una mejor predicción en la mortalidad a 90 días (AUC=0,75-0,81) y similar para un año (AUC=0,77-0,78).
Nuestras indicaciones atendiendo al concepto NOMSAtendiendo a este concepto multidisciplinar en el abordaje del tratamiento del paciente metastásico en el año 2015 el Metastatic Spine Disease Multidisciplinary Working Group, un grupo que incluye a oncólogos radioterapeutas, radiólogos intervencionistas y cirujanos, propone unas guías de tratamiento consensuadas atendiendo a 5 grupos clínicos18, corregido en 201919 (tabla 5). Siguiendo esta idea y la bibliografía actualizada, en la que son el estado general del paciente y la estabilidad los primeros factores a evaluar a la hora de la indicación, más que la propia sintomatología, hemos propuesto los siguientes grupos de tratamiento:
Grupos clínicos del Metastatic Spine Disease Multidiscilinary Working Group
| Grupos clínicos MSDMWG |
|---|
| 1. Metástasis vertebral asintomática |
| 2. Metástasis vertebral no complicada |
| 3. Metástasis vertebral inestable con fractura |
| 4. Metástasis vertebral estable con fractura |
| 5. Metástasis vertebral con compresión neurológica |
MSDMWG: Metastatic Spine Disease Multidiscilinary Working Group.
- a.
Radioterapia paliativa: la indicamos solo en aquellos pacientes con mal estado sistémico, ECOG 3-4 y/o con afectación neurológica ASIA A de más de 48h de evolución.
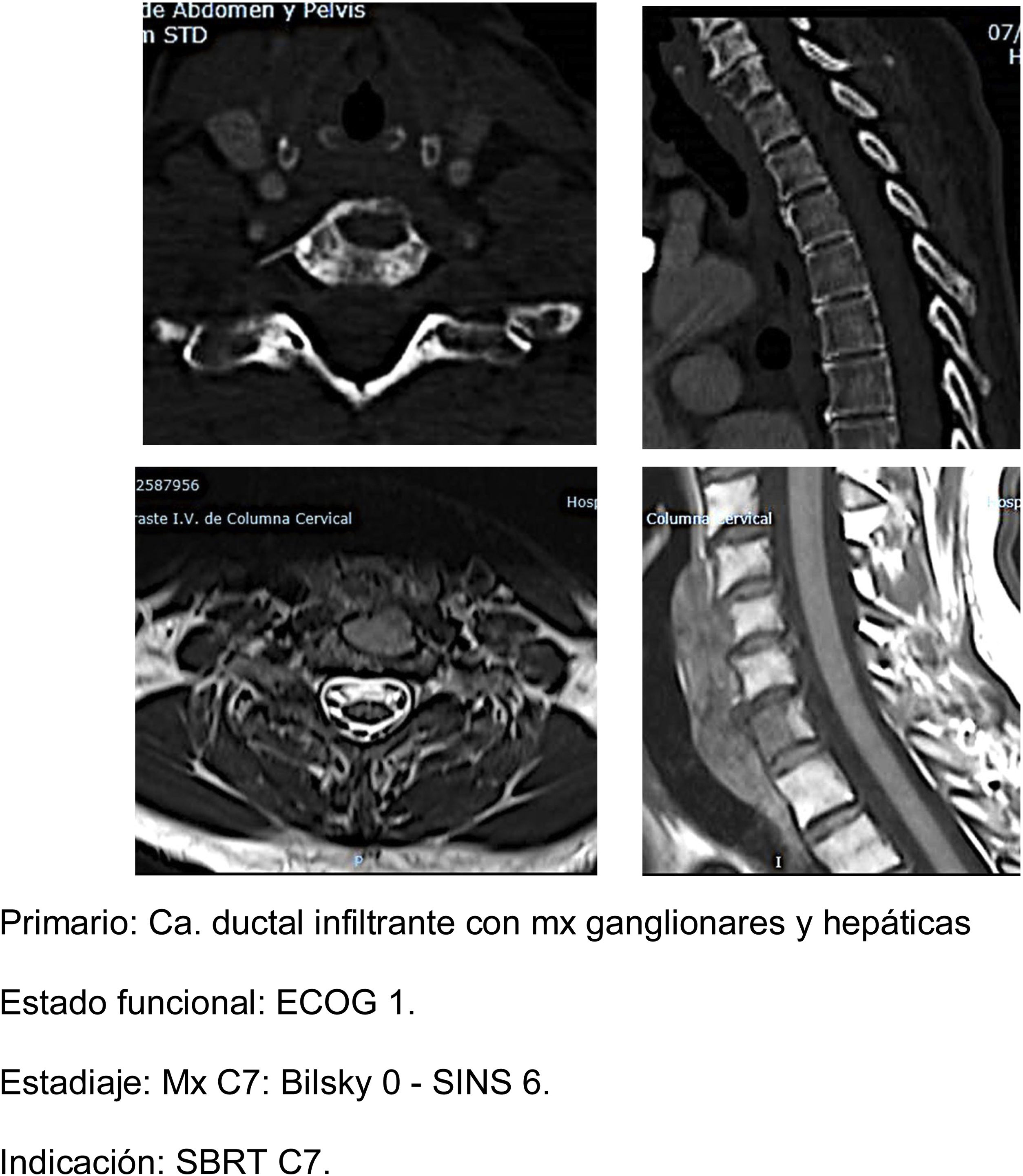
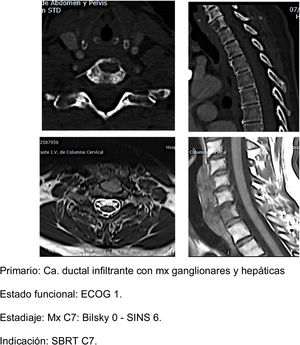
- b.
SBRT (fig. 5a-d): nuestra indicación de radiocirugía estereotáctica en dosis alta única se establece en pacientes con buen estado clínico ECOG 1-2, estables con SINS<6 y con compresión epidural <2. Preferentemente esperanza de vida >6 meses y con metástasis única20. Es importante tener en cuenta la determinación de la estabilidad vertebral previamente a la indicación de la SBRT como tratamiento único incluso en pacientes sin compresión epidural. En un estudio de pacientes21 con mx vertebrales sin compresión epidural, RT previa o cirugía a los que se realiza SBRT. Encuentran que pacientes con SINS≥11 se asociaban a un mayor número de efectos adversos en la zona radiada (fracturas vertebrales, ingreso por dolor, cirugía de urgencia o programada, nuevos síntomas neurológicos y/o compresión epidural). Mayor frecuencia de efectos adversos que se observa también si comparamos SBRT frente a la RT convencional multifracción.
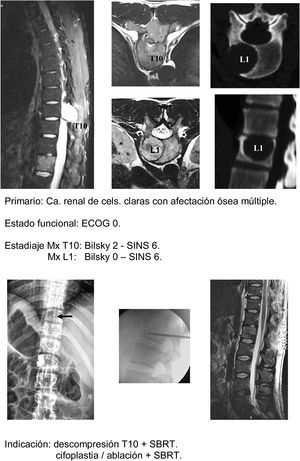
- c.
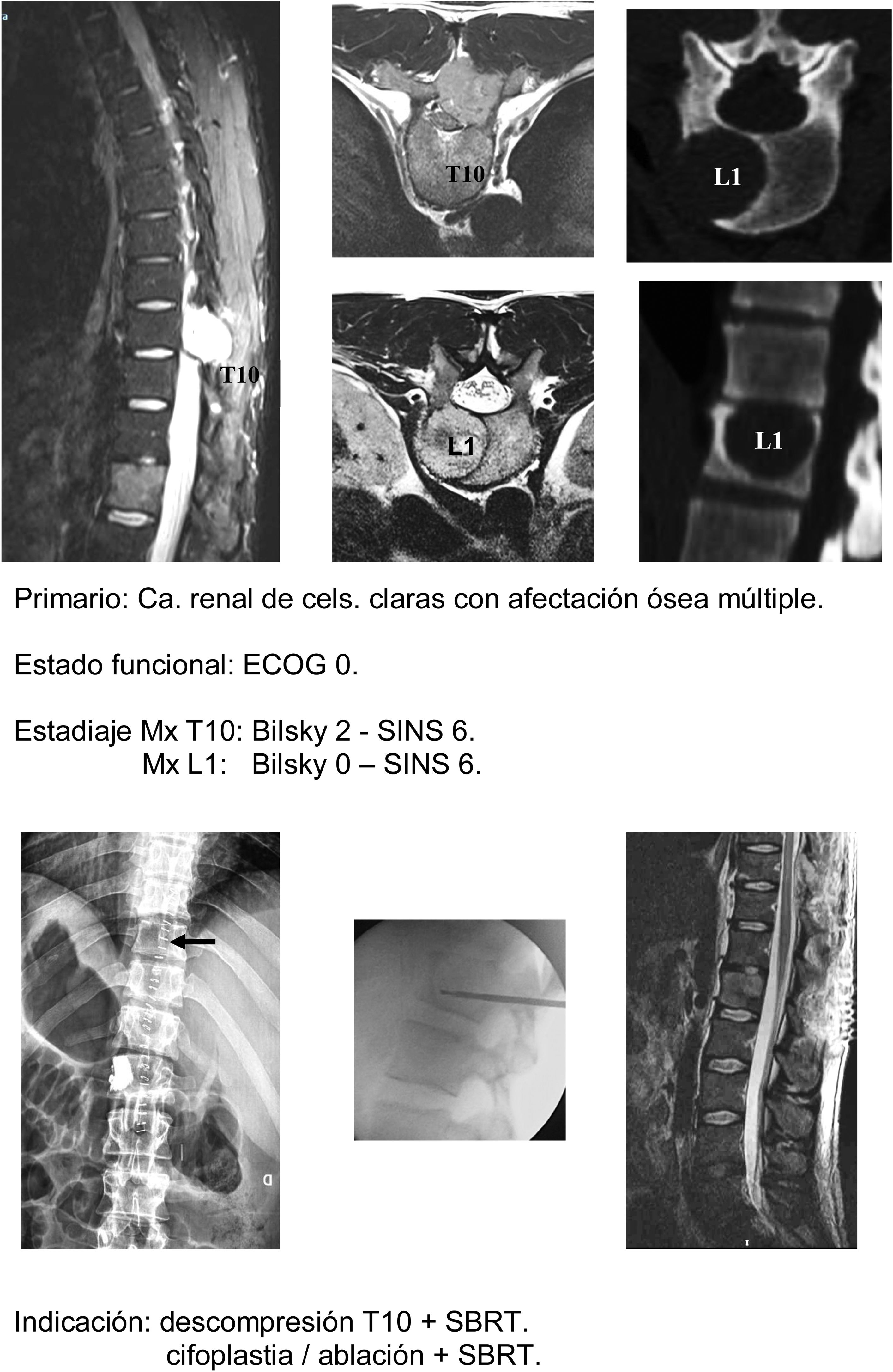
Técnicas mínimamente agresivas (fig. 6a-h): la asociación de RT con técnicas percutáneas como la ablación o la cementación es una opción útil para pacientes frágiles. Nuestra indicación es igualmente en pacientes hasta ECOG 2, con tumores de crecimiento lento y metástasis múltiples o metástasis que progresan a pesar de un control satisfactorio de la enfermedad sistémica, especialmente en zonas de charnela toracolumbar con SINS hasta 9 (atendiendo a las consideraciones indicadas por Lam et al.21, y preferiblemente con grados de compresión medular bajo (Bilsky 1C).
Algunas consideraciones en la aplicación de esta técnica deben de ser tenidas en cuenta a fin de evitar las complicaciones descritas con su aplicación (hasta un 20%). Contraindicaciones para el uso de la cementación son la afectación del muro posterior o la presencia de lesión neurológica. Respecto a la ablación se debe de establecer un mínimo de 5mm entre la zona de ablación y la médula con el fin de evitar la lesión medular y valorar la cementación con el fin de evitar el desarrollo de una fractura.
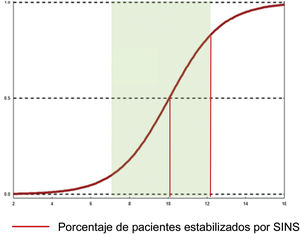
Tratamiento preventivo: SINS 7-12En la evaluación de la estabilidad mecánica de los pacientes valorada por la escala SINS, la guía de actuación es clara para los grupos «estable» (0-6) e «inestable» (13-18). Sin embargo, para la categoría «potencialmente inestable» (7-12), que significan el 75% de los pacientes consultados19 no hay un acuerdo consensuado sobre los parámetros para decidir o no la estabilización.
En este sentido Pennigtong et al.22 llevan a cabo una revisión de las decisiones terapéuticas indicadas en una serie de pacientes clasificados en este grupo, y de las características clínicas de los mismos. Presenta una serie de pacientes con mediana de SINS de 9 (IQR: 7-10 y moda 10) con un Tokuhashi de 8 (IQR: 7-11) con un 75% de lesiones inestables.
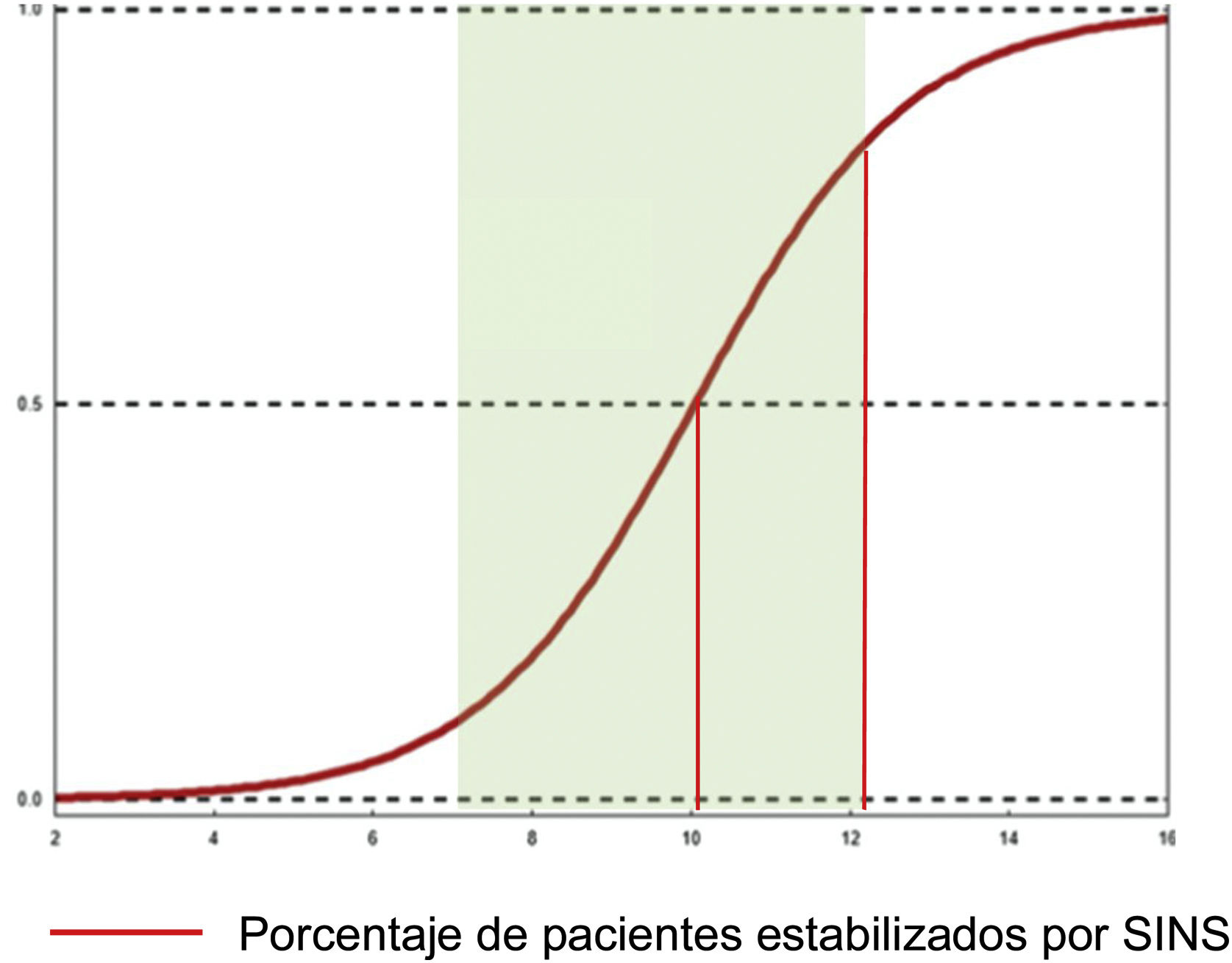
Sus conclusiones fueron que el 79% de los pacientes con SINS 10-12 eran intervenidos por solo el 11% con SINS 7-9. Las razones para intervenir pacientes con SINS 7-9 fue una compresión epidural ESCC 2-3, mientras que no se intervinieron pacientes con SINS altos con baja probabilidad de supervivencia (ECOG 3 y múltiples lesiones). Los pacientes intervenidos, independientemente de su SINS, eran significativamente más jóvenes, tenían un Tokuhashi más alto, asociado por tanto a una supervivencia mayor y también un Karnofsky mayor. Un subanálisis en estos pacientes también encontró una mayor afectación de lesiones líticas y dolor. Este hallazgo es similar al dado por Versteeg et al.23, que dan también cortes de 10,7 vs. 7,2 (fig. 7).
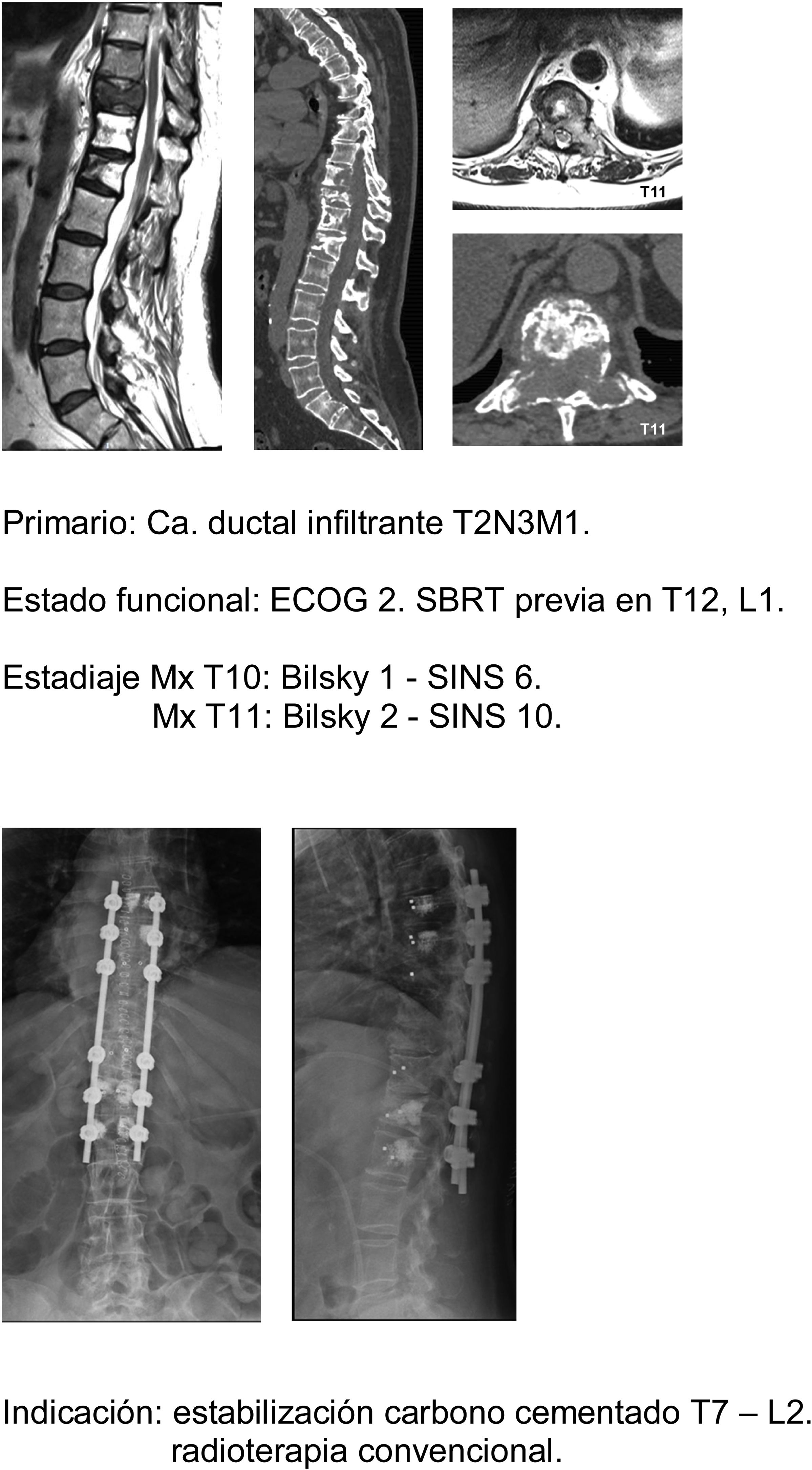
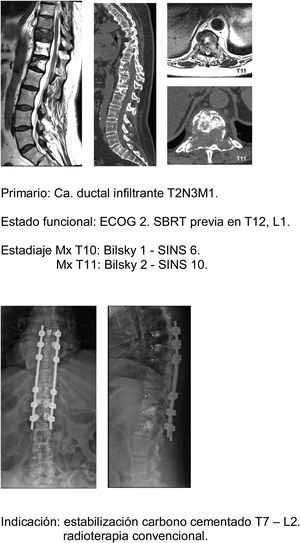
Siguiendo esta línea nuestra unidad es especialmente intervencionista en pacientes con SINS 9-12, especialmente en pacientes con múltiples localizaciones o sometidos a radioterapia previa. Siendo para nosotros el principal factor limitante el estado general del paciente y en un segundo lugar la neurología, mucho menos la supervivencia estimada, nuestro principal fin es asegurar la calidad de vida y estado neurológico durante la misma (fig. 8a-f).
Cirugía separaciónPara muchos grupos, incluido el nuestro, durante la última década del pasado siglo y la primera del presente el tratamiento quirúrgico indicado en los pacientes con metástasis única era la vertebrectomía en bloque descrita por Roy-Camille et al. y popularizada por Tomita et al.24,25 cuyo objetivo era realizar una cirugía «lo más compartimental posible», trasladando el concepto excisional de la cirugía oncológica de extremidades al raquis. Las objeciones a este tratamiento estriban, en primer lugar, en las propias características de la enfermedad metastásica y la presencia de metástasis «skip metástasis» no detectables en el momento de la indicación y a la extensión del tumor al espacio epidural (capa D en la clasificación de Weinstein et al.26 lo que implica la imposibilidad de que esta resección compartimental sea real salvo en los pacientes con afección intraósea tipo 1 de Tomita27.
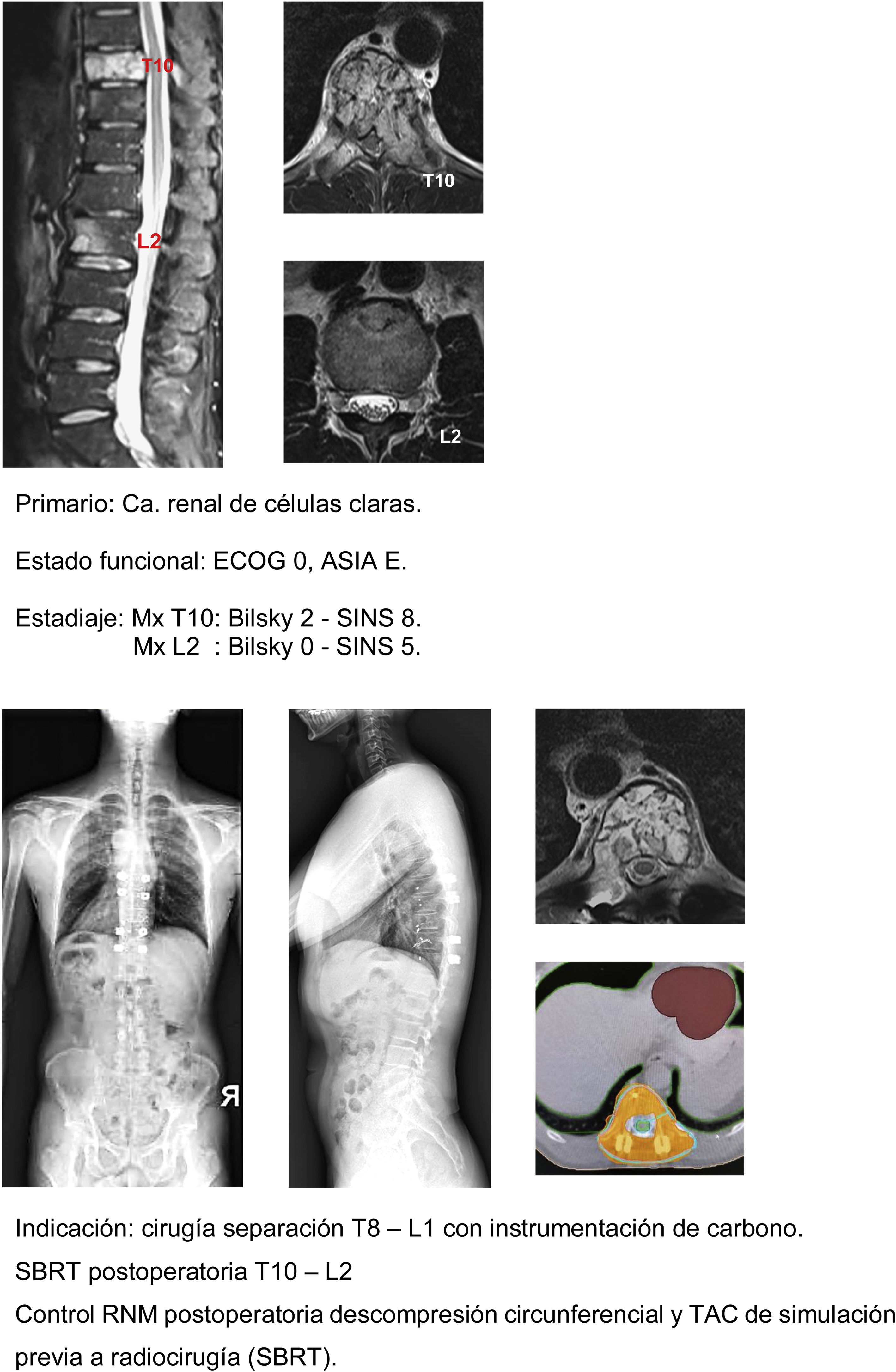
Este concepto cambia radicalmente a partir de la segunda década de nuestro siglo con la aparición de la aparición de la radiocirugía estéreotáctica (SRS o SBRT) que permite la aplicación total de la dosis en fracciones únicas minimizando la exposición de los tejidos en riesgo, especialmente la médula, lo que consigue un efecto citotóxico directo y un control local de hasta el 98% a los 2 años cambiando los objetivos de la radioterapia desde los tradicionales del alivio del dolor al tratamiento ablativo radioterápico de las metástasis vertebrales28 y, por tanto, de las indicaciones quirúrgicas basadas en la necesidad de reducción o escisión tumoral vertebral (corporectomías o vertebrectomías).
Sin embargo, estas altas dosis con efecto tumoricida necesitan un espacio de seguridad, estimado en unos 2mm para poder ser aplicadas, por lo que se define el concepto de «terapia híbrida» en el que la cirugía tiene el objetivo de crear este espacio que permita el tratamiento seguro con radiocirugía en una segunda fase.
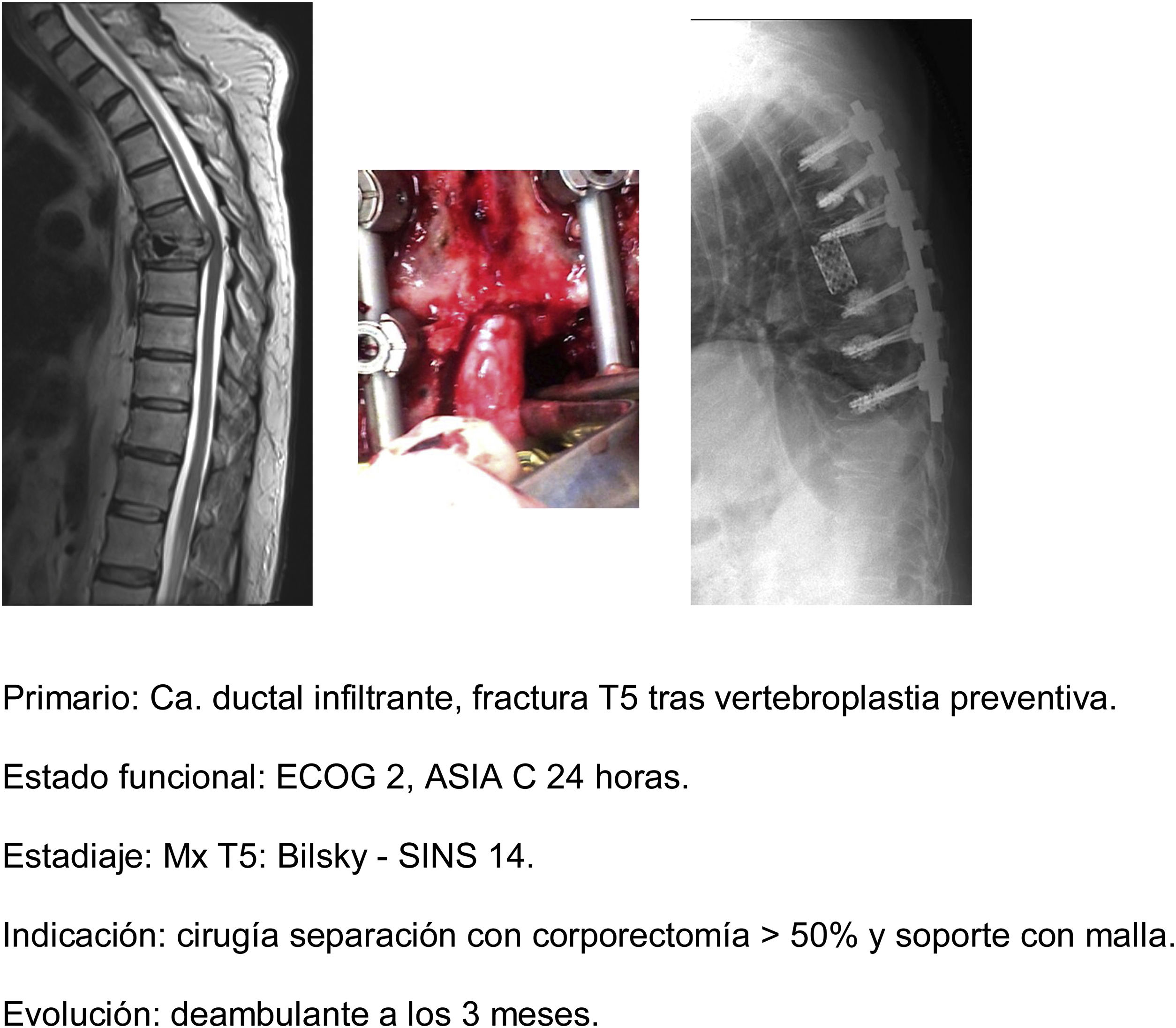
Barzilai et al.29 hacen en su artículo una descripción detallada de la técnica, que se basa en un primer paso en una estabilización instrumentada, al menos 2 niveles superior e inferior a la lesión con el fin de restaurar una inestabilidad mecánica presente o secundaria debido a la extirpación ósea de los elementos posteriores. Un segundo paso de descompresión que debe de tener en cuenta utilizar gestos técnicos que eviten emitir presión a dicha compresión, utilizando fresas en lo posible (zonas libres de afectación tumoral) y siendo cuidadosos en la manipulación intracanal de tacón del Kerrison. Esta parte posterior debe de terminar con la consecución de un pasillo de acceso al componente anterior que permita la resección de un 20% del cuerpo vertebral, la separación del saco dural del ligamento común vertebral posterior y la depresión del componente tumoral con el fin de obtener una separación circunferencial de la dura. La escisión del resto del tumor vertebral dentro del cuerpo o en tejidos paraespinales no es necesaria ya que se incluyen dentro del campo de tratamiento de la radiocirugía. El soporte anterior solo se necesitará en caso de una resección del cuerpo vertebral mayor del 50% (fig. 9a-c). En nuestra unidad, la protocolización de la embolización preoperatoria del tumor se realiza de forma casi rutinaria, especialmente en pacientes con tumores hipervasculares.
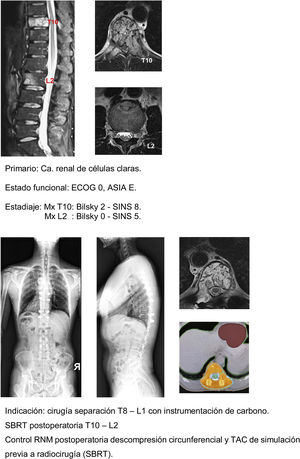
En los últimos años, distintas innovaciones tecnológicas han ido mejorando la técnica de separación, desde el punto de vista quirúrgico el desarrollo de los implantes de fibras de carbono reforzadas con PEEK® (fig. 10a-g) ha supuesto la mejora en la calidad de la aplicación de la planificación y aplicación de la radioterapia al evitar el efecto de dispersión que inducen los implantes de titanio sobre las radiaciones ionizantes y partículas aceleradas sin disminuir la seguridad ofertada por los mismos en términos mecánicos30, así como mejorar la calidad del uso de la RMN de forma postoperatoria31.
En nuestra unidad la técnica de elección en el tratamiento de las metástasis solitarias es la radiocirugía SBRT en caso de compresión medular Bilsky<2 y el protocolo híbrido descrito de cirugía separación con instrumentación de carbono asociada a SBRT precoz (2 semanas) en los casos de compresión Bilsky≥2. De acuerdo con la bibliografía referida la indicación de la técnica híbrida no depende del tipo de tumor o edad del paciente sino sobre todo de su estado funcional del paciente, el grado de lesión medular y el pronóstico atendiendo a la valoración NOMS.
Compresión medular asociada a alteración neurológicaDentro de este apartado de tratamiento «preventivo» hemos querido también incluir las indicaciones, sobre todo en tiempo, de la compresión medular con la afectación neurológica. En este sentido caben destacar los trabajos de Patchel et al.1,32 y Cole et al.32 en los que presentan una recuperación de la capacidad ambulatoria del 62% tras la cirugía de descompresión más estabilización más radioterapia realizada antes de 48h en pacientes con lesiones incompletas o progresivas, o el de Fan et al.33, este realizado sobre un grupo de 43 pacientes con paraplejias completas (34 tipo Frankel A y 9 Frankel B) en los que observaron que aquellos pacientes Frankel B intervenidos en un período menor de 48h también mejoraban en al menos 2 grados de la escala. Respecto a los pacientes Frankel A, ninguno recuperó la deambulación postoperatoria. Esta recomendación se establece en 24h las recomendaciones de tratamiento dado por la guía NICE34.
Respecto a otros predictores, Laufer35 establece como mal predictor de la recuperación funcional la disfunción vesical establecida y, al contrario, presentar un balance muscular de 3. No se ha encontrado relación entre la recuperación funcional con otros tipos de variables como edad, sexo y tipo (agresividad) del tumor. Tampoco se han encontrado relación estadísticamente significativa con un aumento en las complicaciones, infecciones o estancia hospitalaria en relación con la afectación neurológica preoperatoria36.
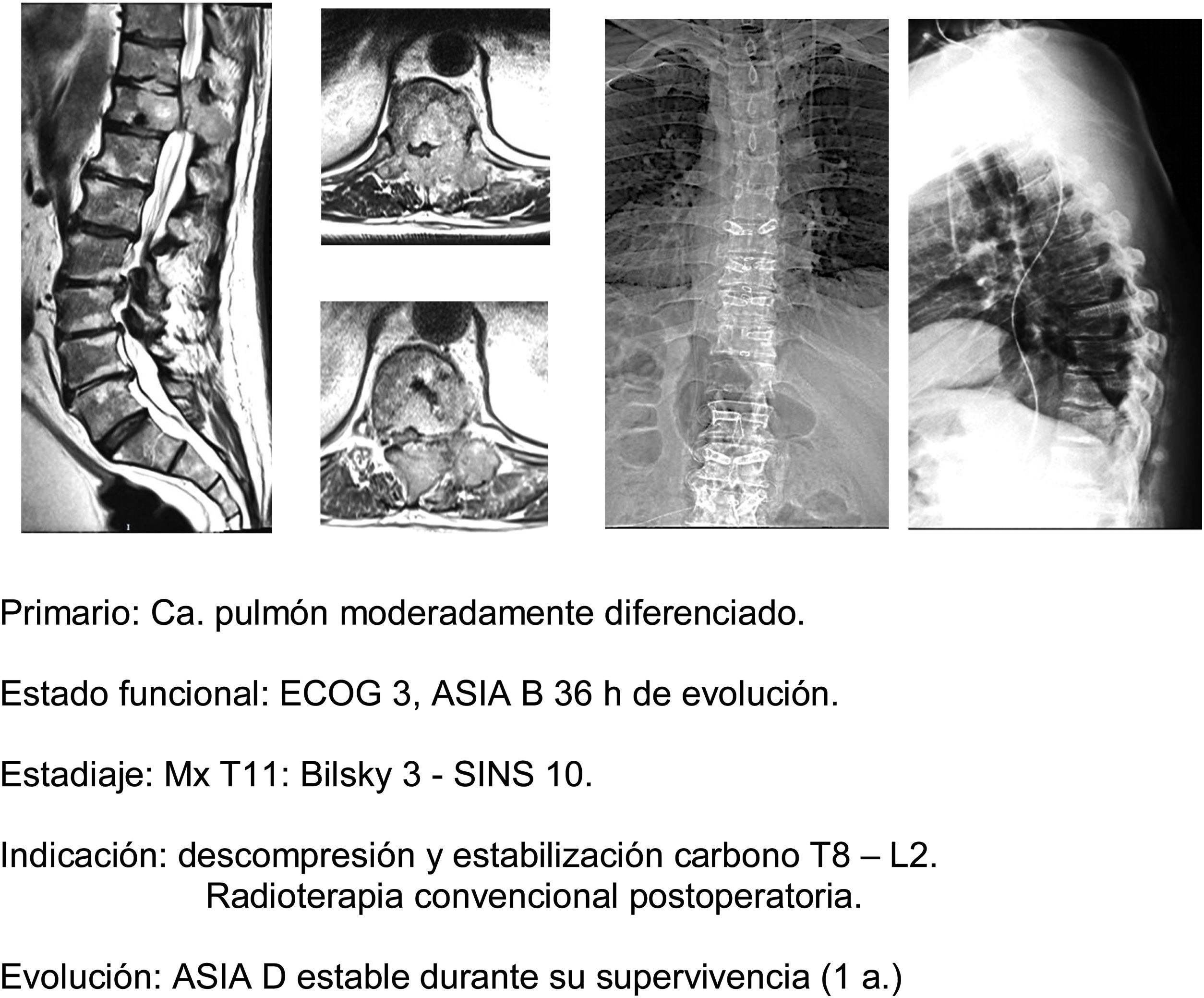
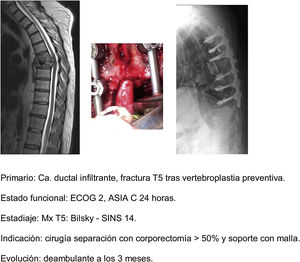
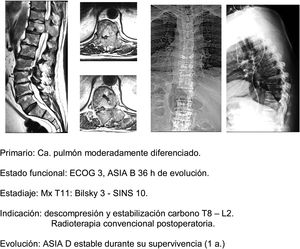
En este sentido, nuestra actitud es paralela a la de los trabajos comentados1,32–34, indicando, en primer lugar, tratamiento médico general (analgesia, tromboprofilaxis), específico con megadosis de dexametasona en dosis de 16mg/24h, control del estado neurológico y cirugía en pacientes ECOG 0-2 que presentan un estadio neurológico hasta ASIA B de menos de 48h de evolución, independientemente del tipo de tumor, y sobre todo si se asocia la imposibilidad de realización de radiocirugía (Bilsky≥2) y/o la presencia de oligometástasis. La descompresión precoz puede evitar la cascada de alteraciones vasculares que desembocan en la isquemia e infarto medular37, y con ello la capacidad de reversibilidad de la afectación neurológica, permitiendo una mejoría cualitativa neurológica de especialmente significativa (fig. 11a-e).
Nivel de evidenciaNivel de evidencia I.
FinanciaciónNo se ha recibido financiación para la realización de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.