La utilización de injertos óseos esponjosos crioconservados para la reconstrucción de defectos óseos acetabulares con osteólisis secundaria a aflojamientos de artroplastias totales de cadera ha demostrado ser útil para restaurar los defectos óseos.
La incorporación de los injertos óseos es multifactorial y compleja. El grado y patrón de integración conseguido depende del comportamiento biológico del injerto, de las condiciones del lecho, especialmente la vascularización, de los requerimientos biomecánicos y la estabilidad entre el injerto y el huésped, y de posibles procesos inmunológicos.
El procesamiento de los aloinjertos (criopreservación) disminuye su inmunogenicidad, pero también su potencial biológico y su capacidad osteogénica al destruir todas las células vivas1-3. Sin embargo, hay hechos que, cuando menos, ponen en duda estas consideraciones.
Diversos estudios clínicos han constatado clínica e histológicamente la integración de aloinjertos criopreservados fragmentados e impactados usados en la cirugía de revisión acetabular. La técnica de Sloof4,5 ha demostrado tener buenos resultados utilizando aloinjerto esponjoso crioconsevado impactado en el acetábulo y fijando sobre él un implante cementado6,7. Nosotros8 hemos publicado excelentes resultados con una técnica semejante utilizando sobre los injertos óseos criopreservados impactados un implante hemisférico atornillado con recubrimiento de hidroxiapatita. El mismo grupo de Nimega9 ha demostrado la rápida revascularización del injerto, seguida de resorción y formación de hueso con mínimo injerto primario remanente, en un estudio de 24 especímenes de biopsias de pacientes tratados con la técnica de Slooff, desde los 3 meses a 15 años de evolución.
Es de suponer que la integración es debida a fenómenos de osteoconducción, quedando excluida la osteoinducción y, sobre todo, la osteogénesis. Sin embargo, a la luz de los resultados clínicos, cabe pensar que existen otros fenómenos implicados además de la simple invasión del injerto por los tejidos circundantes. Recientes hallazgos de persistencia de células vivas en aloinjertos criopreservados añaden argumentos a esta discusión10,11.
Este trabajo trata de profundizar en el estudio de la capacidad biológica intrínseca que conserva el aloinjerto criopreservado como el utilizado habitualmente en nuestra práctica clínica.
MATERIAL Y MÉTODO
Las muestras se obtuvieron de un fragmento óseo esponjoso de un cóndilo femoral del banco de huesos de nuestro hospital, durante un recambio de artroplastia total de cadera que requería un injerto óseo criopreservado. Provenían de un donante varón de 61 años, con grupo sanguíneo B y Rh +, cuya extracción se efectuó 3 meses antes de la implantación.
El almacenamiento del tejido óseo siguió los criterios de la Musculoeskeletal Council of the America Association of Tissue Banks (AATB)12 y la European Association of Musculoeskeletal Transplantation (EAMST)13. Fue congelado a 80 oC, inmediatamente después de la extracción, en doble envase estéril. Las serologías fueron negativas para IgG anti virus de la inmunodeficiencia humana 1 y 2 (VIH-1/VIH-2), Ag Australia, IgG anti virus de la hepatitis C (VHC), lues (RPR [rapid plasma reagin] y HATP [hemaglutinación de Treponema pallidum]), anti virus de la leucemia humana T (HTLV I/II), Ag p-24 VIH, IgG anticore virus de la hepatitis B (VHB) y positiva para IgG anti citomegalovirus (CMV).
Los cultivos para el test de contaminación biológica fueron negativos para anaerobios y aerobios. El examen histológico de la muestra ósea en el momento de la extracción dio como resultado un hueso esponjoso de estructura normal.
El fragmento de hueso esponjoso fue fragmentado en pequeños trozos (3 x 3 x 2 mm). Fueron lavados con tampón fosfato salino libre de calcio y magnesio (PBS) y digeridos durante 24 horas a 37 °C, con 1 mg/ml de colagenasa (tipo II, Worthington) en medio de cultivo α-MEM (GIBCO) sin suero.
Las células aisladas fueron recuperadas por centrifugación, resuspendidas en medio completo de cultivo, α-MEM suplementado con 10% de suero fetal bovino (FBS) (GIBCO) y 1% de penicilina-estreptomicina (GIBCO) y cultivadas en condiciones estándar, a 37 °C y 5% CO2 en el aire. El medio de cultivo fue cambiado a las 48 horas para seleccionar las células adherentes y posteriormente cada 3-4 días. Cuando las células llegaron al 80% de confluencia fueron tripsinizadas, designadas como cultivo primario (pase 0) y resembradas para su posterior expansión.
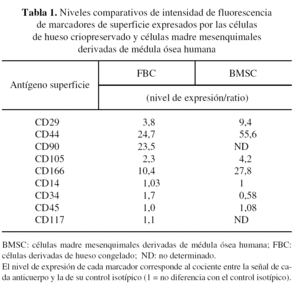
Se estudió la expresión de marcadores de superficie mediante citometría de flujo. Se lavaron 2 x 105 células con tampón de marcaje (PBS suplementado con 1% BSA y 0,1% azida sódica [Sigma, St. Louis, MO, EE. UU.]) en tubos FA CS de polipropileno y inmunomarcadas con 10 µl de anticuerpos conjugados con FITC o PE específicos para CD105 (Serotec, Oxford, Reino Unido), CD166, CD29, CD44, CD90, CD117, CD14, CD34 y CD45 (BD Pharmingen, San Jose, CA, EE. UU.), durante 30 minutos, a temperatura ambiente y a oscuras. Los niveles de expresión de cada marcador fueron comparados con los de los controles isotípicos IgG (Caltag Laboratories, Burlingame, CA, EE. UU.). Las células fueron analizadas utilizando un citómetro Coulter EPICS XL (Beckman Coulter, Miami, FL, EE. UU.). La recogida de datos fue realizada mediante el programa Expo32 (Beckman Coulter, Miami, FL, EE. UU.). El nivel de expresión de cada marcador (intensidad de fluorescencia) se define como el cociente entre la señal del anticuerpo y la del control de isotipo (1 = no diferencia).
RESULTADOS
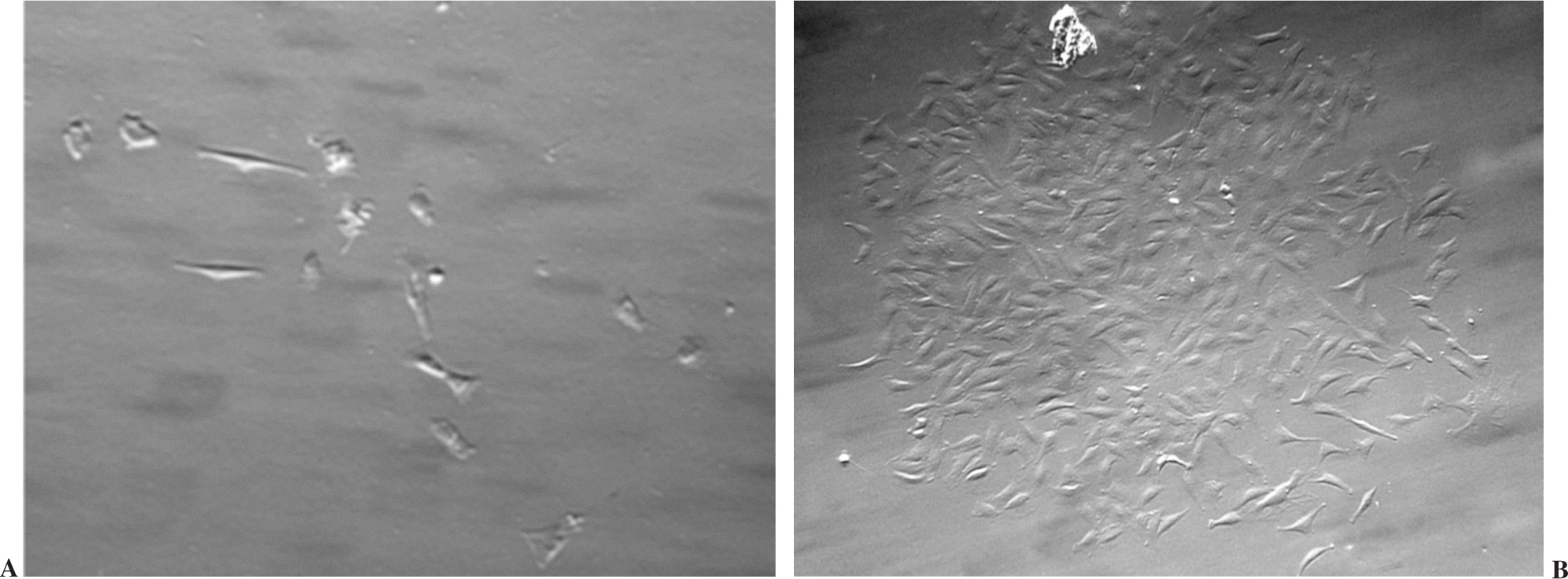
Algunas células con aspecto fusiforme se adhirieron al plástico de la placa de cultivo a las 48 horas del procesamiento. Después de 10 días en cultivo, las células empezaron a proliferar rápidamente y a generar colonias de tipo fibrobástico (fig. 1).
Figura 1. Cultivo primario de las células derivadas del injerto óseo criopreservado. Imágenes representativas que muestran la morfología fusiforme de las células aisladas a los 5 días de cultivo (A), y del aspecto de las colonias a las 2 semanas del cultivo a partir de las células que se adhirieron (B).
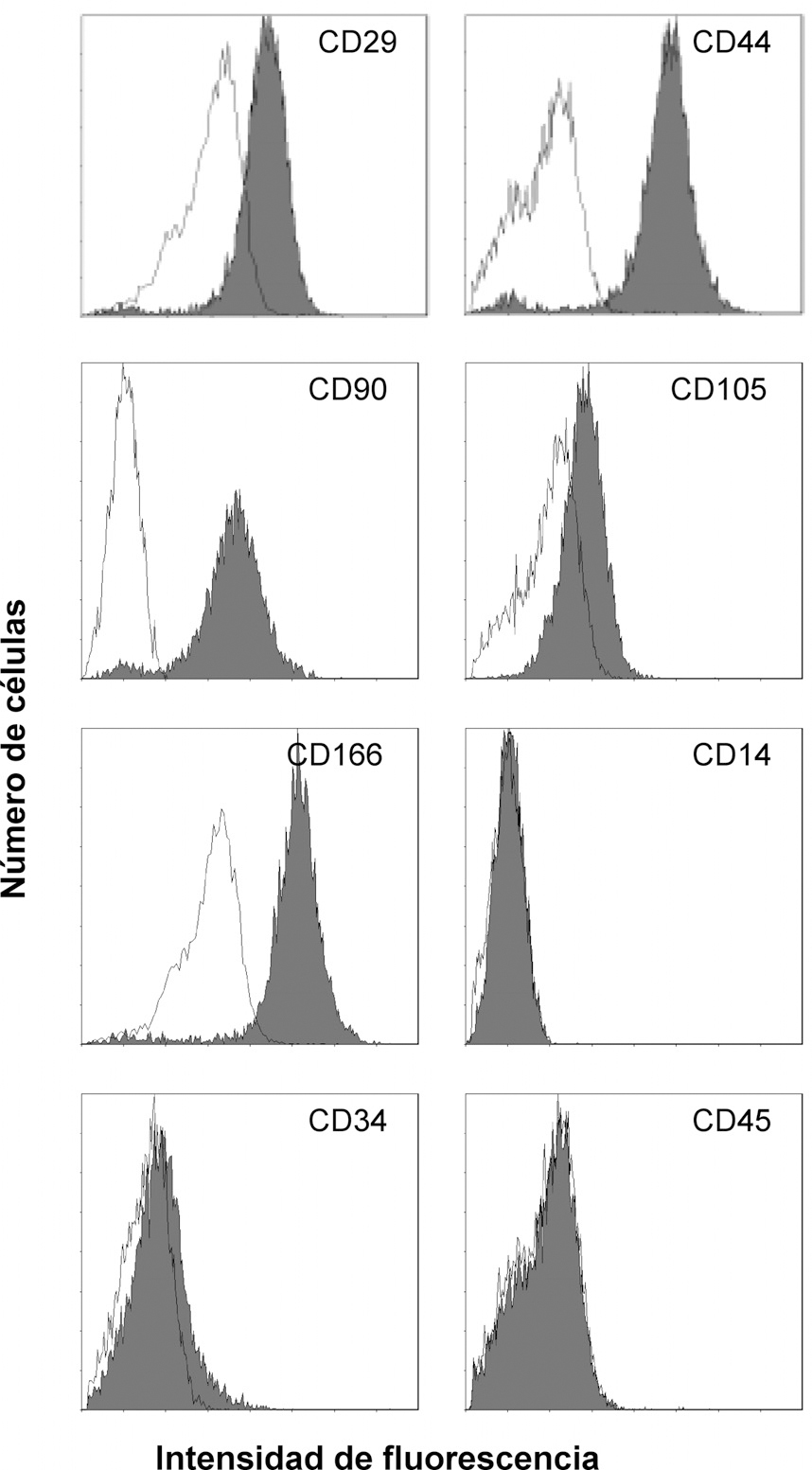
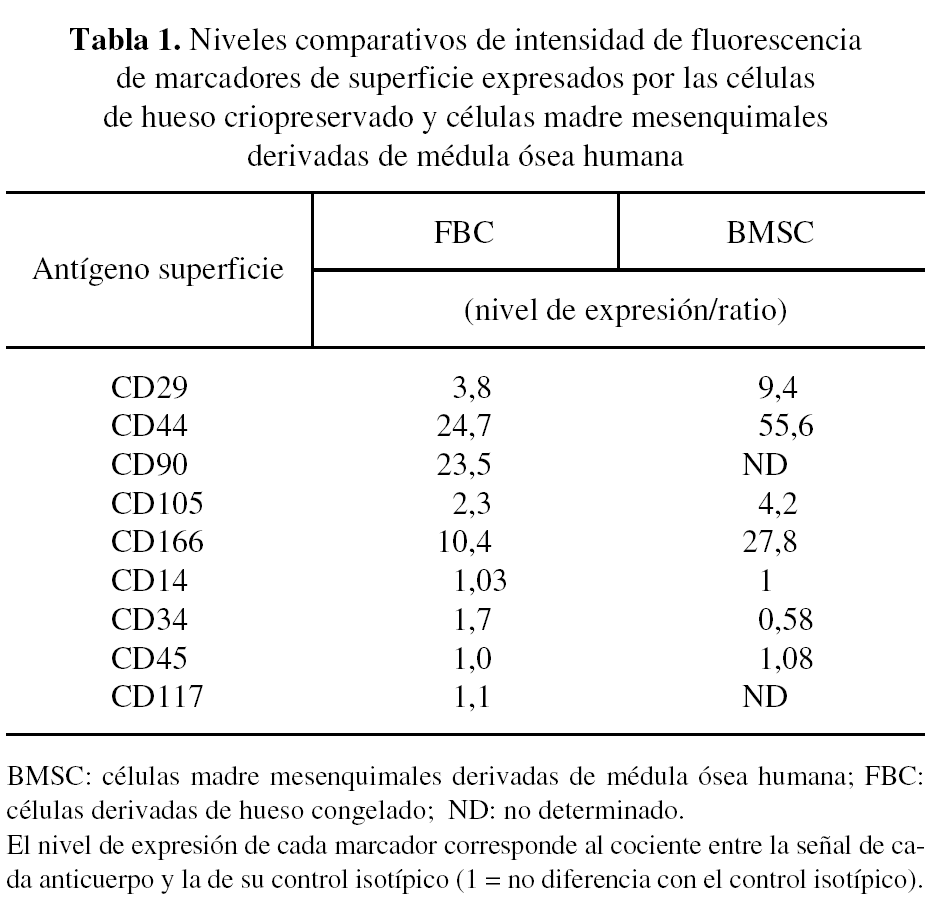
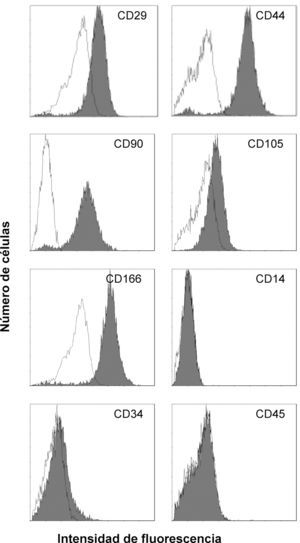
Una vez expandido el cultivo, se procedió al fenotipaje de la población celular aislada. La expresión de los marcadores de superficie analizada mediante citometría de flujo fue positiva para CD105, CD44, CD166, CD29 y CD90, y negativa para CD117, CD34, CD45 y CD14 (fig. 2). Este patrón de expresión es similar al obtenido para la población de células madre mesenquimales derivadas de médula ósea humana14 (tabla 1).
Figura 2. Análisis con citometría de flujo de la expresión de marcadores de superficie de las células derivadas del injerto óseo. Se demuestra la pureza de la población celular aislada mediante el análisis de la distribución de la intensidad de la fluorescencia de los distintos antígenos de superfície estudiados.
DISCUSIÓN
La excelente integración de los injertos óseos esponjosos fragmentados crioconsevados utilizados en la reconstrucción de defectos acetabulares constatada en nuestra práctica clínica nos hizo pensar si una posible viabilidad celular podía desempeñar un papel en la incorporación y remodelación ósea del injerto. Para valorarlo procesamos para cultivo fragmentos de hueso esponjoso crioconservado.El cultivo demostró la existencia de células mesenquimales que sobreviven a los protocolos estándar de congelación en los bancos de hueso.
Se pueden utilizar diversas técnicas para la identificación de tipos celulares. Nosotros hemos utilizado la citometría de flujo con detección de fluorescencia. La citometría de flujo permite el análisis individual en miles de células de la expresión de proteínas localizadas en la superficie celular, tales como los marcadores de diferenciación (CD). La identificación por marcadores de diferenciación se basa en la expresión diferencial según el tipo celular15.
El análisis fenotípico de las células perviventes en el injerto procesado nos muestra que presentan un patrón de expresión de marcadores similar al de las células madre mesenquimales derivadas de la médula ósea.
En este punto es necesario confirmar si las células aisladas presentan la pluripotencialidad demostrada en las células mesenquimales16-18, incluida la capacidad osteogénica, y pueden, de este modo, participar activamente en el proceso de remodelado del hueso del receptor en el lugar del injerto.
Hemos encontrado en la literatura otros estudios que demuestran, como el nuestro, la supervivencia de células vivas en el aloinjerto congelado. Weyts et al10 detectaron células con alelotipaje idéntico al donante en una de las dos muestras de aloinjerto crioconservado procesadas. Estas células se identificaron sólo por su morfotipo como diferenciadas (osteoblastos evolucionados u osteocitos inmaduros) y con escasa capacidad proliferativa. Heyliguers y Klein-Nulend11 también detectaron células vivas en injerto crioconservado. La identificación celular se obtuvo por análisis con marcadores de ADN que mostraron idénticos alelos en donante e injerto y mostraron en los cultivos celulares su capacidad oteoblástica expresada por altos niveles de fosfatasa alcalina en el medio de cultivo.
La inmunogenicidad residual del injerto congelado demostrada por Deijkers et al19 podría ser debida a la persistencia de células vivas. En perros se ha demostrado que la histocompatibilidad mejora la incorporación de los aloinjertos congelados20, sugiriendo que la activación del sistema inmunitario influye negativamente en la osteointegración. En el ser humano no queda clara la influencia de la inmunohistocompatibilidad en el éxito del injerto21, aunque Friedlaender et al publicaron que la coincidencia de los antígenos de inmunocompatibilidad mejoraba el éxito clínico22.
La incorporación radiológica de los injertos óseos crioconservados utilizados en técnicas de fragmentación e impactación, como la de Slooff4-7,22,23 o la nuestra8, podrían corresponderse con una incorporación biológica a la luz de estos hallazgos. Van der Donk et al mostraron, años antes, en 24 biopsias de casos tratados con su técnica, la sustitución del injerto por nuevo hueso lamelar con estructura trabecular y con mínimos restos de injerto9, aunque no se pudo determinar el origen de la regeneración (donante o huésped) mediante ADN.
Estos diferentes comportamientos podrían explicarse por la supervivencia ocasional de células en diversos medios, ambientes, situaciones de presión y nutrientes que explicasen su viabilidad y compatibilidad.
En cualquier caso la supervivencia de células vivas en el aloinjerto crioconservado cuestiona las teorías clásicas, hasta hoy aceptadas, de la muerte de las células por rotura de la membrana celular por las bajas temperaturas1-3. Al mismo tiempo, plantea cuestiones relevantes tanto en lo referente a la capacidad regenerativa del injerto como a la inmunogenicidad del injerto y, sobre todo, a la transmisión de infecciones.
Es obvio que es necesario profundizar en estos estudios para determinar la trascendencia e implicaciones de estos hallazgos preliminares.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia:
R. Sancho Navarro.
Servicio de Cirugía Ortopédica y Traumatología.
Hospital de la Santa Creu i Sant Pau.
C/ Sant Antoni M.a Claret, 167.
08025 Barcelona.
Correo electrónico: Rsancho@hsp.santpau.es
Recibido: enero de 2006.
Aceptado: diciembre de 2006.