El ácido tranexámico (ATX) tópico ha demostrado disminuir de forma significativa el sangrado en artroplastia de cadera y rodilla. A pesar de que en la artroplastia de hombro la mayoría de trabajos han demostrado su eficacia por vía intravenosa, la eficacia y dosis por vía tópica aún no está determinada. El objetivo fue comprobar si 1,5g de ATX en bajo volumen (30mL) administrado de manera tópica disminuiría el sangrado tras la artroplastia invertida de hombro (AIH).
Material y métodosSe revisaron de manera retrospectiva 177 pacientes consecutivos intervenidos de AIH por artropatía y fractura. Se recogieron datos de ΔHb y ΔHto a las 24h, débito del drenaje (mL), estancia media y complicaciones.
ResultadosLos pacientes que recibieron ATX presentaron menor débito del drenaje tanto en artroplastia electiva (AIHE) (104 vs. 195mL, p=0,004) como por fractura (AIHF) (47 vs. 79mL, p=0,01). Aunque fue ligeramente menor en el grupo de ATX, no se observaron diferencias estadísticamente significativas en el sangrado sistémico (AIHE ΔHb 1,67 vs. 1,90mg/dL, AIHF 2,61 vs. 2,7mg/dL, p=0,79), estancia media (AIHE 2,0 vs. 2,3 días, p=0,34; 2,3 vs. 2,5, p=0,56) o necesidad de transfusión (0% en AIHE; AIHF 5% vs. 7%, p=0,66). Los pacientes intervenidos por fractura presentaron mayor tasa de complicaciones que aquellos que lo hicieron por artropatía (7% vs. 15,6%, p=0,04). No se observaron complicaciones asociadas al uso de ATX.
ConclusiónLa administración tópica de 1,5g de ATX reduce el sangrado de manera significativa en el sitio quirúrgico sin observarse complicaciones asociadas. La disminución del hematoma posquirúrgico permitiría evitar el uso sistemático de drenajes posquirúrgicos.
Topical tranexamic acid (TXA) has been shown to decrease blood loss in knee and hip arthroplasty. Despite there is evidence about its effectiveness when administered intravenous, its effectiveness and optimal dose when used topically has not been established. We hypothesized that the use of 1.5g (30mL) of topical TXA could decrease the amount of blood loss in patients after reverse total shoulder arthroplasty (RTSA).
Material and methodsOne hundred and seventy-seven patients receiving a RSTA for arthropathy or fracture were retrospectively reviewed. Preoperative-to-postoperative change in hemoglobin (ΔHb) and hematocrit (ΔHct) level drain volume output, length of stay and complications were evaluated for each patient.
ResultsPatients receiving TXA has significant less drain output in both for arthropathy (ARSA) (104 vs. 195mL, p=0.004) and fracture (FRSA) (47 vs. 79mL, p=0.01). Systemic blood loss was slightly lower in TXA group, but this was not statistically significant (ARSA, ΔHb 1.67 vs. 1.90mg/dL, FRSA 2.61 vs. 2.7mg/dL, p=0.79). This was also observed in hospital length of stay (ARSA 2.0 vs. 2.3 days, p=0.34; 2.3 vs. 2.5, p=0.56) and need of transfusion (0% AIHE; AIHF 5% vs. 7%, p=0.66). Patients operated for a fracture had a higher rate of complications (7% vs. 15.6%, p=0.04). There were no adverse events related to TXA administration.
ConclusionTopical use of 1.5g of TXA decreases blood loss, especially on the surgical site without associated complications. Thus, hematoma decrease could avoid the systematic use of postoperative drains after reverse shoulder arthroplasty.
El ácido tranexámico (ATX) es un agente antifibrinolítico que funciona como un inhibidor competitivo con la lisina bloqueando su unión a las moléculas de plasminógeno. Actualmente se trata de un fármaco ampliamente usado que ha demostrado ser seguro y coste-efectivo en artroplastia de cadera y rodilla en términos de disminución del sangrado sistémico, menor número de transfusiones y menor débito en el drenaje1,2. Se trata de un fármaco bien tolerado con escasos efectos secundarios; los más habituales son de tipo digestivo (náuseas o diarrea) y, en casos excepcionales, convulsiones en pacientes con antecedentes a los que se administran altas dosis o alergia al mismo. Existe preocupación en el potencial aumento del riesgo de eventos tromboembólicos tras su administración intravenosa, aunque estudios recientes han demostrado su seguridad y eficacia independientemente del riesgo de muerte individual del paciente, no solo en el campo de la ortopedia, sino también en otros campos quirúrgicos3.
A pesar de la evidencia actual en favor del uso del ATX en la artroplastia de rodilla y cadera, todavía existe reticencia para su uso en pacientes con antecedentes tromboembólicos o patología renal concomitante y la dosis y vía de administración óptima aún no está establecida2. El uso de la vía tópica ha demostrado ser tan efectivo como la administración intravenosa en las artroplastias de cadera y de rodilla. Habitualmente se administran entre 1 y 3g de ATX de forma tópica antes del cierre, solo o en combinación con suero salino (SSF) y, en ocasiones, otros fármacos como anestésico local, corticoide, antiinflamatorio no esteroideo (AINE) o antibiótico, demostrando que disminuye el sangrado postoperatorio en diferentes articulaciones, incluyendo el hombro4.
La tasa de transfusión en la artroplastia de hombro varía en la literatura, desde menos de un 1% en cohortes seleccionadas hasta un 43%5,6. Tan solo, en 2015, el primer estudio analizado sobre el ATX en artroplastia de hombro evaluó su eficacia al administrarlo por vía tópica4. Otros autores han demostrado posteriormente la eficacia del ATX en la artroplastia de hombro con diferentes dosis intravenosas al compararlo con placebo7–11.
La reducción en el sangrado permitiría reducir el número de transfusiones, con una disminución de las infecciones, reacciones alérgicas y otras complicaciones asociadas. Además, un menor sangrado podría permitir evitar el uso sistemático de drenajes, por lo que el ATX podría ayudar a mejorar y facilitar el manejo perioperatorio del paciente.
El objetivo del trabajo es determinar si 1,5g de ATX en una solución de bajo volumen (30mL) disminuiría el sangrado en pacientes intervenidos de artroplastia invertida de hombro (AIH).
Material y métodosSe diseñó un estudio retrospectivo observacional de cohortes revisando los pacientes intervenidos de AIH primaria de hombro entre enero de 2013 y marzo de 2020; las cohortes se establecieron en función de si habían recibido ATX o no. Se obtuvo la aprobación del Comité de Ética del hospital (PI-4267). Los criterios de inclusión fueron pacientes intervenidos de AIH primaria. Se excluyeron cirugías de revisión o cirugías tumorales, por lo que tras revisar 177 artroplastias se obtuvo una muestra de 169 pacientes.
Se recogieron datos demográficos, así como la existencia de comorbilidades, el riesgo preoperatorio según la escala de la Sociedad Americana de Anestesistas (ASA), el motivo de cirugía, la estancia hospitalaria, la hemoglobina (Hb) y el hematocrito (Hto) prequirúrgicos y a las 24h de la cirugía, así como el débito del drenaje —en los pacientes en los que se colocó— y las complicaciones en el postoperatorio inmediato.
Un total de 63 pacientes (35 en el grupo de ATX) fueron excluidos al presentar una historia clínica incompleta (no tenían analítica a las 24h o no tenían recogido en mililitros [mL] el volumen de drenaje). Finalmente se incluyeron 106 pacientes con una edad media de 76,3±7,5 años, de los que el 85% (90 pacientes) fueron mujeres.
Todos los pacientes fueron intervenidos mediante bloqueo interescalénico y anestesia general. Con el paciente en silla de playa se realizó un abordaje deltopectoral, utilizando el mismo implante y técnica quirúrgica en todos los casos. La administración de ATX se realizó según la preferencia del cirujano, aunque se observó que al familiarizarse con su uso existía una tendencia en aumento a lo largo de los años ya que hasta 2015 se utilizó en menos de un 50% de los casos para, a partir de 2017, administrarlo a más del 70-80% de los pacientes. La pauta de administración fue la inyección local de 1,5g de ATX en planos profundos y superficiales antes del cierre. Cada ampolla de 0,5g tiene un volumen de 10mL para un volumen total de inyección de 30mL. El drenaje se colocó intraarticular, se mantuvo cerrado durante 2h y se retiró a las 24h.
En los pacientes en tratamiento anticoagulante (warfarina) se suspendió y se administró heparina de bajo peso molecular (HBPM) cada 12h por indicación del servicio de Anestesia. Los pacientes en tratamiento con ácido acetilsalicílico (AAS) 100mg no modificaron su pauta. Se indicó transfusión en los casos en los que la Hb fue ≤7g/dL o presentaron síntomas de anemia (taquicardia, hipotensión, etc.).
La principal variable del estudio fue la variación de Hb (ΔHb) y Hto (ΔHto) posquirúrgicas. Las variables secundarias fueron el débito del drenaje (mL), el tiempo de hospitalización (días tras la cirugía) y la aparición de complicaciones en los primeros 6 meses postoperatorios.
Los datos fueron analizados mediante SPSS (versión 21.0, SPSS, Chicago, IL). Se utilizó el test de χ2 para el contraste de proporciones de las variables. Se valoró la distribución normal de las variables cuantitativas mediante el test de Kolmogorov-Smirnov. Para comparar las medias de las variables con distribución normal se utilizó el test ANOVA y el test Mann-Whitney en aquellas no paramétricas.
Se consideraron diferencias estadísticamente significativas aquellas en las que p fue <0,05.
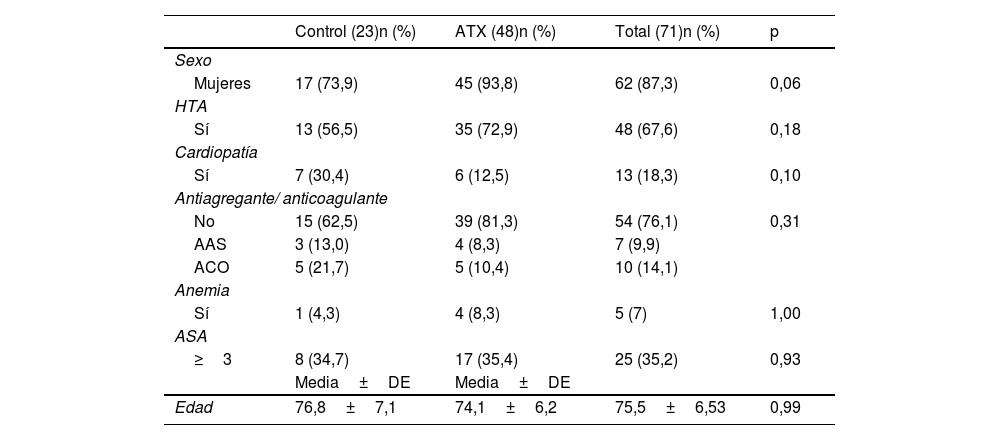
ResultadosSe realizó un primer análisis para determinar qué características preoperatorias se podían relacionar con un mayor riesgo de sangrado. Los pacientes intervenidos de cirugía electiva presentaban un menor sangrado que los pacientes intervenidos por fracturas de húmero proximal (FHP) (ΔHb 1,50 vs. 2,14g/dL, p=0,032; ΔHto 5,00% vs. 6,53%, p=0,034), por lo que se establecieron grupos separados en función del diagnóstico preoperatorio: 73 pacientes fueron intervenidos por artropatía y 33 correspondían al grupo de fractura.
Asimismo, se observó que 3 pacientes presentaban coagulopatías valoradas previamente por el servicio de Hematología: 2 pacientes presentaban trombocitopenia idiopática y otra paciente presentaba anticoagulante lúpico. Este grupo de pacientes presentó un sangrado mayor (ΔHb 3,9 vs. 1,9g/dL, p=0,001; ΔHto 11,87 vs. 6,14%, p=0,003) y fueron excluidos. De estos pacientes, uno de los pacientes fue intervenido de AIH por fractura y precisó de una transfusión postoperatoria por una Hb de 7g/dL. Los otros 2 pacientes se sometieron a cirugía electiva y a pesar de un mayor sangrado no precisaron transfusión (fig. 1).
No se observaron diferencias en ΔHb ni ΔHto respecto al sexo (p=0,557; p=0,154), hipertensión (p=0,183; p=0,433), diagnóstico de cardiopatía (p=0,420; p=0,694), uso de anticoagulantes o antiagregantes (p=0,885; p=0,533), o clasificación ASA (p=0,488; p=0,466). Las características de ambos grupos son comparables y aparecen recogidas en las tablas 1 y 2.
Datos de los pacientes intervenidos de AIH electiva, excluyendo los pacientes con coagulopatía
| Control (23)n (%) | ATX (48)n (%) | Total (71)n (%) | p | |
|---|---|---|---|---|
| Sexo | ||||
| Mujeres | 17 (73,9) | 45 (93,8) | 62 (87,3) | 0,06 |
| HTA | ||||
| Sí | 13 (56,5) | 35 (72,9) | 48 (67,6) | 0,18 |
| Cardiopatía | ||||
| Sí | 7 (30,4) | 6 (12,5) | 13 (18,3) | 0,10 |
| Antiagregante/ anticoagulante | ||||
| No | 15 (62,5) | 39 (81,3) | 54 (76,1) | 0,31 |
| AAS | 3 (13,0) | 4 (8,3) | 7 (9,9) | |
| ACO | 5 (21,7) | 5 (10,4) | 10 (14,1) | |
| Anemia | ||||
| Sí | 1 (4,3) | 4 (8,3) | 5 (7) | 1,00 |
| ASA | ||||
| ≥3 | 8 (34,7) | 17 (35,4) | 25 (35,2) | 0,93 |
| Media±DE | Media±DE | |||
| Edad | 76,8±7,1 | 74,1±6,2 | 75,5±6,53 | 0,99 |
Características de los pacientes intervenidos de AIH por FHP excluyendo pacientes con coagulopatía
| Control (13)n (%) | ATX (19)n (%) | Total (32)n (%) | p | |
|---|---|---|---|---|
| Sexo | ||||
| Mujeres | 12 (92,3) | 13 (68,4) | 25 (78,1) | 0,19 |
| HTA | ||||
| Sí | 9 (69,2) | 18 (94,7) | 27 (84,4) | 0,13 |
| Cardiopatía | ||||
| Sí | 4 (30,8) | 4 (21,1) | 8 (25) | 0,68 |
| Antiagregante/ anticoagulante | ||||
| No | 9 (69,2) | 13 (68,4) | 22 (68,8) | 0,73 |
| AAS | 3 (23,1) | 3 (15,8) | 6 (18,8) | |
| ACO | 1 (7,7) | 3 (15,8) | 4 (12,5) | |
| Anemia | ||||
| Sí | 1 (7,7) | 5 (26,3) | 6 (18,8) | 0,36 |
| ASA | ||||
| ≥3 | 7 (53,8) | 5 (26,3) | 12 (37,5) | 0,21 |
| Media±DE | Media±DE | |||
| Edad | 80,3±7,7 | 80,4±5,5 | 80,3±6,3 | 0,98 |
Respecto al sangrado, no se observaron diferencias estadísticamente significativas en ΔHb ni ΔHto entre los pacientes que recibieron ATX y los que no, tanto en pacientes intervenidos por cirugía electiva como en los intervenidos por FHP (fig. 2). Sin embargo, sí se observó una disminución del sangrado local en 40%: en los pacientes intervenidos por artropatía que recibieron ATX el sangrado medio fue de 104,7±76,7mL, mientras que el grupo control recogió 195,5±132mL (p=0,004); en el caso de la AIH por fractura el grupo control drenó 78,7±67,6mL vs. 47,1±35,5mL en el grupo que recibió ATX (p=0,01). Los pacientes intervenidos por cirugía electiva que recibieron ATX tuvieron una estancia hospitalaria postoperatoria ligeramente menor, aunque esta diferencia no alcanzó la significación estadística (2,0 vs. 2,3 días, p=0,34), del mismo modo que ocurrió para el grupo fracturas (2,3 vs. 2,5 días, p=0,56).
Fig. 2.1 ΔHb en los pacientes intervenidos de AIH por artropatía (1,67g/dL para el grupo ATX vs. 1,90g/dL, p=0,31) y ΔHto (5,67% vs. 5,61%, p=0,94).
Fig. 2.2 ΔHb en los pacientes intervenidos de AIH por FHP (2,61g/dL en el grupo TXA vs. 2,70g/dL en grupo control, p=0,31) y ΔHto (7,26% vs. 7,90%, p=0,94).
Se observó un menor número de complicaciones en las AIH por artropatía (7%) que en las AIH por fractura (15,6%, p=0,04). En los pacientes por artropatía, un 4,2% de los pacientes con ATX (2 pacientes) y un 13% de los del grupo control (3 pacientes) presentaron alguna complicación (p=0,18), ninguna relacionada con los posibles efectos adversos del fármaco (eventos trombóticos, cambio de visión de colores, etc.). En el grupo del ATX se observó un episodio de desaturación con hipotensión y mareo, en el que se descartó causa embólica y se registró un hematoma subcutáneo al que se administró una dosis de ATX (500mg) por vía oral sin problemas posteriores en la herida. En el grupo control un paciente presentó un seroma que precisó 24h más de uso del drenaje, un segundo paciente tuvo una infección periprotésica a los 4 meses por C. acnes que requirió una segunda cirugía de desbridamiento y retención de implante y un tercer paciente presentó clínica de infección respiratoria durante el ingreso.
En el grupo de AIH por fractura 5 pacientes presentaron complicaciones (15,6%), 2 en el grupo control (15,3%) y 3 en el grupo de ATX (15,7%). Del grupo control, un paciente requirió transfusión y otro presentó un episodio de desorientación durante el ingreso por cambio en su medicación. En el grupo que recibió ATX también fue necesaria una transfusión, una paciente sufrió un pequeño TEP segmentario debido a inmovilidad en domicilio sin profilaxis antitrombótica; la paciente fue estudiada, no hallándose signos de TVP en el eco-doppler. La tercera paciente sufrió una reactivación de una infección crónica previa de cadera.
Todos los pacientes que precisaron transfusión —incluyendo la paciente con coagulopatía— fueron mujeres mayores de 82 años intervenidas de FHP; se relacionó la necesidad de transfusión con la AIH por fractura (0% vs. 6%, p=0,02), ser mayor de 80 años (0% vs. 8%, p=0,04) y el uso previo de anticoagulantes (1,8% vs. 16,7%, p=0,07). Sin embargo, no se encontró relación con el uso del drenaje (3,3% vs. 2,3%, p=0,29) o el uso de ATX (5% vs. 7%, p=0,66).
DiscusiónLos datos de nuestro trabajo recogen que la administración de 1,5g de forma tópica reduce en un 40% el sangrado local tras la AIH, sin influir de manera significativa sobre el sangrado sistémico o la necesidad de transfusión.
Al igual que en otras articulaciones, el sangrado en la artroplastia de hombro es una preocupación importante. A pesar de que las tasas de transfusión recogidas son menores que en las artroplastias de cadera o rodilla, la incidencia es muy variable y aumenta en los casos de cirugía tras fracturas o en artroplastia de revisión6,12. En la artroplastia de cadera y rodilla existen múltiples estudios de calidad que avalan la eficacia del ATX no sólo disminuyendo el sangrado, sino también otros riesgos asociados como el de transfusión o la infección1,13, por lo que recientemente, con el incremento del número de artroplastias de hombro en los últimos años, ha aumentado el interés por su uso en esta cirugía. Al igual que en la cadera y rodilla, no existe consenso sobre la dosis óptima y la vía de administración ideal. Respecto a la vía de administración, tan solo Gillespie et al. publicaron los datos tras la administración tópica de ATX: utilizaron 2g en formulación de alto volumen (100mL) en pacientes intervenidos de prótesis anatómica (44 pacientes) e invertida (67 pacientes), observando un menor sangrado por el drenaje y un menor sangrado en los pacientes con prótesis anatómica, pero no así en los de invertida4. Los estudios posteriores utilizan la vía intravenosa o combinada7–9,14–19. El uso de estas alternativas ha presentado resultados similares: Vara et al.18 observaron tras la administración de 2 dosis i.v. un menor sangrado sistémico, menor débito local y una tasa de transfusión menor. Pauzenberger et al.8 también utilizaron 2 dosis i.v., observando además menor hematoma y una disminución del dolor. Otros autores han encontrado resultados también favorables al ATX administrando una única dosis7,9,15. Yoon et al. compararon en un ensayo clínico ambas vías de administración y de forma combinada sin encontrar diferencias entre ellas19. Entre las ventajas teóricas de la administración intravenosa se encuentra su efecto antifibrinolítico desde el inicio de la intervención, mientras que la vía tópica permite evitar potenciales efectos secundarios sistémicos y permite al cirujano la administración de forma independiente al anestesista. Con los datos actualmente disponibles no se puede determinar la superioridad de una vía sobre la otra, pero todos los datos apuntan a que el ATX disminuye el sangrado asociado a la cirugía, de manera tanto tópica como intravenosa.
En nuestro trabajo se administró una dosis de 3 ampollas de ATX para una formulación de bajo volumen de 30mL y, aunque observamos una tendencia menor de sangrado en ambos grupos, estas diferencias no son significativas en la anemización sistémica (ΔHb y ΔHto). Lo que sí observamos fue un sangrado local un 65-80% mayor en los pacientes sin ATX (cirugía electiva: 104 vs. 195mL, p=0,004; AIH por fractura: 79 vs. 47mL, p=0,01). El uso de ATX disminuye la formación de hematoma y permite plantear la posibilidad de abandonar de manera segura los drenajes simplificando los cuidados postoperatorios y disminuyendo el coste asociado al mismo.
Analizando la transfusión posquirúrgica, se han propuesto diferentes factores de riesgo para su uso, entre ellos la anemia, la enfermedad cardiaca, la edad, la indicación traumática, el tipo de implante (AIH, ATH, hemiartroplastia, revisión…) o incluso el uso de cemento o la enfermedad pulmonar obstructiva (EPOC)12,20–23. Estos estudios suelen incluir poblaciones heterogéneas y usan diferentes diseños de implantes. Esta heterogeneidad justifica en parte la variabilidad encontrada en la tasa de transfusión, entre un 43% y un 0%4,5. Nuestro estudio recoge una población intervenida mediante el mismo modelo de AIH, corroborando que la artroplastia electiva presenta una menor anemización que la AIH por fractura, como ha sido observado previamente20,24. Otro factor que afecta significativamente la tasa de transfusión es el protocolo utilizado en cada centro. En nuestro hospital los criterios de transfusión siguen los criterios restrictivos recogidos en las recomendaciones de las guías de ahorro de sangre en pacientes sometidos a cirugía mayor25. Nuestra tasa de transfusión fue de un 0% en los pacientes de cirugía electiva y un 6% en aquellos intervenidos por fractura, siendo inferiores a otras series publicadas.
La preocupación existente por disminuir las necesidades transfusionales está ampliamente justificada. Recientemente, Grier et al. identificaron 7794 pacientes transfundidos tras ATH y AIH, en los que se observó mayor tasa de complicaciones, desde la enfermedad tromboembólica a la neumonía o la infección del sitio quirúrgico26. En artroplastia de cadera y rodilla existen varios trabajos que encuentran correlación entre la administración de ATX y la disminución de estas complicaciones27. Existen trabajos in vitro en favor del ATX para prevenir la infección al impedir la formación de biofilm bacteriano por inhibición directa de la lisina28, por lo que su aplicación local sería una posible ventaja.
Si bien es cierto que existen otros trabajos que sí han encontrado diferencias en favor del ATX al conseguir disminuir la necesidad de transfusión7,29, el único trabajo en artroplastia de hombro publicado que analiza su relación con la infección no ha encontrado diferencias significativas entre administrarlo o no para disminuir esta tasa30. En nuestro trabajo, al ser una serie relativamente pequeña con una incidencia muy baja de complicaciones, estas relaciones no se han podido establecer ni en el grupo de cirugía electiva (0 pacientes transfundidos), ni si quiera en los pacientes intervenidos de fractura (7% en el grupo control vs. 5% con ATX, p=0,66); tan sólo se ha podido relacionar el riesgo de transfusión con características del paciente (>80 años, mujer, cirugía por fractura…). Del mismo modo, no se observaron eventos tromboembólicos asociados al uso de ATX.
Este estudio presenta varias limitaciones. En primer lugar, la recogida retrospectiva de datos supone una pérdida importante de pacientes, aunque fueron similares en ambos grupos. Por otro lado, la inclusión de un número limitado de pacientes —aunque similar a otras series— con una baja incidencia de complicaciones no permite establecer asociaciones que sí se han visto en estudios basados en registros. Como fortaleza, este estudio presenta una población homogénea con un único implante, por lo que las diferencias observadas no se pueden atribuir al diseño del implante ni a la técnica quirúrgica. Además, este es el primer estudio que analiza el uso de ATX en pacientes intervenidos de AIH por fractura, no incluidos en estudios previos. Muchos de estos pacientes presentan antecedentes de enfermedad tromboembólica o cardiopatías y son precisamente estos pacientes con mayor sangrado y riesgo de transfusión los que más pueden beneficiarse de la acción del ATX. Estudios más amplios son necesarios para determinar el impacto específico en las necesidades transfusionales en esta población más frágil.
ConclusiónEl uso de 1,5g de ATX en formulación bajo volumen administrados de manera local reduce de forma efectiva el sangrado en pacientes intervenidos de AIH; además, en los pacientes intervenidos de AIH por artropatía, disminuyó también la estancia media hospitalaria.
Nivel de evidenciaNivel de evidencia III.
FinanciaciónNinguno de los autores han recibido financiación para la realización de esta investigación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Aprobación del comité de éticaInvestigación aprobada por el Comité de Ética del hospital (PI-4267).