Analizar la eficacia y la seguridad de la analgesia preventiva en pacientes que son sometidos a artroplastia de cadera o rodilla por artrosis.
MétodosSe realizó una revisión sistemática: se definió una estrategia de búsqueda bibliográfica sensible en Medline, Embase y Cochrane Library hasta mayo de 2013; se definió la población con los siguientes criterios: pacientes con indicación de artroplastia de cadera y/o rodilla, adultos, dolor moderado a intenso (≥4 en la Escala Visual Analógica), la intervención, el uso (eficacia y seguridad) del tratamiento farmacológico (preventivo) próximo a la cirugía. Se incluyeron formulaciones orales, tópicas y parches. Se incluyeron revisiones sistemáticas, metaanálisis, ensayos clínicos y estudios observacionales.
ResultadosSe incluyeron 36 artículos de calidad moderada. Incluían pacientes representativos de aquellos a los que se les indica una artroplastia de cadera o rodilla en nuestro país, adultos, con una edad media superior a 50 años, ligera mayor proporción de mujeres y que presentan dolor de moderado a grave (≥4 en la Escala Visual Analógica). El dolor posquirúrgico se evaluó sobre todo con la Escala Visual Analógica. Existe mucha variabilidad en cuanto a los fármacos utilizados incluyendo paracetamol, AINE clásicos, AINE selectivos de la Cox-2, opioides, corticoides, antidepresivos, analgésicos para el tratamiento del dolor neuropático y otros como sulfato magnésico, ketamina, nimodipino o clonidina. Todos en general parecen mejorar el dolor posquirúrgico sin presentar acontecimientos adversos graves.
ConclusionesEl uso de uno o varios analgésicos en el preoperatorio disminuye el consumo de analgésicos y el dolor en el posoperatorio, al menos el dolor agudo.
To analyze the efficacy and safety of preventive analgesia in patients undergoing hip or knee arthroplasty due to osteoarthritis.
MethodsA systematic literature review was performed, using a defined a sensitive strategy on Medline, Embase and Cochrane Library up to May 2013. The inclusion criteria were: patients undergoing knee and/or hip arthroplasty, adults with moderate or severe pain (≥4 on a Visual Analog Scale). The intervention, the use (efficacy and safety) of pharmacological treatment (preventive) close to surgery was recorded. Oral, topical and skin patch drugs were included. Systematic reviews, meta-analysis, controlled trials and observational studies were selected.
ResultsA total of 36 articles, of moderate quality, were selected. The patients included were representative of those undergoing knee and/or hip arthroplasty in Spain. They had a mean age >50 years, higher number of women, and reporting moderate to severe pain (≥4 on a Visual Analog Scale). Possurgical pain was mainly evaluated with a Visual Analog Scale. A wide variation was found as regards the drugs used in the preventive protocols, including acetaminophen, classic NSAID, Cox-2, opioids, corticosteroids, antidepressants, analgesics for neuropathic pain, as well as others, such as magnesium, ketamine, nimodipine or clonidine. In general, all of them decreased post-surgical pain without severe adverse events.
ConclusionsThe use or one or more pre-surgical analgesics decreases the use of post-surgical drugs, at least for short term pain.
Se define la analgesia preventiva como un conjunto de estrategias farmacológicas y no farmacológicas llevadas a cabo antes del inicio de la lesión quirúrgica cuyo fin es prevenir o minimizar el dolor producido por estímulos nocivos quirúrgicos1,2. Sus objetivos fundamentales son disminuir el dolor agudo ante la lesión de los tejidos, prevenir la modulación patológica relacionada con el dolor sobre el sistema nervioso central e inhibir la persistencia del dolor postoperatorio y el desarrollo del dolor crónico. La analgesia preventiva también puede disminuir el consumo de analgésicos en el postoperatorio.
Distintos estudios experimentales3,4 confirman que, al menos en animales, la administración de analgésicos antes de una agresión tisular es más eficaz para el control del dolor que si estos se administran después de este.
Sin embargo, en la práctica clínica diaria, estos resultados no han podido reproducirse de forma concluyente. Varias revisiones sistemáticas que incluían el análisis de más de 80 ensayos clínicos controlados, mostraban que el tiempo de comienzo de la analgesia no afectaba al control del dolor postoperatorio independientemente del tipo de analgesia preventiva5. De todos modos esta conclusión no es del todo categórica puesto que la mayoría de los estudios existentes se basan en intervenciones a corto plazo sobre el dolor postoperatorio, por lo que no se puede valorar su influencia en el desarrollo de hipersensibilidad central al dolor6–8. Además, es posible que existan diferencias dependiendo del tipo de cirugía.
El objetivo de la presente revisión sistemática es revisar la bibliografía para analizar la eficacia y seguridad del tratamiento preventivo perioperatorio con medidas farmacológicas en pacientes con indicación de artroplastia de cadera o rodilla en relación al dolor posquirúrgico.
Material y métodoSe realizó una revisión sistemática de la literatura siguiendo la guía de la Cochrane Collaboration9.
Criterios de selección de estudiosSe seleccionaron estudios que incluyesen pacientes con indicación de artroplastia de cadera y/o rodilla, adultos, y dolor de moderado a intenso prequirúrgico (≥4 en la Escala Visual Analógica). Estos estudios debían evaluar el uso (eficacia y seguridad) de un tratamiento farmacológico específico (preventivo) próximo a la cirugía (no necesariamente las 24-48 horas anteriores). Se incluyen formulaciones orales (opioides, antiinflamatorios no esteroideos [AINE], analgésicos, corticoides, anticonvulsionantes y antidepresivos), tópicas (incluyendo capsaicina, lidocaína tópica, AINE tópicos, masaje con vaselina tópico), parches transdérmicos, etc. Como comparadores estos estudios podían tener un fármaco activo, placebo u otros procedimientos (ejercicio, etc.). La medida de resultado (eficacia) principal fue el dolor posquirúrgico, como medidas de resultado (eficacia) secundarias, el ahorro de opioides, días de hospitalización, calidad de vida, función, satisfacción, etc. Otras variables incluidas fueron: hemorragia digestiva, estreñimiento y costes.
Finalmente solo se incluyeron estudios con los siguientes diseños: metaanálisis, revisiones sistemáticas, ensayos clínicos o estudios observacionales.
Se excluyeron estudios en animales, de ciencia básica, artículos sobre revisiones de prótesis o prótesis por fracturas, estudios donde todos los pacientes tienen de base una enfermedad inflamatoria crónica (artritis reumatoide, lupus, etc.), medidas no farmacológicas, infiltraciones articulares (de ningún tipo, incluyendo infiltraciones de ácido hialurónico), los SYSADOAS, así como artículos donde el tratamiento preventivo se basaba exclusivamente en el bloqueo anestésico.
Estrategia de búsquedaPara esta revisión se han cribado las siguientes bases de datos bibliográficas: Medline (desde su inicio a mayo de 2013), Embase (desde su inicio a mayo de 2013), y Cochrane Library (desde su inicio a mayo de 2013). Dado el volumen de citas encontradas no se buscó en congresos nacionales ni internacionales. Posteriormente, se realizó una búsqueda manual secundaria de la bibliografía de los artículos que finalmente se incluyeron en la revisión sistemática.
En la tabla 1 se muestran las estrategias de búsqueda de Medline, así como el número de citas que recuperaron. Para la misma se utilizaron términos Mesh y términos en texto libre. Como límites se buscaron solo artículos en humanos, y en inglés o español.
Estrategia de búsqueda en Medline
| # | Términos de la búsqueda | Citas |
|---|---|---|
| 7 | #6 Filters: Humans; English; Spanish | 2.977 |
| 6 | #4 AND #5 | 3.258 |
| 5 | ((((((((((((((((«Review»[Publication Type] OR Review, Systematic OR Review, Multicase OR Review Literature OR Review, Academic OR Review of Reported Cases OR Review)) OR (((«Clinical Trial»[Publication Type]) OR «Validation Studies»[Publication Type]) OR «Evaluation Studies»[Publication Type])) OR («Clinical Trial, Phase I»[Publication Type] OR Clinical Trial, Phase 1)) OR («Clinical Trial, Phase II»[Publication Type] OR Clinical Trial, Phase 2 OR Clinical Trial, Phase II)) OR («Clinical Trial, Phase III»[Publication Type] OR Clinical Trial, Phase 3 OR Clinical Trial, Phase III)) OR («Clinical Trial, Phase IV»[Publication Type] OR Clinical Trial, Phase 4 OR Clinical Trial, Phase IV)) OR («Controlled Clinical Trial»[Publication Type])) OR («Multicenter Study»[Publication Type] OR Multicenter Studies OR Multicenter Study)) OR («Randomized Controlled Trial»[Publication Type] OR Randomized Controlled Trial)) OR («Cohort Studies»[Mesh] OR Cohort Study OR Studies, Cohort OR Study, Cohort OR Concurrent Studies OR Studies, Concurrent OR Concurrent Study OR Study, Concurrent OR Historical Cohort Studies OR Studies, Historical Cohort OR Cohort Studies, Historical OR Cohort Study, Historical OR Historical Cohort Study OR Study, Historical Cohort OR Analysis, Cohort OR Analyses, Cohort OR Cohort Analyses OR Cohort Analysis OR Closed Cohort Studies OR Cohort Studies, Closed OR Closed Cohort Study OR Cohort Study, Closed OR Study, Closed Cohort OR Studies, Closed Cohort OR Incidence Studies OR Incidence Study OR Studies, Incidence OR Study, Incidence OR Cohort Studies)) OR («Cohort Studies»[Mesh] OR cohort study OR studies, cohort OR study, cohort OR concurrent studies OR studies, concurrent OR concurrent study OR study, concurrent OR historical cohort studies OR studies, historical cohort OR cohort studies, historical OR cohort study, historical OR historical cohort study OR study, historical cohort OR analysis, cohort OR analysis, cohort OR cohort analyses OR cohort analysis OR closed cohort studies OR cohort studies, closed OR closed cohort study OR cohort study, closed OR study, closed cohort OR studies, closed cohort OR incidence studies OR incidence study OR studies, incidence OR study, incidence OR cohort studies)) OR («Longitudinal Studies»[Mesh] OR Longitudinal Study OR Studies, Longitudinal OR Study, Longitudinal OR Longitudinal Survey OR Longitudinal Surveys OR Survey, Longitudinal OR Surveys, Longitudinal OR Longitudinal Studies)) OR («Follow-Up Studies»[Mesh] OR Follow Up Studies OR Follow-Up Study OR Studies, Follow-Up OR Study, Follow-Up OR Followup Studies OR Followup Study OR Studies, Followup OR Study, Followup OR Follow-Up Studies)) OR («Prospective Studies»[Mesh] OR Prospective Study OR Studies, Prospective OR Study, Prospective OR Prospective Studies)) OR («meta-analysis»[Publication Type] OR «meta-analysis as topic»[MeSH Terms] OR «meta-analysis»[All Fields])) | 4.426.305 |
| 4 | #1 AND #2 AND #3 | 4.729 |
| 3 | Risk factors[MH] OR causalities OR multifactorial causality OR causalities, multifactorial OR causality, multifactorial OR multifactorial causalities OR multiple causation OR causation, multiple OR causations, multiple OR multiple causations OR reinforcing factors OR factors, reinforcing OR factors, reinforcing OR reinforcing factor OR causation OR causations OR enabling factors OR enabling factor OR factors, enabling OR factors, enabling OR predisposing factors OR factors, predisposing OR factors, predisposing OR predisposing factor OR determinant OR predictor OR predict* OR prognostic | 1.542.865 |
| 2 | Search «pain, postoperative»[MeSH Terms] OR («pain»[All Fields] AND «postoperative»[All Fields]) OR «postoperative pain»[All Fields] OR («postoperative»[All Fields] AND «pain»[All Fields]) OR («pain, postoperative»[MeSH Terms] OR («pain»[All Fields] AND «postoperative»[All Fields]) OR «postoperative pain»[All Fields] OR («postoperative»[All Fields] AND «pains»[All Fields]) OR «postoperative pains»[All Fields]) OR «pain»[MeSH Terms] OR «pain»[All Fields] | 536.118 |
| 1 | Osteoarthritides OR Osteoarthrosis OR Osteoarthroses OR Arthritis, Degenerative OR Arthritides, Degenerative OR Coxarthrosis OR Arthroplasties, Replacement, Hip OR Arthroplasties, Replacement, Hip OR Hip Prosthesis Implantation OR Hip Replacement, Total OR Hip Replacements, Total OR Arthroplasties, Replacement, Knee OR Knee Replacement, Total OR Knee Replacements, Total | 315.207 |
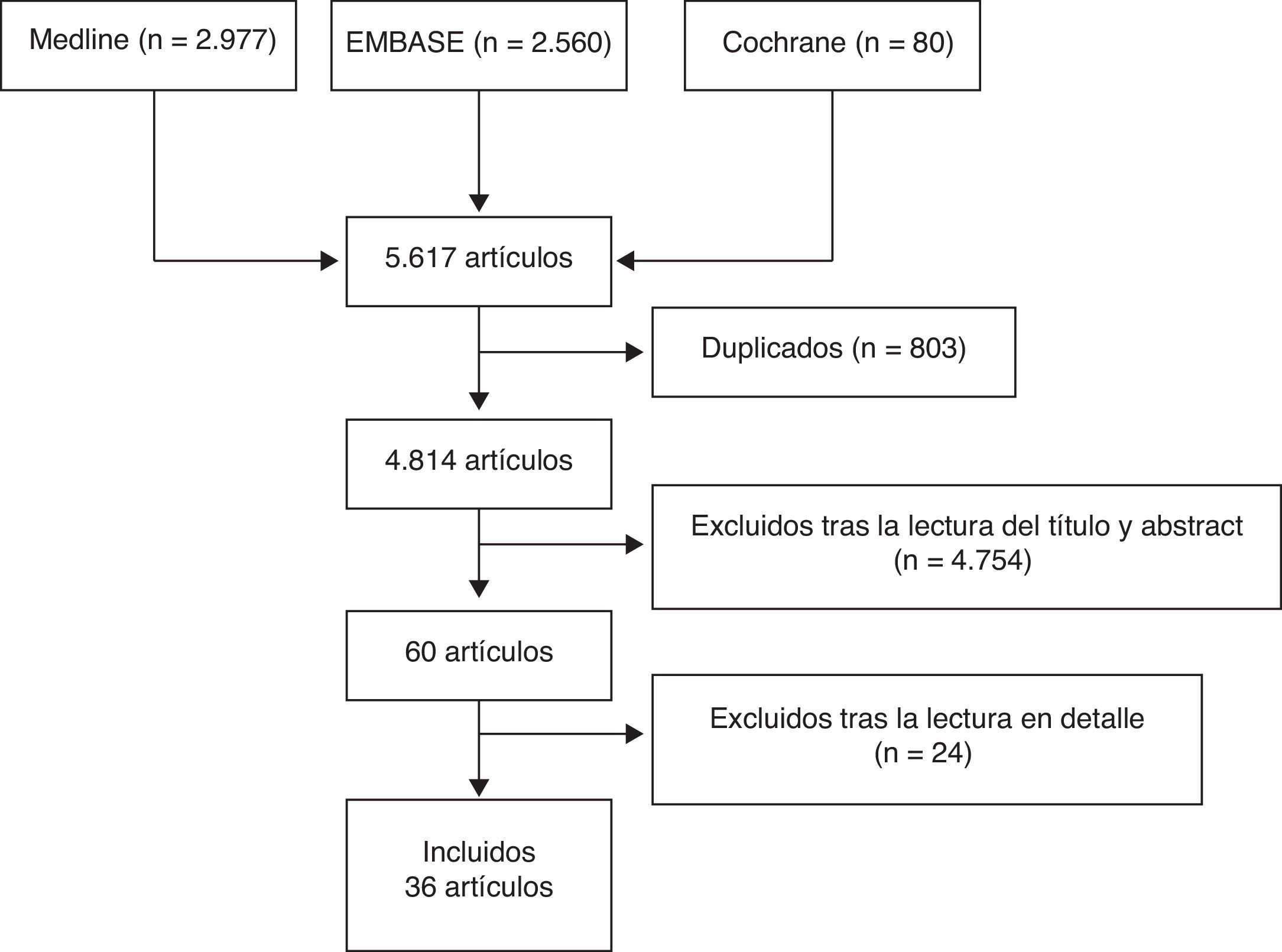
Tres revisores analizaron de forma independiente los artículos resultantes de la estrategia de búsqueda en las diferentes bases de datos bibliográficas, seleccionaron aquellos que cumplían los criterios definidos y analizaron en detalle los artículos incluidos. En caso de discrepancia, uno de los revisores, un experto metodólogo, resolvió el problema. El resultado de la búsqueda primeramente se depuró por título y abstract o por artículo entero en caso de que no tuviera resumen, mediante sesiones de 20min de duración máxima. Tras este proceso, los artículos seleccionados se analizaron en detalle (lectura completa del artículo). En la figura 1 se muestra el diagrama de flujo del proceso de selección de los artículos.
Finalmente, se realizó una búsqueda manual sobre las referencias bibliográficas incluidas en los artículos seleccionados para su análisis en detalle. Todas las referencias se recuperaron de Internet y se introdujeron en el programa EndNote para facilitar su gestión.
Recogida de datos y evaluación de la calidad de los estudiosLos tres revisores recogieron los datos de los estudios incluidos utilizando plantillas específicas prediseñadas para esta revisión. Para evaluar la calidad metodológica de los estudios incluidos, se utilizó la escala de calidad de Oxford10.
Análisis y presentación de los datosSe crearon tablas de evidencia en las que se describen las principales características de los estudios incluidos. Algunos de los resultados se expresan como número y porcentaje (%), media y desviación estándar, mediana y rango interquartílico (p25-p75), otros como odds ratio, riesgo relativo o hazard ratio y sus intervalos de confianza al 95%. Solo se valoró la posibilidad de realizar un metaanálisis en caso de homogeneidad.
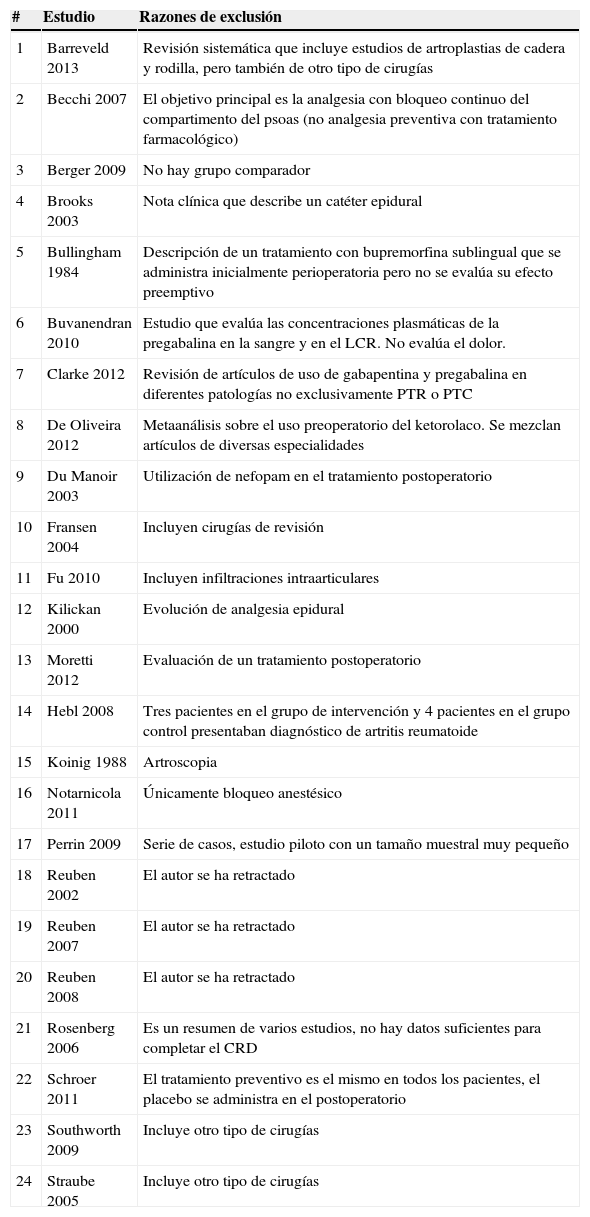
ResultadosInicialmente se seleccionaron 60 artículos para lectura en detalle (fig. 1); de estos se incluyeron finalmente 36 (tabla 2). Los artículos excluidos y los motivos de exclusión se muestran en la tabla 3, y sus referencias en el anexo 1. Las conclusiones principales con su nivel de evidencia y grado de recomendación se muestran en la tabla 4.
Tabla de evidencia
| # | Estudio | Población | Intervención | Medidas de desenlace | Comentarios |
|---|---|---|---|---|---|
| 1 | Adam 200542, ECA, 3 mes seguimiento | • n=40 ATR• Edad media 68 años• 70% mujeres• Criterios ASA I-III | • Ketamina- >0,05ml/kg, iv en bolo tras inducción anestesia- 3μg kg-1min−1 iv (infusión continua) intraoperator- 1,5μg kg-1min−1 iv (infusión continua) durante 48h postoperatorio• Solución salina (mismo volumen) | • Dolor posquirúrgico• Consumo opioides posquirúrgico• Flexión de rodilla• Días hospitalización• Acontecimientos adversos | • Calidad 1b |
| 2 | Alexander 200212, ECA doble ciego placebo control, 24h seguimiento | • n=99 ATR o ATC• Edad media 64 años• 63% mujeres• Dolor basal moderado | • Diclofenaco 75mg iv y ketorolaco 60mg iv (antes de la inducción anestésica) en dosis única• Placebo iv | • Consumo opioides posquirúrgico• Acontecimientos adversos | • Calidad 1b |
| 3 | Beaupre 201218, observacional prospectivo, 12 sem seguimiento | • n=39 ATR• Edad media 65 años• 50% mujeres• Dolor basal moderado | • Oxicodona 10mg vo y celecoxib 100-200mg vo (2-12h antes de cirugía)• Bloqueos anestésicos (nervio femoral) | • Dolor posquirúrgico hasta 12 sem• Acontecimientos adversos | • Calidad 2b• Tamaño muestral muy pequeño |
| 4 | Bergeron 200936, ECA doble ciego, 6 sem seguimiento, evaluación un año después | • n=50 ATR• no ofrecen más información | • Dexametasona 40mg iv en la inducción anestésica• Solución salina | • Dolor posquirúrgico a los 6 sem y un año | • Calidad 1cMuchos sesgos |
| 5 | Bugter 200311, ECA doble ciego placebo control, 16 días seguimiento | • n=36 ATC• Edad media 61 años• 70% mujeres | • Ibuprofeno 600mg/8h vo 2 sem antes de la cirugía• Placebo | • Dolor posquirúrgico a las 24h• Consumo opioides posquirúrgico a las 24h• Sangrado perioperatorio | • Calidad 1c• Muchos sesgos• Tamaño muestral muy pequeño |
| 6 | Buvanendran 200322, ECA doble ciego placebo control, 8 días seguimiento | • n=70 ATR• Edad media 61 años• 67% mujeres | • Rofecoxib 50mg vo pre-operatorio 24h antes y 2 sem después de cirugía• Placebo | • Dolor posquirúrgico• Consumo opioides pos-quirúrgico y otros fármacos relacionados intrahospitalarios• Acontecimientos adversos | • Calidad 1b |
| 7 | Buvanendran 201039, ECA doble ciego placebo control, 6 mes seguimiento | • n=240 ATR• Edad media 21 años• 68% mujeres | • Pregabalina 300mg vo 24h antes y 2 sem después cirugía• Placebo | • Dolor posquirúrgico hasta los 6 mes• Consumo opioides posquirúrgico• Días hospitalización• Acontecimientos adversos | • Calidad 1b |
| 8 | Casey 200644, ECA doble ciego placebo control, 2 días seguimiento | • n=40 ATR• Edad media 71 años• 58% mujeres | • Nimodipino 90mg vo unah previa a cirugía y durante 48h más• Placebo | • Consumo opioides posquirúrgico | • Calidad 2b |
| 9 | Clarke 2009_140, ECA placebo control, 6 mes seguimiento | • n=126 ATR• Edad media 62 años• 35% mujeres | • Gabapentina 100-600mg 2h antes y 2h después de cirugía• Placebo | • Dolor posquirúrgico hasta los 6 mes• Consumo opioides posquirúrgico hasta los 6 mes | • Calidad 1b |
| 10 | Clarke 2009_241, ECA placebo control, 2 días seguimiento | • n=40 ATR• Edad media 61 años• 61% mujeres | • Gabapentina 100-600mg 2h antes y 2h después de cirugía• Placebo | • Dolor postquirúrgico a los 2 días• Consumo opioides postquirúrgico a 2 días | • Calidad 2b |
| 11 | Duellman 200919, observacional retrospectivo | • n=127 ATR o ATC• Edad media 62 años48% mujeres | • Oxycodona y celecoxib o valdecoxib (desde la cirugía, diferentes dosis y esquemas) y en el posoperatorio | • Consumo opioides posquirúrgico• Días hospitalización• Acontecimientos adversos | • Calidad 2b |
| 12 | Eggers 199920, ECA placebo control, 9 días seguimiento | • n=101 ATR• Edad media 67 años• < 50% • mujeres | • Tenoxicam 40mg vo unah antes de cirugía+20mg iv a 24 h+20mg vo 8 días• Tenoxicam 40mg iv una hora después cirugía+20mg iv a 24 h+20mg vo 8 días• Placebo | • Dolor posquirúrgico a 48h y 3-9 días• Consumo opioides posquirúrgico a 48h y a 3-9 días• Consumo analgésicos posquirúrgico a 48h, 3-9 días• Acontecimientos adversos | • Calidad 1b |
| 13 | Feng 200823, ECA placebo control, 3 días seguimiento | • n=34 ATR• Edad media 66 años• 69% mujeres | • Rofecoxib 25mg unah antes de cirugía• Placebo | • Dolor posquirúrgico a las 48-72h• Consumo opioides posquirúrgico a las 48-72h• Acontecimientos adversos | • Calidad 2b• Tamaño muestral muy pequeño |
| 14 | Fletcher 199513, ECA doble ciego placebo control, 5 días seguimiento | • n=60 ATC• Edad media 64 años• 60% mujeres | • Ketorolaco 60mg unas h antes de cirugía• Placebo | • Dolor posquirúrgico• Consumo opioides posquirúrgico• Sangrado peri-operatorio | • Calidad 1b |
| 15 | Hendolin 199627, ECA, seguimiento 24 horas | • n=41 ATR• Edad media 70 años• 90% mujeres | • Morfina 0,14mg/kg im unah antes de cirugía | • Dolor postquirúrgico• Consumo opioides postquirúrgico• Acontecimientos adversos | • Calidad 2b |
| 16 | Ho 201045, observacional prospectivo, 2 días seguimiento | • n=50 ATR | • Duloxetina 60mg 2h antes cirugía y día siguiente• Placebo | • Dolor posquirúrgico• Consumo opioides posquirúrgico• Acontecimientos adversos | • Calidad 1b |
| 17 | Huang 200815, ECA, 7 días seguimiento | • n=80 ATR• Edad media 70 años• Dolor basal moderado | • Celecoxib 400mg 1h previa a cirugía+200mg/12h 5 días | • Dolor posquirúrgico a las 48-72h• Consumo opioides posquirúrgico a las 48-72h• Acontecimientos adversos | • Calidad 2a |
| 18 | Inan 200725, ECA doble ciego placebo control, 2 días seguimiento | • n=46 ATR• Ancianos• >80% de mujeres | • Lornoxicam dosis alta 15min antes de cirugía y a dosis baja en posoperatorio• Placebo | • Dolor postquirúrgico• Consumo opioides postquirúrgico• Acontecimientos adversos | • Calidad 1b |
| 19 | Iohom 200214, ECA placebo control, 2 días seguimiento | • n=30 ATC• Edad media 62 años• ASA I-II | • Dexketroprofeno 25mg 24h previa a cirugía y hasta 48h poscirugía• Placebo | • Dolor posquirúrgico a las 15h• Consumo opioides posquirúrgico• Acontecimientos adversos | • Calidad 1b• Tamaño muestral muy pequeño |
| 20 | Ittichaikulthol 201016, ECA placebo control, 2 días seguimiento | • n=120 ATC y ATR• Edad 18-75 años• ASA I-II | • Parecoxib 40mg 1h antes de cirugía• Celecoxib 400mg pre-quirúrgico• Placebo | • Dolor posquirúrgico• Consumo de opioides posquirúrgico• Acontecimientos adversos | • Calidad 1b |
| 21 | Hwang 200943, observacional prospectivo, 2 días seguimiento | • n=40 ARC• Edad media <50 años• 45% mujeres• Criterios ASA I-II | • Sulfato magnésico- 50mg/kg infusión iv 15 minutos antes de cirugía- 15mg/kg infusión iv durante cirugía• Solución salina (mismo volumen) | • Dolor posquirúrgico a 48h• Consumo opioides posquirúrgico 48h• Satisfacción global• Acontecimientos adversos | • Calidad 1b |
| 22 | Kardash 200834, ECA doble ciego placebo control, 2 días seguimiento | • n=50 ATC, unilateral o total• Edad media 68 años• 50% mujeres | • Dexametasona 40mg iv, 10min antes de cirugía• Ibuprofeno 400mg/6h vo (durante 48h)• Paracetamol 650mg/6h vo (durante 48h)• Placebo | • Dolor posquirúrgico• Consumo opioides posquirúrgico• Niveles de PCR• Acontecimientos adversos | • Calidad 1b |
| 23 | Lunn 201138, ECA doble ciego placebo control, 2 días seguimiento | • n=48 ATR• Edad media 66 años• 50% mujeres• ASA I-II | • Metilprednisolona 125mg (2ml) iv, dosis única antes de cirugía• Placebo | • Dolor posquirúrgico a las 48h• Ahorro opioides a las 48h• Acontecimientos adversos | • Calidad 1b |
| 24 | Lunn 201337, doble ciego placebo control, 2 días seguimiento | • n=48 ATC• Edad media 66 años• 56% mujeres• ASA I-II | • Metilprednisolona 125mg (2ml) iv, dosis única antes de cirugía• Placebo | • Dolor posquirúrgico a las 48h• Ahorro opioides a las 48h• Acontecimientos adversos | • Calidad 1b |
| 25 | Mallory 200224,observacional prospectivo, 24 días seguimiento | • n=317 ATR o ATC• Edad media 64 años• 50% mujeres | • Rofecoxib o celecoxib 2 sem antes de cirugía y durante 10 días después | • Dolor posquirúrgico• Días hospitalización• Acontecimientos adversos | • Calidad 2a |
| 26 | Martinez 200726, ECA placebo control, 5 días de seguimiento | • n=78 ATC• Edad media 63 años• 50% mujeres | • Grupo pre:- Parecoxib 40mg iv en inducción y 12h después de la inducción- Placebo 40mg iv. En el cierre de la herida• Grupo post:- Parecoxib 40mg iv. En el cierre de la herida y 12h después de la inducción- Placebo 40mg iv. En la inducción• Grupo control:- Placebo 40mg iv. En la inducción, cierre de la herida y 12h después de la inducción | • Dolor posquirúrgico• Consumo opioides posquirúrgico• Sangrado perioperatorio• Acontecimientos adversos | • Calidad 1b |
| 27 | Mc Swiney 199729, ECA doble ciego, 24h seguimiento | • n=50 ATR• No se aportan datos explícitos de características basales. Indican que no hay diferencias entre grupos | • Grupo experimental:- Morfina 0,125mg/kg (60ml solución salina) iv• Grupo control:- Morfina 0,125mg/kg im. en la pierna opuesta | • Dolor posquirúrgico• Consumo opioides posquirúrgico | • Calidad 1b |
| 28 | Meurnier 200717, ECA placebo control, un año seguimiento | • n=44 ATR• Edad media 68 años• 55% mujeres• ASA I-II | • Celecoxib 200mg vo unah antes de cirugía y durante 3 sem después (2 veces al día)• Placebo 200mg víavo unah antes de cirugía y durante 3 sem después (2 veces al día)• Técnica anestésica: raquídea subaracnoidea con bupivacaína isobárica de 17,5 a 20mg | • Dolor posquirúrgico hasta 28 días• Sangrado perioperatorio• Acontecimientos adversos | • Calidad 1b |
| 29 | Park 199646, ECA doble ciego placebo control, 36h seguimiento | • Población (n=39) ATR• Edad media 67 años• 60% mujeres• ASA I-III | • Clonidina 5μg kg-1 vo una hora y media antes de cirugía, 12h y 24h después de dosis inicial• Placebo misma dosificación por vía oral | • Dolor posquirúrgico• Consumo opioides posquirúrgico• Acontecimientos adversos | • Calidad 1b |
| 30 | Porter 198333,ECA doble ciego | • n=26 ATC o ATR• Edad media 63 años• 50% mujeres | • Grupo I: metadona 10mg iv. Justo después de inducción de anestesia• Grupo P: metadona 10mg, iv. Después de la operación (3h después de la inducción)• Grupo I: bloqueo neuromus pancuronio 0,1mg kg-1• Grupo P: bupivacaína 0,5% extradural | • Consumo opioides posquirúrgico• Acontecimientos adversos | • Calidad 1b• Tamaño muestral muy pequeño |
| 31 | Rasmussen 201035, ECA doble ciego placebo control, 24h seguimiento | • n=42 ATC• Edad media 71 años• 57% mujeres• ASA I-III• Dolor basal moderado | • Grupo experimental:- Gabapentina 1.200mg unah antes de anestesia- Dexametasona 8mg iv antes inducción anestesia- Ketamina 0,15mg kg-1 pre-operatorio- Paracetamol 1g unah antes de anestesia- Ketorolaco 15mg al final de cirugía• Grupo control:- Placebo 1.200mg unah antes de anestesia- Placebo 8mg iv antes de inducción anestesia- Paracetamol 1g unah antes de anestesia- Ketorolaco 15mg al final de cirugía | • Dolor posquirúrgico• Consumo opioides posquirúrgico• Acontecimientos adversos | • Calidad 1b |
| 32 | Reiter 200332, ECA doble ciego placebo control, 24h seguimiento | • n=98 ATR o ATC• Edad media 62 años• 60% mujeres• ASA I-III | • Morfina 20mg vo unah antes de cirugía• Placebo 20mg vo unah antes de de cirugía• Anestesia con fentanil 3μg kg-1 iv, tiopental 3-5mg kg-1 iv y vecuronio 0,1mg kg-1 iv. Se mantuvo con isoflurano y óxido nitroso al 60% en O2 | • Dolor posquirúrgico• Consumo opioides pos-quirúrgico• Acontecimientos adversos | • Calidad 1b |
| 33 | Renner 201121, ECA doble ciego, 24h seguimiento | • n=11 ATC• Edad media 68 años83% mujeres | • Etoricoxib 120mg vo 2h antes de cirugía; 120mg vo un día después de cirugía• Placebo vo 2h antes de cirugía, vo un día después de cirugía | • Inhibición de la producción de prostaglandinas• Supresión del aumento de IL-6• Dolor posquirúrgico• Consumo opioides posquirúrgico• Satisfacción global• Acontecimientos adversos | • Calidad 1b• Tamaño muestral muy pequeño |
| 34 | Skinner 200447, observacional prospectivo | • n=102 ATR o ATC• Edad media 63 años• 65% mujeres | • Grupo experimental:- Preoperatorio (inmediatamente antes de cirugía): rofecoxib 50mg vo; tramadol 50mg vo; paracetamol 650mg vo; dexametasona 2mg vo- Posoperatorio (hospital): rofecoxib 50mg/día vo; tramadol 50mg/6h vo; paracetamol 650mg/6h vo; hidrocodona 5mg/paracetamol 500mg vo, 1-2 comp/4h y opioides iv a demanda- Posoperatorio (tras alta): rofecoxib 50mg/día vo; tramadol 50mg/6h vo; hidrocodona 5mg/paracetamol 500mg vo 1-2 comp/4h- Posoperatorio (tras heparina, 14 días): rofecoxib 50mg/día vo; tramadol 50mg/6h vo; aspirina 350mg/día- Bupivacaína 0,25% intraarticular 2ml/h durante 48h (a pacientes de ATR)• Grupo control: terapia convencional | • Dolor posquirúrgico• Acontecimientos adversos | Calidad 2b |
| 35 | Slowey 198530, ECA, 24h seguimiento | • n=30 ATC• Edad media 65 años• 60% mujeres• ASA I-II | • Grupo intramusc: morfina 15mg im unah antes de cirugía; placebo vo unah antes de cirugía (3 comp)• Grupo oral-60: placebo im unah antes de cirugía; morfina 30mg LC vo unah antes de cirugía (2 comp); placebo vo unah antes de cirugía (un comp)• Grupo oral -90: placebo im unah antes de cirugía; morfina 30mg LC vo unah antes de cirugía (3 comp) | • Dolor posquirúrgico• Acontecimientos adversos | • Calidad 1b• Tamaño muestral muy pequeño |
| 36 | Wong 199731, observacional prospectivo 3 días seguimiento | • n=45 ATR• Edad media 61 años• 50% mujeres• ASA I-II | • Grupo G:- 30min antes de cirugía y en momento incisión: solución salina 15ml iv- 30 y 60min postoperatorio: solución salina 10ml• Grupo EA:- 30min antes de cirugía y en momento de incisión: lidocaína 2% 15ml iv- 30 y 60min postoperatorio: lidocaína 2% 10ml; morfina 1,5mg, ketamina 20mg• Grupo EB:-30min antes de cirugía y en incisión: lidocaína 2% 15ml iv, morfina 1,5mg, ketamina 20mg-30 y 60min postoperatorio: lidocaína 2% 10ml• Técnica anestésica: anestesia general (grupo G), lidocaína epidural (grupos EA, EB) | • Dolor posquirúrgico• Consumo opioides posquirúrgico• Satisfacción global• Acontecimientos adversos | • Calidad 1b |
ATC=artroplastia total de cadera; ATR=artroplastia total de rodilla; comp=comprimidos; ECA=ensayo clínico aleatorizado; h=horas; iv=intravenoso; kg=kilogramo; min=minuto; ml=mililitro; mg=miligramo; mes=meses; im=intramuscular; sem=semanas; vo=vía oral.
Estudios excluidos y motivos de exclusión
| # | Estudio | Razones de exclusión |
|---|---|---|
| 1 | Barreveld 2013 | Revisión sistemática que incluye estudios de artroplastias de cadera y rodilla, pero también de otro tipo de cirugías |
| 2 | Becchi 2007 | El objetivo principal es la analgesia con bloqueo continuo del compartimento del psoas (no analgesia preventiva con tratamiento farmacológico) |
| 3 | Berger 2009 | No hay grupo comparador |
| 4 | Brooks 2003 | Nota clínica que describe un catéter epidural |
| 5 | Bullingham 1984 | Descripción de un tratamiento con bupremorfina sublingual que se administra inicialmente perioperatoria pero no se evalúa su efecto preemptivo |
| 6 | Buvanendran 2010 | Estudio que evalúa las concentraciones plasmáticas de la pregabalina en la sangre y en el LCR. No evalúa el dolor. |
| 7 | Clarke 2012 | Revisión de artículos de uso de gabapentina y pregabalina en diferentes patologías no exclusivamente PTR o PTC |
| 8 | De Oliveira 2012 | Metaanálisis sobre el uso preoperatorio del ketorolaco. Se mezclan artículos de diversas especialidades |
| 9 | Du Manoir 2003 | Utilización de nefopam en el tratamiento postoperatorio |
| 10 | Fransen 2004 | Incluyen cirugías de revisión |
| 11 | Fu 2010 | Incluyen infiltraciones intraarticulares |
| 12 | Kilickan 2000 | Evolución de analgesia epidural |
| 13 | Moretti 2012 | Evaluación de un tratamiento postoperatorio |
| 14 | Hebl 2008 | Tres pacientes en el grupo de intervención y 4 pacientes en el grupo control presentaban diagnóstico de artritis reumatoide |
| 15 | Koinig 1988 | Artroscopia |
| 16 | Notarnicola 2011 | Únicamente bloqueo anestésico |
| 17 | Perrin 2009 | Serie de casos, estudio piloto con un tamaño muestral muy pequeño |
| 18 | Reuben 2002 | El autor se ha retractado |
| 19 | Reuben 2007 | El autor se ha retractado |
| 20 | Reuben 2008 | El autor se ha retractado |
| 21 | Rosenberg 2006 | Es un resumen de varios estudios, no hay datos suficientes para completar el CRD |
| 22 | Schroer 2011 | El tratamiento preventivo es el mismo en todos los pacientes, el placebo se administra en el postoperatorio |
| 23 | Southworth 2009 | Incluye otro tipo de cirugías |
| 24 | Straube 2005 | Incluye otro tipo de cirugías |
Principales conclusiones con su nivel de evidencia y grado de recomendación*
| CONCLUSIÓN | NE; GR |
|---|---|
| -La analgesia preventiva con AINE parece disminuir tanto el dolor como el consumo de opioides en el postoperatorio-Los resultados son más consistentes y duraderos con los Cox-2 que con los AINE tradicionales-No se producen eventos adversos significativos salvo sangrado perioperatorio con AINE tradicionales que no aparece con Cox-2 | 1b; A |
| -La analgesia preventiva con opioides disminuye el consumo de analgésicos en el postoperatorio. También se observa una mejor analgesia durante el postoperatorio inmediato, no así a largo plazo-Son estrategias seguras, sin eventos adversos significativos | 1b; A |
| -La analgesia preventiva con corticoides parece disminuir tanto el dolor como el consumo de opioides en el postoperatorio a las 48 horas, pero no tras 6 meses o un año | 2a; B |
| -La analgesia preventiva con pregabalina parece disminuir el dolor neuropático a corto y largo plazo-No hay evidencia suficiente para determinar su efecto sobre el dolor postoperatorio nociceptivo ni sobre el consumo de opioides-La analgesia preventiva con gabapentina no tiene influencia en el dolor postoperatorio | 2b; B |
| -El uso de ketamina y sulfato de magnesio durante la inducción analgésica parece tener un efecto beneficioso en el control del dolor y el consumo de opioides en el postoperatorio inmediato. | 1b; A |
| -No hay evidencia suficiente para determinar el efecto de la analgesia preventiva con nimodipino, duloxetina o clonidina | 2b; B |
| -La analgesia preventiva con varios analgésicos combinados disminuye el dolor y el requerimiento analgésicos postquirúrgico | 2b; B |
| -No hay evidencia suficiente para recomendar una estrategia de analgesia preventiva en concreto ni un protocolo de administración, sin embargo, parece que la administración de uno o varios analgésicos en algún momento del proceso preoperatorio disminuye el consumo de analgésicos y el dolor en el postoperatorio. | 2b; B |
GR:grado de recomendación; NE:nivel de evidencia.
Los datos epidemiológicos de las poblaciones de los estudios se pueden ver en la tabla 1. Eran adultos, con una edad media superior a 50 años, con una ligera mayor proporción de mujeres y que presentan dolor de moderado a severo ≥4 en la Escala Visual Analógica. El dolor postquirúrgico se evaluó sobre todo con la Escala Visual Analógica. La calidad de los estudios fue moderada en general con estudios aislados de mayor calidad pero «n» pequeña.
Existe mucha variabilidad en cuanto a los fármacos utilizados incluyendo paracetamol, AINE no selectivos, AINE selectivos de la Cox-2 (Coxib), opioides, corticoides, antidepresivos, anticomiciales y otros como sulfato magnésico, ketamina, nimodipino o clonidina.
La estrategia de analgesia preventiva también fue muy variable. Se incluyó un estudio que definía la administración «preventiva» como aquella administrada en las 2 semanas previas a la cirugía11 pero en la mayor parte de los estudios se refería a analgesia administrada en las 24-48 horas previas a la intervención o justo en el momento de la inducción de la anestesia. En muchos estudios la estrategia no consiste únicamente de una administración prequirúrgica, sino que además incluye un tratamiento analgésico durante la cirugía y/o en las horas posteriores.
De forma general se apreció que en la mayoría de los estudios la analgesia preventiva disminuyó el dolor posquirúrgico y el consumo de opioides en las primeras horas tras la cirugía. A continuación se presentan los resultados agrupados por la estrategia de analgesia utilizada.
Tratamiento preventivo con AINELa administración de AINE como estrategia preventiva fue eficaz de forma general y parece disminuir tanto el dolor como el consumo de opioides en el postoperatorio inmediato. Los Coxib presentan la ventaja de no producir alteraciones de la agregación plaquetaria lo que no altera la tasa de complicaciones hemorrágicas.
El uso de ibuprofeno11 2 semanas previas a la cirugía no demostró influencia en el control de dolor postoperatorio. Diclofenaco y ketorolaco12,13 antes de la inducción anestésica en dosis única disminuyen el consumo de morfina y sus efectos secundarios respecto del placebo en las primeras 24h poscirugía. Por otro lado, el dexketroprofeno14 24 horas previas a la cirugía y hasta 48 horas poscirugía mejora el dolor a las 15 horas y disminuye el consumo de opioides.
En 5 estudios se usó celecoxib15–19 de forma preventiva, administrado de una hora a 2 semanas previas. El resultado fue una disminución del dolor y del consumo de opioides en el postoperatorio inmediato (primeras 72 horas). Los resultados más a largo plazo no son tan consistentes. En un estudio17 se utilizó celecoxib una hora antes de la cirugía y durante 3 semanas en el postoperatorio y se observó una mejoría del dolor postoperatorio comparado con el placebo hasta 28 días después. El uso de tenoxicam20 una hora antes del inicio de la intervención no influenció en la mejoría del dolor ni en el consumo de opiodes a corto plazo. A los 9 días postoperatorios no había diferencias en el dolor respecto del placebo pero sí en el consumo de opioides, que era menor en el grupo tratado.
Se ha evaluado21 el efecto de etoricoxib una y dos horas previo a la cirugía, y se observó una diminución en los niveles de interleucina-6 y prostaglandina E-2 en sangre respecto del grupo control y un menor nivel de dolor que se mantenía hasta el tercer o cuarto día. El consumo de opiodes fue mayor en el grupo control durante las primeras 12 horas del postoperatorio. El uso de rofecoxib22–24 una hora previa a la cirugía disminuyó la estancia hospitalaria y mejoró el dolor posquirúrgico y consumo de analgésicos a los dos días. Estos resultados no se mantuvieron tras el alta.
Se ha visto que el lornoxicam25 a dosis alta 15 minutos antes de cirugía y a dosis baja en postoperatorio disminuye el consumo de opioides, pero no se asocia a una clara disminución del dolor posquirúrgico. El parecoxib16,26 en la inducción y 12 horas después de la inducción, mejora el dolor posquirúrgico y disminuye el consumo de morfina. Los efectos analgésicos siguen siendo evidentes a las 24 horas cuando se administran dos inyecciones espaciadas por 12 horas.
Las estrategias de analgesia preventiva con AINE fueron seguras, salvo en el caso del aumento del sangrado perioperatorio que se produjo con ibuprofeno11 y ketorolaco13, evento que no se apreció ni con parecoxib16,26 ni con celecoxib15,17–19.
Tratamiento preventivo con opioidesEn general, la administración preventiva de opioides es segura y disminuye el consumo de opioides en el postoperatorio inmediato. En muchos de los estudios también se observa una mejor analgesia posquirúrgica inmediata. No hay datos de su efecto a largo plazo.
En diversos estudios se ha usado la morfina21,27–32, en formulaciones orales, intravenosas e intramusculares, aplicadas desde una hora antes de la cirugía hasta en la misma la inducción anestésica. En estos estudios se ha objetivado una disminución de los niveles de dolor y consumo de opioides durante las primeras horas posquirúrgicas, salvo en un estudio de baja calidad27 en el que el dolor aumentaba en los pacientes tratados con morfina oral una hora previa a la cirugía.
El uso de oxicodona18,19 se evaluó en 2 estudios de baja calidad, con resultados opuestos tanto en el control del dolor como en el consumo de opioides en el postoperatorio. El uso de metadona33 justo después de la inducción y después de la operación disminuye el requerimiento analgésico poscirugía.
Tratamiento preventivo con corticoidesEn general, el uso preventivo de corticoides parece disminuir tanto el dolor como el consumo de opioides en el postoperatorio a las 48 horas, pero no tras 6 meses o un año.
Se ha evaluado el uso de dexametasona34–36 y de metilprednisolona37,38. En un estudio de baja calidad36, se usó la dexametasona durante la inducción anestésica y se evaluaron los resultados a los 6 meses y un año, sin mejoría del dolor ni el consumo de opioides. La dexametasona usada minutos antes de la cirugía34 demostró en un estudio mejorar el dolor dinámico durante la rehabilitación y también disminuyó el consumo de opiodes durante el postoperatorio, pero no tuvo efecto en el dolor en reposo. Un estudio35 asoció la dexametasona con gabapentina y ketamina en un protocolo de analgesia multimodal y apreció una mejoría de los niveles de dolor postoperatorio pero no disminuyó el consumo de opioides. Dos estudios26,27 apreciaron que el uso de metilprednisolona antes de la cirugía mejoraba el dolor posquirúrgico a las 48 horas y disminuía el uso de opiáceos
Tratamiento preventivo con anticomicialesEn general, la administración de pregabalina preventiva parece disminuir el dolor neuropático y el consumo de opioides en el postoperatorio inmediato y a largo plazo, sin embargo, no hay evidencia suficiente sobre su efecto en el dolor nociceptivo postoperatorio. Sus efectos secundarios pueden ser una limitación. No hay evidencia concluyente sobre la gabapentina.
Un estudio39 evaluó el dolor neuropático tras artroplastia de rodilla al administrar pregabalina 24 horas antes de la cirugía y a las 2 semanas postoperatorias. Disminuyó el dolor neuropático hasta 6 meses tras la cirugía, hubo un menor consumo de opioides intrahospitalarios, una menor estancia hospitalaria y un mayor rango de movilidad durante los 30 primeros días de rehabilitación (comparado con placebo). Sin embargo, los efectos secundarios, sobre todo somnolencia y obnubilación fueron mayores con pregabalina.
La gabapentina ha sido usada en protocolos de analgesia multimodal y de forma aislada. De forma aislada administrada 2 horas previas a la cirugía fue usada en 2 estudios40,41. En el primero40 se concluye que no disminuía el nivel de dolor ni el consumo de opioides respecto del placebo en el postoperatorio inmediato ni a los 6 meses. En el segundo41 sí se apreció un menor consumo de opioides en pacientes con gabapentina, sin embargo, este es un estudio con baja calidad, con un seguimiento escaso. La gabapentina35 en un protocolo de analgesia multimodal con dexametasona, ketamina y AINE mejoró el dolor postoperatorio sin diferencias en el consumo de opioides comparado con uso de AINE solo.
Tratamiento preventivo con otros fármacosEl uso de ketamina y sulfato de magnesio durante la inducción analgésica parece tener un efecto beneficioso en el control del dolor y el consumo de opioides en el postoperatorio inmediato. No hay evidencia suficiente en relación al nimodipino, duloxetina o clonidina como estrategia preventiva para la analgesia posquirúrgica y el consumo de opiáceos.
La ketamina administrada durante la inducción anestésica puede tener un efecto preventivo. En un estudio42 al administrarlo de forma aislada concluyeron que no había variaciones en el nivel de dolor en las primeras 48 horas postoperatorias, pero sí disminuía el consumo de opioides y se obtenía una recuperación más rápida de la flexión de rodilla. En otro31 asociaron ketamina y morfina y comprobaron una mejoría en la analgesia postoperatoria.
El uso de sulfato de magnesio43 en la inducción redujo el dolor postoperatorio y consumo de opioides en las primeras 48 horas después de la operación. El nimodipino44 administrado una hora previa a la cirugía y durante 48 horas en el postoperatorio no disminuía los niveles de dolor y aumentaba el uso de morfina a partir de las 12 horas tras la cirugía. Por otro lado, el uso de duloxetina45 dos horas antes de la cirugía y la mañana siguiente de la cirugía no modifica el dolor posquirúrgico pero disminuye el uso de mórficos durante el ingreso. La clonidina46 administrada una hora y media antes de la cirugía, 12 y 24 horas después de la dosis inicial, no mejoraba el dolor posquirúrgico pero disminuye el uso de morfina.
Tratamiento preventivo con varias intervencionesParece que la utilización de varios analgésicos combinados como estrategia preventiva tiene un efecto beneficioso y disminuye el dolor y los requerimientos analgésicos posquirúrgicos.
Un estudio47 usó un protocolo prequirúrgico con rofecoxib, tramadol, paracetamol y dexametasona, y en el postoperatorio rofecoxib, tramadol, paracetamol, hidrocodona y opioides. Obtuvieron una reducción significativa del nivel de dolor respecto del placebo.
No se demostró que añadir bloqueos anestésicos (nervio femoral) a oxicodona y celecoxib (2-12 horas antes de la cirugía) mejorase la analgesia posquirúrgica hasta 12 semanas18. El uso preventivo de oxicodona y celecoxib o valdecoxib (desde la cirugía) y en el postoperatorio disminuye el consumo de opioides, náuseas, vómitos y los días de ingreso19.
Además, el uso de gabapentina, ketamina y dexametasona en el preoperatorio, combinado con paracetamol y ketorolaco mejoró el dolor posquirúrgico en comparación con el uso de paracetamol y ketorolaco solo. No hubo diferencias en el consumo de morfina35. El uso de ketamina con morfina y anestesia epidural con lidocaína antes de la cirugía proporciona una mejor analgesia postoperatoria en comparación con la anestesia general31.
DiscusiónLa analgesia preventiva agrupa los tratamientos instaurados los días previos o durante la inducción anestésica con el objetivo de disminuir el dolor y el consumo de fármacos durante el postoperatorio. Esta estrategia es especialmente relevante en pacientes intervenidos de artroplastia de cadera y rodilla, ya que son cirugías agresivas con gran daño tisular y habitualmente en pacientes con dolor crónico establecido previamente48.
No se han descrito ni existen guías clínicas que determinen la medicación y la pauta más adecuada. Buvanendran49 en una revisión similar a esta, en la que se incluían diversos tipos de cirugías, destacó que los AINE han demostrado de una forma consistente su capacidad de reducir los niveles de dolor y consumo de opiodes postoperatorios. Por otro lado recomendó el uso preoperatorio de gabapentina y la instilación de anestésico local durante la cirugía dentro de los protocolos de analgesia multimodal. Los AINE demostraron eficacia en un metaanálisis de Ong50 evaluando estudios que incluían todo tipo de cirugías.
En esta revisión sistemática de la literatura se analizó la eficacia y seguridad de los tratamientos farmacológicos propuestos en diferentes estudios, y las pautas descritas en pacientes que son sometidos a una artroplastia de cadera o rodilla.
No hay estudios de alto nivel de calidad ni homogéneos que nos aporten evidencia suficiente para recomendar una estrategia preventiva en concreto ni un protocolo de administración, sin embargo, parece que la administración de uno o varios analgésicos en algún momento del proceso preoperatorio disminuye el consumo de analgésicos y el dolor en el postoperatorio18,19.
Han demostrado ser eficaces los AINE tanto los tradicionales11–14 como los Cox-215–17,20–23,25,26, los opiodes27-33 y los corticoides34,37,38. El uso de neurolépticos39,41 puede tener algún efecto beneficioso en el manejo del dolor neuropático postoperatorio sin evidenciarse efecto sobre el nociceptivo35,40. El uso de ketamina42 y sulfato de magnesio43 durante la inducción analgésica parece tener un efecto beneficioso. No hay evidencia suficiente para determinar el efecto de nimodipino44, duloxetina45 o clonidina46 como estrategia preventiva. Parece que la utilización de varios analgésicos combinados como estrategia preventiva, disminuye el dolor y el requerimiento analgésicos posquirúgico19,35,47.
Como limitación de nuestra revisión se puede destacar la gran variabilidad de fármacos y estrategias preventivas descritas en la literatura que dificultan enormemente la generalización de los resultados. También se apreció la presencia de distintos tipos de sesgos que afectan a la validez de muchos estudios, y por tanto condicionan la reproductibilidad de los resultados. Sin embargo las características epidemiológicas de la población incluida en los estudios seleccionados son similares a las de los pacientes a los que se les indica una artroplastia de cadera o rodilla en nuestro país51. Otra limitación del presente estudio es que solo realiza una revisión sistemática sin profundizar en un metaanálisis que permitiese sintetizar los resultados de los diferentes estudios y evaluar mejor la fortaleza de los tratamientos, sin embargo la variabilidad de los fármacos y dosis usados en los estudios hace este abordaje imposible.
En conclusión, no hay evidencia suficiente para recomendar una estrategia preventiva en concreto ni un protocolo de administración, sin embargo, creemos que la administración de Cox-2 y/o opiodes las semanas previas a la intervención quirúrgica asociados al uso de fármacos como los corticoides, la ketamina o el sulfato de magnesio durante la inducción analgésica son estrategias seguras y eficaces para el manejo del dolor postoperatorio en nuestros pacientes intervenidos de artrosplastia de cadera o rodilla.
FinanciaciónEl presente artículo contó con la financiación de MSD. MSD no participó en la definición del tema, desarrollo de la revisión, conclusiones ni en la edición del mismo.
Conflicto de interesesEl Dr. Díaz Heredia declara conflicto de intereses relacionado directamente con el presente original: «He recibido honorarios de MSD en calidad de consultor para la realización de dicho estudio», y no relacionado directamente con el presente original:. «He recibido honorarios por actividades docentes de las siguientes compañías: Biomet, Grunenthal, MSD, Pfizer, Smith and Nephew; he recibido financiación para proyectos de investigación de las siguientes compañías: Biomet, Grunenthal y MSD».
La Dra. Loza Santamaría declara conflicto de intereses relacionado directamente con el presente original: «He recibido honorarios de MSD en calidad de metodóloga para la realización de dicho estudio», y no relacionado directamente con el presente original: «He recibido financiación para proyectos de investigación de las siguientes compañías: Pfizer, Roche, Abbvie, Novartis y MSD».
El Dr. Cebreiro declara conflicto de intereses relacionado directamente con el presente original: «He recibido honorarios de MSD en calidad de consultor para la realización de dicho estudio».
El Dr. Ruiz Iban declara conflicto de intereses relacionado directamente con el presente original: «He recibido honorarios de MSD en calidad de consultor para la realización de dicho estudio», y no relacionado directamente con el presente original: «He recibido honorarios como consultor de las siguientes compañías: Biomet, Bristol-Myers Squibb; Grunenthal, MSD; he recibido honorarios por actividades docentes de las siguientes compañías: Astelas, Biomet, Bristol-Myers Squibb; Grunenthal, MSD, Pfizer, Smith and Nephew y Zambon; «He recibido financiación para proyectos de investigación de las siguientes compañías: Biomet, Grunenthal y MSD».
AgradecimientosA Cristina Benitez y Eduardo Junco por su contribución en el desarrollo de la revisión sistemática.
Agradecemos la financiación de Merck Sharp and Dohme para la realización de esta revisión sistemática.
Nivel de evidenciaNivel de evidencia II.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.