Existen muchos estudios referentes a los diferentes efectos producidos por el fresado intramedular en el callo de fractura, pero no existe evidencia en la literatura del efecto de dicho fresado en la osteogénesis. Realizamos un estudio prospectivo para analizar el efecto del fresado endomedular y enclavado en la producción de factores de crecimiento durante el proceso de consolidación de la fractura en el fémur producida en ratas.
Material y métodosProducimos una fractura diafisaria, transversa, no conminuta de fémur en 64 ratas: 34 ratas no recibieron ningún tratamiento y las otras 30 se trataron mediante un procedimiento quirúrgico estandarizado, consistente en fresado del canal medular de distal a proximal y fijación de la fractura con una aguja de Kirschner. Las ratas fueron sacrificadas a las 24h, 4.°, 7.° y 15.° días después de la fractura. Medimos la cantidad de factores de crecimiento (PDGFA, TGF2 y TGFβ-R2) en el callo de fractura mediante estudio anatomopatológico en los diferentes momentos del sacrificio.
ResultadosLos resultados de las variables primarias del estudio, estratificadas por tiempo hasta el sacrificio, no mostraron diferencias estadísticas significativas.
DiscusiónAunque la presencia de una aguja intramedular facilita la estabilización de la fractura y la formación del callo de fractura, no hemos encontrado ninguna evidencia significativa de que el fresado endomedular produzca cambios en la expresión de los factores de crecimiento estudiados (TGFβ-R2, PDGFA y TGFβ2) durante la formación del callo de fractura de fémur en ratas.
Many studies have been conducted to determine the different effects that reaming or intramedullary nailing have on fracture healing, but there is no evidence in the literature of the effect of intramedullary reaming on osteogenesis. We performed a prospective study to analyse the effect of intramedullary reaming and nailing on the production of growth factors during the process of fracture healing in the femur of rats.
Material and methodsA transverse mid-shaft non-comminuted femur fracture was produced in 64 rats; 34 rats did not receive any treatment, and a standardized surgical procedure was performed on 30 rats, by exposing the left knee, reaming the medullary canal from distal to proximal, and then fixing the fracture with a steel pin. The rats were sacrificed at the 24th hour, 4th, 7th and 15th days after the fracture. The amount of growth factors that appeared in the callus fracture was measured using histopathology studies. The primary categorical variables analysed were PDGFA, TGF2 and TGFβ-R2. These variables were analysed in each group at the different sacrifice times.
ResultsThe results of the primary variables of the study, stratified by the time until sacrifice, showed no statistically significant differences.
DiscussionEven if the presence of an intramedullary wire facilitates the fracture repair and the stabilising the bridge of bone between both edges of the fracture site, no evidence was found that reaming changes the expression of the growth factors studied (PDGFA, TGFβ-R2 and TGFβ2) during the callus formation in rats.
Muchos factores de crecimiento están involucrados en la regulación de la reparación de la fractura del hueso1. En las fases iniciales, los macrófagos movilizados en el foco de la fractura producen factores de crecimiento, incluyendo el factor de crecimiento derivado de plaquetas (PDGF)2 y el factor de crecimiento transformante β (TGFβ)3, que estimulan la proliferación de las células mesenquimales y su transformación y diferenciación en condroblastos4. Los PDGF que también se liberan de las plaquetas y de las células endoteliales dañadas5, son un potente estimulador de condroblastos, osteoblastos, así como de sus precursores6 favoreciendo la producción de hueso mediante la regulación de dichas células. Especial importancia tiene en la regeneración tisular de la capa interna del periostio de huesos largos. Estas células pueden diferenciarse en osteoblastos y condroblastos y, por tanto, son de especial importancia para le formación de hueso tras la fratura7.
Se han realizado muchos estudios para valorar el efecto que tienen el fresado y el enclavado endomedular en el proceso de consolidación de las fracturas8, algunos de ellos evaluando las propiedades mecánicas del enclavado9, los efectos de la rigidez del clavo10, o los criterios de inestabilidad tras el enclavamiento femoral8, los efectos del fresado en el flujo sanguíneo11 y su restauración después del fresado12, así como la comparación de los efectos entre la fijación externa y el enclavamiento endomedular13, pero no hay evidencia en la literatura de los efectos que el fresado y enclavado endomedular tienen en la osteogénesis.
El objetivo de este estudio es evaluar los cambios morfológicos y la producción de mensajeros celulares y su evolución en el callo de fractura producido en 2 grupos de ratas: un grupo tratado mediante fresado endomedular, y otro grupo que no recibió ningún tratamiento. Se ha analizado mediante inmunohistoquímica la distribución de los factores de crecimiento involucrados en la proliferación y diferenciación de las células mesenquimales que participan en el proceso de consolidación de las fracturas.
Material y métodosSe realiza un estudio experimental con 64 ratas modelo Sprague-Dawley, con un peso medio de 200g. Ninguna de las ratas incluidas en el estudio había sido utilizada en anteriores estudios y ninguna rata fue excluida. Todas tuvieron el mismo tratamiento perioperatorio. Fueron expuestas a un ciclo de 12h de luz y 12h de oscuridad a 22°C. Las ratas fueron estabuladas en jaulas de roedores con 2 ratas en cada una y recibieron una dieta estándar y agua ad libitum.
Cuidados y cirugía animalEsta investigación siguió las directrices internacionales para la protección de los animales y fue aprobada por el Comité de Ética del Departamento de Cirugía de nuestra institución.
Se produce una fractura de fémur en todas las ratas, dividiéndolas en 2 grupos: 30 ratas se trataron con un clavo endomedular y 34 ratas no recibieron ningún tratamiento.
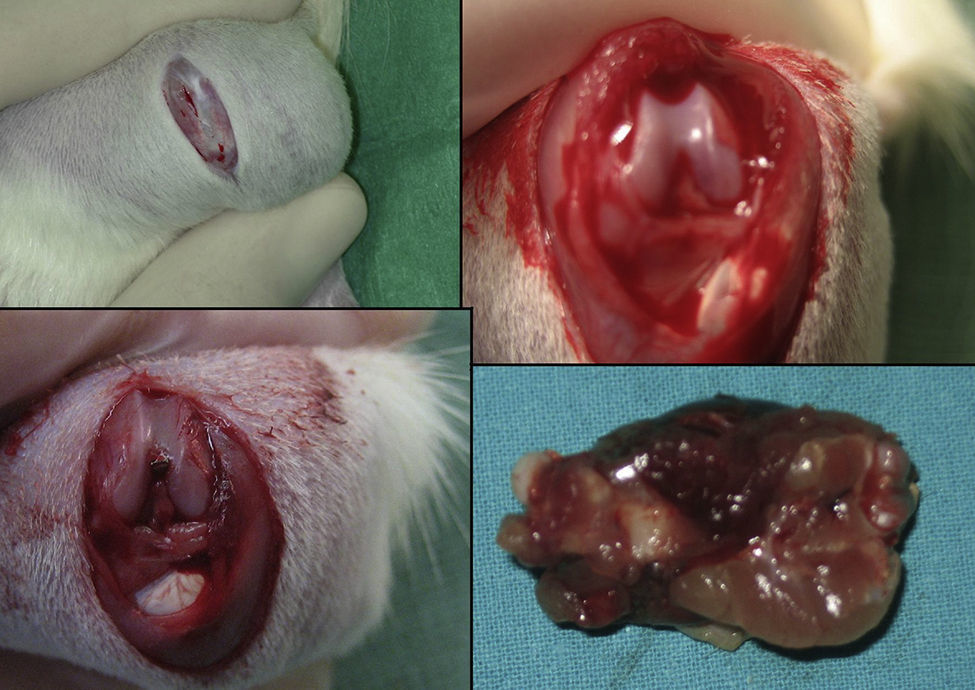
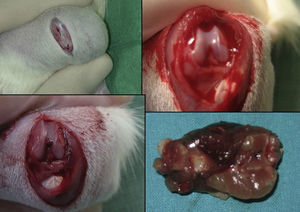
La anestesia perioperatoria fue de 2cc (1cc por 100g) de una solución de ketamina de 10mg, atropina 1mg y diazepam 10mg, y solución salina 5cc administrado por vía intraperitoneal. En todas las ratas se produce manualmente una fractura de tercio medio de fémur utilizando los principios de una palanca de tipo 1, usando un punto de apoyo entre ambas zonas de carga (cadera y rodilla). Esta técnica nos permite crear una fractura transversal no conminuta en todos los animales.
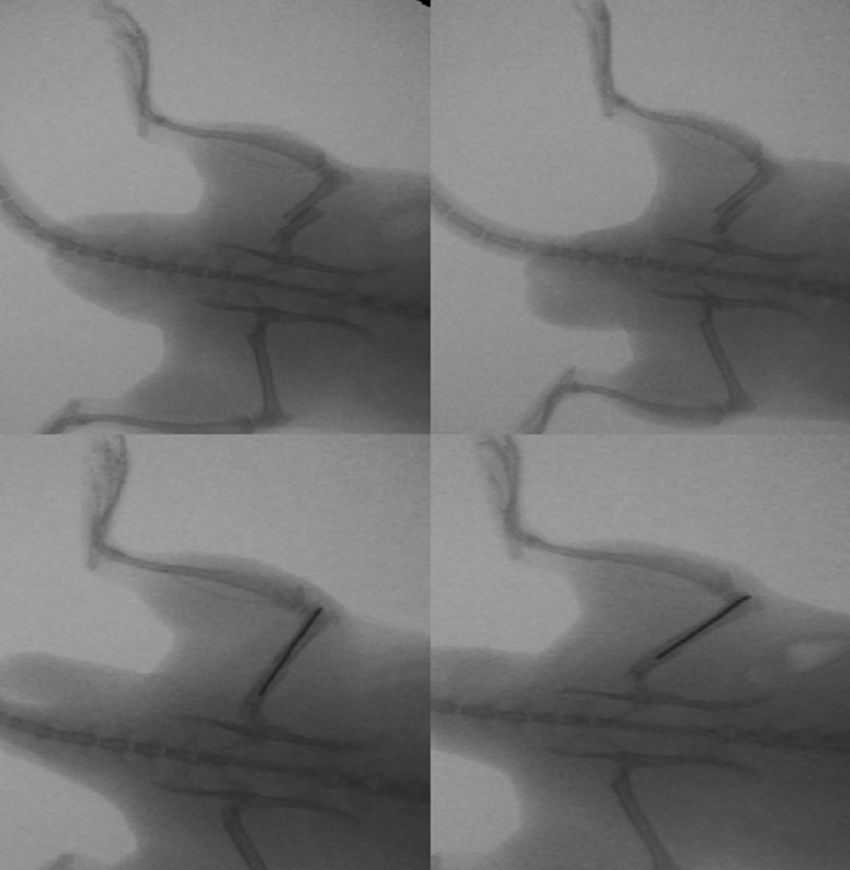
En el grupo operado con clavo intramedular (30 ratas) se realizó un procedimiento quirúrgico estándar. Tras anestesia intraperitoneal y después del rasurado local, se expone la rodilla izquierda mediante una incisión media y un abordaje parapatelar medial, luxación de la patela, exponiendo así la escotadura intercondílea. Se realiza un fresado retrogrado del canal endomedular y fijación definitiva con aguja Kirschner de 1,6mm. La herida es lavada con solución salina y cerrada con sutura absorbible. No se protegió la carga tras la cirugía. Los animales se observaron diariamente durante los primeros 3 días, y después semanalmente. Se administró amoxicilina en agua durante 7 días.
Las ratas fueron sacrificadas mediante una sobredosis de éter en 4 momentos diferentes: a las 24h, 4.°, 7.° y 15.° días después de la fractura. La extracción del fémur en las ratas sacrificadas se realizó mediante abordaje lateral junto a los compartimentos musculares del muslo a fin de no alterar la formación del callo. Se midieron la cantidad de factores de crecimiento que aparecieron en el callo de fractura mediante estudio anatomopatológico.
Variables de estudioLas principales variables categóricas analizadas fueron PDGFA, TGF2 y TGFβ-R2. De cada grupo evaluamos estas variables en los diferentes momentos de sacrificio (24h, 4.°, 7.° y 15.° días después de la fractura). Para ello, se realizó un análisis inmunohistoquímico en células endoteliales, mesenquimales, osteoblastos, osteocitos, condroblastos y condrocitos. Se aplicó una puntuación cuantitativa en función del número de anticuerpos presentes para cada factor de crecimiento: no positivo (−), solo ocasionalmente positivo (+/−), menos de 10% de células positivas (+), de 10-50% células positivas (++), y más del 50% de células positivas (+++).
Se analizaron otras variables categóricas secundarias, tales como el grado de necrosis, hemorragia, células inflamatorias, neoformación de vasos y el callo. Se evaluó la respuesta de cada grupo al tratamiento.
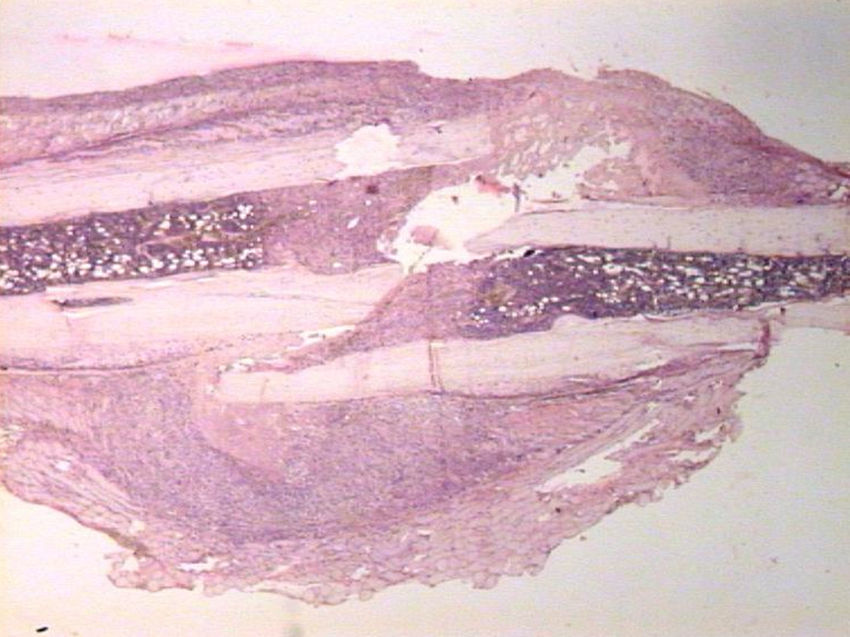
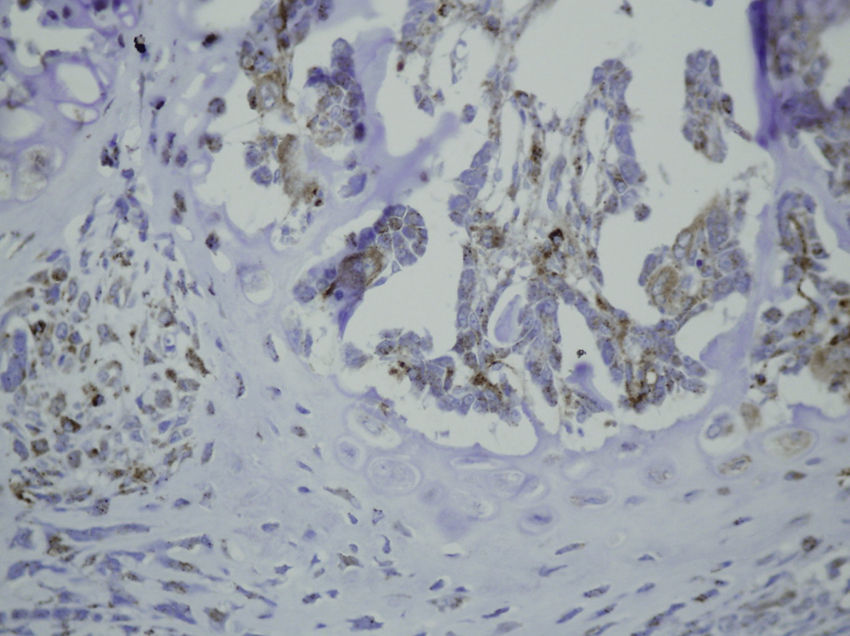
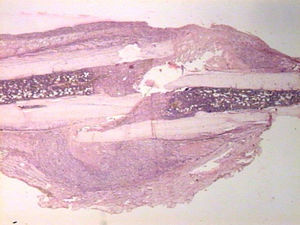
HistologíaCada espécimen, que consistía en hueso y músculo con los tejidos blandos adyacentes, fue fijado en formaldehído al 10% y descalcificado en una solución de ácido fórmico al 10%. Las muestras fueron seccionadas a lo largo del eje del fémur en el plano sagital e introducidas en parafina. En el grupo enclavado, la aguja de Kirschner fue retirada previamente a su preparación. Se realizaron cortes de 4μm de espesor, teñidas con hematoxilina-eosina y tricrómico de Masson. Se realizaron preparaciones más específicas para la inmunohistoquímica, gracias a la máquina de tinción TechMate™ (DakoCytomation). Se utilizaron los siguientes anticuerpos policlonales y diluciones: TGFβ2 (Santa Cruz Biotechnology®, sc-90; 1:40), PDGFA (N-30) (Santa Cruz Biotechnology®, sc-128; 1:20) y TGFβ-R2 (L-21) (Santa Cruz Biotechnology®, sc-400; 1:40). La unión de los anticuerpos primarios fue visualizada utilizando el método peroxidasa-antiperoxidasa. Después de completar la inmunorreacción, las secciones fueron teñidas con hematoxilina.
Análisis estadísticoLas variables fueron descritas por su distribución de frecuencia. La comparación entre el grupo experimental y el grupo de control para los resultados categóricos primarios (PDGFA, TGF2, TGFR2) fue evaluada con la prueba Chi-cuadrado de Pearson o la prueba de Fisher (en caso necesario). Así mismo, el riesgo relativo (RR) y su intervalo de confianza del 95% fueron estimados. Se realizó el mismo análisis estratificado por tiempo de sacrificio (antes y después de las 24h). Un análisis de remisión logística fue empleado con el fin de evaluar el efecto de la interacción entre el grupo de estudio y la variable dicotómica tiempo de sacrificio.
Se agruparon los resultados de la valoración en positivo o negativo basado en la presencia o no de células positivas.
Un valor del 5% se acepta como significativo para todas las pruebas. El procesamiento de datos y análisis se ha realizado mediante el paquete estadístico SPSS® v15.0.
ResultadosPreparación animalNo hubo incidencias perioperatorias, y no se observaron signos de sufrimiento durante el periodo experimental. El grupo intervenido mediante fijación interna recuperó marcha normal al día siguiente de la intervención, mientras que el grupo sin fijación interna caminaba a 3 patas durante los primeros días tras la fractura. No hubo ninguna infección o la muerte.
HistologíaSacrificio en las primeras 24 horasUn día después de la fractura, las características morfológicas de ambos grupos fueron muy parecidas. Se observaron áreas de necrosis, hemorragia con hematoma, y numerosas células inflamatorias, tales como neutrófilos y macrófagos en los bordes de la fractura.
No se observó neoformación de hueso o cartílago aunque se evidenciaron osteoblastos en la capa interna del periostio.
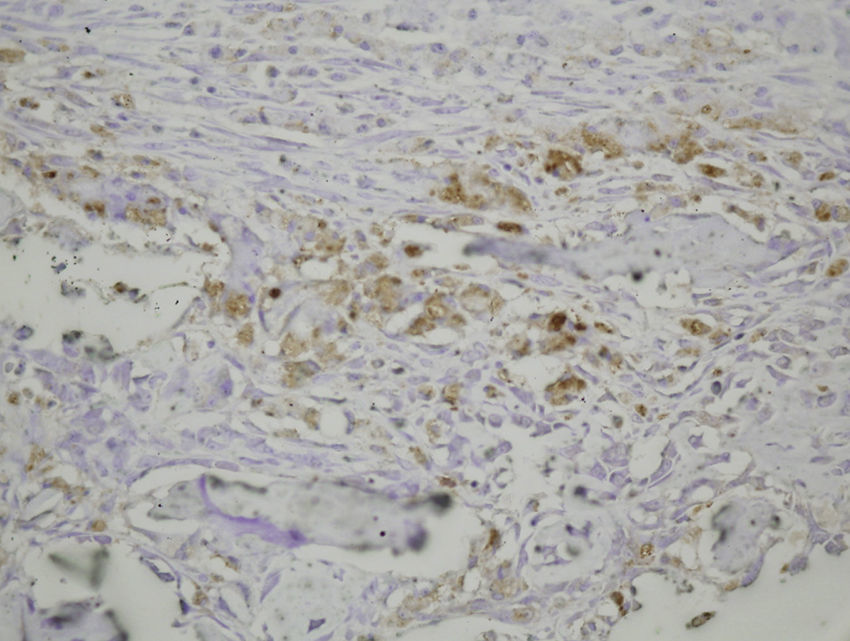
En las muestras histológicas obtenidas en los grupos sacrificados a las 24h después de la fractura, la inmunotinción para PDGFA fue positiva en células mesenquimales y endotelio. La inmunotinción para TGFβ-R2 fue positiva en células endoteliales, células mesenquimales, osteoblastos y osteocitos. Además, se observó una inmunotinción débil para TGFβ2 en células mesenquimales y solo ocasionalmente en el resto de tejidos y células circundantes.
Sacrificio al cuarto día de la fracturaCuatro días después de la fractura se evidencia la neoformación de vasos. El callo periostal y endostal están presentes, y pequeñas islas de condroblastos y condrocitos pueden identificarse entre abundante proliferación osteoblástica. Las células mesenquimales son también numerosas. La formación ósea fue aparentemente más extensa en el grupo con una fijación intramedular. Posteriormente al cuarto día posfractura, la histología demostró que la tinción para PDGFA fue igualmente positiva para células endoteliales y las células mesenquimales, pero también en los osteoblastos. Todas las líneas celulares, incluyendo las células endoteliales, las células mesenquimales, condroblastos, condrocitos, osteoblastos y osteocitos mostraron una alta inmunotinción positiva para TGFβ-R2. La tinción para TGFβ2 no mostró diferencias con el grupo de las primeras 24h postsacrificio, con solo un ligero incremento en algunas células mesenquimales.
Sacrificio a la semana posfracturaUna semana después de la fractura, los cambios morfológicos en ambos grupos fueron parecidos aunque la formación de hueso, tanto en el periostio como endostio fue más extensa que en los momentos anteriores. La tinción para PDGFA apareció en todos los tipos de células en estudio, incluyendo las células endoteliales, células mesenquimales, osteoblastos y osteocitos, apareciendo por primera vez en condroblastos y condrocitos. De igual forma a lo observado en el cuarto día posfractura, la tinción para TGFβ-R2 fue positiva en todas las células, siendo más intensa en ambos grupos de ratas que para PDGFA. Al igual que en las muestras anteriores, la tinción para TGFβ2 fue muy débil de forma generalizada.
Sacrificio a los 15 días posfracturaA los 15 días de la fractura, los cambios morfológicos no relevaron cambios significativos aunque los infiltrados inflamatorios no fueron tan intensos. Las tinciones para PDGFA no mostraron diferencias respecto al grupo del séptimo día posfractura, siendo más intensa la tinción para TGFβ-R2. La tinción para TGFβ2 fue igual a días anteriores.
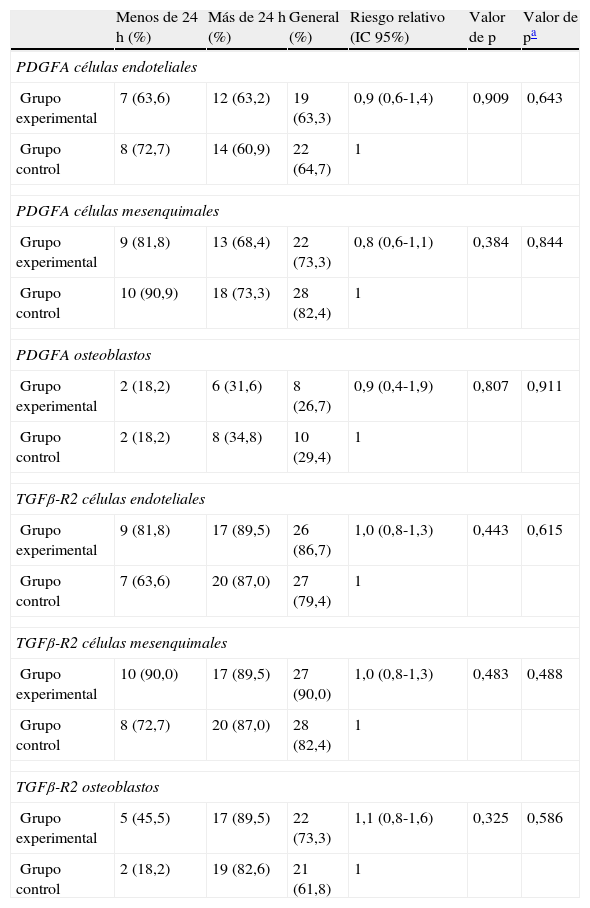
Resultados estadísticosLa tabla 1 muestra los resultados de las principales variables de estudio estratificado por tiempo hasta el sacrificio. En la muestra global, no se evidencia diferencias estadísticamente significativas para ninguna variable. Cuando se evaluaron las diferencias en la incidencia de resultados de las distintas variables entre los 2 grupos, según el tiempo de sacrificio, ninguna interacción demostró diferencias estadísticas.
Comparación de la incidencia de factores de crecimiento según la variable tiempo
| Menos de 24 h (%) | Más de 24 h (%) | General (%) | Riesgo relativo (IC 95%) | Valor de p | Valor de pa | |
| PDGFA células endoteliales | ||||||
| Grupo experimental | 7 (63,6) | 12 (63,2) | 19 (63,3) | 0,9 (0,6-1,4) | 0,909 | 0,643 |
| Grupo control | 8 (72,7) | 14 (60,9) | 22 (64,7) | 1 | ||
| PDGFA células mesenquimales | ||||||
| Grupo experimental | 9 (81,8) | 13 (68,4) | 22 (73,3) | 0,8 (0,6-1,1) | 0,384 | 0,844 |
| Grupo control | 10 (90,9) | 18 (73,3) | 28 (82,4) | 1 | ||
| PDGFA osteoblastos | ||||||
| Grupo experimental | 2 (18,2) | 6 (31,6) | 8 (26,7) | 0,9 (0,4-1,9) | 0,807 | 0,911 |
| Grupo control | 2 (18,2) | 8 (34,8) | 10 (29,4) | 1 | ||
| TGFβ-R2 células endoteliales | ||||||
| Grupo experimental | 9 (81,8) | 17 (89,5) | 26 (86,7) | 1,0 (0,8-1,3) | 0,443 | 0,615 |
| Grupo control | 7 (63,6) | 20 (87,0) | 27 (79,4) | 1 | ||
| TGFβ-R2 células mesenquimales | ||||||
| Grupo experimental | 10 (90,0) | 17 (89,5) | 27 (90,0) | 1,0 (0,8-1,3) | 0,483 | 0,488 |
| Grupo control | 8 (72,7) | 20 (87,0) | 28 (82,4) | 1 | ||
| TGFβ-R2 osteoblastos | ||||||
| Grupo experimental | 5 (45,5) | 17 (89,5) | 22 (73,3) | 1,1 (0,8-1,6) | 0,325 | 0,586 |
| Grupo control | 2 (18,2) | 19 (82,6) | 21 (61,8) | 1 | ||
La fractura ideal en un estudio experimental debe ser una fractura estándar, tanto en localización, como en tipo de fractura, grado de conminución, lesión de partes blandas, estabilidad y desplazamiento de los fragmentos14. En la literatura se describen distintos modelos de fractura14–17, utilizando diferentes métodos de fijación para fémur, incluso técnicas percutáneas18, si bien es cierto que el mayor número de estudios experimentales son realizados en fracturas de tibia.
En nuestro estudio, hemos creado un modelo experimental mediante el uso de una técnica sencilla y reproducible en que la fractura se produce manualmente. La lesión de partes blandas con este modelo ha sido baja con el fin de evitar en lo posible la hipoperfusión tisular de los compartimentos del muslo que podrían afectar a la consolidación de la fractura. Una cobertura muscular adecuada del hueso cortical es necesaria para maximizar el potencial osteogénico en fracturas con fresado endomedular, tal vez debido a la capacidad de la musculatura para restablecer el flujo sanguíneo del periostio y la contribución a la diferenciación de células mesenquimales pluripotenciales en células con capacidad osteogénica en el foco de fractura19.
La reparación de las fracturas presenta 2 procesos diferentes20, la proliferación celular y la diferenciación que se puede dividir en 4 etapas basadas en las características celulares, matriz extracelular y el momento de aparición de estas células21. Estas etapas serían: primera, una respuesta de lesión inmediata (desde el momento de la lesión hasta 2 días después de la fractura); segunda etapa con la formación de hueso intramembranoso (de 2 a 4 días); tercera etapa, la fase de condrogénesis (de 4 a 10 días), y la cuarta etapa con la osificación endocondral (15 días).
Esto sigue una respuesta biológica específica que empieza con una respuesta aguda inflamatoria. Después del traumatismo que produce la fractura, el hematoma que se forma alrededor de la fractura formará un molde para la formación del callo. La respuesta aguda inflamatoria se inicia dentro de las primeras 24h, como puede verse en este estudio, y es completa después de los 7 días tras el traumatismo. Esas células inflamatorias promueven la angiogénesis.
En una segunda fase, participarían las células mesenquimales diferenciándose en células con poder osteogénico. La formación osteocondral se produce entre los extremos de la fractura y la zona externa del periostio. Debido a que la curación de las fracturas requiere un suministro de sangre adecuado, la angiogénesis y revascularización tienen lugar en el punto de la fractura. Finalmente, el callo cartilaginoso se reabsorbe y es reemplazado por un callo óseo duro22.
Pero esta vía de curación puede ser modificada por el fresado endomedular23. Se ha demostrado que el fresado endomedular produce daños en el suministro de sangre endostal, lo que conduce a la necrosis avascular del endostio. Pero el fresado también tiene efectos positivos, como el incremento del aporte sanguíneo al periostio24 o el aporte de autoinjerto al foco de fractura25.
En el presente estudio los resultados son parecidos. El acontecimiento más temprano en la curación de la fractura es la presencia de un infiltrado inflamatorio, incluyendo los macrófagos y la proliferación de células mesenquimales. Tanto las células endoteliales como las mesenquimales comienzan a expresar PDGFA, que se libera en el lugar de la fractura, e induce la proliferación de células mesenquimales y su diferenciación a osteoblastos y condroblastos. Poco después de las primeras 24h, los osteoblastos fueron evidentes en la superficie endosteal y las células mesenquimales periostales comenzaron a aparecer alrededor de los bordes de la fractura. Seguidamente, a los 4 días, continúa con la formación de hueso intramembranoso con osteoblastos, condroblastos y condrocitos.
La reabsorción se lleva a cabo por numerosos osteoclastos en las superficies óseas adyacentes al hueso necrótico, mientras que el crecimiento vascular se hace evidente. Después de 7 días comienza la osificación encondral en la fractura, y 15 días más tarde un puente de hueso y cartílago se forma en la superficie externa del hueso. Este puente se encontró siempre en las ratas con una fijación intramedular, pero no en el otro grupo aunque la formación de cartílago si fue visto en ambos grupos.
Incluso si la fractura tiene un potencial riesgo de inestabilidad rotacional, como es el caso, no tuvimos ningún caso de no unión o retraso de unión en el presente estudio, obteniendo buenas tasas de consolidación, en comparación con otros estudios10,26. Muchos estudios han valorado los efectos del fresado en el flujo sanguíneo intramedular y su efecto en el callo de fractura11,12 encontrando áreas altamente vascularizadas en el callo a pesar del fresado. Nosotros no encontramos ninguna diferencia en el tamaño del callo o la morfología del mismo entre las fracturas fresadas y no fresadas.
Estudios previos in vitro y estudios in vivo han demostrado que numerosos factores de crecimiento y moléculas de la matriz extracelular desempeñan un papel esencial en la reparación de las fracturas. En este estudio, se analizaron las diferencias en los patrones temporales de expresión de diversos factores de crecimiento cuando la fractura es fresada y fijada mediante una osteosíntesis endomedular, analizando PDGFA, TGFβ-R2 y TGFβ2.
Estudios in vitro han sugerido que TGFβ induce la diferenciación de células mesenquimales en el periostio a osteoblastos y condrocitos, pero el mecanismo por el cual el TGFβ promueve la condrogénesis y osteogénesis es desconocido27. En nuestro estudio, la tinción para TGFβ2 se positiviza solo ocasionalmente, y esto puede deberse a la mala reactividad del anticuerpo, ya que el receptor de TGFβ-R2 es expresado por todos los tipos celulares del callo óseo. La tinción TGFβ-R2 es positiva a las 24h, principalmente en las células endoteliales y mesenquimales, y desde el cuarto día es además positivo en condroblastos, condrocitos, osteoblastos y osteocitos.
Las PDGF mejoran tanto la proliferación como la diferenciación osteogénica de células mesenquimales28. En nuestro estudio, hemos observado una tinción ligeramente positiva a PDGFA en células endoteliales y mesenquimales hasta el séptimo día cuando apreciamos alguna tinción positiva en condroblastos y osteoblastos.
En resumen, nuestros resultados demuestran que en la reparación de las fracturas del fémur de ratas tiene lugar tanto una reparación intramembranosa como endocondral. Estos procesos se ven estimulados por los diversos factores de crecimiento, los cuales están implicados en la proliferación y diferenciación celular. Pero, incluso si la presencia de una fijación intramedular puede facilitar la reparación de la fractura al estabilizar el puente óseo entre ambos bordes de la zona de la fractura, no hemos encontrado ninguna evidencia de que el fresado intramedular cambie la expresión de los factores de crecimiento estudiados (PDGFA, TGFβ-R2 y TGFβ2) durante la formación del callo de fractura (figs. 1–5).
Nivel de evidencia ii.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.