Recordar una enfermedad poco tratada en la literatura científica.
Material y métodosEstudio observacional, longitudinal y ambispectivo de una serie de 51 lipomas intramusculares en 50 pacientes. Se ha calculado la distribución de frecuencias de las variables cualitativas y la mediana y el rango intercuartil (RIC) de las cuantitativas. La relación entre el tamaño de los lipomas (recodificada en 2 valores) y las variables de estudio se ha analizado con el test exacto de Fisher.
ResultadosEl 62% de los pacientes de la serie fueron varones y la mediana de edad, 61 años, con sobrepeso en el 55% del total. Se describe su localización, sus características de presentación clínica y de imagen, su tratamiento y resultados.
DiscusiónLos lipomas intramusculares tienen un aspecto característico, aunque a veces la RM no los distingue de liposarcomas bien diferenciados. El tamaño como criterio único de derivación de un paciente con una lesión de partes blandas a un centro de referencia es discutible.
ConclusionesLos pacientes con lipomas intramusculares, aunque estos puedan ser típicos en su presentación, sobre todo cuando sean grandes y muestren signos que los puedan confundir con liposarcomas bien diferenciados de bajo grado, se deberían tratar en centros con experiencia.
To review a poorly studied pathology in the scientific literature.
Material and methodsAn observational, longitudinal and ambispective study of a series of 51 intramuscular lipomas in 50 patients. The frequency distribution of qualitative variables, and the median and the interquartile range (IQR) for continuous variables were calculated. The relationship between the size of the lipomas (recoded into two values) and the study variables were analyzed using the Fisher exact test.
ResultsMen made up 62% of the series, and the median age was 61 years, with 55% of the total being overweight. About half of the patients were diagnosed in the upper limb. More than three-quarters (78%) were strictly intramuscular lipomas. Location, clinical and image presentation, treatment and results are described.
DiscussionIntramuscular lipomas have their own particular characteristics. Nevertheless, MRI is sometimes unable to distinguish them from well differentiated liposarcomas. Using size as the only criterion for referring a patient with a soft tissue injury to a reference center is still debatable.
ConclusionsPatients with intramuscular lipomas, although they may be typical in their presentation, especially when they are large and show findings that can be confused with a well-differentiated low grade liposarcoma, should be treated in experienced centers
Una tumoración profunda de más de 5cm de diámetro, no necesariamente dolorosa, que crece o reaparece después de extirpada, debe considerarse un sarcoma mientras no se demuestre lo contrario y proceder en consecuencia. Esto sería completar el estudio de la lesión y derivar al paciente de forma rápida a un centro de referencia para su tratamiento específico1,2.
Los lipomas intramusculares (IM) son tumores adiposos benignos de partes blandas que pueden simular un sarcoma por su tamaño, localización profunda y crecimiento, a veces, infiltrante3. El conocimiento de su existencia es fundamental para su correcto tratamiento4.
El objetivo del presente estudio es recordar una enfermedad que, no siendo infrecuente y pareciendo banal, ha sido abordada en la literatura científica de forma puntual5–8 y en series de relativamente pocos casos4,9–12, además de, a menudo, ser descuidada por quedar a caballo entre distintos especialistas, generando su manejo, en ocasiones, dudas en cuanto al diagnóstico, lugar y tipo de tratamiento.
Material y métodosSe ha realizado un estudio observacional, longitudinal y ambispectivo de una serie de 50 pacientes con 51 lipomas intramusculares atendidos de forma continua en la Unidad de Tumores Músculo-Esqueléticos del Complejo Asistencial Universitario de León, desde julio de 2006 hasta junio de 2013. Treinta y nueve pacientes (78%) procedían del Área Sanitaria de León y 11 (22%) de otras áreas sanitarias de la CC.AA. de Castilla y León. Cuarenta y nueve casos (96%) fueron de nuevo diagnóstico, mientras que 2 fueron recidivas de lesiones tratadas previamente en otro centro (un paciente con 2 recidivas sometido a radioterapia después de la primera).
Treinta y cuatro casos (67%) fueron intervenidos quirúrgicamente y el diagnóstico de lipoma confirmado por estudio anatomopatológico convencional. En un caso de lipoma intramuscular del peroneo lateral largo se informó de degeneración grasa concomitante del músculo. En ningún caso se identificaron lipoblastos ni atipias celulares. El diagnóstico en los 17 casos no intervenidos, 2 de los cuales están pendientes de cirugía, se hizo por las imágenes de RM.
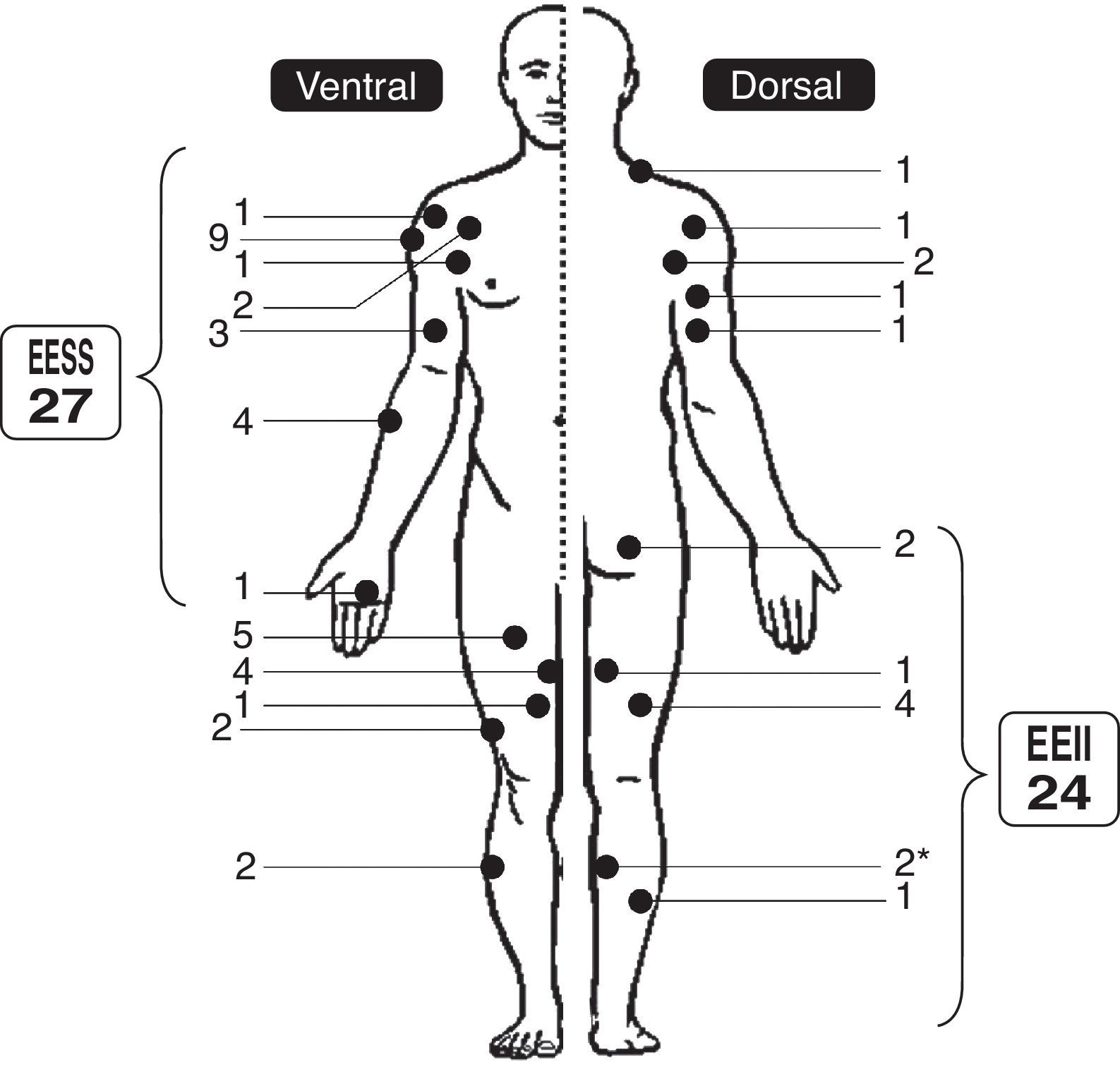
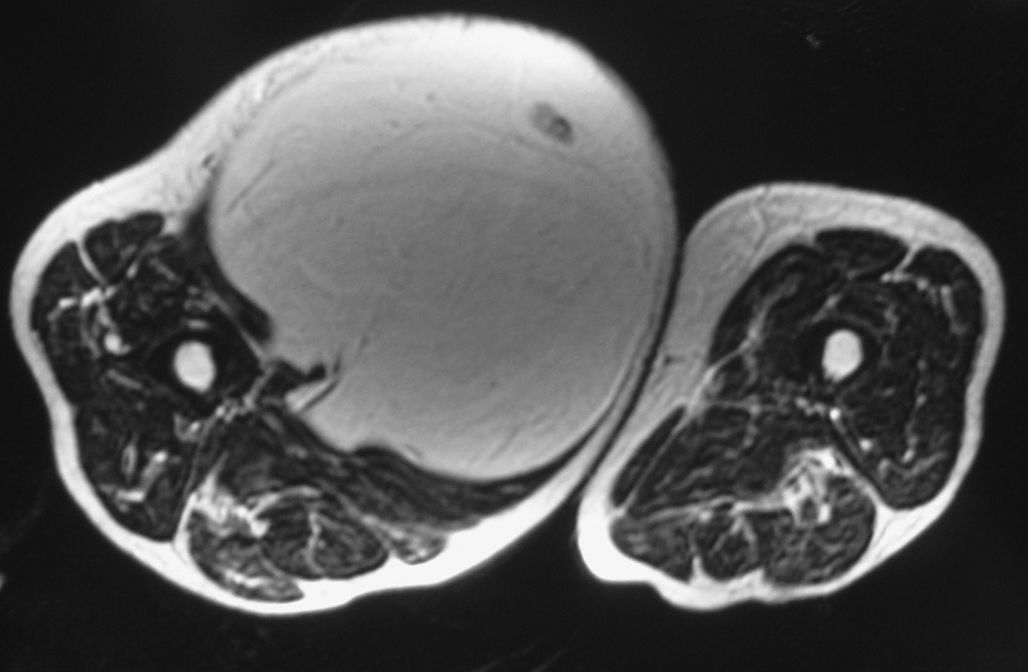
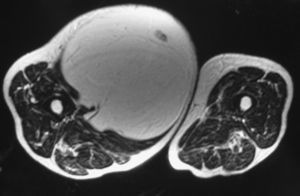
Se analizaron las características epidemiológicas, clínicas y de imagen de la serie (fig. 1), el tratamiento al que los pacientes fueron sometidos y los resultados de la intervención quirúrgica. En 14 casos (27%), en la mayoría de los cuales se sospechó un liposarcoma bien diferenciado de bajo grado por las pruebas de imagen, se realizaron biopsias cerradas con tru-cut, en 3 ocasiones guiadas por ecografía, que lo descartaron. El tratamiento quirúrgico, que en 31 pacientes fue realizado por el mismo cirujano (LRRP), consistió en la resección completa de la tumoración con márgenes marginales (31 casos: 91%) (figs. 2 y 3) o intralesionales (3 casos). Todos los pacientes intervenidos, después del alta hospitalaria, fueron seguidos de forma rutinaria en consulta externa y al final del estudio, con exploración física en todos los casos y RM en los de duda de recidiva local (un caso). Los pacientes no intervenidos se revisaron anualmente, repitiendo la RM en la mayoría de ellos.
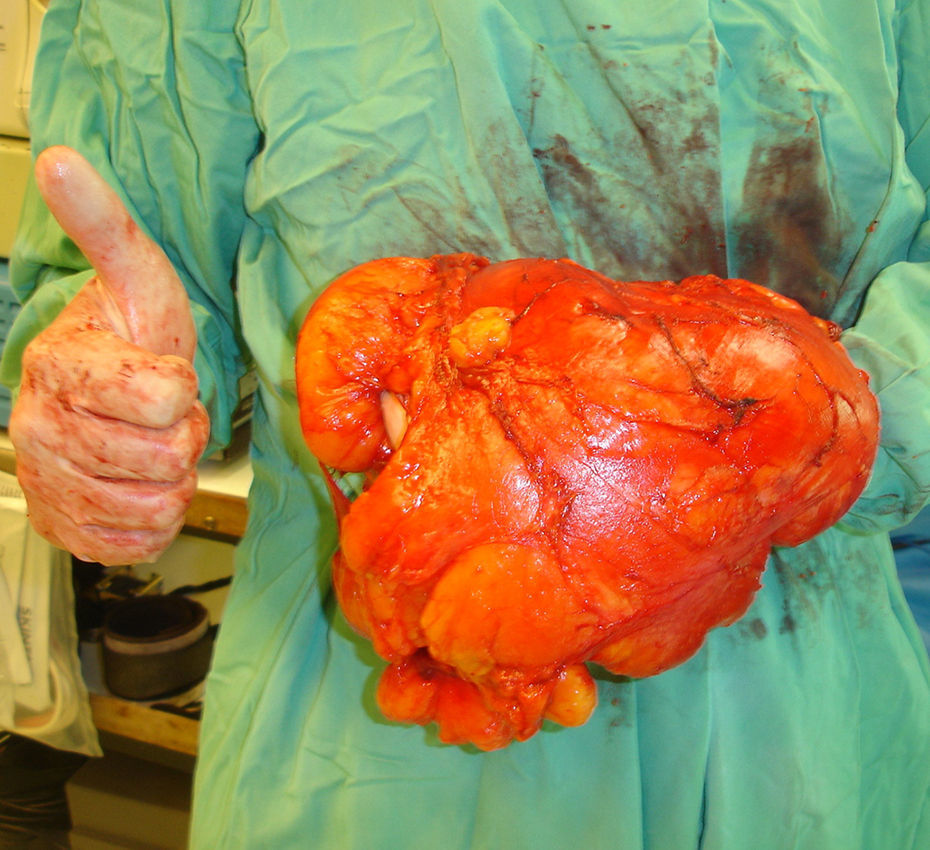
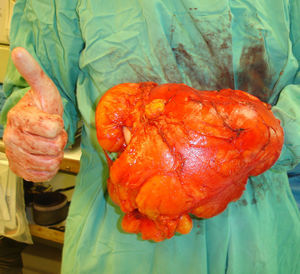
Pieza de resección del caso de la figura 2, extirpado con márgenes marginales. Se observa el gran tamaño de la tumoración comparada con la mano del cirujano. Excelente resultado clínico y ausencia de recidiva 6 años después de la intervención quirúrgica.
Los resultados del tratamiento quirúrgico incluyeron la descripción de las complicaciones generales, la recidiva o no de la tumoración y los resultados funcionales según la escala modificada de la Sociedad de Tumores Musculoesqueléticos (MSTS)13. El tiempo medio de seguimiento de los casos intervenidos fue de 34 meses (1-75 meses). El de los casos no operados o pendientes de la intervención quirúrgica desde la primera consulta en la Unidad fue de 26 meses (1 mes-70 meses).
El tamaño de los casos, determinado por el diámetro mayor en cualquier corte de RM, fue recodificado en variables categóricas dicotómicas con tamaños de corte en 5 y 8cm, que se relacionaron con las siguientes variables independientes: a) ligadas con las características de la persona (edad mayor o igual/menor de 60 años, sexo e índice de masa corporal (IMC) según la OMS –normal, con sobrepeso u obeso–14); b) y relacionadas con características del tumor (localización en miembros superiores o inferiores, presencia o no de dolor, crecimiento o no de la tumoración y presencia o no de septos en la RM).
La información se recogió en una base de datos creada con el programa Access® 2000 de Microsoft. Una vez revisada y depurada, se procedió a la exportación de todos los datos al programa estadístico SPSS® v.18, con el que se realizó el análisis estadístico. Este consistió en un análisis descriptivo de las variables, calculando la distribución de frecuencias para las cualitativas y la mediana y el rango intercuartil (RIC) para las cuantitativas. Para analizar la relación entre el tamaño recodificado a valores dicotómicos y las variables de estudio se ha utilizado el estadístico exacto de Fisher. En todos los casos se ha utilizado el nivel de significación α=0,05.
ResultadosResultados epidemiológicosDe los 50 pacientes de la serie, 31 (62%) fueron varones y 19 (38%) mujeres. La mediana de la edad fue 61 años y el RIC, de 54 a 69. Idénticos valores se obtuvieron al analizar solo los 49 casos nuevos. Entre los varones, los mismos estadísticos fueron de 59 años y el RIC, de 53 a 71; mientras que entre las mujeres fueron de 63 años y el RIC, de 55 a 67. La mediana del IMC (peso/estatura2) fue de 26,5 y el RIC, de 24,2 a 28,4; con 16 pacientes (31%) con peso normal, 28 con sobrepeso (55%), 5 con obesidad de tipo 1 y uno con obesidad de tipo 2 según la OMS.
La localización de los casos de la serie se representa en la figura 1. Veintiséis lipomas se diagnosticaron en el lado derecho, 23 en el izquierdo y uno fue bilateral (en ambas piernas). De los 51 lipomas, 40 (78%) fueron intramusculares (2 con extensión submuscular), 10 (20%) intermusculares (4 en la cintura escapular –2 de ellos con extensión subdeltoidea–, uno en el antebrazo, 2 en región medial del muslo y 2 en el compartimento posterior del muslo) y uno subfascial (superficial al bíceps braquial).
Resultados clínicos y de imagenEl primer síntoma fue una tumoración descubierta casualmente por el paciente en 48 casos (94%), en 4 con molestias asociadas. En el paciente con la lesión bilateral, el segundo lipoma se descubrió casualmente durante la realización de la RM para filiar el primer lipoma. En un paciente el diagnóstico de lipoma en los músculos peroneos fue casual al realizar una RM por una rotura fibrilar. En otro, el diagnóstico se hizo por la asociación de la tumoración en el antebrazo con un déficit para la extensión del primer dedo de la mano, que un electromiograma relacionó con la lesión del nervio interóseo posterior. Doce pacientes refirieron algún tipo de dolor en el momento de la consulta en nuestra Unidad y 14 refirieron la impresión de que la tumoración hubiera crecido en el último año.
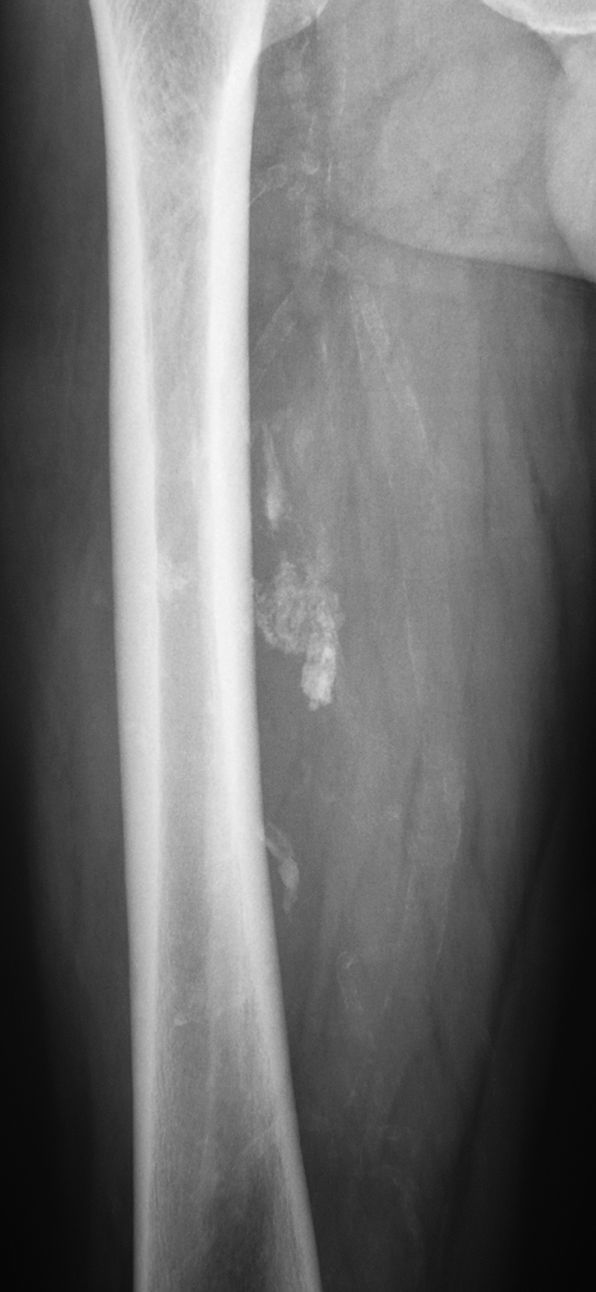
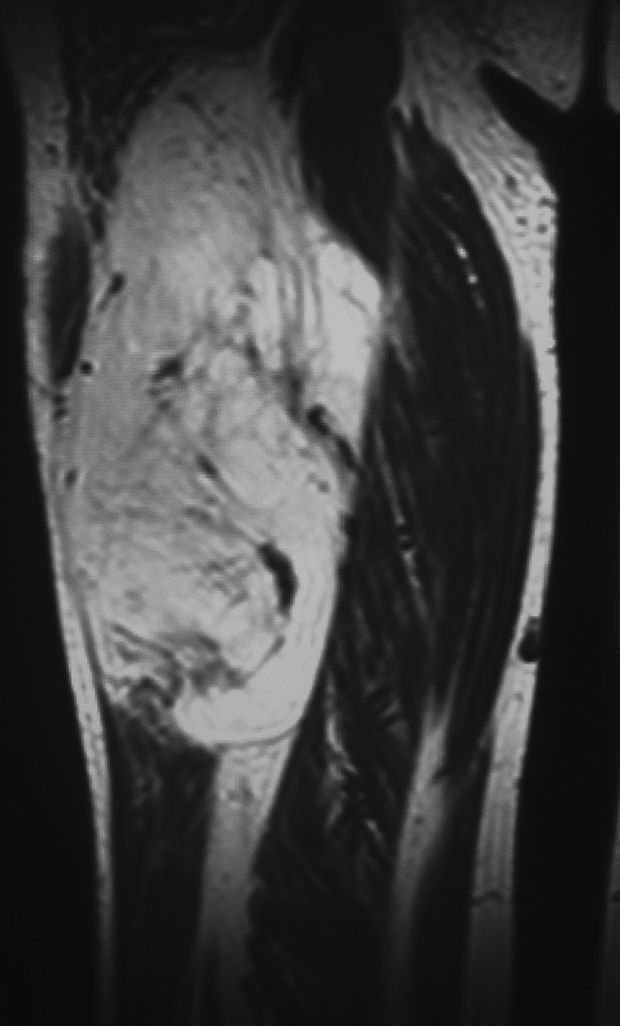
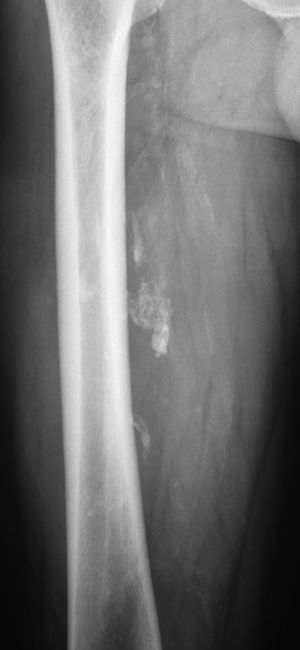
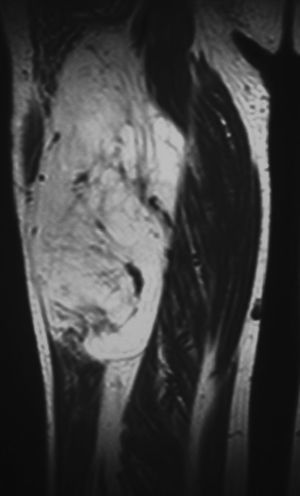
En todos los pacientes se realizaron radiografías simples de la región afectada. En 4 casos se descubrieron calcificaciones en el lugar de la lesión de partes blandas (fig. 4), que a veces se adivinaba. En 14 pacientes (27%) se realizaron ecografías, sugiriéndose como diagnóstico un lipoma (13 casos) y un hemangioma. En todos los casos se realizaron RM de la región de asiento del tumor en las secuencias habituales, con inyección de gadolinio en 16 pacientes. En 27 pacientes (53%) se observaron septos, que fueron delgados en 20 ocasiones (2 con captación de contraste) y gruesos en 7 (5 con captación de contraste y 2 con formaciones nodulares asociadas) (fig. 5). No se observaron quistes ni edema en ningún caso. El paquete neurovascular vecino estuvo comprimido y desplazado en 9 casos, contactado en 3 casos y envuelto por la tumoración en un caso de lipoma del muslo. La mediana y el RIC de los ejes anteroposterior, transversal y vertical fueron, respectivamente, de 42cm (RIC:25-91), 47cm (RIC:25-80) y 82cm (RIC:59-133). La mediana del diámetro mayor de los casos fue de 90, con un RIC de 60 a 137. El radiólogo emitió un informe de lipoma en 41 casos (80%); de lipoma o liposarcoma de bajo grado en 8 casos (16%) y de liposarcoma bien diferenciado en 2 casos.
Corte coronal de RM del caso de la figura 4 en el que se observan múltiples septos groseros e irregulares que hicieron sospechar de un liposarcoma de bajo grado. Excelente resultado clínico y ausencia de recidiva 5 años después de la intervención quirúrgica.
Ninguna de las variables estudiadas mostró relación estadísticamente significativa con el tamaño tumoral.
Resultados del tratamiento quirúrgicoLa estancia hospitalaria postoperatoria fue de 2 días, con un RIC de 1 a 3, y una estancia máxima de 11 días en un paciente que sufrió un sangrado intraoperatorio por lesión de la arteria circunfleja humeral anterior. Seis pacientes experimentaron complicaciones generales postoperatorias que se resolvieron pronto con los tratamientos correspondientes: un seroma, 2 hematomas, una dehiscencia de la herida quirúrgica y 2 infecciones superficiales.
Al final del seguimiento, uno de los pacientes de la serie había fallecido por un cáncer de pulmón 3 años después de la intervención por el lipoma. Ni en este hasta su fallecimiento ni en el resto de los pacientes al final del estudio se registró recidiva de la tumoración lipomatosa, aunque en el paciente con la lesión recidivada 2 veces en el muslo y región inguinal se observó un pequeño resto tumoral en la RM de control postoperatorio a los 6 meses. Los resultados funcionales de la serie en los 34 pacientes intervenidos según la escala de la MSTS fueron excelentes (30 puntos: 100%) en 30 pacientes (88%). En los cuatro restantes, con lipomas en el muslo, cintura escapular, muslo y antebrazo, la puntuación global fue de 28 puntos (93% de funcionalidad), 26 puntos (90%), 25 puntos (84%) y 17 puntos (60%), respectivamente. Ninguno de los pacientes en los que no se recomendó tratamiento quirúrgico tiene dolor ni limitación funcional y la tumoración no ha crecido de forma significativa desde el diagnóstico.
DiscusiónLos tumores lipomatosos benignos comprenden una gran y compleja variedad de lesiones: el lipoma clásico y sus variantes (angiolipoma, miolipoma, lipoma osificante, lipoma condroide, lipoma de células fusiformes y lipoma pleomórfico), los lipoblastomas, el hibernoma y los lipomas infiltrantes, entre los que están las lipomatosis15,16. Los lipomas clásicos, por su localización, habitualmente solitaria, se clasifican en superficiales y profundos17. Estos, menos comunes que las formas superficiales y más frecuentes en el retroperitoneo, la pared torácica y la parte proximal de los miembros, se suelen definir como intramusculares o intermusculares10,18, aunque los términos a menudo se agrupan e incluyen otras formas que no están exactamente dentro de los músculos o entre ellos.
Bajo el término de lipoma intramuscular19, que asumiremos a efectos académicos, se incluyen tumores benignos compuestos por células grasas maduras sin atipia ni lipoblastos de localización profunda a la fascia que asientan dentro de un músculo (los lipomas realmente intramusculares), a menudo con carácter infiltrante11, o entre grupos musculares (lipoma intermuscular), así como los de asiento subfascial y submuscular o parostal, que algunos han considerado como entidad independiente. En nuestra serie de 51 lipomas clásicos profundos, hemos considerado 40 formas intramusculares, 10 intermusculares y una subfascial, si bien el mismo caso podría haber presentado distintos asientos en diferentes cortes de RM. Cinco de los casos intra e intermusculares tuvieron extensión submuscular. Todos, en conjunto, habitualmente se han publicado como casos clínicos5–8, en series de relativamente pocos casos4,9–12 o sin detallar en una serie más amplia de tumores adiposos. La nuestra, que nosotros sepamos, es de las mayores descritas.
La epidemiología de los lipomas intramusculares, que reproduce de forma general nuestra serie, incluye que suponen algo menos del 2% de los tumores grasos6,20, presentándose en pacientes de todas las edades, más frecuentemente en los adultos, con un leve predominio en los varones17 y asiento indistinto en los miembros superiores y, más frecuentemente, inferiores, con el muslo como principal localización4,11,19. Sin ahondar en la etiopatogenia del tumor, que se desconoce, su relación con la obesidad, que algunos han sugerido21, también parece intuirse en nuestros casos, dos tercios de los cuales tenían sobrepeso u obesidad14.
Clínicamente los pacientes suelen referir tumoraciones indoloras o mínimamente molestas de tamaño variable y crecimiento nulo o lento, con otra semiología en casos puntuales6. Así fue también en nuestra serie, donde, por ejemplo, un paciente presentaba a la exploración incapacidad para la extensión del primer dedo por lesión del nervio interóseo posterior del antebrazo, similar al que había descrito Lewkonia et al.22.
Por cuanto respecta a las pruebas complementarias de imagen, entre las que la radiografía simple y la RM son obligadas, la mayor parte de los lipomas IM muestran los mismos hallazgos que los de los lipomas subcutáneos y son inequívocas en los casos típicos4,6,10,23. Radiográficamente puede identificarse, además del área grasa radiolucente, signos de osificación o calcificación, especialmente en los de mucho tiempo de evolución. En nuestra serie ocurrió en 4 casos. En la TC y en la RM siempre se observa un tejido idéntico al de la grasa subcutánea que no capta contraste, aunque esto ha sido observado de forma leve o moderada en algún septo o la cápsula en algún paciente24. Así fue, de la misma manera, en 7 de los nuestros. Como pueden contener otros elementos mesenquimales, especialmente tejido conjuntivo fibroso, en el 46% de los casos pueden observarse septos como áreas lineales de atenuación aumentada en TC o lineales de menor intensidad en RM, dependiendo de la secuencia17,18. En nuestra serie se identificaron septos en la mitad de los pacientes. En la misma línea, un porcentaje sustancial de lipomas tienen hallazgos no adiposos25.
Con todo, el diagnóstico diferencial de los lipomas intramusculares incluye otros tumores adipocíticos benignos, a los que ya nos hemos referido al comienzo de esta discusión; y lesiones que pueden contener grasa (hemangiomas, elastofibroma dorsi, hernias que contienen grasa y atrofias musculares con reemplazo graso)17. De forma más trascendente hay que distinguirlos de los sarcomas de partes blandas2,16 y, particularmente, del subtipo liposarcoma bien diferenciado, con el que puede confundirse, además de clínicamente, por los hallazgos de imagen10,17,25,26. En 8 de nuestros casos, de hecho, el radiólogo no fue capaz de distinguir entre lipoma o liposarcoma de bajo grado y en 2 emitió un diagnóstico de liposarcoma bien diferenciado, que la biopsia no confirmaría. Finalmente, cuando se trata de lipomas osificantes o condroides5, hay que incluir en el diagnóstico diferencial la miositis osificante, tumores calcificados u osificados (liposarcoma, sarcoma sinovial, osteosarcoma extraesquelético y condrosarcoma extraesquelético, condromas de partes blandas), hemangiomas y bursas calcificadas.
Insistiendo en el tamaño tumoral, una tumoración profunda a la fascia y grande es un sarcoma mientras no se demuestre lo contrario. El tamaño a partir del cual sospecharlo es de 5cm, con medidas medias al diagnóstico en los sarcomas de partes blandas de los miembros que oscilan entre 8 y 10cm27. Sin embargo, el tamaño como criterio único de derivación de un paciente con una lesión de partes blandas a un centro de referencia es discutible, pues se ha observado que un 10% de las lesiones malignas pueden medir menos de 5cm y más de la mitad de las benignas pueden tener más de 5 cm28. En nuestra serie, 46 (90%) de los casos medían 5 o más centímetros y 33 (65%), 8 o más, sin que identificáramos ningún factor relacionado con el tamaño.
El tratamiento de los lipomas intramusculares sintomáticos, en los que no sería necesaria una biopsia previa en los casos típicos18,23,24, consiste en la resección completa del tumor con márgenes marginales o, cuando el tumor fuera infiltrante y la morbilidad de la cirugía asumible, amplios12,18,19. En los pacientes asintomáticos y sin ninguna duda diagnóstica podría contemplarse la observación, teniendo en cuenta que la posibilidad de una transformación maligna es excepcional, habiéndose apuntado que los pocos casos reportados probablemente tuvieran un bajo grado de malignidad desde el principio17. Por otra parte, la variante de liposarcoma bien diferenciado, que actualmente engloba a los antes denominados lipomas atípicos, tiene tendencia a recidivar localmente19,29, pero no a metastatizar, con una pequeña probabilidad de desdiferenciación y del consiguiente empeoramiento pronóstico17. En nuestra serie realizamos biopsias cerradas con tru-cut en 14 casos, habitualmente cuando dudábamos de la posibilidad de un liposarcoma de bajo grado, si bien también la obviamos cuando los márgenes de la resección quirúrgica no cambiarían independientemente de que se tratara de un lipoma o de un liposarcoma, como fue en los casos en los que el tumor contactaba con un paquete neurovascular mayor que no íbamos a sacrificar. En estos pacientes, nuestro planteamiento es informarle de la duda diagnóstica y de la necesidad de radioterapia complementaria posteriormente a la cirugía si se demostrara malignidad.
Los resultados que pueden esperarse del tratamiento quirúrgico, por otra parte, suelen ser satisfactorios desde el punto de vista oncológico, si bien se han publicado recidivas locales hasta en el 80% de los casos4, generalmente en relación con resecciones quirúrgicas incompletas6 o con diagnósticos originalmente equivocados19. Descartando estos factores, la incidencia real de recidivas rondaría el 4% de los casos y sería independiente de la edad del paciente, de su género, del tamaño y de la localización tumoral19. El resultado funcional dependería de los músculos sacrificados, si llegara a ser el caso. Cuando ninguno lo fuera, la recuperación sería la norma en ausencia de complicaciones. Todos los resultados de nuestros casos fueron satisfactorios o muy satisfactorios y no registramos, hasta la fecha, ninguna recidiva local, sin considerar el resto tumoral que quedó en un paciente y aceptando los sesgos del trabajo que se referirán a continuación.
Las limitaciones de nuestra serie son varias. La primera se refiere al carácter retrospectivo del estudio. La segunda, al sesgo de selección que sería haber agrupado a todos nuestros casos como lipomas intramusculares, sin la confirmación citogenética que algunos actualmente recomiendan y que podría haber convertido alguno de nuestros casos en verdaderos liposarcomas desdiferenciados19. Del mismo modo, en otro caso de asiento peroneal se informó, entre algunas fibras musculares, de infiltración grasa que podría haber correspondido a una degeneración muscular lipomatosa y no a un lipoma intramuscular, como el patólogo concluyó y cuyo diagnóstico asumimos. La tercera, al relativamente corto seguimiento de algunos de los casos intervenidos, con un tiempo medio de seguimiento global de 33 meses, habiéndose sugerido un periodo de 48 meses como tiempo medio habitual de aparición de recidivas en lipomas IM y atípicos19. En la serie de Su et al.12, el seguimiento de los casos fue de 40 meses. La cuarta limitación de nuestro estudio, también en relación con la posibilidad de recidivas no diagnosticadas, fue que la prueba en la que nos basamos para descartar una recidiva durante el seguimiento fue habitualmente la exploración física, que tiene menos sensibilidad que la RM, que solo realizamos en un paciente de los intervenidos. A pesar de todo, pensamos que el trabajo cumple con el objetivo del recuerdo de la enfermedad y da orientaciones prácticas sobre su manejo, lo que podría ser motivo de dudas en algún caso.
En conclusión, los lipomas intramusculares, aunque puedan ser típicos en su presentación, sobre todo cuando sean grandes y muestren signos que los puedan confundir con liposarcomas bien diferenciados de bajo grado, se deberían tratar en centros con experiencia.
Nivel de evidenciaNivel de evidencia IV.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.