Establecer un modelo experimental sencillo, reproducible y seguro para conocer el desarrollo de la necrosis vascular isquémica de la cadera en el cordero.
Material y metodologíaUtilizamos 15corderos (10machos y 5hembras) de 4semanas de edad, divididos en un grupo control (7animales) y otro grupo experimental (8animales), a los que se provocó la isquemia de la extremidad proximal del fémur. Se efectuaron radiografía convencional y resonancia nuclear magnética. Tras el sacrificio de los animales, a la 4.a, 8.a y 12.a semanas poscirugía, extrajimos y medimos la cabeza femoral. Una vez fijada la pieza obtuvimos cortes histológicos de diferentes zonas que se tiñeron con hematoxilina-eosina.
ResultadosRadiográficamente disminuyó la altura y aumentó la anchura de la cabeza femoral, más evidente a partir de la 4.a semana. No objetivamos cambios en la altura del pilar lateral ni en la distancia artículo-trocantérea. El grupo experimental macroscópicamente demostró hipertrofia y aplanamiento progresivo de la cabeza. A las 4semanas de la cirugía aparecieron zonas de necrosis en el cartílago articular, una médula ósea más densa y menor altura de la fisis. Los vasos estaban engrosados por proliferación de la capa media y de la adventicia. A las 8semanas encontramos una fibrosis subcondral, con un cartílago articular irregular, adelgazado y desvitalizado, y áreas de angiogénesis con grasa en el hueso subcondral. A las 12semanas apreciamos el cierre de la fisis, áreas condrales en las trabéculas óseas y células adiposas en la médula diafisaria.
ConclusiónAunque los cambios histológicos son compatibles con necrosis de la cabeza femoral, las pruebas de imagen obtenidas no se asemejan a la enfermedad de Perthes, por lo que desaconsejamos este modelo experimental para el estudio de esta entidad.
To establish a simple, reproducible and safe experimental model, for the development of ischemic vascular necrosis of the hip in the lamb.
Material and methodsWe used 15lambs (10males and 5females) aged four weeks, divided into a control group (7animals) and an experimental group (8animals) producing ischemia in the proximal femur. Standard radiography and MRI were performed. The animals were euthanised at the 4th, 8th and 12th weeks after surgery. The femoral heads were extracted and measured and a histological analysis was performed with hematoxylin-eosin staining.
ResultsDecreased height and increased width of the femoral head was observed in the X-Rays, particularly after the 4th week. We did not observe any changes in the height of the lateral pillar or trochanteric distance. The experimental group showed macroscopical hypertrophy and progressive flattening of the head. At 4weeks necrotic areas in articular cartilage were observed, bone marrow was dense and the growth cartilage height was lower. The vessels were thickened by proliferation of the medial and adventitia layers. At 8weeks, we found fibrosis in the subchondral bone with thinned and devitalized angiogenesis fat areas. The articular cartilage showed irregularities. At 12weeks the closure of the physis was noted, as well as chondral areas in the trabecular bone and fat cells in the methaphysis.
ConclusionAlthough the histological changes are consistent with necrosis of the femoral head, the images obtained did not resemble Perthes disease, so we do not advise this experimental model for the study of this disease.
La importancia clínica de la enfermedad de Leg-Calvé-Perthes (ELCP) se basa en la deformidad progresiva de la cabeza femoral inmadura, que provoca la degeneración precoz de la articulación1. Diferentes trabajos han discutido sobre la etiopatogenia de la necrosis avascular idiopática en humanos y los diferentes mecanismos etiopatológicos implicados, como la isquemia secundaria a microémbolos grasos procedentes de la médula ósea2, la coagulación intravascular3 o la embolización retrógrada de la grasa de la médula ósea4. También se ha descrito la teoría de la presión celular acumulada como causa del fenómeno isquémico5 que postula que las células estarían expuestas a presiones o agresiones múltiples cuyos efectos producen la muerte celular. De esta forma, la osteonecrosis estaría causada por una enfermedad de las células óseas o de las células madre mesenquimales (CMM), sugiriendo que la causa no es únicamente vascular. Apoyando esta teoría, se ha observado que el grado de actividad y el número de CMM en pacientes con osteonecrosis de la cabeza femoral es inferior al normal6, así como también la capacidad de proliferación de las células osteoblásticas7.
La lesión necrótica se caracteriza por la apoptosis de los osteocitos y de las células de revestimiento del hueso trabecular en la cabeza femoral, pudiendo afectar a distancia al hueso del fémur proximal5. Kim8 demostró el mecanismo de muerte celular secundario al proceso de lesión isquémica en cabezas femorales de cerdos.
El proceso regenerativo que sigue a la necrosis isquémica se realiza por aposición de nuevas capas de hueso desde el propio hueso necrótico. Estudios realizados con cabezas femorales humanas6,9,10 y un estudio experimental realizado en conejos11 han demostrado que existe una regeneración tisular gracias a la penetración de CMM y de los capilares en el hueso necrótico desde zonas no afectadas por la isquemia. Además observaron que las CMM próximas a la superficie del hueso necrótico se diferencian en osteoblastos que, a su vez, forman hueso por aposición sobre la superficie del hueso necrótico trabecular recubriendo, eventualmente, la superficie de la cabeza femoral. Posteriormente, la zona necrótica central es reabsorbida por los osteoclastos y reemplazada por un neoformado óseo. Esto explica los cambios hallados en la necrosis de la cabeza femoral, como son el ensanchamiento de las trabéculas, el incremento de masa ósea por volumen y el aumento de la densidad en las zonas de reparación. El hueso neoformado presenta menor plasticidad y rigidez mecánicas, por lo que la carga axial y los traumatismos de repetición provocan un aplanamiento y deformidad progresiva de la cabeza femoral. Koob et al.12 observaron que la alteración de las propiedades mecánicas del hueso epifisario y el cartílago se relaciona con la patogénesis de la deformidad de la cabeza femoral.
El mecanismo etiopatogénico de la ELCP es desconocido, y su evolución anatomopatológica es difícil de evaluar en clínica. Los modelos experimentales resultan de mucha utilidad aun a sabiendas de que son animales cuadrúpedos que no se parecen al humano. Para el estudio experimental de la ELCP se han utilizado como modelo animal el conejo11, el perro13,14, la cabra15,16 y, sobre todo, el cerdo14,17–22, pero los resultados macroscópicos y radiológicos obtenidos en ellos no han sido capaces de explicar la patogénesis de la deformidad de la cabeza femoral. Menos se ha trabajado con el cordero como modelo experimental, pero nos parece un animal fácil de conseguir, trabajar y manejar que, aunque se ha utilizado en estudios sobre la patología del desarrollo de la cabeza femoral, nunca se ha realizado mediante alteración aislada de la vascularización23–25. Nuestra hipótesis es que la alteración de la vascularización aislada produce una alteración en la extremidad proximal del fémur semejante a la ELCP. Nos hemos planteado como objetivo establecer un modelo experimental sencillo, reproducible y seguro en el cordero que permita conocer el desarrollo de la necrosis vascular isquémica de la cadera en el cordero. Es la primera vez que se utiliza el cordero como modelo experimental para estudio de la osteonecrosis de la cabeza femoral en esqueleto inmaduro mediante devascularización, en un intento de reproducir las condiciones que se asocian a la enfermedad de Perthes.
Material y metodologíaRealizamos un estudio experimental comparativo con valoración de pruebas de imagen y morfológica en corderos. El estudio fue aprobado por el Comité de Ética de la Fundación de Investigación Biomédica de nuestro hospital. Utilizamos 15corderos (10machos y 5hembras) de raza manchega. Se establecieron 2grupos: un grupo control, con 7animales de 4semanas de edad en los que no se realizó ningún gesto experimental, y otro grupo experimental, con 8animales de 4semanas de edad en los que se provocó la isquemia de la extremidad proximal del fémur mediante intervención quirúrgica. Los animales fueron sacrificados de 2 en 2 de manera secuencial (4, 8 y 12 semanas).
Técnica quirúrgicaLa cirugía se efectuó bajo anestesia general y profilaxis antibiótica. Para ello se premedicaron con diacepam (0,5mg/kg), y para realizar la inducción se utilizó ketamina (2mg/kg) y propofol (0,5mg/kg). El mantenimiento de la anestesia se realizó mediante isofluorano en oxígeno al 100%. Se colocó el animal en decúbito lateral izquierdo para efectuar un abordaje posterolateral de la cadera derecha mediante incisión longitudinal de 10cm. Se localizó el trocánter mayor y se desinsertó la musculatura rotadora y glútea para acceder a la cápsula articular de la cadera. Se realizó una capsulotomía parcial procediendo al cerclaje del cuello femoral mediante doble ligadura (PremiCron n.° 2, Aesculap, Tuttlingen, Alemania). A continuación se seccionó el ligamento redondo subluxando la cabeza femoral. Por último, se cerró la cápsula y se reinsertó la musculatura con puntos transóseos, suturando por planos. La duración media de la cirugía fue de 22min (rango: 15-30min).
PostoperatorioNo se realizó ninguna inmovilización, y tras la cirugía se dejó caminar libremente a los animales por sus boxes con alimentación ad líbitum. Algunos animales presentaron complicaciones: áreas de necrosis isquémica en la musculatura periarticular, un absceso superficial en la herida que se extendió hasta la cápsula articular y, debido a la sección del ligamento redondo, la luxación de la cadera en el 60% de los animales.
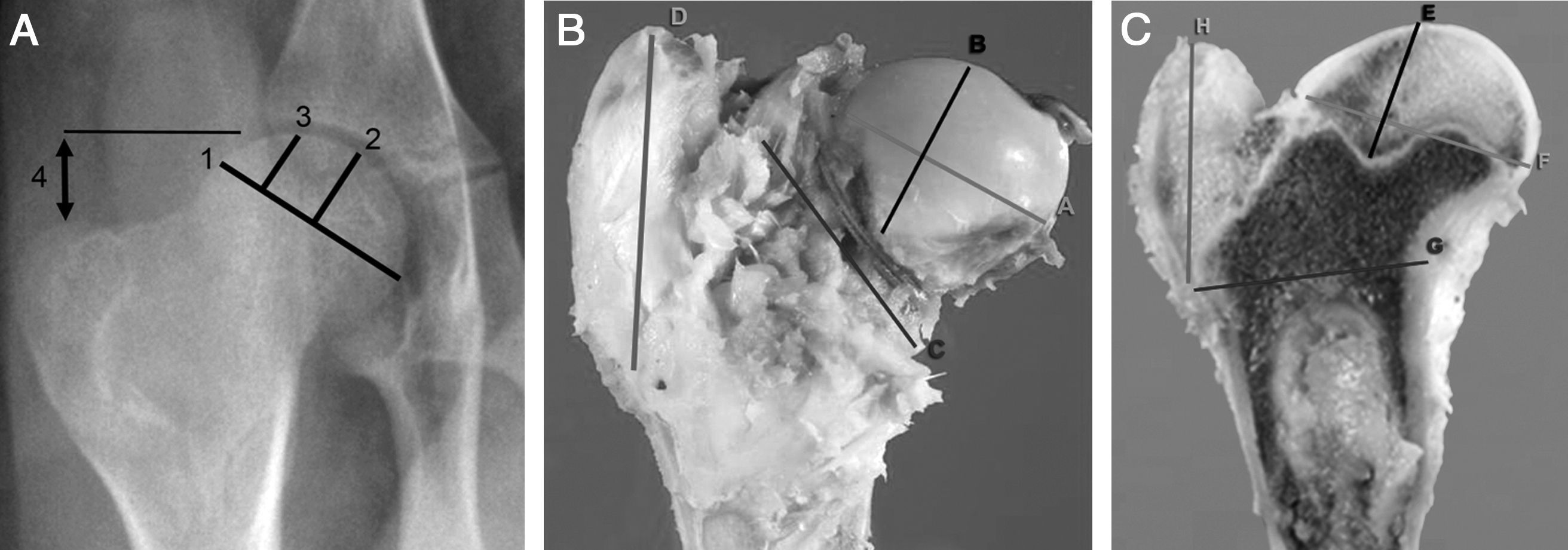
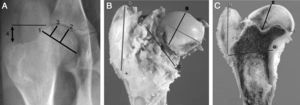
Pruebas de imagenSe efectuaron pruebas de imagen a todos los animales de forma seriada cada semana. Se utilizó radiología computarizada convencional (35×45cm Agfa CR 30-X, AGFA Healthcare, Barcelona), realizando 2 proyecciones radiográficas (anteroposterior y axial de ambas caderas), y se evaluaron las siguientes mediciones radiográficas comparándolas con la cadera contralateral (fig. 1a):
1. Anchura de la cabeza femoral: se realiza medición de la longitud de la zona de mayor diámetro de la cabeza femoral uniendo los extremos delimitados por la fisis de crecimiento.
2. Altura del pilar central: medición de la línea perpendicular a la fisis de crecimiento en su zona media hasta el borde superior de la cabeza.
3. Altura del pilar lateral: medición de la línea perpendicular a la fisis de crecimiento en la unión del tercio medio con el tercio lateral hasta el borde superior de la cabeza.
4. Distancia artículo-trocantérea: medición de la línea vertical que une la zona más proximal de la epífisis y la punta del trocánter mayor26. Se considera un crecimiento mayor del trocánter mayor si la distancia se reduce un 20% o más respecto al lado contralateral.
5. Subluxación de la cabeza femoral: se valora mediante el índice acetábulo-cabeza27.
También se efectuó un estudio mediante resonancia nuclear magnética (Panorama 0.23 T, Philips Medical Systems, Eindhoven, Países Bajos) para valoración precisa de los fenómenos de necrosis y edema óseo. En este estudio no se realizaron mediciones y se utilizó solamente para valoración morfológica.
SacrificioEl sacrificio se efectuó de forma secuencial a las 4, a las 8 y a las 12 semanas de la cirugía, tras la inducción con pentobarbital sódico y posterior inyección intracardiaca de 10cc de T61 (Intervet, Schering-Plough Animal Health, Kenilworth, New Jersey). A los animales se les practicó una necropsia completa y ordenada para poder determinar las posibles complicaciones, extrayendo de forma precisa la porción proximal del fémur intervenido, que fue analizada macroscópicamente, procediendo a su medida y al corte sagital. Con el fin de estandarizar el estudio, realizamos 4medidas de la cabeza y el trocánter mayor con un pie de rey, obteniendo: A)la anchura de la cabeza femoral, midiendo el mayor diámetro, uniendo los extremos de la fisis; B)la altura de la cabeza femoral, midiendo la línea perpendicular a la fisis en su zona media; C)el diámetro del cuello femoral, obteniendo el diámetro del cuello femoral en su parte más ancha, y D)la altura del trocánter, midiendo la distancia desde la fisis proximal de la metáfisis a la punta del trocánter (fig. 1b).
Una vez fijada la pieza seccionamos la cabeza del fémur sagitalmente para realizar 4mediciones con el pie de rey, midiendo: E)la distancia entre la parte más proximal de la cabeza y la zona más profunda del cartílago de crecimiento; F)la distancia entre el punto más craneal y más caudal de la fisis; G)la distancia desde el punto más caudal de la fisis y la cortical interna por encima del trocánter menor, y H)la distancia perpendicular entre el punto más caudal de la fisis y el punto más craneal del trocánter mayor (fig. 1c). Para realizar el estudio histopatológico de las muestras, la sección medial de la cabeza del fémur se fijó en formol tamponado comercial al 10% (Panreac©, Barcelona), estabilizado con metanol a pH=7, durante 12-24h, a temperatura ambiente.
Posteriormente la cabeza femoral se divide por la mitad, procediendo a decalcificar una parte durante 5-7días con Osteodec (Bioptica Milano Spa. 05-M03005); la otra parte se conserva en formol al 10%.
Se obtuvo una sección de la cabeza y del trocánter del fémur que fueron incluidas en parafina sintética (Casa Álvarez Histo-comp, ref. CA-09-5658), con un punto de fusión de 56°C, utilizándose un procesador automático de tejidos Leica© ASP 300, con un programa de cambios automáticos de alcoholes de creciente graduación e histo-clear. Los bloques fueron realizados en una unidad formadora de bloques, consola Leica© EG1140H y placa de frío Leica© EG1130. Se obtuvieron secciones de 3-4μm de grosor con un microtomo de rotación (modelo Leica® RM2155). Las secciones fueron teñidas con hematoxilina-eosina en el teñidor automático Leica© SP4040.
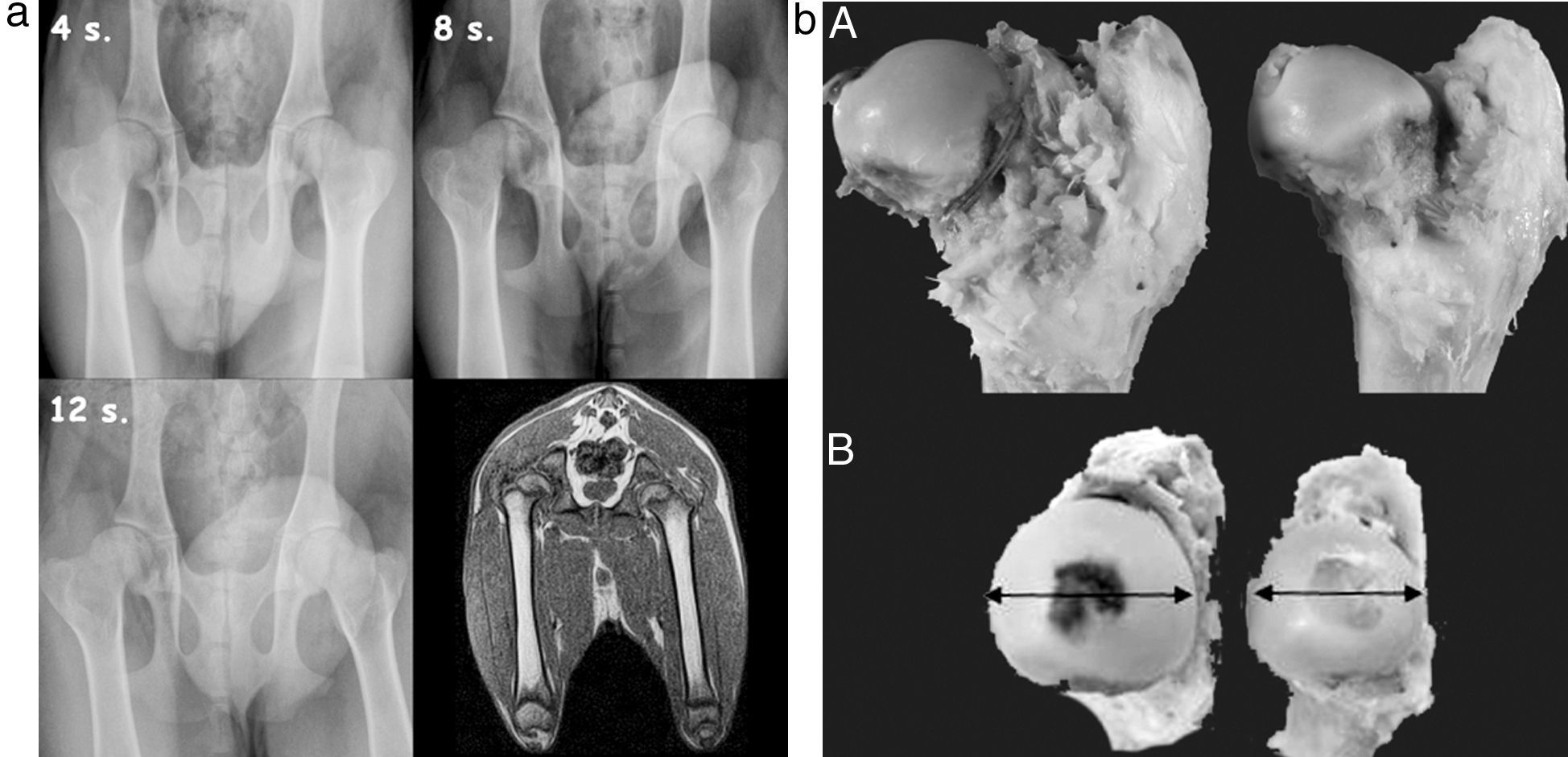
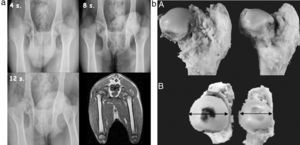
ResultadosPruebas de imagenEvidenciamos en las radiografías convencionales un aumento de la densidad de la cabeza femoral a partir de la segunda semana posquirúrgica, compatible con un fenómeno de necrosis (fig. 2a). También observamos una disminución de la altura del pilar central y un aumento de la anchura de la cabeza femoral, que es más evidente a partir de la 4.a semana. No observamos cambios en la altura del pilar lateral ni en la distancia artículo-trocantérea (fig. 2b).
A)Estudio radiográfico secuencial a las 4, 8 y 12semanas poscirugía. Se observa un ensanchamiento y aplanamiento de la cabeza femoral que es más evidente a las 12semanas. La RM muestra un aplanamiento cefálico y una subluxación lateral de la cabeza femoral. B)Macroscópicamente observamos en el grupo experimental una hipertrofia y un aplanamiento progresivo de la cabeza femoral respecto al grupo control desde la semana 4.a a la semana 12.a poscirugía.
En los estudios de resonancia nuclear magnética se evidencia un aplanamiento de la cabeza y un ensanchamiento del cuello. Asimismo se aprecia una subluxación lateral de la cabeza femoral.
Anatomía patológicaMacroscópicamente observamos en el grupo experimental una hipertrofia (medidaB) y un aplanamiento progresivo (medidaA) de la cabeza femoral respecto al grupo control desde la semana 4.a a la semana 12.a poscirugía (fig. 2b). En la sección sagital apreciamos una pérdida del grosor del cartílago articular, una línea de crecimiento fisario irregular y un cambio del color rojizo del hueso trabecular por un tejido fibroso de aspecto blanquecino con núcleos de osificación en su interior.
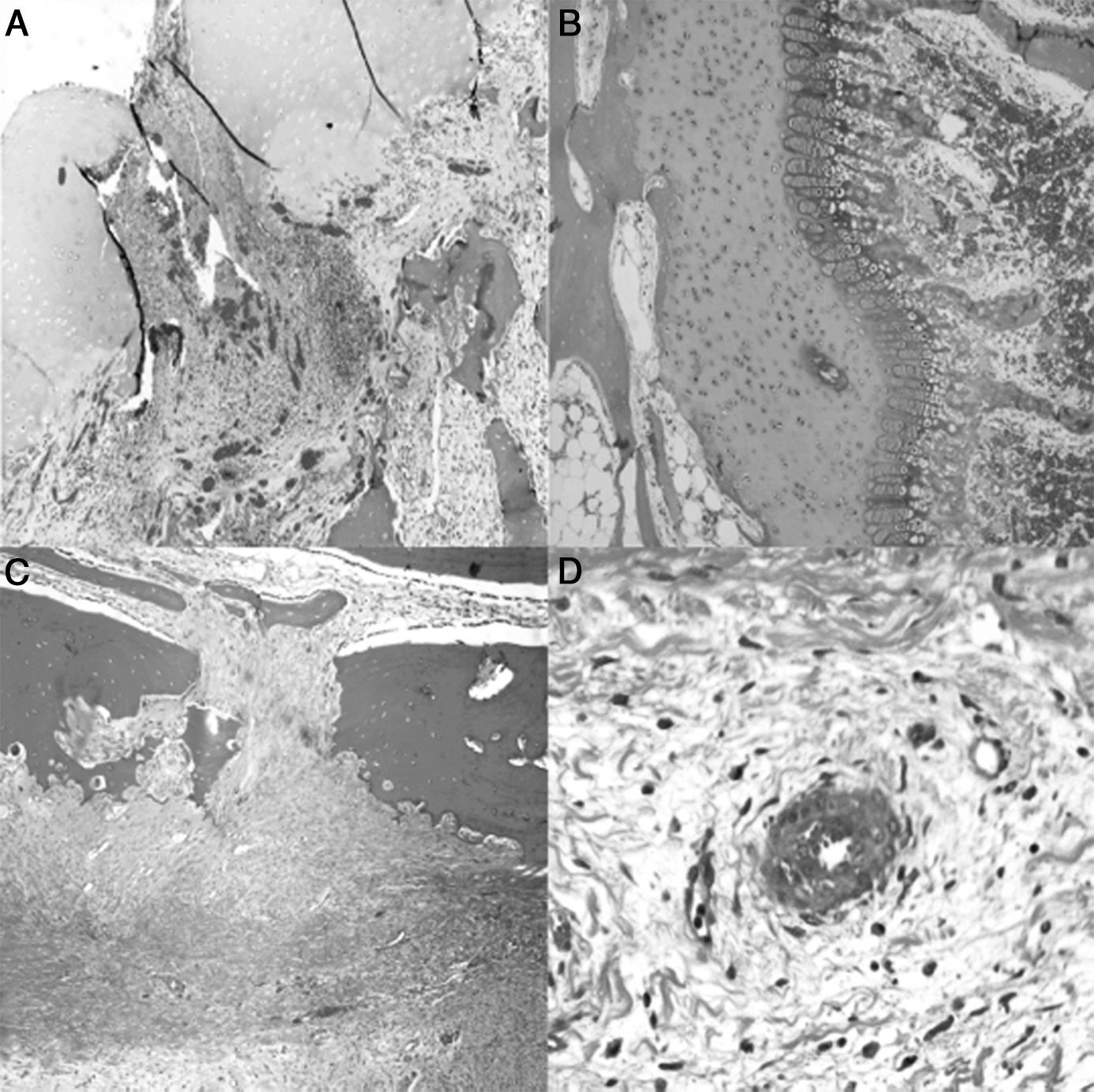
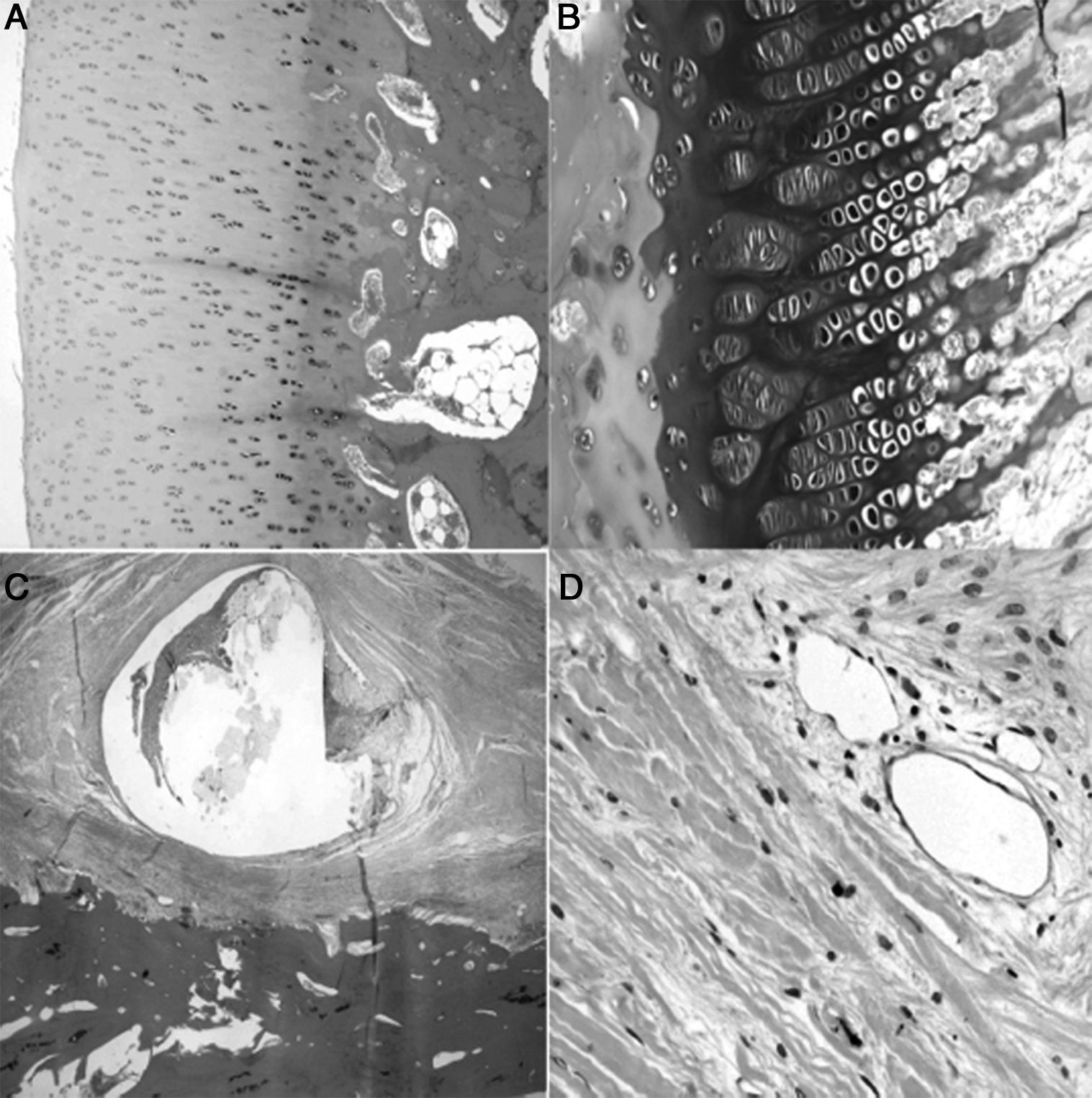
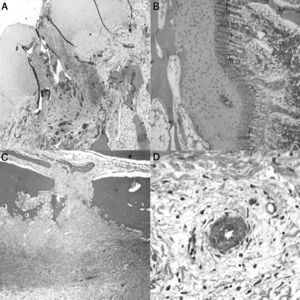
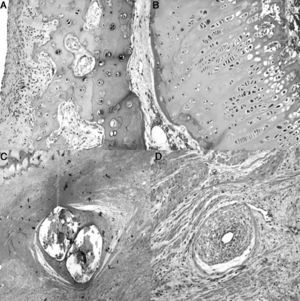
El estudio histológico de las piezas obtenidas a las 4semanas de la cirugía reveló pequeñas zonas de necrosis en el cartílago articular, además de una médula ósea más densa y un cartílago fisario de menor altura. Se apreció una reacción perióstica con mayor actividad osteoclástica en la cortical y presencia de puentes entre el periostio y la diáfisis que atraviesan la cortical. En la zona de la ligadura observamos un proceso de neovascularización. Los vasos presentaban un marcado engrosamiento caracterizado por una proliferación de la capa media y de la adventicia compatible con una hiperplasia plexiforme externa. En el trocánter el cartílago fisario presentó áreas de osificación prematura (fig. 3).
Histología a las 4semanas poscirugía. A)En el cartílago articular superficial aparecen pequeños focos de necrosis con reacción inflamatoria asociada (H&E, ×2). B)La fisis aparece ligeramente aumentada en relación con el animal control y con una zona más reducida de cartílago seriado (H&E, ×4). C)Marcada reacción perióstica con mayor actividad osteoclástica en el límite cortical con remodelación ósea. Puentes óseos entre la zona perióstica y endóstica que atraviesan la cortical del hueso (H&E, ×4). D)Asociada a la ligadura, se observa neovascularización; los vasos muestran engrosamiento de la pared por hiperplasia plexiforme externa (H&E, ×10).
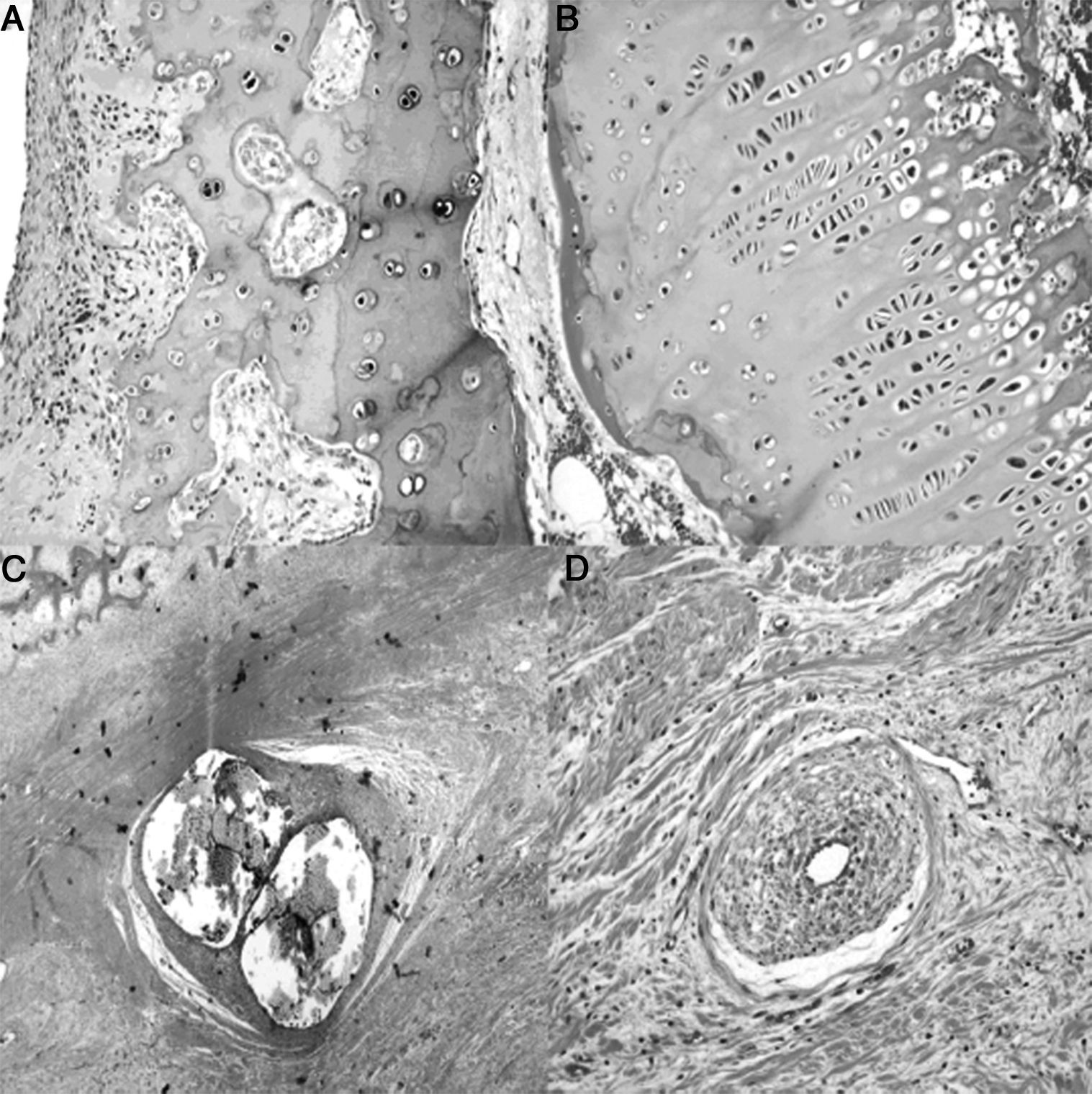
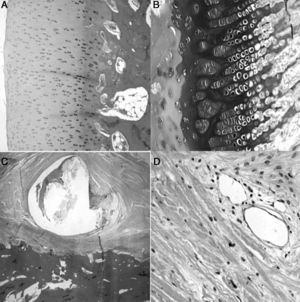
A las 8semanas de evolución los animales presentaron una fibrosis subcondral, con un cartílago articular irregular y adelgazado, desvitalizado, sin observar actividad condroblástica. Además, próximo al hueso subcondral aparecieron áreas de angiogénesis con mayor cantidad de tejido adiposo. La fisis siguió mostrando pérdida de tinción y un aspecto irregular. Más próximo a la diáfisis la médula presentaba un aumento de la actividad y de la celularidad, mientras que el trocánter tenía un desarrollo menor que el del lado control con cierre del cartílago de crecimiento. La zona en contacto con la ligadura ofreció un área de fibrosis con remodelación ósea y áreas de neovascularización (fig. 4).
Histología a las 8semanas poscirugia: A)En el cartílago articular superficial existe una marcada fibrosis subcondral que produce un cartílago articular irregular con pérdida de grosor y sin actividad condroblástica (H&E, ×10). B)La físis muestra un cierre prematuro, es irregular, sin actividad condroblástica (H&E, ×10). C)Marcada reacción perióstica en la zona correspondiente a la doble ligadura, con fibrosis, remodelación ósea y amplias zonas de angiogénesis (H&E, ×2). D)Zonas de neovascularización asociada a la fibrosis; los vasos de mediano calibre con marcada hiperplasia plexiforme de la pared y recanalización de los mismos (H&E, ×10).
En las muestras con 12semanas de evolución apreciamos un cartílago articular semejante al grupo de evolución anterior, un cierre del cartílago de crecimiento, un aumento de las áreas de cartílago en las trabéculas óseas y un mayor número de células adiposas en la médula diafisaria. El cartílago fisario del trocánter estaba completamente cerrado. Por su parte, en el periostio en contacto con la ligadura observamos un aumento de tejido fibroso con vasos sanguíneos en su capa profunda (fig. 5).
Histología a las 12semanas poscirugia: A)No se aprecian diferencias significativas en la estructura histológica del cartílago articular del animal operado y control (H&E, ×4). B)El área de proliferación y diferenciación de la fisis es menor que en el animal control, al producirse una osificación prematura de la misma (H&E, ×10). C)En el periostio se aprecia una reacción fibrótica alrededor de la sutura que no colapsa los vasos sanguíneos de la capa profunda (H&E, ×2). D)Sin alteraciones vasculares en las zonas de reacción perióstica (H&E, ×10).
Los ovinos son animales de utilidad para trabajos experimentales relacionados con la fisiopatología del sistema musculoesquelético, por el tamaño y las características mecánicas de su esqueleto comparable al humano. Las ovejas presentan el proceso de remodelación de hueso haversiano, están más próximas genéticamente al hombre, son dóciles, baratas de mantener, disponibles en buen número en todas las áreas del mundo y, por último, presentan menos condicionantes éticos que la mayoría de las mascotas domésticas12,28,29. Mazoochian et al.30 compararon, mediante el método de elementos finitos, la cadera humana y la de los ovinos, concluyendo que la oveja es un modelo adecuado para efectuar estudios preclínicos de la cadera.
Uno de los mayores problemas en los estudios experimentales de la ELCP es adecuar la edad de los animales con el hombre en desarrollo y, evidentemente, la carga cuadrúpeda. Los trabajos experimentales de ELCP en los últimos años no son muy frecuentes y se diferencian según el animal escogido y la técnica de provocación de la necrosis. La necrosis ósea de la cabeza femoral en modelos animales no guarda relación con la humana; en el cerdo la evolución es diferente al humano en desarrollo11. En modelos de conejos adultos con necrosis isquémica femoral, la invasión de los espacios vasculares medulares de la porción «muerta» de la cabeza femoral se realiza por células mesenquimales proliferativas y por los capilares de la metáfisis adyacente viva; estas CMM se pueden diferenciar hacia la línea osteoblástica y formar hueso nuevo por aposición que sustituye al hueso necrótico31.
Numerosos autores han empleado métodos agresivos para conseguir la necrosis ósea. Crawford et al.16 provocaron necrosis en cabras mediante la ablación de la fisis con un electrocauterio. Jin et al.32, luxando la cabeza femoral y aplicando nitrógeno líquido; también Velez et al.24,25, en ovejas maduras, mediante nitrógeno líquido y ligando, posteriormente, los vasos cefálicos. Aimaiti et al.33 inyectaron, en conejos, metilprednisolona intramuscular y efectuaron la electrocoagulación de los vasos de la cabeza femoral, obteniendo necrosis a las 8semanas.
Simank et al.34 y Manggold et al.35, inyectando etanol en un modelo ovino de necrosis ósea de la extremidad proximal del fémur, encontraron las mismas alteraciones óseas que las observadas en clínica, viendo un cartílago articular intacto, la estructura trabecular proximal del fémur preservada y mantenida la microcirculación; observaron mayores daños en la cabeza femoral y vieron que la inducción ósea comienza hacia las 12semanas después de la inyección. Además, compararon el tamaño del hueso y demostraron que era similar al fémur humano en desarrollo. TajraFeitosa et al.23 utilizaron la misma metodología mediante la infiltración de etanol puro en la cabeza femoral. Seis semanas después de la provocación de la necrosis se procedió a las perforaciones en el grupo control y la infiltración de médula ósea en el grupo experimental, y vieron que la regeneración ósea era más rápida que en los humanos, y que esta era mejor que en el grupo experimental tras la infiltración de células mesenquimales.
Nosotros hemos seguido un modelo experimental avascular provocando una isquemia progresiva sin dañar directamente ni al hueso ni al cartílago con el objetivo de crear una necrosis similar a la observada en pacientes con ELCP. Los trabajos más citados en la literatura con este método lo realizan con cerdos esqueléticamente inmaduros. Rowe et al.36,37 describieron el modelo experimental con cerdos para el estudio de la patogénesis de la ELCP. Observaron que los cambios más evidentes se producían en los estadios iniciales de la privación vascular. Estos resultados son similares a los obtenidos en nuestro trabajo, observando los mayores cambios a las 4semanas y prácticamente restauración morfológica a las 12semanas. Kim et al.38–40 describieron un método para producir necrosis isquémica de la cabeza del fémur en cerdos en desarrollo, de 5 a 6semanas y con un peso de 5 a 6kg, mediante una ligadura alrededor del cuello femoral y una sección del ligamento redondo. Después, con una aguja perforaron desde el cartílago articular hasta el hueso subcondral, confirmando que no sangra la isquemia. Nuestro modelo isquémico se ha realizado mediante una doble ligadura alrededor del cuello femoral y la sección completa del ligamento redondo. La ausencia de graves alteraciones con fragmentación de la cabeza femoral con incompatibilidad acetabular podría estar originada porque los corderos son animales de gran resistencia que se mueven con mucha facilidad después de las cirugías. La sección del ligamento redondo ha provocado la luxación de la cadera en numerosos casos, disminuyendo la transmisión de cargas a través de la extremidad proximal del fémur, lo cual evita el agravamiento de las lesiones. La luxación provoca que los animales queden postrados, facilitando las infecciones de la herida con abscesos que llegan a causar una artritis supurativa. Además, debido al modelo propuesto, hemos observado algunas necrosis de los músculos desinsertados. Por otra parte, la sección del ligamento redondo no siempre se consigue en la totalidad al no poder luxar la cabeza femoral. Esto puede explicar que en algunos casos no se consiga una necrosis intensa, aunque no hay que olvidar que a esta edad, en el cordero, el aporte vascular a través de esta estructura solo supone el 10% de la sangre que llega a la extremidad proximal del fémur41.
En los niños, la fisis proximal del fémur actúa como una barrera para los vasos de la metáfisis, de forma que la vascularización de la epífisis femoral proximal depende exclusivamente de los vasos retinaculares extraóseos42. Los vasos retinaculares llegan desde el anillo vascular alrededor de la base del cuello, ascienden a lo largo de la superficie del cuello y entran periféricamente por la base de la epífisis femoral proximal, dejando la cabeza vulnerable a la isquemia.
La revascularización también depende de los vasos retinaculares periféricos, y tras un fenómeno isquémico precisa de mucho tiempo hasta llegar a la porción central de la cabeza femoral. Por ello las perforaciones se consideran una buena opción para acelerar el proceso de revascularización estableciendo canales para el paso de los vasos a través de la barrera fisaria43. La realización de perforaciones también puede dañar el cartílago de crecimiento, por lo que este procedimiento se recomienda en pacientes mayores con poca capacidad regenerativa y, por lo tanto, con poco peligro de alterar el desarrollo44, aunque se ha descrito que perforar menos del 7% de la fisis no modifica el crecimiento posterior31,44.
Se ha observado un proceso de reabsorción osteoclástica predominante durante el proceso de reparación sin conseguir formar hueso38–40,45,46, y como claves del proceso necrótico destacan la pérdida temprana de hueso, la ausencia de formación ósea y la persistencia de tejido fibroso rico en vasos en la zona de la reabsorción ósea. Estos cambios provocan el colapso progresivo de la cabeza femoral. Gong et al.44, por su parte, describen la formación ósea por osificación encondral en el cartílago de crecimiento rodeando el núcleo de osificación secundario, sin apreciar nuevo hueso por aposición en el espacio medular central de la epífisis femoral proximal.
Los hallazgos obtenidos en nuestro estudio muestran cambios importantes en la extremidad proximal del fémur del cordero. La isquemia provocada por la doble ligadura en esqueletos inmaduros afecta tanto al hueso como al cartílago, produciendo además alteraciones morfológicas histológicamente visibles. Nuestro objetivo era el desarrollo del modelo experimental de necrosis isquémica en corderos por ser un animal accesible, de fácil manejo y estabulación.
Con nuestro modelo hemos observado cambios morfológicos, con hipertrofia de la cabeza y engrosamiento del cuello femoral, al compararlo con el grupo control. A partir de la 4.asemana de la cirugía también aparecen cambios en el núcleo de osificación, haciéndose más evidentes a las 8semanas, adquiriendo un aspecto blanquecino en relación con el grupo control. A partir de este momento los cambios no son tan evidentes.
La histología muestra signos de isquemia a partir de la 4.asemana después de la cirugía, siendo más evidente en la 8.a semana, con aumento de la fibrosis y mayores áreas de osificación encondral, presentando un cartílago articular irregular, con menor grosor y sin actividad condroblástica. Este proceso se extiende al núcleo de osificación, mostrando un aspecto macroscópico blanquecino, y con mayor grado de osificación. Existe un aumento de células adiposas en la médula, tanto epifisaria como metafisaria, y un cierre precoz de las fisis. En las zonas donde colocamos las ligaduras no encontramos necrosis en ningún punto. Se observó un aumento de la fibrosis en el periostio con numerosas áreas de angiogénesis, sin llegar a ver colapso de los vasos, que presentaban una proliferación de las capas media y adventicia con una hiperplasia plexiforme externa.
Los cambios observados en el cartílago articular son poco evidentes. El cartílago articular carece de vasos y el mecanismo por el cual los nutrientes alcanzan el cartílago han sido discutidos desde hace tiempo47. Para algunos, los nutrientes del cartílago llegan única y exclusivamente a través del líquido sinovial48–50, mientras que otros trabajos señalan que existe también un aporte vascular desde la metáfisis proximal del fémur que nutre el cartílago articular, hecho demostrado en conejos51–53 y en corderos54.
Kalhor et al.41, en 28cadáveres humanos adultos frescos, con 35caderas, observaron que la arteria circunfleja interna (ACI) era el principal aporte vascular a la extremidad proximal del fémur en 29ocasiones, mientras que la arteria glútea inferior lo era en 6casos. En sus especímenes la arteria del ligamento redondo no tenía ningún aporte, mientras que observaron que la ACI da una rama de menor calibre, la arteria retinacular ínfero-medial, de manera constante. La cantidad y el calibre de los vasos retinaculares superiores demostraron un predominio en la vascularización de la cabeza femoral, aunque las arterias retinaculares inferiores siempre están presentes. Para disminuir el riesgo de necrosis isquémica, ramas de la ACI y de la arteria glútea inferior pasan por el espacio entre el musculus quadratus femoris (músculo cuadrado femoral) y el musculus piriformis (músculo piramidal) y deben ser protegidas durante la cirugía. Como todos los vasos intracapsulares penetran cerca de las inserciones distales, la capsulotomía distal comporta un riesgo mucho mayor de producir necrosis que la capsulotomía proximal. Esta distribución arterial nos hace pensar que es muy difícil conseguir una isquemia completa, y que posiblemente tuvimos un proceso transitorio de hipertensión de la zona por compresión de la sutura. Los cambios radiológicos observados no son similares a los obtenidos en humanos con fases de necrosis, fragmentación, reosificación y remodelación, por lo que consideramos que el cordero no es un buen modelo experimental para el estudio de la enfermedad de Leg-Calvé-Perthes.
Nivel de evidenciaNivel de evidencia I.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Premio Antonio Riosalido para trabajos relacionados con la Cirugía Ortopédica y Traumatología 2013.