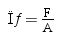El hueso como material varía su composición y sus propiedades mecánicas a lo largo de la vida. Aunque estas variaciones se conocen mejor en la edad adulta, existe poca información experimental sobre la variación de estas propiedades en los estados tempranos de desarrollo. El objetivo de este estudio es analizar el comportamiento mecánico y las propiedades químicas de tejido óseo cortical de 2 especies animales en estas etapas más tempranas.
Material y metodologíaSe fabricaron 20 probetas de hueso cortical de especies bovina y ovina que se encontraban en diferentes etapas de desarrollo (alimentación exclusiva de leche materna, en período de transición a pienso o pasto y animales jóvenes, pero con dieta de alimentos sólidos). Las probetas fueron sometidas a ensayos de tracción, grabados con una cámara de alta velocidad para obtener mapas de deformación. También se realizaron medidas de la fuerza de tracción hasta la rotura de la probeta. Se efectuó un estudio fractográfico con microscopio electrónico de barrido para analizar la superficie de fractura y un análisis de la cantidad de calcio en cada una de las probetas mediante espectroscopía de dispersión de rayos-X.
ResultadosSe encontró una correlación estadísticamente significativa y positiva entre el módulo de elasticidad de las probetas y el contenido en calcio de estas. Se observó una tendencia a un comportamiento más rígido con la edad.
ConclusionesEl tejido óseo joven tiende a rigidizarse con la edad al aumentar el contenido en calcio con un aumento del módulo elástico.
Bone as a material varies its composition and mechanical properties throughout life. Although these variations are better understood in adulthood, there is little experimental information on the variation of these properties in early stages of development. The objective of this study is to analyze the mechanical behavior and chemical properties of cortical bone tissue from two animal species in these earliest stages.
Material and methodologyTwenty specimens of cortical bone were manufactured from bovine and ovine species that were in different stages of development (feeding exclusively on breast milk, in the transition period to feed or pasture, and young animals but on a solid food diet). The specimens were subjected to tensile tests, recorded with a high-speed camera to obtain deformation maps. Measurements of the tensile force until the specimen broke were also carried out. A fractographic study was carried out with a scanning electron microscope to analyze the fracture surface and an analysis of the amount of calcium in each of the specimens using X-ray dispersion spectroscopy.
ResultsA statistically significant and positive correlation was found between the elastic modulus of the specimens and their calcium content. A trend towards more rigid behavior with age was observed.
ConclusionsYoung bone tissue tends to stiffen with age as the calcium content increases with an increase in elastic modulus.
Establecer la relación entre la biología y la mecánica del tejido óseo es fundamental, pues un hueso no apto mecánicamente no puede cumplir su función. La relación entre la biología del hueso, su composición y su función mecánica se entiende con el concepto de adaptación funcional. Estudiar, analizar y sistematizar el hueso como tejido y como órgano ayuda a comprender la relación que existe entre la estructura y la función, ya que la forma ósea debe reflejar una morfología equilibrada de las diferentes tensiones a las cuales está sometido1,2.
Los huesos del esqueleto no solo resisten las solicitaciones e impactos accidentales, sino que sobre todo sufren cargas repetidas, cíclicas, y de diferente magnitud que se producen con la actividad normal. Cada hueso mantiene una competencia funcional, es decir, se adapta a un sin fin de posibilidades y situaciones, lo que Biewener3 denominó «factores de seguridad», muy frecuentes en el diseño ingenieril, que se definen como el índice de resistencia de fallo de una estructura frente a la mayor solicitación que puede esperarse durante su uso4.
El 70% del contenido óseo corresponde a minerales (calcio, fósforo, magnesio...), oxígeno e hidrógeno, en proporciones que se corresponden con la hidroxiapatita. El 30% restante está formado por colágeno. En las fibras de colágeno se fijan pequeños cristales de hidroxiapatita. Desde el punto de vista mecánico se comporta como un material heterogéneo y anisótropo. La unión del colágeno con la hidroxiapatita es lo que confiere al hueso propiedades mecánicas excepcionales. Cuanto menos pese el esqueleto, habrá un gasto menor y un ahorro de economía, aumentando la eficacia. Por ello, el diseño de los huesos largos son tubos huecos con mayor grosor de la pared ósea en su porción media que en los extremos, lugar donde las solicitaciones a tensión y compresión son mayores5.
Las propiedades minerales del hueso son muy sensibles al grado de mineralización de la matriz ósea hallando un crecimiento exponencial en la rigidez ósea con el aumento de la mineralización6–9. De hecho, Currey et al.7, demostraron que el módulo de elasticidad y el contenido de calcio estaban fuertemente relacionados. Sin embargo, otras publicaciones no encuentran una relación entre la mineralización y la resistencia del material e incluso se ha visto una correlación negativa.
La finalidad de este proyecto es desarrollar una técnica para analizar el comportamiento mecánico y su relación con la composición química de tejido óseo cortical en etapas tempranas del desarrollo. Nuestro objetivo es determinar los cambios en las propiedades mecánicas en diferentes momentos del desarrollo óseo en edades tempranas en 2 especies animales distintas (bovina y ovina) y analizar si este cambio se encuentra relacionado con la cantidad de calcio de forma similar en ambas especies.
Materiales y metodologíaA través de proveedores locales, se obtuvieron huesos largos (tibias y fémures) de 2 especies de mamíferos (bovina y ovina), asegurando que los huesos estuvieran dentro de los grupos de edad apropiados: individuos alimentados solo con leche materna (amamantados), en transición a alimentos sólidos y de edad madura (alimentados solo con alimentos sólidos).
Las especies amamantadas incluyeron terneros hasta los 12 meses de edad y ovejas hasta 4 meses; en el grupo de animales de transición a alimento sólido se incluyeron aquellos que comienzan a pastar, es decir, en la especie bovina entre 12 y 18 meses y en la especie ovina entre 4 y 12 meses; mientras que los individuos en edad madura abarcaban rangos de edad desde los 18 meses y los 12 meses en adelante para vacas y ovejas, respectivamente.
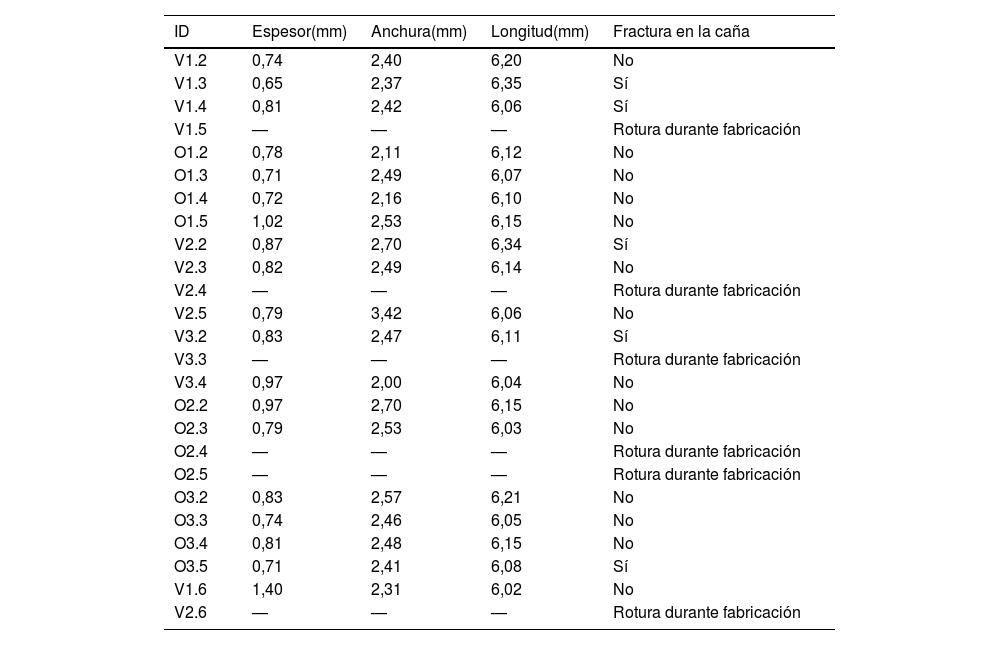
Se construyeron probetas de hueso que se extrajeron de la diáfisis del hueso, obteniendo láminas longitudinales de 0,8mm de espesor, empleando una cortadora de cuchilla circular de 1mm de espesor con refrigeración (Remet Micromet Evolution 8502, Bolonia, Italia). Estas láminas fueron mecanizadas para obtener probetas en forma de hueso de perro (con dimensiones nominales de 6×25mm)10 (tabla 1 y fig. 1).
Dimensiones y características de las probetas ensayadas
| ID | Espesor(mm) | Anchura(mm) | Longitud(mm) | Fractura en la caña |
|---|---|---|---|---|
| V1.2 | 0,74 | 2,40 | 6,20 | No |
| V1.3 | 0,65 | 2,37 | 6,35 | Sí |
| V1.4 | 0,81 | 2,42 | 6,06 | Sí |
| V1.5 | — | — | — | Rotura durante fabricación |
| O1.2 | 0,78 | 2,11 | 6,12 | No |
| O1.3 | 0,71 | 2,49 | 6,07 | No |
| O1.4 | 0,72 | 2,16 | 6,10 | No |
| O1.5 | 1,02 | 2,53 | 6,15 | No |
| V2.2 | 0,87 | 2,70 | 6,34 | Sí |
| V2.3 | 0,82 | 2,49 | 6,14 | No |
| V2.4 | — | — | — | Rotura durante fabricación |
| V2.5 | 0,79 | 3,42 | 6,06 | No |
| V3.2 | 0,83 | 2,47 | 6,11 | Sí |
| V3.3 | — | — | — | Rotura durante fabricación |
| V3.4 | 0,97 | 2,00 | 6,04 | No |
| O2.2 | 0,97 | 2,70 | 6,15 | No |
| O2.3 | 0,79 | 2,53 | 6,03 | No |
| O2.4 | — | — | — | Rotura durante fabricación |
| O2.5 | — | — | — | Rotura durante fabricación |
| O3.2 | 0,83 | 2,57 | 6,21 | No |
| O3.3 | 0,74 | 2,46 | 6,05 | No |
| O3.4 | 0,81 | 2,48 | 6,15 | No |
| O3.5 | 0,71 | 2,41 | 6,08 | Sí |
| V1.6 | 1,40 | 2,31 | 6,02 | No |
| V2.6 | — | — | — | Rotura durante fabricación |
Se fabricaron 25 probetas que se clasificaron en 6 grupos diferentes conforme a su especie y su grupo de edad. Las probetas fueron nombradas en función de la etapa de desarrollo de la alimentación de los animales y del grupo al que pertenecían. V1 y O1 se utilizaron para referirse a sujetos todavía amamantados (bovinas y ovinas, respectivamente), V2 y O2 para animales en transición a alimentos sólidos y V3 y O3 para los mamíferos de mayor madurez. Seis de estas probetas se dañaron durante el proceso de fabricación y no se pudieron utilizar en los ensayos experimentales, por lo cual los cálculos se efectuaron sobre diecinueve probetas.
Las probetas obtenidas (n=19) se mantuvieron embebidas en suero fisiológico salino. Antes de realizar los experimentos, se evaluaron las superficies de las muestras con un microscopio digital de alta resolución (Olympus DSX10-UZH, Tokio, Japón).
Los ensayos mecánicos de tracción se realizaron en una máquina de ensayo de tracción universal (Ibertest IBTH-5/500, España), utilizando un sistema de sujeción de aluminio diseñado específicamente para evitar la desalineación entre los extremos superior e inferior de las probetas y asegurar la carga axial de la probeta.
Los ensayos se realizaron de forma cuasi-estática a una velocidad de deformación de 50mm/min y con una precarga de 2,2N. Los datos de fuerza fueron obtenidos mediante una célula de carga de 6 ejes y un sistema de adquisición de datos DTS Slice Micro. La tensión se calculó como la fuerza de tracción dividida por la sección transversal inicial en el medio del área de referencia, usando la fórmula:
Donde σ es la tensión, F la carga de tracción aplicada y A la sección transversal de la probeta medida en el medio del área de la caña. La deformación se calculó utilizando las medidas de desplazamiento proporcionadas por la máquina de ensayo de tracción, utilizando la siguiente ecuación:
Donde ɛ es la deformación, Δl es la diferencia entre la longitud final y la inicial y l0 la longitud inicial, consideramos 6mm como longitud inicial para las probetas que se rompieron por la zona central y 20mm la longitud inicial para el caso de las probetas que rompieron en la zona de sujeción, siendo esta la distancia entre los taladros de las barras de aluminio. Los ensayos fueron grabados a 100Hz mediante una cámara de alta velocidad (iXCamera) sincronizada con el sistema de adquisición.
La estimación del módulo de elasticidad de las muestras se realizó mediante el desarrollo un código propio en el programa MATLAB (R2023a Update 1, The Mathworks Inc).
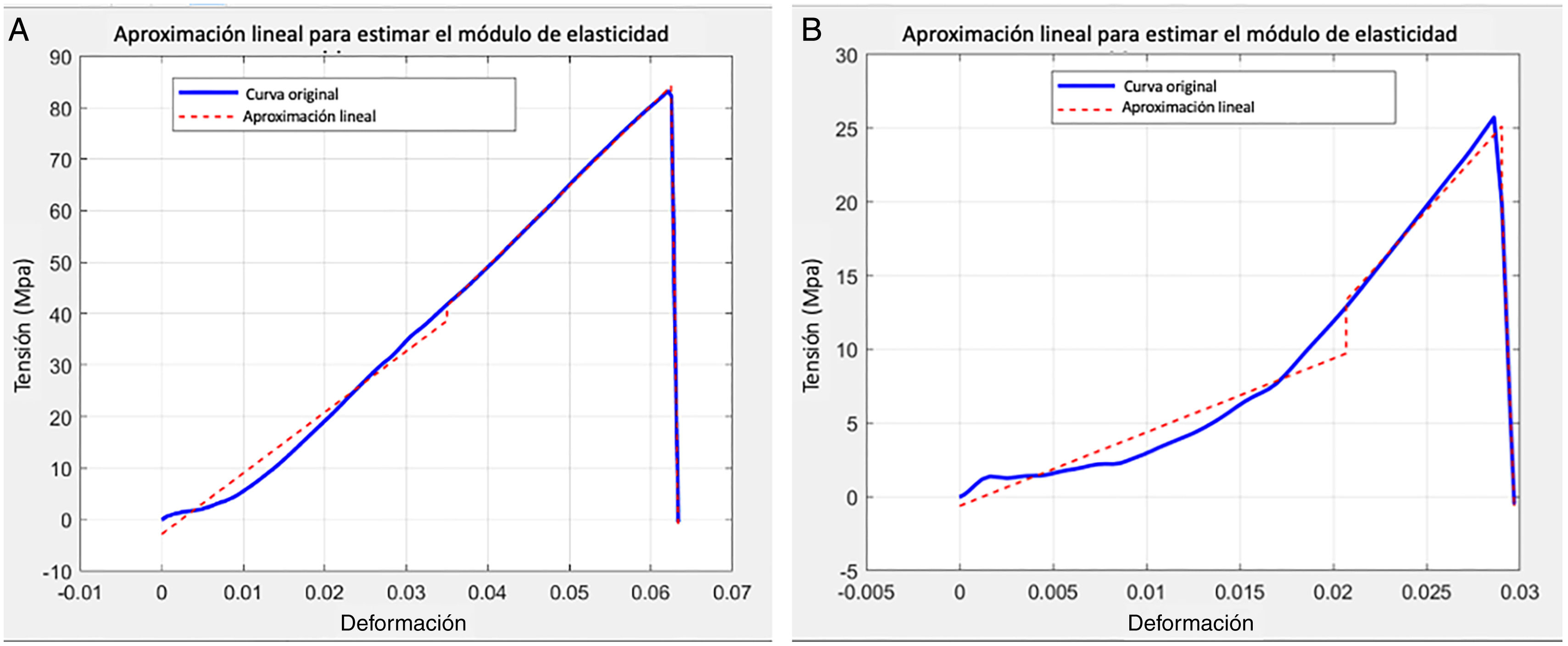
Cada una de las curvas tensión/deformación se aproximó mediante una curva lineal por tramos. El número de segmentos de la curva se obtuvo mediante iteraciones en las que se minimizaba el error RMS de cada tramo. El número de tramos final fue elegido de forma visual encontrando el número de tramos que minimizaba el error para los distintos tramos lineales. Por último, el módulo de elasticidad se escogió como la pendiente correspondiente al segundo tramo lineal de la aproximación, puesto que el primer tramo lineal habitualmente se correspondía con un tramo de menor pendiente que probablemente estuviera relacionado con una alineación de los cabezales de la máquina de tracción durante los primeros instantes del ensayo.
Adicionalmente, se estudió la morfología de la superficie de fractura y la cantidad de calcio de cada probeta realizando un análisis fractográfico y composicional con un microscopio electrónico de barrido (SEM) (Zeiss Auriga Gemini). Dado que los huesos no son materiales conductores se aplicó un proceso de metalización a las muestras antes de analizarlas mediante una cinta conductora de carbono. Luego se depositó una capa de carbono de 12,67nm en cada una de las probetas utilizando una metalizadora Leica EM ACE600. La presión de vacío de metalización fue de 10-4mbar y se requirieron 26 pulsos para depositar el espesor de capa adecuado. Para el estudio fractográfico la tensión de trabajo fue de 15kV y solo se inspeccionó la fractura superficial de probetas que rompieron en la caña. Para el análisis composicional se utilizó el programa QUANTAX (Bruker AXS), basado en el microanálisis de dispersión de energía por rayos X (EDX). Una de las probetas no se pudo metalizar correctamente y, por tanto, el análisis composicional se limitó a las 18 probetas restantes.
Hay que resaltar que el cálculo del módulo de elasticidad sólo tiene sentido para aquellas probetas que rompieron en la zona de la caña (fig. 2), aunque se trazaron las curvas tensión-deformación para todas las probetas ensayadas (fig. 3). Hay que resaltar que el cálculo del módulo de elasticidad solo tiene sentido para aquellas probetas que rompieron en la zona de la caña, aunque se trazaron las curvas tensión/deformación para todas las probetas ensayadas (fig. 3).
A) Curvas tensión-deformación de las probetas que fallaron en la zona de la caña. B-D) Curvas tensión-deformación de las probetas de origen ovino en función del grupo de edad: sujetos alimentados con leche materna (superior), sujetos en transición (centro), sujetos maduros (inferior). E-G) Curvas tensión-deformación de las probetas de origen bovino en función del grupo de edad: sujetos alimentados con leche materna (superior), sujetos en transición (centro), sujetos maduros (inferior).
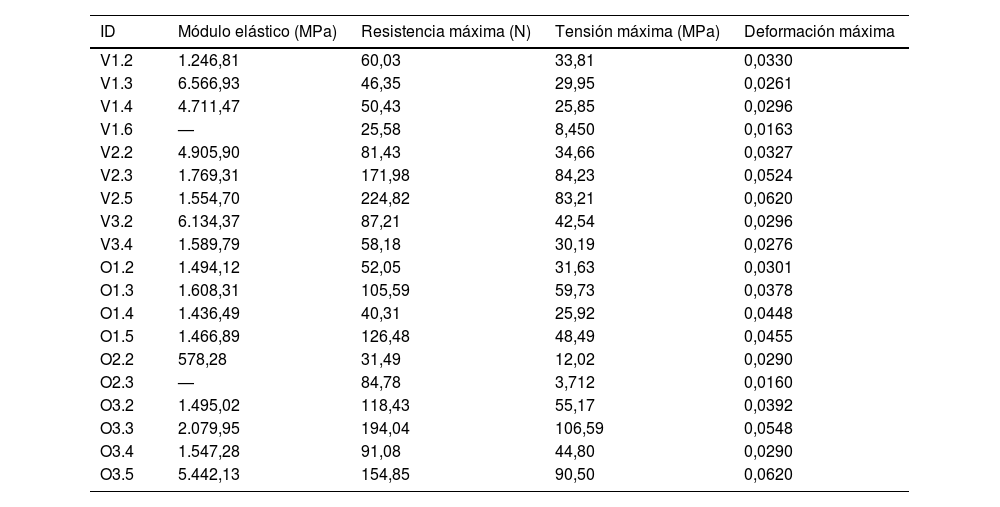
Para el cálculo del módulo de elasticidad, se analizó la curva de carga de la probeta previa a la fractura y una longitud inicial l0=6mm, que se corresponde con la longitud de la caña de la probeta. La tabla 2 muestra los valores del módulo de elasticidad, resistencia, tensión y deformación máxima obtenidos para estas muestras (en las celdas sombreadas).
Valores de resistencia máxima, tensión máxima y deformación máxima. Las probetas sombreadas se corresponden con las probetas que rompieron en la zona de la caña, y por tanto se presenta el valor del módulo elástico corregido por la longitud de caña (6mm)
| ID | Módulo elástico (MPa) | Resistencia máxima (N) | Tensión máxima (MPa) | Deformación máxima |
|---|---|---|---|---|
| V1.2 | 1.246,81 | 60,03 | 33,81 | 0,0330 |
| V1.3 | 6.566,93 | 46,35 | 29,95 | 0,0261 |
| V1.4 | 4.711,47 | 50,43 | 25,85 | 0,0296 |
| V1.6 | — | 25,58 | 8,450 | 0,0163 |
| V2.2 | 4.905,90 | 81,43 | 34,66 | 0,0327 |
| V2.3 | 1.769,31 | 171,98 | 84,23 | 0,0524 |
| V2.5 | 1.554,70 | 224,82 | 83,21 | 0,0620 |
| V3.2 | 6.134,37 | 87,21 | 42,54 | 0,0296 |
| V3.4 | 1.589,79 | 58,18 | 30,19 | 0,0276 |
| O1.2 | 1.494,12 | 52,05 | 31,63 | 0,0301 |
| O1.3 | 1.608,31 | 105,59 | 59,73 | 0,0378 |
| O1.4 | 1.436,49 | 40,31 | 25,92 | 0,0448 |
| O1.5 | 1.466,89 | 126,48 | 48,49 | 0,0455 |
| O2.2 | 578,28 | 31,49 | 12,02 | 0,0290 |
| O2.3 | — | 84,78 | 3,712 | 0,0160 |
| O3.2 | 1.495,02 | 118,43 | 55,17 | 0,0392 |
| O3.3 | 2.079,95 | 194,04 | 106,59 | 0,0548 |
| O3.4 | 1.547,28 | 91,08 | 44,80 | 0,0290 |
| O3.5 | 5.442,13 | 154,85 | 90,50 | 0,0620 |
MPa: megapascales.
Por completar el análisis, se repitió el proceso del cálculo del módulo de elasticidad para todas las muestras ensayadas, pero en el caso en el que la fractura ocurriera fuera de la zona central, se utilizó la longitud inicial entre los orificios de sujeción a la máquina en el cálculo de la deformación (l0=20mm).
Por último, se realizaron test no-paramétricos (correlación de Spearman) para comprobar si existía relación entre el módulo de elasticidad, la resistencia máxima, la tensión y la deformación máximas obtenidas en los ensayos de tracción y la cantidad de calcio medida en la muestra. El nivel de significación estadística se estableció en p<0,05.
ResultadosEnsayo de tracciónSolo 5 muestras rompieron en la zona de la caña mientras que las otras experimentaron fractura en una de las cabezas de la probeta. En varias de estas probetas se observaron defectos iniciales en el hueso como consecuencia del mecanizado que probablemente influyeron en la localización de la fractura de la probeta.
A la vista de las curvas tensión/deformación obtenidas, las probetas mostraron un comportamiento elástico lineal, conduciendo a un comportamiento de fractura frágil.
Tanto la tensión como la fuerza máxima aumentaron con el estado de desarrollo de la muestra, alcanzando valores de 29,95 megapascales (MPa) y 25,85MPa para las muestras de especies amamantadas, alrededor de 35MPa para la probeta bovina de transición a alimento sólido, y 42,54 y 90,5MPa para muestras bovinas y ovinas maduras (tabla 2).
Debido al reducido tamaño muestral, resultó difícil observar la tendencia de variación de la tensión máxima o la deformación de rotura en función del estado de desarrollo de los huesos de cada especie. Observamos una tendencia a comportamientos más rígidos de las curvas (mayor pendiente) al aumentar la edad de la muestra, aunque debe de ser interpretada con cautela debido a la variabilidad existente dentro de cada grupo etario.
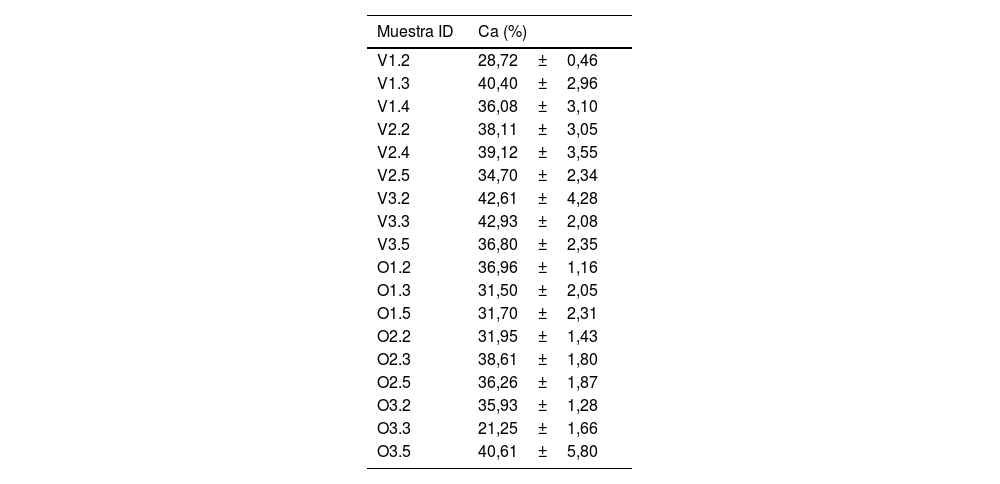
Análisis composicionalEl porcentaje de calcio hallado en las probetas, analizadas utilizando la técnica EDX (tabla 3) mostraron una gran dispersión.
Análisis composicional (%) obtenido en 18 muestras utilizando EDX (X±DE)
| Muestra ID | Ca (%) |
|---|---|
| V1.2 | 28,72±0,46 |
| V1.3 | 40,40±2,96 |
| V1.4 | 36,08±3,10 |
| V2.2 | 38,11±3,05 |
| V2.4 | 39,12±3,55 |
| V2.5 | 34,70±2,34 |
| V3.2 | 42,61±4,28 |
| V3.3 | 42,93±2,08 |
| V3.5 | 36,80±2,35 |
| O1.2 | 36,96±1,16 |
| O1.3 | 31,50±2,05 |
| O1.5 | 31,70±2,31 |
| O2.2 | 31,95±1,43 |
| O2.3 | 38,61±1,80 |
| O2.5 | 36,26±1,87 |
| O3.2 | 35,93±1,28 |
| O3.3 | 21,25±1,66 |
| O3.5 | 40,61±5,80 |
EDX: espectroscopía de dispersión de rayos-X.
En la figura 4 se observan los planos de fractura correspondientes a las probetas V1.3 y V1.4 (lactantes de la especie bovina). La superficie de fractura en ambos casos fue muy plana, indicativo de un comportamiento frente a rotura frágil. Fueron fracturas de comportamiento elástico, sin deformación plástica y con baja liberación de energía, lo que se confirmó por la limpieza de la superficie y con las curvas de tensión. Los planos de fractura se orientaron hacia la izquierda, lo que indica que la grieta comenzó en el lado derecho de la superficie, probablemente influenciadas por la presencia de poros en las probetas. Este tipo de fractura fue observado para todas las muestras de individuos en edad lactante y en aquellos individuos en transición hacia una alimentación sólida. Sin embargo, la fractografía de la probeta O3.5, que fue la que soportó una mayor fuerza antes de la fractura, presentó un patrón de fractura distinto con signos de microdeformación y múltiples planos de fractura (fig. 4).
El análisis fractográfico mostró que el hueso de la especie ovina era más poroso que el de bovina.
El análisis estadístico demostró una correlación significativa y positiva entre el módulo de elasticidad de las muestras y el contenido en calcio de estas. Sin embargo, no se obtuvo correlación significativa de la resistencia máxima con la tensión máxima (p=0,061) ni con la deformación máxima (p=0,073).
DiscusiónEl hueso es un tejido complejo, excepcional por sus propiedades como una estructura material rígida y sin embargo notable por su plasticidad morfológica. Estas propiedades mecánicas únicas están relacionadas con la composición del tejido óseo que combina una fase inorgánica formada principalmente por cristales de hidroxiapatita con una fase orgánica en la que se pueden encontrar más de 30 proteínas, siendo el colágeno tipo I el componente mayoritario durante el crecimiento. El colágeno se mineraliza9. Los cristales de hidroxiapatita son resistentes a la compresión presentando una resistencia alta pero una elasticidad pequeña mientras que las fibras de colágeno presentan una resistencia baja y una elasticidad alta. La combinación de ambos forma un material más duro que cada uno de sus componentes por separado11.
La densidad de un hueso no es la misma durante toda la vida. Estudios efectuados en diferentes poblaciones han demostrado que el aumento de la densidad ósea sigue un patrón positivo y casi lineal hasta los 20 años, después de los cuales aumenta muy lentamente alcanzando su pico hacia los 35 años. Algunos autores muestran un rápido crecimiento de la densidad durante la pubertad existiendo diferencias significativas en edad y sexo tanto a nivel de la masa ósea como de la densidad con las mayores variaciones durante la adolescencia12–14. Después de un periodo de estabilidad comienza la pérdida ósea en ambos sexos si bien esta es mayor en mujeres que pierden un 35% de hueso cortical y entre un 50-60% de hueso trabecular, mientras que el varón pierde cantidades inferiores al 30%15. En el varón, la pérdida de densidad ósea con la edad parece consecuencia de la disminución de la formación ósea mientras que, en las mujeres, después de la menopausia, resulta de un aumento de la resorción ósea16–18.
Nos hemos centrado en el análisis óseo a edades muy tempranas para detectar la relación de mineral óseo/colágeno que no han sido analizados en profundidad19,20. Por ello, este estudio sometió a experimentos de tracción cuasi-estáticos probetas de hueso joven dividido en 3 grupos relacionados con el tipo de alimentación. La edad es difícil de comparar entre diferentes especies. Por ello recurrimos a diferenciar lactancia y pienso y establecimos un grupo intermedio del paso de la lactancia al alimento sólido en 2 especies diferentes de mamíferos, bovino y ovino. En estos experimentos se ha encontrado que tanto el módulo elástico como la resistencia ósea aumentaron con la edad, siendo estos números consistentes con los resultados del análisis composicional. Además, hemos detectado una tendencia similar en ambas especies analizadas.
Otros estudios en animales confirman que el módulo elástico y la resistencia mantienen una correlación positiva con la edad en el tejido óseo juvenil. Akkus et al.21, analizaron fémures de ratas hembra de 3, 8 y 24 meses de edad mediante espectroscopia, demostrando que el aumento de la mineralización y de la cristalinidad correlacionaron con la disminución de la deformación elástica con la edad. Yerramshetty et al.22, estudiaron la asociación entre la cristalinidad mineral y las propiedades mecánicas del hueso cortical humano, viendo que a mayor resistencia y rigidez del tejido óseo corresponde mayor cristalinidad, mientras que la ductilidad se veía reducida. Además, concluyen que la cristalinidad podría servir para la predicción de la resistencia ósea. Currey et al.23, estudiaron el efecto del contenido mineral y el módulo de Young concluyendo que el contenido mineral se asocia positivamente con el módulo elástico, pero negativamente con la tenacidad.
Entre las limitaciones del estudio mencionar que en este estudio piloto sobre hueso de mamíferos jóvenes cuadrúpedos con el tipo de alimentación como variable para la edad de los sujetos incluidos. Aunque esta aproximación es razonable, se pierde cierto control sobre la edad ósea de los sujetos participantes y dificulta identificar de forma más clara la variación de las propiedades mecánicas con la edad de los sujetos. Además, en el proceso de fabricación de las probetas, el espesor de 0,8mm se eligió para comparar nuestros resultados con otros publicados anteriormente24–26, pero las probetas son frágiles con alto riesgo de rotura durante el proceso. Se perdieron varias probetas y solo 5 rompieron en la zona de la caña. La mayoría rompieron en la zona del agarre de la probeta a la máquina de tracción. La geometría de esta zona coincide con una zona de concentración de tensiones. Esta limitación tiene otra consecuencia para calcular la deformación pues la longitud inicial que se utilizó para el cálculo fue la longitud entre los orificios que se utilizaron para sujetar la probeta a la máquina de tracción (20mm) en lugar de los 6mm de la longitud de la zona de la caña. Esta modificación hace que los valores estimados del módulo de elasticidad sea tan pequeña comparada con los valores publicados. Por tanto, para trabajos posteriores se debería optimizar el diseño de esta sujeción para provocar la fractura de la probeta en la zona de la caña. El método de cálculo del módulo de elasticidad está sujeto a limitaciones dado que requirió de la valoración subjetiva de los autores para encontrar el modelo lineal que permitiera aproximar la pendiente de la zona de comportamiento elástico de la probeta. La figura 5 muestra 2 casos extremos de esta aproximación: uno en el que la aproximación lineal funciona bien y la curva tensión/deformación se puede descomponer en tramos lineales, y un segundo en el que la aproximación tomada tiene un error mayor.
Al considerar los valores de porcentaje de masa de calcio detectados con EDX hemos encontrado que su contenido aumenta con el desarrollo para el tejido óseo juvenil bovino y ovino. En el grupo de hueso ovino adulto obtuvimos un porcentaje de calcio ligeramente menor comparado con los especímenes en transición a alimentos sólidos, pero se necesitaría un mayor número de probetas para poder confirmar este resultado.
El análisis fractográfico ha permitido identificar diferencias entre las especies, ya que las muestras de hueso ovino presentaban mayor porosidad que las provenientes de especímenes bovinos, contribuyendo a una menor densidad mineral ósea. Las variaciones en la calcificación y, en consecuencia, en la cristalinidad parecen ser pequeñas en nuestras muestras, pero lo suficientemente grandes como para contribuir a la variación de las propiedades mecánicas.
El estudio biomecánico del hueso dispone actualmente de nuevas tecnologías que permiten conocer mejor su comportamiento mecánico. En nuestro caso hemos conjuntado un estudio mecánico a tracción con cámaras de alta velocidad, unido al estudio composicional y fractográfico. Estudios posteriores nos obligan a cambiar el diseño de las probetas para evitar la pérdida de muestras. En nuestro estudio hemos demostrado que el tejido óseo joven tiende a rigidizarse con la edad, con las semanas de vida y el cambio de alimentación, al aumentar el contenido en calcio en el hueso que conlleva un aumento del módulo elástico.
Nivel de evidenciaNivel de evidencia I.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticasEs un trabajo sobre huesos frescos procedentes de matadero.