El derrame pleural es una de las posibles complicaciones del abordaje toracoabdominal de la columna. Lo más frecuente es que se trate de una efusión reactiva, pero entre sus causas posibles se encuentran el hemotórax, el empiema o, con menor frecuencia, el quilotórax. Presentamos un caso de quilotórax como complicación tardía de una artrodesis instrumentada de columna lumbar mediante doble abordaje, su manejo y evolución clínica, y una revisión de la bibliografía.
Pleural effusion is a possible complication of the thoraco-abdominal approach to the spine. It is more commonly a reactive effusion, but it also may be caused by hemothorax, empyema or, less commonly, a chylothorax. The case of a chylothorax is reported as a late onset complication of a double anterior and posterior instrumented fusion of the lumbar spine. Its management and clinical outcome, and a review of the literature is presented.
El derrame pleural es una de las posibles complicaciones del abordaje toracoabdominal de la columna. Lo más frecuente es que se trate de una efusión reactiva, pero entre sus causas posibles se encuentran también el hemotórax, el empiema o con menor frecuencia, el quilotórax.
Debido a la baja incidencia de quilotórax, la falta de estudios clínicos comparativos dificulta el consenso en el tratamiento, ya que los datos provienen de series de casos retrospectivas1.
Presentamos un caso de quilotórax como complicación tardía de una artrodesis instrumentada de columna lumbar mediante doble abordaje, su manejo y evolución clínica, y una revisión de la bibliografía.
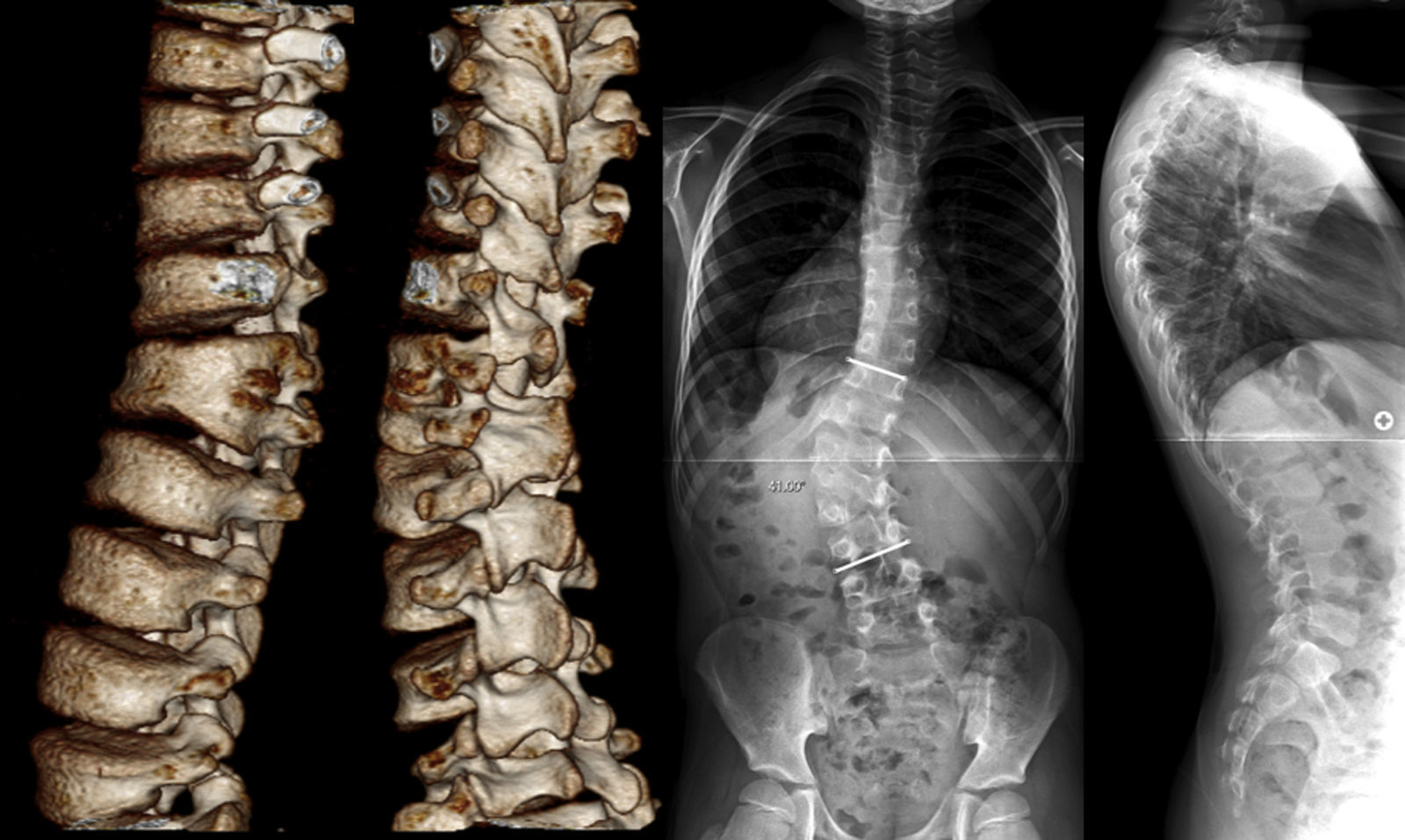
Caso clínicoPaciente de 9 años y 3 meses de edad, nacido a las 41 semanas de gestación en parto eutócico, sin antecedentes patológicos de interés y actual campeón regional de taekwondo. A los 4 años de edad fue diagnosticado de escoliosis congénita, que no fue tratada dada su pequeña magnitud y lenta progresión, sin dolor ni déficit neurológicos. Acudió por primera vez a la consulta a los 9 años por un súbito aumento de la progresión, con 138,4cm de altura (65,4cm en sedestación) y 25,4kg de peso. El estudio radiológico mostró una curva toracolumbar izquierda de T11 a L4 de 41° (5 años antes 27,6°) originada por una hemivértebra semisegmentada izquierda L2 fijada a L1, un recuento de 6 vértebras lumbares, una pequeña curva compensatoria torácica y un equilibrio coronal de 1cm a la derecha de la plomada a C7, dentro de la normalidad. A pesar del remanente de crecimiento (Risser 0 y cartílagos trirradiados abiertos), la indicación quirúrgica se estableció por la reciente progresión de la curva lumbar (fig. 1).
Un mes después de la consulta se realizó la intervención mediante doble abordaje, bajo control con neuromonitorización intraoperatoria. En un primer tiempo quirúrgico (liberación anterior), se colocó al paciente en decúbito lateral derecho con elevación de la mesa a nivel de la cintura para aumentar la curva lumbar y la exposición de los discos, y de ese modo facilitar la realización de las discectomías, previa esterilización e infiltración del subcutáneo con xilocaína y adrenalina 1/200.000. Se realizó el abordaje toracoabdominal izquierdo a través de la resección subperióstica del 10° arco costal izquierdo, que se preservó para posterior uso como autoinjerto en los espacios discales. Tras el acceso a cavidad pleural, se ingresó en cavidad abdominal a través del diafragma, con disección roma del retroperitoneo hasta la localización del psoas, identificación del uréter y plexo prevertebral, y acceso al aspecto anterolateral izquierdo de la curva lumbar, donde se realzaba la protrusión de los discos por la curvatura y la posición. Tras comprobación radiológica del nivel, se realizó discectomía desde T12 a L3 y se colocó en empalizada el autoinjerto procedente de la costilla resecada. Una vez aplanada la mesa, se comprobó la flexibilidad de la curva. Se procedió al cierre de la herida por planos y se dejó un drenaje torácico.
A continuación, en la misma sesión quirúrgica, se colocó al paciente en decúbito prono con flexión de ambas caderas y rodillas de unos 30°. Se procedió al abordaje posterior con liberación de los elementos posteriores e instrumentación mediante tornillos pediculares uniplanares de 4,5mm de diámetro y 30mm de longitud. Fue posible instrumentar ambos pedículos de T12 y L3, y el pedículo derecho de L1 (el pedículo izquierdo de L1 y el de la hemivértebra L2 eran extremadamente atróficos y no fue posible su instrumentación). Se realizó la fijación con 2 barras de cromo-cobalto, y corrección in situ de la curva mediante compresión sobre la barra izquierda y distracción sobre la derecha. Una vez finalizada la instrumentación, reducción y fijación segmentaria de la curva lumbar se comprobó una corrección espontánea casi completa de la curva compensatoria torácica. Por último, se procedió a la impactación del aloinjerto, profilaxis con 1g de vancomicina en polvo y cierre por planos.
La intervención se llevó a cabo sin complicaciones, con una pérdida hemática aproximada de 200mL (30% de la volemia estimada, con hemoglobina postoperatoria de 9,9g/dL) y sin eventos neurofisiológicos en los potenciales evocados sensitivos y motores normales hasta 20 min después de la última maniobra de reducción.
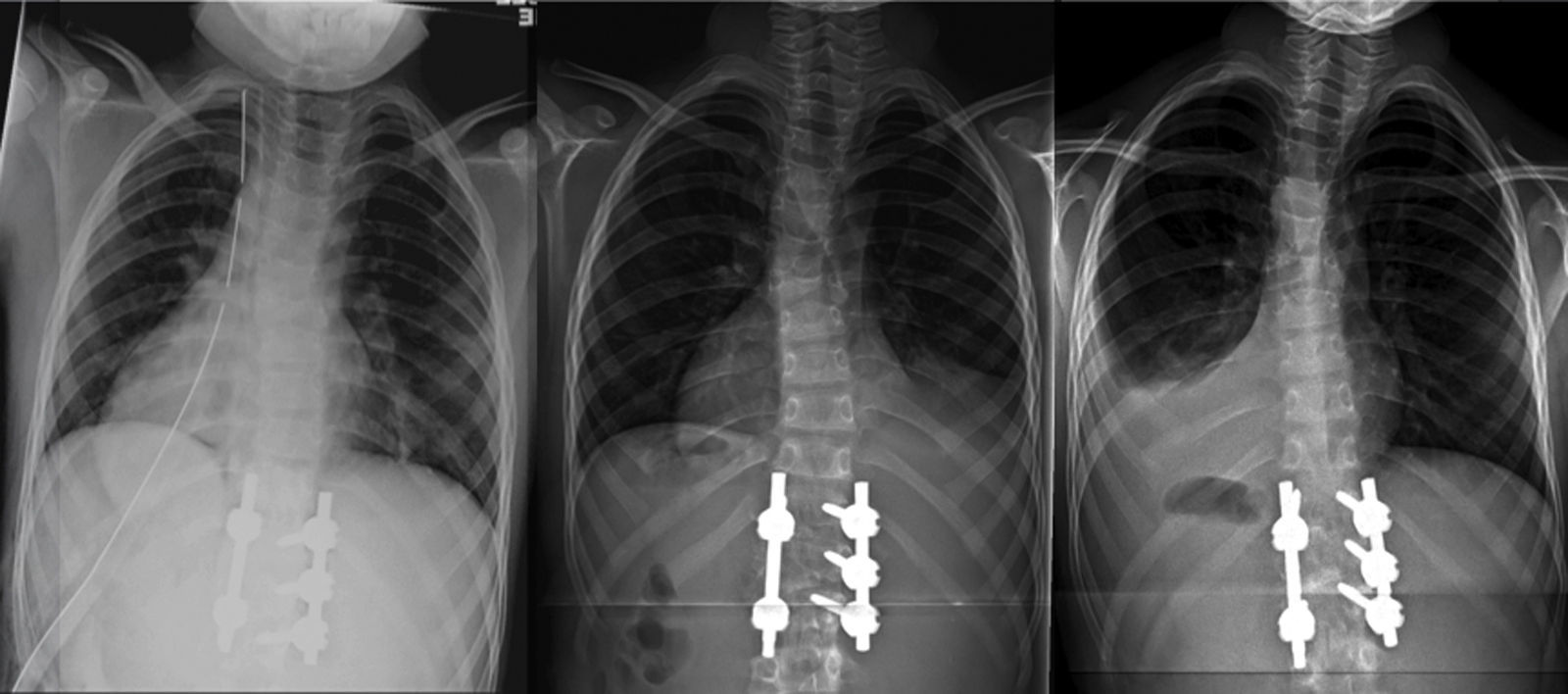
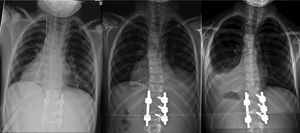
El paciente fue trasladado a UCI donde permaneció intubado las primeras 24 h, manteniendo la estabilidad hemodinámica y respiratoria. Una vez extubado, fue trasladado a la planta de hospitalización, sin complicaciones durante su estancia hospitalaria y con una saturación de oxígeno normal respirando aire ambiente. El drenaje torácico se mantuvo 48 h, y resultó improductivo (fig. 2a). El día del alta hospitalaria, a los 10 días de la intervención, se detectó un mínimo derrame pleural derecho en la radiografía de control postoperatorio en bipedestación, asintomático y que se interpretó como efusión reactiva (fig. 2b). Se prescribió una ortesis antiálgica blanda de uso diurno para las primeras 12 semanas del postoperatorio.
Evolución radiológica del tórax tras la intervención: a) postoperatorio inmediato, con el drenaje pleural, b) a los 10 días de la intervención, ya sin drenaje y con mínima efusión reactiva derecha, y c) a las 6 semanas, resolución completa de la efusión reactiva derecha y derrame pleural izquierdo con colapso pulmonar.
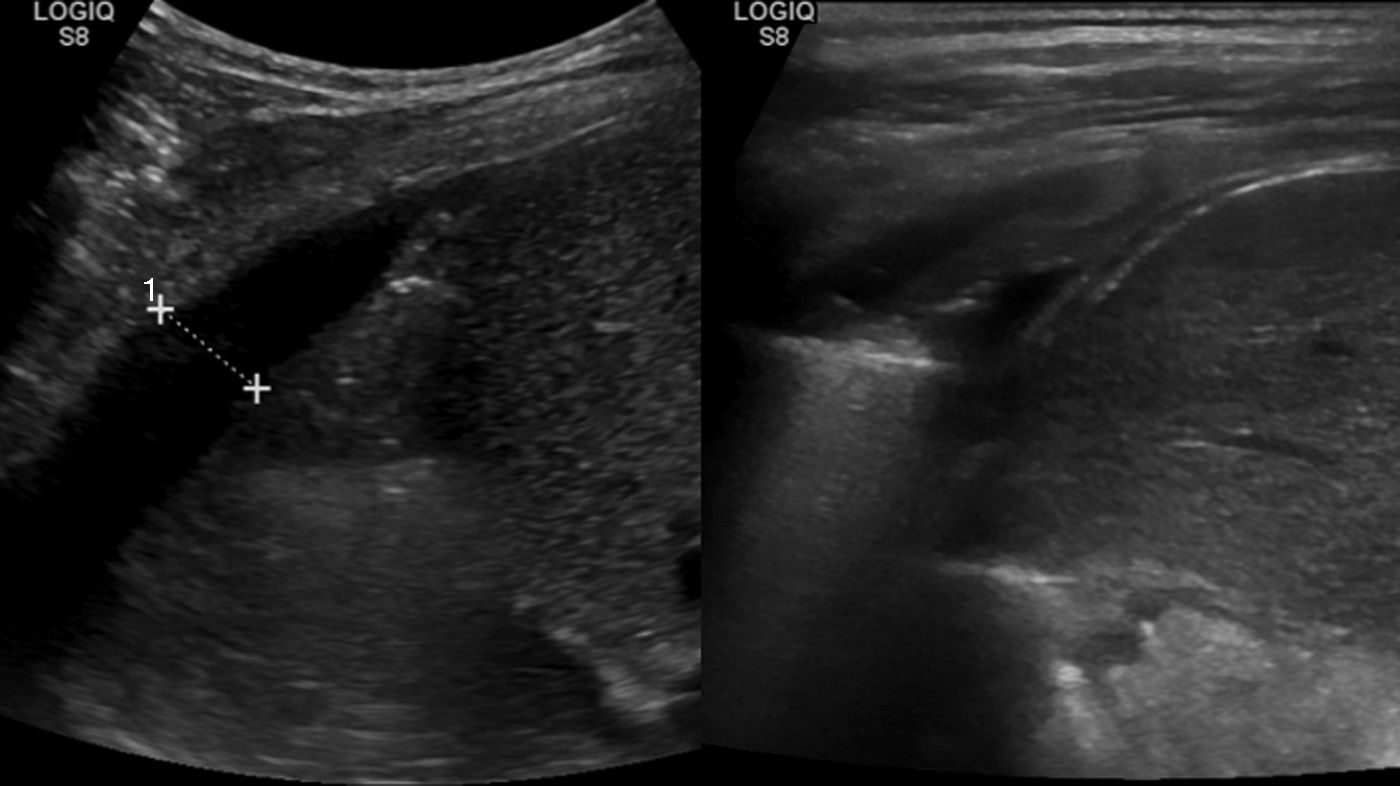
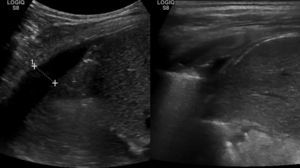
En el control ambulatorio a las 6 semanas, la radiografía en bipedestación mostró la resolución completa de la efusión reactiva derecha, pero un derrame pleural unilateral izquierdo, con colapso pulmonar (fig. 2c). La ecografía mostró una consolidación en el lóbulo inferior izquierdo, con pérdida de volumen y broncograma aéreo (fig. 3a), líquido subpulmonar de unos 5mm de profundidad y derrame pleural con profundidad máxima de 1,5cm.
A pesar de la ausencia de repercusión clínica (SO2 94% en aire ambiente), se optó por el ingreso del paciente para la realización de toracocentesis guiada por ecografía en quirófano bajo anestesia general, con resultado de un líquido lechoso denso con aspecto macroscópico de quilotórax. El resultado analítico apoyó el diagnóstico de quilotórax estéril, con un nivel de triglicéridos de 20,7 mmol/l (1.833mg/dL), proteínas totales 73g/l y glucosa 4,6 mmol/l (83mg/dL).
De acuerdo con los servicios de Radiología, Anestesia, Respiratorio y Cirugía Ortopédica, se decidió iniciar tratamiento dietético con dieta baja en grasas y mantener el drenaje torácico. El paciente mantuvo saturaciones de oxígeno del 97-100%, sin necesidad de oxigenoterapia. El drenaje inicial fue de 425mL, y durante los días posteriores osciló entre los 0 y los 250mL con disminución progresiva de la producción hasta la resolución completa del cuadro.
El control ecográfico a las 2 semanas fue normal (fig. 3b), y el paciente fue dado de alta tras la retirada del drenaje torácico a los 18 días, con introducción progresiva de grasa en la dieta y control normal a los 2 meses.
DiscusiónEl conducto torácico es el colector principal del sistema linfático, y drena ¾ partes de la linfa corporal al sistema venoso. Aunque tiene múltiples variantes anatómicas, en el 50% de la población se origina en la cisterna de Pecquet (cisterna chyli), que es la confluencia de vasos linfáticos retroperitoneales, tiene unos 6mm de diámetro y 16mm de longitud y está situada sobre la zona posteromedial derecha de la arteria aorta, a nivel de las arterias renales y los cuerpos vertebrales de L1 y L2. El conducto torácico ingresa en la cavidad torácica por el hiato aórtico y asciende entre la aorta y la vena ácigos. En su porción torácica, transcurre en la superficie anterior de los cuerpos vertebrales torácicos hasta que drena en la unión de las venas subclavia y yugular interna izquierdas2, con una diferencia de diámetro entre 2mm en su porción más caudal y 3,6mm en la porción terminal.
El quilo se genera en el sistema linfático del intestino delgado producto de la digestión grasa, y se compone de lípidos, electrolitos, proteínas, inmunoglobulinas y linfocitos (principalmente linfocitos T).
El quilotórax es una causa infrecuente de derrame pleural, típicamente unilateral en un 80% de los casos. A diferencia de los estudios antiguos, en que el origen más frecuente era la enfermedad oncológica (especialmente los linfomas no Hodgkin, que constituyen hasta el 60% de estos casos), en la actualidad la causa más frecuente es traumática (50% frente al 25% descrito previamente). Son causas conocidas de quilotórax traumático las fracturas vertebrales, hiperextensión brusca de la columna, traumatismos penetrantes, aumento de la presión intraabdominal en traumatismos cerrados, lesión iatrogénica durante abordajes a la cavidad abdominal o torácica, procedimientos invasivos no quirúrgicos como la colocación de catéteres centrales, e incluso accesos de tos o vómito por tracción del conducto a nivel de la cruz diafragmática2–4. La gran variabilidad anatómica favorece su lesión accidental durante la cirugía cervical, torácica o lumbar y, aunque la incidencia de quilotórax postraumático es baja (1-4%, y menos del 1% de las intervenciones de columna), su manejo puede llegar a ser complejo2,5.
La infrecuente lesión del conducto torácico, la cisterna chyli o los troncos linfáticos retroperitoneales, descrita por primera vez en 18756, produce drenaje de quilo hacia la cavidad torácica (quilotórax) o abdominal (quiloperitoneo)7. El diagnóstico se confirma por la típica secreción lechosa y opalescente, y la confirmación analítica del fluido, con características de exudado (aunque en quilotórax no traumáticos puede ser trasudado hasta en 1/3 de los casos8) con niveles de colesterol (CH) <200mg/dL y rico en triglicéridos (TG). El diagnóstico se confirma con niveles de TG superiores a 110mg/dL, y se excluye por debajo de 50mg/dL, pero en niveles intermedios se debe investigar la presencia de quilomicrones o cristales de colesterol. También es diagnóstica la relación CH/TG inferior a 13.
Hay que hacer el diagnóstico diferencial con el seudoquilotórax, de aspecto también lechoso pero que contiene >200mg/dL de CH y <110mg/dL de TG, con un ratio CH/TG mayor de uno, y se asocia a malnutrición9.
En cirugía lumbar baja con el diafragma intacto, el drenaje es atribuible a una lesión de la cisterna chyli, y se confina exclusivamente a la cavidad retroperitoneal. Cuando se intervienen niveles craneales a L1, se requiere la disección del diafragma, que pierde la capacidad de aislar ambas cavidades. En estos casos es difícil saber si el quilotórax es debido a una lesión de la cisterna con drenaje retroperitoneal y posterior fistulización a la cavidad torácica, o a una lesión primaria del conducto en su porción ascendente. La disección diafragmática per se no aumenta la tasa de quilotórax10.
La importancia clínica de este proceso estriba en que, sin diagnóstico precoz, puede derivar en insuficiencia respiratoria, disfunción nutricional e inmunológica y, en definitiva, un aumento de la morbimortalidad3.
El tratamiento con medidas conservadoras ha demostrado ser peor en pacientes con quilotórax no traumáticos, en los que solo resuelve una minoría de los casos, que en los de origen traumático, la mitad de los cuales consiguen la curación1.
El objetivo del tratamiento dietético es la disminución de la formación de quilo, que es de 1.500 a 2.000mL al día en adultos. Esto se puede conseguir evitando la circulación linfática con nutrición parenteral, o bien mediante fórmulas entéricas con <3% de TG de cadena larga3 con suplementación de TG de cadena media, que se absorben directamente a la circulación portal sin estimular el flujo linfático y preservan el aporte nutricional necesario para favorecer la consolidación ósea4,9. En ambos casos se debe mantener el drenaje torácico y hacer un tratamiento de soporte, con suplementación de vitaminas liposolubles y proteínas. Hay que considerar el riesgo de septicemia a partir de los 8 días de depleción de linfocitos T, que es mayor en pacientes con nutrición parenteral, y transcurrido este tiempo puede valorarse la quimioprofilaxis con antibioticoterapia de amplio espectro9.
Hay estudios sobre el uso de octreótido en perfusión continua o en bolos, que disminuye el flujo linfático mediante reducción de las secreciones gastrointestinales y flujo sanguíneo esplácnico, pero los resultados son inconsistentes3,9.
Tampoco hay consenso sobre la duración del tratamiento dietético, que en general debe mantenerse unas 2 semanas o hasta la resolución del quilotórax. Posteriormente, se puede reanudar una dieta normal. Algunos autores3 proponen una prueba de provocación con dieta de alto contenido en grasas antes de retirar el tubo torácico en casos complicados, para asegurarse de la completa resolución del cuadro. Debemos asumir un fracaso del tratamiento conservador y plantear la necesidad de la resolución quirúrgica en los siguientes escenarios: 1) drenaje excesivo durante más de 5 días, que supone >500ml/día en adultos y >10ml/kg/día (o >100ml/día por cada año de edad) en niños; 2) cualquier producción durante más de 14 días en adultos (en niños puede admitirse más tiempo); 3) aparición de signos de complicaciones metabólicas5,7,9.
Las opciones quirúrgicas son la pleurodesis, pleurectomía, ligadura del conducto torácico (realizada por primera vez en 1948)6 o su reparación, anastomosis linfovenosa (poco eficaz) y shunt pleuro-peritoneal en casos de no reexpansión pulmonar a pesar de la evacuación del líquido en aquellos casos en que no está indicada una cirugía más agresiva4. La elección de toracotomía abierta o toracoscopia depende de las preferencias y experiencia del cirujano. La embolización percutánea del conducto torácico es una opción cada vez más utilizada, con una tasa de complicaciones del 3% (edema crónico en miembros inferiores y diarrea crónica) y sin complicaciones fatales descritas en la actualidad9.
La respuesta al tratamiento quirúrgico es también peor en los quilotórax de origen no traumático, con mayor tasa de recurrencias y no resolución hasta en 1/3 de los casos1,9.
ConclusionesEl conocimiento de la anatomía del conducto torácico, así como sus posibles variantes anatómicas, es imprescindible para evitar su lesión iatrogénica en los abordajes anteriores a la columna toracolumbar.
El manejo del quilotórax traumático debe ser inicialmente dietético con soporte electrolítico y nutricional, y resuelve la mayoría de los casos. En casos complicados es preciso indicar su resolución quirúrgica en el momento idóneo para evitar el deterioro metabólico e inmunológico del paciente.
Nivel de evidenciaNivel de evidencia V.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ninguna relación financiera o personal con otras personas u organizaciones que pudieran dar lugar a un conflicto de intereses en relación con el artículo que se remite para publicación.