Analizar una serie de pacientes oncológicos tratados con prótesis modulares y evaluar: 1) Supervivencia del implante. 2) Causas de fracaso. 3) Tasa de reintervención. 4) Supervivencia del miembro. 5) Resultados funcionales y tiempo hasta la carga completa.
Materiales y métodosSe realizó una búsqueda retrospectiva en una base de datos oncológica entre marzo de 2001 y agosto de 2015 de pacientes con tumores óseos y pacientes con cirugía de revisión de trasplantes óseos reconstruidos con endoprótesis. Se incluyó a 106 pacientes con seguimiento mínimo de 2 años. Se dividió la población en 3 grupos: grupo 1, tumores óseos primarios; grupo 2, metástasis ósea; grupo 3, revisiones de trasplantes óseos masivos. Las causas de fracasos fueron clasificadas según Henderson et al. (2014) y la funcionalidad se evaluó según el la escala de la Musculoskeletal Tumor Society (MSTS). Se realizó análisis demográfico, estimación de la supervivencia y se compararon las diferencias entre grupos.
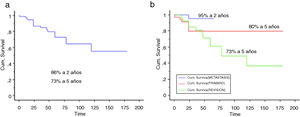
ResultadosEl seguimiento medio de los pacientes fue de 68 meses. La edad promedio fue de 43 años. La supervivencia global del implante fue del 86% a 2 años (IC 95%: 79-94) y del 73% a 5 años (IC 95%: 60-80). Diecinueve pacientes (18%) presentaron fracaso protésico, con revisión. La conservación del miembro en nuestra serie fue del 96% a 5 años(IC 95%: 91-99). Los resultados funcionales promedio según la escala de la MSTS fueron de 24 y el tiempo medio para carga completa de 2, 3 semanas.
ConclusiónLa cirugía de conservación de miembro representa el tratamiento de elección en pacientes con tumores óseos y la reconstrucción con endoprótesis resulta una alternativa válida, con índices de fracaso similares a otras reconstrucciones.
To analyze a series of patients with bone tumours reconstructed with modular prostheses and to evaluate: 1) Survival of the implant. 2) Causes of failure. 3) Complication rates. 4) Limb salvage overall survival. 5) Functional results and full weight bearing.
Materials and methodsA retrospective study from longitudinally maintained oncology databases was undertaken. All patients with bone tumours reconstructed with endoprosthesis were analysed. A toal of 106patients matched the inclusion criteria. They were divided into groups: group 1, primary bone tumours; group 2, bone metastasis; group 3, osteoarticular allograft reconstruction revisions. The type of failures were classified according to Henderson et al. (2014) and functional results assessed by the Musculoskeletal Tumor Society (MSTS). Demographic analysis, survival and the differences between groups were recorded.
ResultThe mean follow-up of the patients was 68 months. Mean age was 43 years. Overall implant survival was 86.4% at 2 years (95% CI: 79-94) and 73% at 5 years (95% CI: 60-80). Nineteen patients (18%) developed a prosthetic failure. The limb salvage overall survival was 96% at 5 years (95% CI: 91-99). The mean functional results according to the MSTS was 24 and mean time to full weight bearing was 2.3 weeks.
ConclusionsLimb conservation surgery and endosprosthetic reconstruction is a valid option for patients with bone tumours with failure rates similar to other reconstruction methods.
El tratamiento de los tumores musculoesqueléticos ha experimentado un cambio trascendental en las últimas décadas. A comienzos de 1970 el pilar de tratamiento para este tipo de tumores era la amputación, con tasas de supervivencia inferiores al 30%1,2. Con el advenimiento de la quimioterapia neoadyuvante y los avances en la terapia radiante, las tasas de supervivencia mejoraron de forma significativa, ascendiendo a valores del 60-70% a 5 años3,4. La cirugía de conservación de miembro representa en la actualidad el tratamiento de elección para la mayoría de estos pacientes. Numerosos estudios en la literatura muestran que no hay diferencias en términos de supervivencia entre los pacientes tratados con cirugía de conservación de miembro y aquellos que fueron amputados5-7. Se han descrito un gran número de opciones reconstructivas para el tratamiento de los defectos óseos posteriores a resecciones oncológicas, que incluyen reconstrucciones biológicas, protésicas o la combinación de ambas, como las aloprotesis8-11.
La reconstrucción con aloinjerto estructural posterior a la resección tumoral en miembros posibilita la conservación de mayor cantidad de stock óseo y restituir biomecánicamente el aparato flexoextensor y ligamentario, con la limitación de que se debe restringir la carga del miembro por un tiempo prolongado y demanda un período de rehabilitación es extenso y el riesgo de fracaso del trasplante ante la necesidad de tratamiento radiante adyuvante. En contraposición, las endoprótesis presentan mayores beneficios en aquellas personas con tumores de mal pronóstico o añosas, y permiten una deambulación temprana y cese del dolor. Beneficios y desventajas asociados a ellas han sido descritos para ambos procedimientos, pero existen controversias respecto a cuál es la mejor opción reconstructiva12-14. Históricamente, nuestra institución fue reconocida por el uso de los trasplantes óseos como técnica reconstructiva15-17. Sin embargo, desde el inicio del año 2000ha habido un importante aumento en la indicacion de endoprótesis en la cirugía de conservación del miembro18. El uso de las endoprótesis ha evolucionado en las últimas décadas y esto se debe principalmente a las mejoras de estos implantes. Las ventajas que presentan son la disponibilidad, flexibilidad para abordar defectos óseos variables, permitir una carga precoz y movilización temprana, con una rápida reincorporación de los pacientes a la vida diaria. Por otra parte, complicaciones como aflojamiento, luxación, desacople de los módulos del implante e infección siguen siendo una preocupación para el cirujano19,20.
El objetivo de nuestro trabajo fue analizar una serie de pacientes oncológicos tratados con endoprotesis modulares y evaluar:
Materiales y métodosSe realizó una búsqueda retrospectiva en nuestra base de datos oncológica de recolección longitudinal entre marzo de 2001 y agosto de 2015 de todos los pacientes reconstruidos con endoprótesis modular. Se incluyó en el estudio a pacientes esqueléticamente maduros, con enfermedad tumoral ósea primaria o secundaria, con un seguimiento mínimo de 24 meses para los pacientes vivos al momento del estudio. Se excluyó a todos aquellos operados por causa puramente reconstructiva o tratados en otra institución inicialmente. Las indicaciones del uso de endoprótesis modulares en pacientes oncológicos en nuestra institución fueron: pacientes con mala respuesta a la quimioterapia, con metástasis (con una supervivencia esperable mayor a 6 meses), en tratamiento con radioterapia adyuvante, pacientes añosos, en la región anatómica del fémur proximal y con cirugías reconstructivas secundarias a fracaso de trasplantes óseos masivos. Se utilizaron prótesis modulares con bisagra rotatoria y vástagos cementados. Las utilizadas fueron del fabricante Zimmer Biomet Spain S.L.U (Barcelona, España). Se dividió a la población en estudio en 3 grupos: grupo 1, constituido por pacientes con tumores primarios óseos malignos o benignos localmente agresivos; grupo 2, pacientes con metástasis óseas y grupo 3, pacientes reconstruidos con una endoprótesis modular por fracaso de trasplantes óseos masivos.
Se analizaron las siguientes variables:
- •
Supervivencia del implante de acuerdo con el método de Kaplan-Meier.
- •
Causas de fracaso de la cirugía de conservación del miembro de acuerdo con lo establecido en la clasificación de Henderson et al. (2014). Esta consta de 5 tipos. Del 1 al 3 son fracasos mecánicos. Los tipos 4 y 5 son fracasos no mecánicos. Tipo 1: fracaso de tejidos blandos (1A: fracaso funcional; 1B: fracaso de cobertura). Tipo 2: aflojamiento aséptico (2A:<a 2 años; 2B:> a 2 años). Tipo 3: fracaso estructural (3A: rotura o desgaste del implante; 3B: fractura periprotésica). Tipo 4: infección que requiera recambio protésico (4A: <a 2 años; 4B:> a 2 años). Tipo 5: recurrencia o progresión tumoral en contacto con la prótesis (5A: partes blandas; 5B: ósea).
- •
Tasa de reintervención por complicaciones.
- •
Tasa de conservación del miembro.
- •
Resultados funcionales según el score de MSTS, el cual asigna un valor máximo de 30 puntos y mínimo de 0 puntos. El tiempo a la carga se analizó desde el primer día postoperatorio hasta el momento en que el paciente deambulaba cargando el 100% de su peso.
- •
La supervivencia fue analizada utilizando el método de Kaplan-Meier. El analisis demográfico de los grupos se evaluó mediante la prueba t de Student. Las diferencias en los grupos se compararon mediante la prueba log-rank. Para el análisis estadístico se utilizó el software STATVIEW. Se consideró estadísticamente significativa una p <0,05.
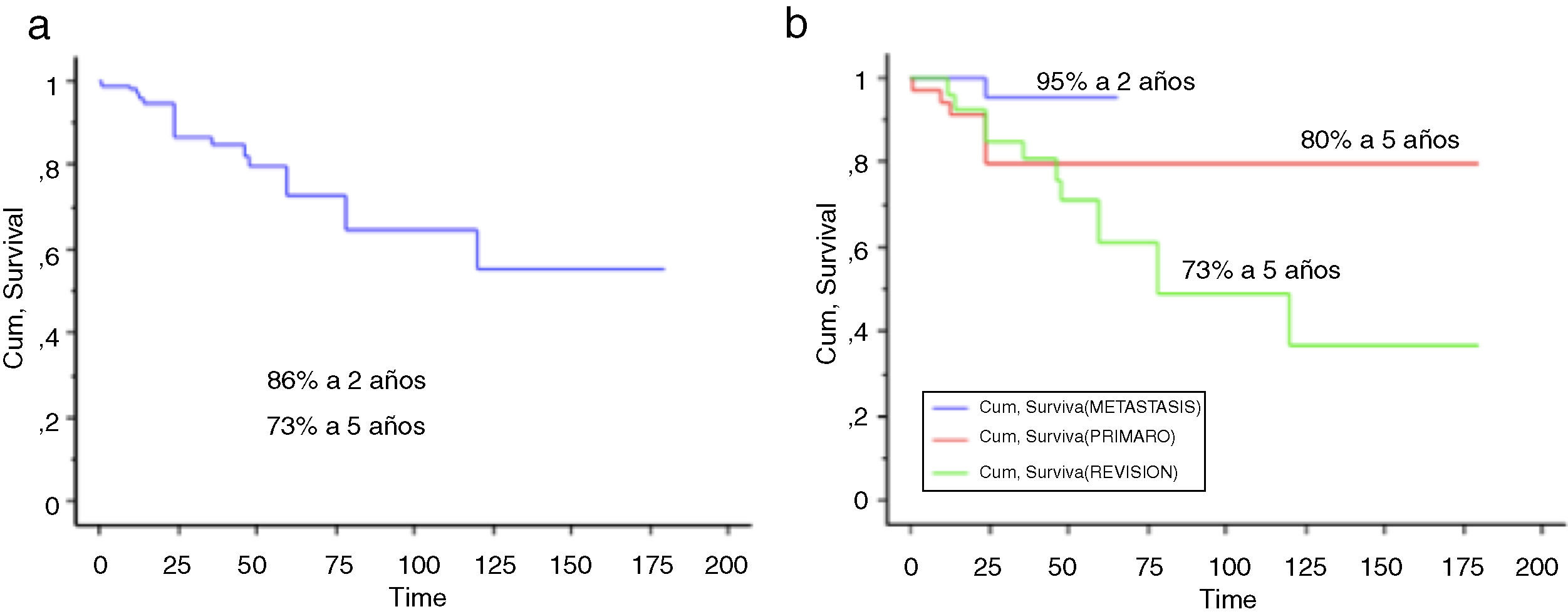
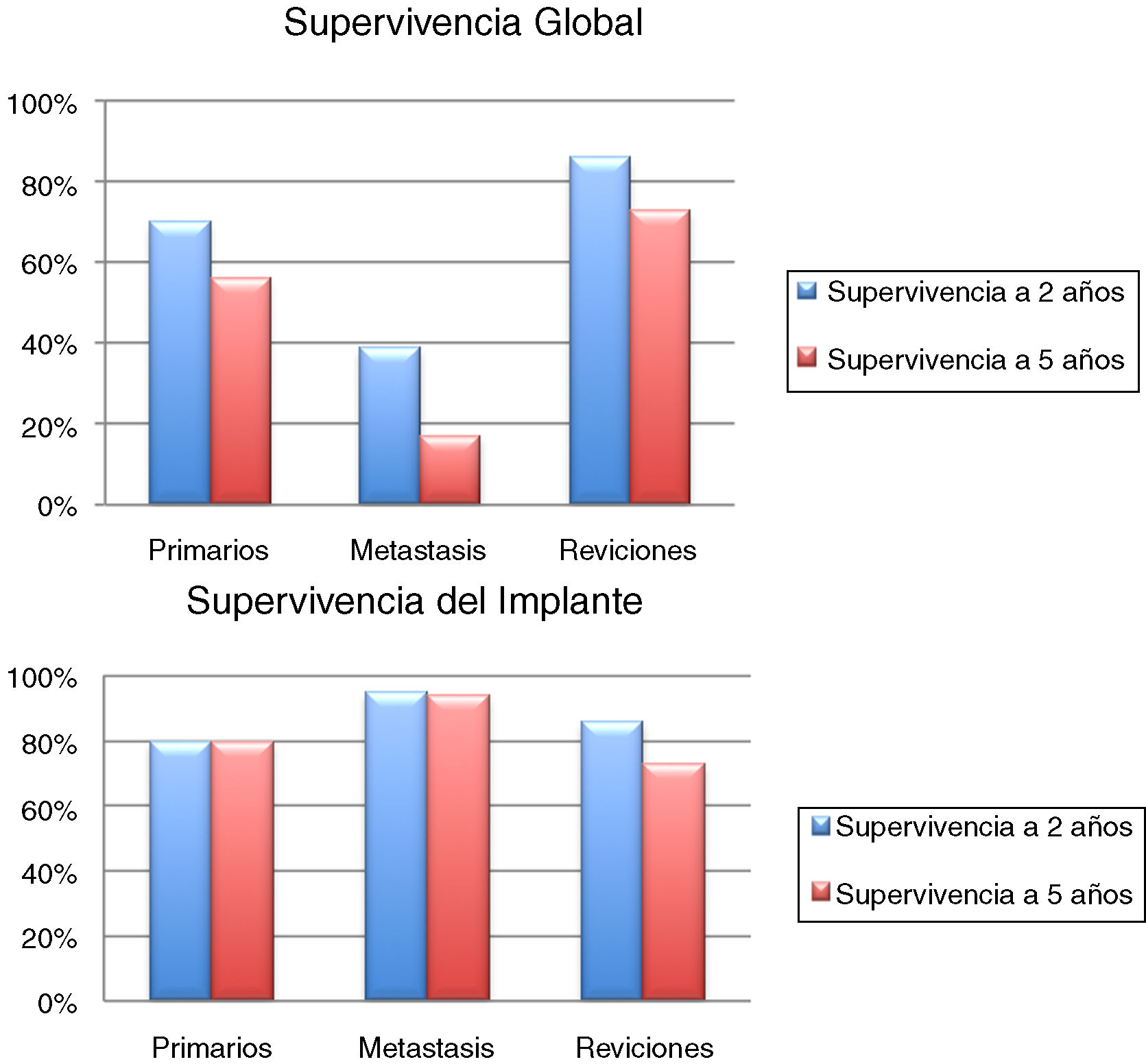
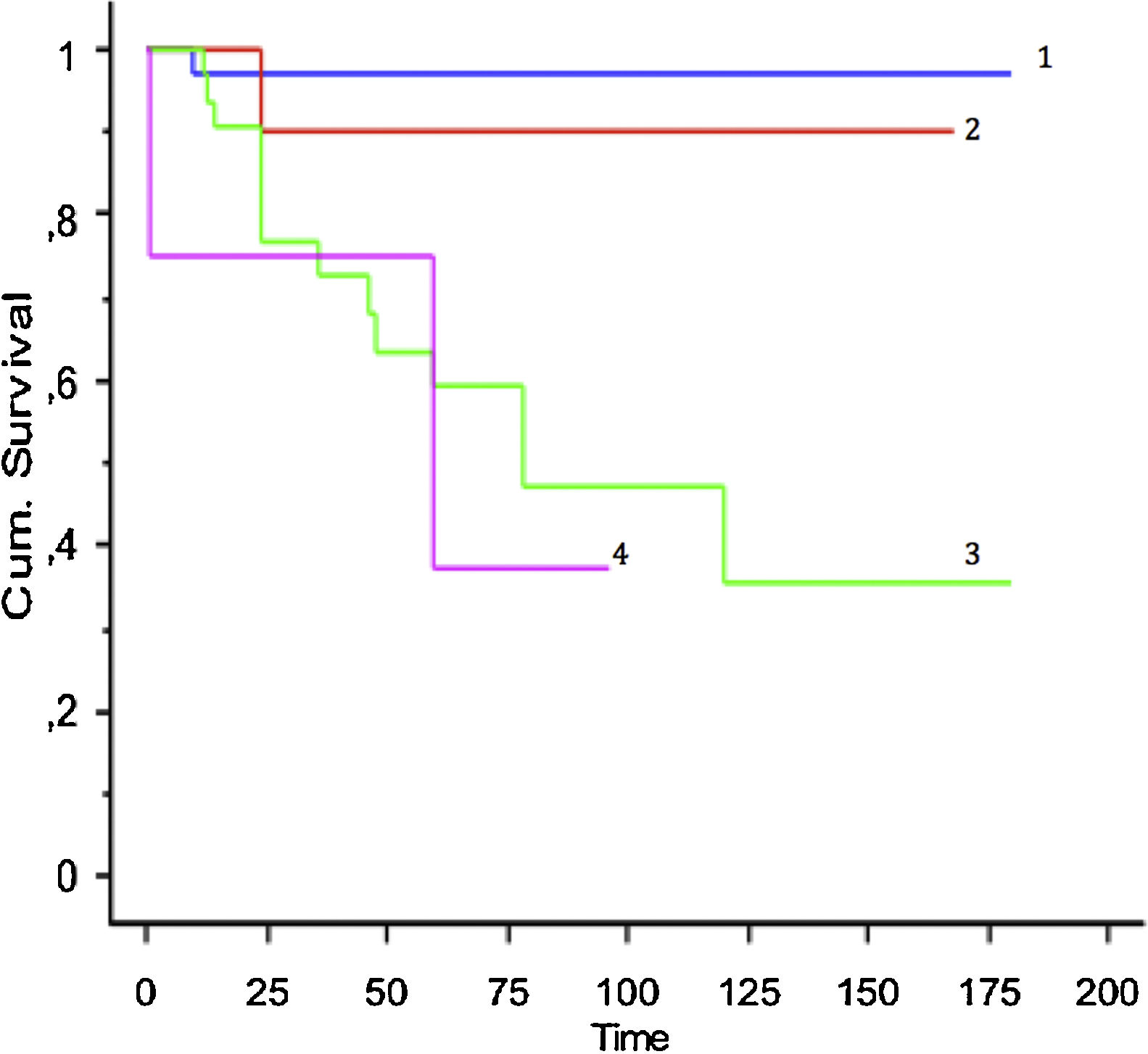
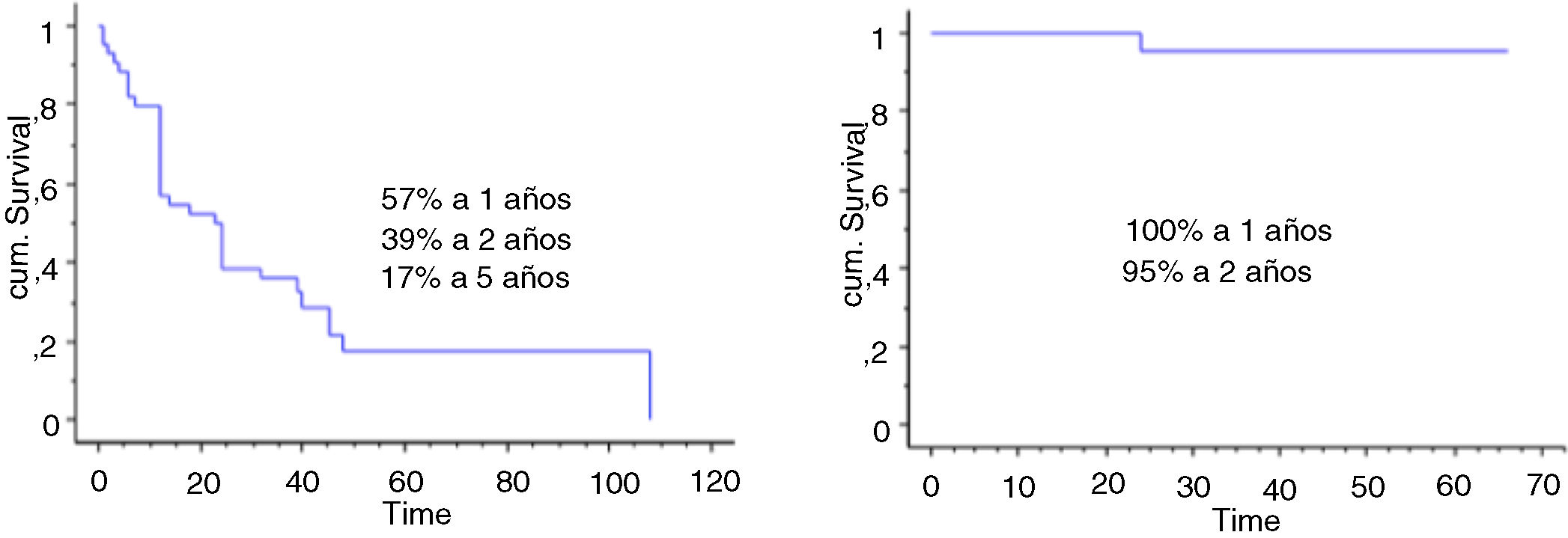
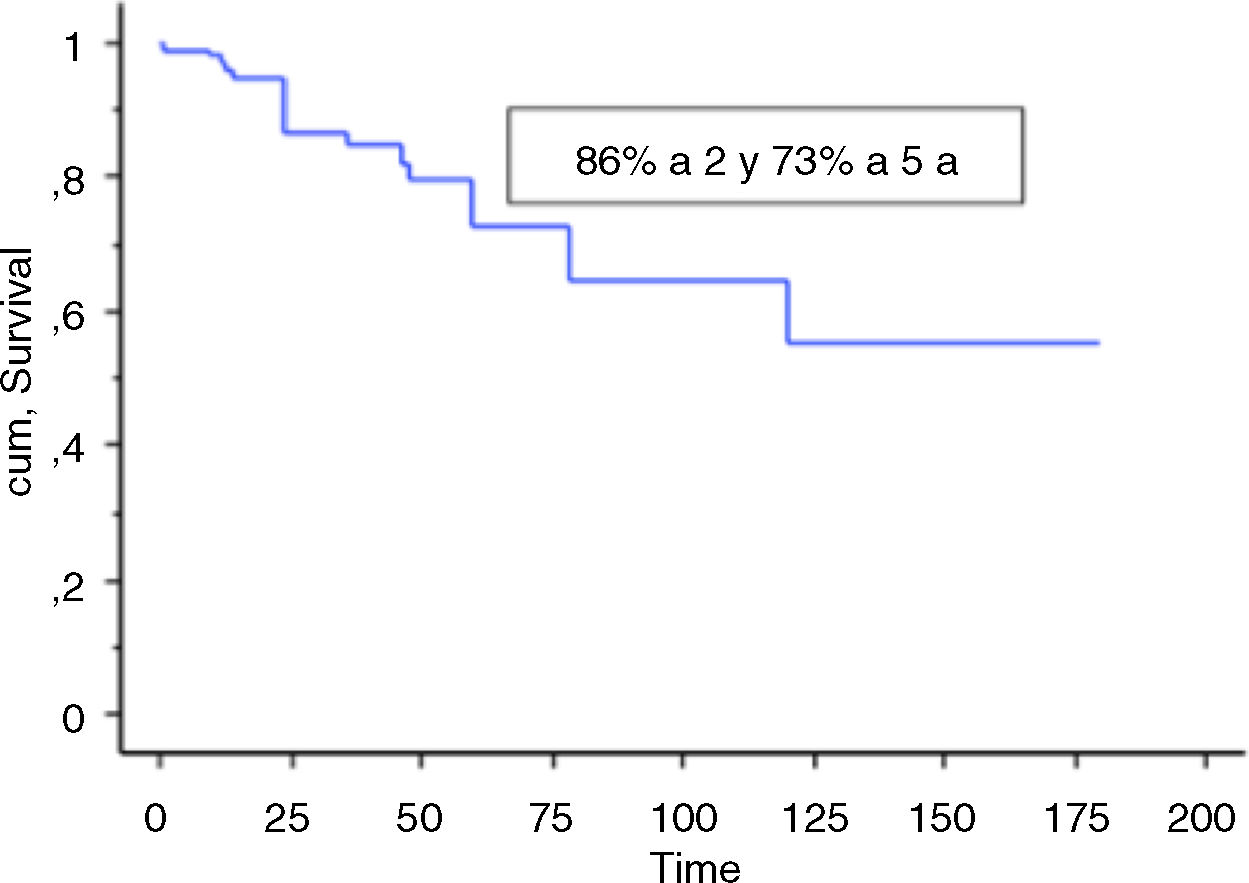
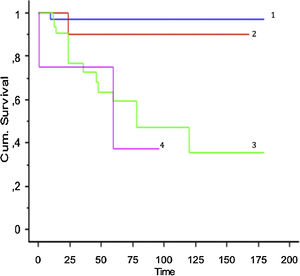
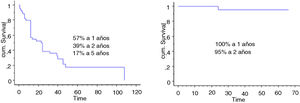
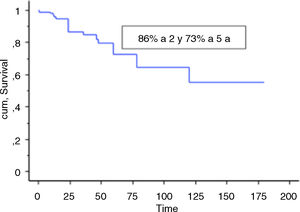
Se incluyó en el estudio a un total de 106 pacientes con tumores óseos tratados con endoprótesis modulares. La edad media de la serie fue de 48,5 (IC 95% rango: 14-89) y el seguimiento promedio del paciente de 68 meses (IC 95% rango: 24-288). La supervivencia global del implante en nuestra serie fue de 86,4% a 2 años (IC 95%: 79-94) y de 73% a los 5 años (IC 95%: 60-80) (figs. 1-3). Según el sitio anatómico, la supervivencia de la reconstrucción en la cadera fue del 97% a 5 años (IC 95%: 91-102), en el húmero del 90% a 5 años (IC 95%: 77-103) y en la rodilla del 60% a 5 años (IC 95%: 40-78) (fig. 4).
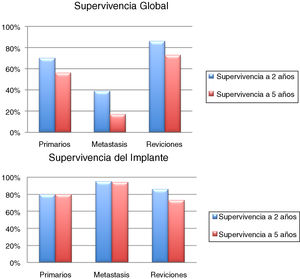
a) La supervivencia global del implante fue del 86,4% a 2 años (IC 95%: 79-94) y del 73% a los 5 años (IC 95%: 60-80). b) La supervivencia global del implante por grupos: primarios: 80% a los 2 y 5 años (IC 95%: 65-94,4); metástasis: 95% a los 2 años; revisiones: 73% a los 5 años (IC 95%: 60-80).
El tamaño de la resección no ha resultado ser un factor pronóstico para los fracasos de las reconstrucciones protésicas (p: 0,2). Cirugía primaria vs. cirugía de revisión no se ha asociado con un mayor índice de fracaso del implante (p: 0,21).
La tasa de conservación del miembro en toda la serie fue del 96% a 5 años (IC 95%: 91-99). El tiempo medio para carga completa de los pacientes fue de 2,3 semanas (rango 2-5).
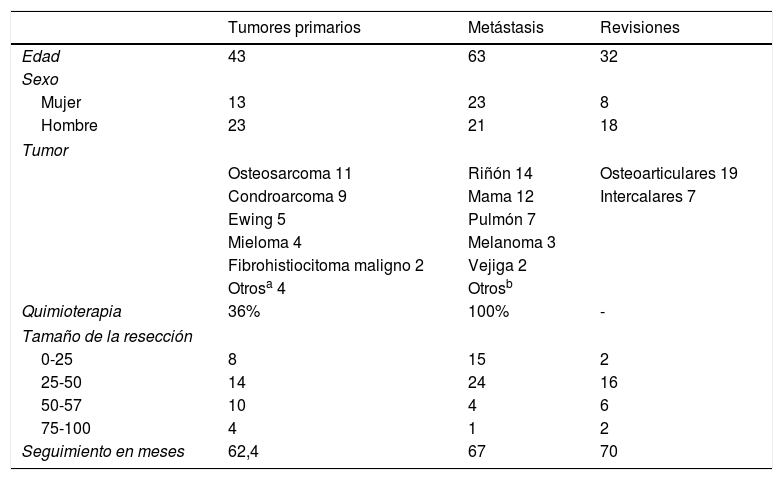
Grupo 1 Tumores óseos primarios: se incluyó a 36 pacientes. La edad media de la serie fue 43 años (rango 14 -81) y el seguimiento promedio de 62,5 meses (rango 24-180 meses). Las características demográficas de la serie se resumen en la tabla 1. El sitio anatómico más frecuente fue el fémur proximal (33%), seguido del húmero proximal (19%), luego el fémur distal (8%) y la tibia proximal (8%) (tabla 2).
Resultados demográficos
| Tumores primarios | Metástasis | Revisiones | |
|---|---|---|---|
| Edad | 43 | 63 | 32 |
| Sexo | |||
| Mujer | 13 | 23 | 8 |
| Hombre | 23 | 21 | 18 |
| Tumor | |||
| Osteosarcoma 11 | Riñón 14 | Osteoarticulares 19 | |
| Condroarcoma 9 | Mama 12 | Intercalares 7 | |
| Ewing 5 | Pulmón 7 | ||
| Mieloma 4 | Melanoma 3 | ||
| Fibrohistiocitoma maligno 2 | Vejiga 2 | ||
| Otrosa 4 | Otrosb | ||
| Quimioterapia | 36% | 100% | - |
| Tamaño de la resección | |||
| 0-25 | 8 | 15 | 2 |
| 25-50 | 14 | 24 | 16 |
| 50-57 | 10 | 4 | 6 |
| 75-100 | 4 | 1 | 2 |
| Seguimiento en meses | 62,4 | 67 | 70 |
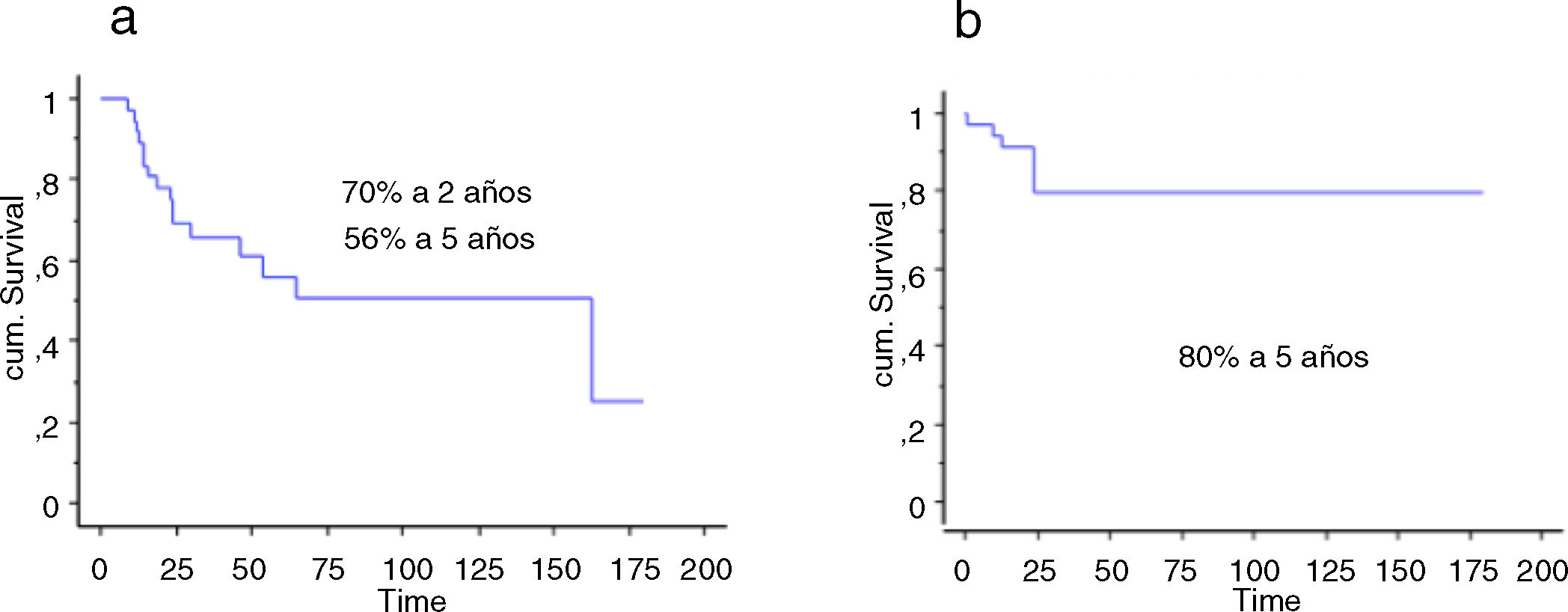
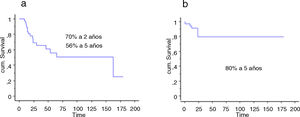
La supervivencia global de los pacientes a los 2 años fue del 70% (IC 95%: 54 -84), y a los 5 años del 56% (IC 95%: 71-70). La supervivencia a 2 y 5 años del implante fue del 80% (IC 95%: 65-94,4) (fig. 5). La quimioterapia adyuvante resultó ser un factor de riesgo para la fracaso de la reconstrucción (p <0,01); no así el tamaño de la resección (p: 0,2) ni la presencia de una fractura patológica (p: 0,67).
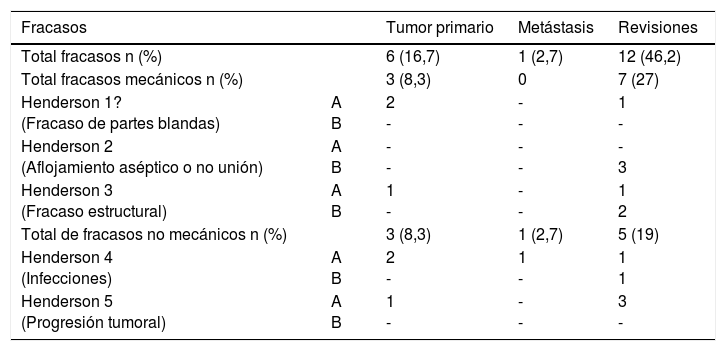
Tres fracasos fueron clasificados como mecánicos (2 tipo 1A, uno tipo 3A) y 3 como no mecánicos (2 tipo 4A, uno tipo 5A). El tiempo medio a la fracaso fue de 16 meses (rango: 1-24). Diecisiete de los 36 pacientes (47,2%) debieron ser tratados mediante al menos un nuevo procedimiento quirúrgico producto de una complicación (total 22 procedimientos). Las causas fueron: recurrencia local (9), infección (5) y luxaciones (5). La tasa de conservación del miembro fue de 94,4% (IC 95%: 91-99). La evaluación funcional según el MSTS fue de 26 puntos (rango: 20-29).
Grupo 2 Metástasis óseas: 44pacientes fueron incluidos en este grupo. La edad promedio fue de 63 años (rango 34-89). La media de seguimiento fue 67 meses (rango 24-170). Las características demográficas de la serie se resumen en la tabla 1. El sitio anatómico más frecuente fue el fémur proximal (21/44 pacientes; 48%), luego el húmero proximal (16/44 pacientes; 36%), seguido del fémur distal (3/44 pacientes; 9%) (tabla 2).
La supervivencia global de los pacientes fue del 57% a un año (IC 95%: 42 y 51), 39% a 2 años (IC 95%: 24 y 73) y 17% a los 5 años (IC 95%: 24 -30). La supervivencia del implante en este grupo fue del 100% a los 12 meses y del 95% a los 24 meses (IC 95%: 87-100) (fig. 6). El único paciente que fracasó fue por una infección aguda (Henderson 4A). Seis de los 44 pacientes (14%) tuvieron que ser tratados mediante al menos un nuevo procedimiento producto de una complicación (total 7 procedimientos). Las causas fueron: luxación (n=4) e infección (n=3). La tasa de conservación del miembro en este grupo fue del 100%. La evaluación funcional según el MSTS fue de 24/30 (rango: 19-29).
Grupo 3 Revisión de trasplantes óseos masivos. Se incluyó a 26 pacientes en este grupo, con una edad promedio de 32,5 años (rango: 14-76) y un seguimiento promedio de 70 meses (rango: 12-180). Las reconstrucciones primarias fueron 7 trasplantes intercalares y 19 trasplantes osteoarticulares.
La supervivencia del implante fue del 86% a 2 años (IC 95%: 79-94) y del 73% a 5 años (IC 95%: 60-83). Doce reconstrucciones fracasaron; la causa mecánica fue la más prevalente (n=7) y, dentro de estas, el aflojamiento aséptico (Henderson tipo 2A) fue la más frecuente (n=3). Las demás fracasos se detallan en la tabla 3. Catorce de los 26 pacientes (58%) tuvieron que ser tratados con al menos un nuevo procedimiento quirúrgico, producto de una complicación, con un total de 27 procedimientos. Las causas fueron: infección (n=8), rotura del implante (n=3), recurrencia tumoral (n=4), aflojamiento (n=3) y luxación (n=3).
Tipo de fracaso protésico según Henderson et al
| Fracasos | Tumor primario | Metástasis | Revisiones | |
|---|---|---|---|---|
| Total fracasos n (%) | 6 (16,7) | 1 (2,7) | 12 (46,2) | |
| Total fracasos mecánicos n (%) | 3 (8,3) | 0 | 7 (27) | |
| Henderson 1? (Fracaso de partes blandas) | A B | 2 - | - - | 1 - |
| Henderson 2 (Aflojamiento aséptico o no unión) | A B | - - | - - | - 3 |
| Henderson 3 (Fracaso estructural) | A B | 1 - | - - | 1 2 |
| Total de fracasos no mecánicos n (%) | 3 (8,3) | 1 (2,7) | 5 (19) | |
| Henderson 4 (Infecciones) | A B | 2 - | 1 - | 1 1 |
| Henderson 5 (Progresión tumoral) | A B | 1 - | - - | 3 - |
Fuente: Henderson et al. (2014)21.
De acuerdo con la evaluación MSTS, el resultado funcional promedio fue de 24 puntos (rango: 17-28).
DiscusiónLa cirugía de conservación de miembro representa el tratamiento de elección para los pacientes con tumores óseos malignos y locamente agresivos. A pesar de que se han descrito múltiples técnicas reconstructivas, no existe evidencia en la literatura de que una técnica sea superior a otra. Albergo et al. compararon 133 pacientes con reconstrucciones de tibia proximal con trasplantes óseos masivos y endoprótesis, sin hallar diferencias en las tasas de fracaso a 5 y 10 años23. En las últimas décadas, el uso de endoprótesis para reconstruir grandes defectos óseos segmentarios ha ganado aceptación entre los cirujanos ortopédicos. Esto se debe a los avances en las terapias adyuvantes para el tratamiento de los pacientes oncológicos, a la mejoría de los diseños protésicos y a su disponibilidad, al progreso en las técnicas quirúrgicas y al aumento de la experiencia de los cirujanos. Myers et al. analizan el seguimiento a largo plazo de las endoprótesis de fémur distal, en las que el riesgo de revisión por aflojamiento aséptico de las prótesis abisagradas fue del 35%, con las constreñidas sin collar de hidroxiapatita del 24% y de 0% para aquellas con collar de hidroxiapatita24.
Las tasas de supervivencia de las endoprótesis varían según la localización, desde el 54% en tibia proximal hasta un 90% en fémur proximal25,26. Zeegen et al. analizaron a 141 pacientes tratados con endoprótesis y comunicaron una supervivencia global del implante del 88% a 3 años y de 76% a los 5 años, con una tasa de supervivencia a 3 años en la cadera y en el hombro del 100%, mientras que en la rodilla fue del 87% y en el fémur total del 53%27. La supervivencia global del implante en nuestra serie fue del 86% a 2 años y de 73% a los 5 años. Según el sitio anatómico, en la cadera fue de 97% a 5 años, en el húmero 90% y en la rodilla de 60%. Creemos que estos hallazgos son concordantes con los índices de supervivencia correspondientes en los estudios publicados en la literatura. En cuanto al análisis de la supervivencia del implante en cada grupo en particular, encontramos que el grupo de pacientes con metástasis presentó mejores índices con relación a los 2grupos restantes (100% al año y 95% a los 2años). Sin embargo, debemos resaltar que este hallazgo está en relación con la baja supervivencia global de estos pacientes, que fue del 17% a 5 años28. Acorde a la clasificación de Henderson et al., 19 fracasos de implantes han sido descritos en nuestra serie, con los de tipo mecánico como los más prevalentes. Los sitios más frecuentes de fracaso fueron el fémur distal y tibia proximal. De los fracasos mecánicos, los de partes blandas, tipo 1 de la clasificación, se presentaron pricipalmente en la cadera y en el hombro, lo que refleja la inestabilidad intrínseca de estas articulaciones19. Unwin et al. describieron los resultados de 1.001 endoprotesis con aflojamiento aséptico como resultado final y comunicaron que el fracaso de la prótesis fue más frecuente en el fémur distal, con un 9,9% de revisiones29.
El 47% de los pacientes con tumores primarios, el 58% de los pacientes revisados por trasplantes óseos masivos fracasados y el 13% de los pacientes con metástasis tuvieron que ser reintervenidos por una complicación. La infección fue la principal causa de reintervención en la suma de los 3grupos. Sin embargo, en nuestra serie los fracasos de las endoprótesis de causa infecciosa representaron menos del 8%. Jeys et al. han comunicado una tasa del 11% de infección periprotésica en una serie de 1.264 pacientes oncológicos tratados con endoprótesis en un periodo de 37 años30.
Si bien era esperable que las cirugías de revisión secundarias a un trasplante óseo masivo fallido presentaran una mayor tasa de complicaciones que las cirugías primarias, la tasa de fracaso del implante entre estos 2grupos no fue estadísticamente significativa (p: 0,21), lo cual también fue comunicado por Zeegen et al.27.
Grimer et al., en su trabajo de seguimiento a muy largo plazo luego de reemplazo con endoprótesis para tumores malignos óseos, comunicaron un promedio de 2,7 reintervenciones por paciente. Sin embargo, el riesgo de amputación a 30 años fue del 16% y la mayoría de los pacientes conservaron su miembro31. En nuestra serie, la tasa de conservacion del miembro fue 96% a 5 años.
Nuestro trabajo presenta ciertas limitaciones: el corto plazo de seguimiento, el diseño retrospectivo y la heterogeneidad de la muestra.
ConclusiónLa cirugía de conservación de miembro representa el tratamiento de elección en pacientes con tumores óseos y la reconstrucción con endoprótesis resulta una alternativa válida, con índices de fracaso similares a otras reconstrucciones.
Nivel de evidenciaNivel de evidencia III.
Conflicto de interesesLos autores declaran no presentar conflictos de intereses.