Los sarcomas de partes blandas se localizan excepcionalmente en la región del codo. El objetivo de este trabajo fue estudiar los sarcomas de partes blandas de la región del codo, sus características epidemiológicas e histopatológicas, particularidades anatómicas, tratamiento realizado y resultados obtenidos, en una Unidad de Tumores Musculoesqueléticos.
Materiales y métodosRevisión retrospectiva de 10 pacientes con un seguimiento de 65,0 ± 11,9 (rango 21-132) meses con sarcoma de partes blandas situado en la región del codo, intervenidos en nuestro centro entre los años 2008 y 2016.
ResultadosLa edad media fue de 60,8 ± 6,7 años. La histología más frecuente fue sarcoma pleomórfico indiferenciado. El 90% de los pacientes fueron sometidos a cirugía de preservación de extremidad. Tres pacientes fueron previamente intervenidos sin criterios oncológicos en otro centro, y esto se relacionó de forma estadísticamente significativa con requerir más de una cirugía para el control de la enfermedad. En cinco pacientes se obtuvo un margen R1 y en cinco R0. La radioterapia adyuvante se utilizó en siete casos. En cuatro pacientes se realizó cirugía posterior para control local o sistémico de la enfermedad. En tres casos se produjo recidiva local y en cinco se presentó enfermedad a distancia.
ConclusionesLa región del codo presenta dificultad para lograr márgenes amplios por la proximidad de estructuras neurovasculares, por lo que las terapias adyuvantes, neoadyuvantes (o ambas) podrían tener un papel importante para poder realizar una cirugía de preservación de la extremidad. Sería recomendable remitir estos tumores a unidades especializadas con equipos multidisciplinarios.
Soft tissue sarcomas are exceptionally located in the elbow region. The aim of this work was to study the soft tissue sarcomas of the elbow region, their epidemiological and histopathological characteristics, anatomical features, the treatment performed, and the results obtained, in a unit of musculoskeletal tumours.
MethodsRetrospective review of ten patients with a mean follow-up of 65.0 ± 11.9 (range 21-132) months with soft tissue sarcomas located in the elbow region operated in our centre between 2008 and 2016.
ResultsMean age was 60.8 ± 6.7 years. Undifferentiated pleomorphic sarcoma was the most frequent histological diagnosis. Limb preservation surgery was performed in 90% of patients. Three patients were previously operated without following surgical oncology guidelines in another hospital, and this was statistically related to the need for more than one surgery to control the disease. R1 margin was obtained in 5 patients and R0 in another 5. Adjuvant radiotherapy was used in 7 cases. In 4 patients, subsequent surgery was performed for local or systemic control of the disease. Local recurrence occurred in 3 cases and in 5 there was distant disease.
ConclusionThe elbow region presents difficulty in achieving wide margins due to the proximity of neurovascular structures, adjuvant and / or neoadjuvant therapies could play an important role in performing limb preservation surgery. It would be advisable to refer these tumours to specialized units with multidisciplinary teams.
En Europa, la incidencia aproximada de sarcomas de partes blandas en adultos es de 4-5/100.000 al año1. Del total de sarcomas de partes blandas, se estima que solo un 14% afectan las extremidades superiores2. La afectación de la región del codo es excepcional y representa solo el 1% del total de sarcomas3.
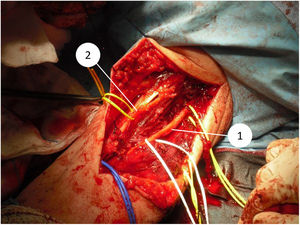
En el año 2015 Halai et al. publicaron la serie más extensa de tumores óseos de la región del codo tratados de forma quirúrgica4. Hasta ahora, no hemos encontrado trabajos publicados que hagan referencia de forma específica a sarcomas de partes blandas en la región del codo. La importancia de estudiar el codo de manera particular radica en la complejidad anatómica que supone la presencia de estructuras vasculonerviosas importantes muy cercanas entre sí (nervio mediano y arteria braquial con su división en arteria cubital y arteria radial en la parte anterior, nervio cubital en el borde medial y nervio radial en el borde lateral) y la escasa cantidad de partes blandas, sobre todo en la parte posterior. Esto puede dificultar la resección con un margen oncológico amplio, ya que se pueden afectar estas estructuras neurovasculares y las opciones de cobertura y reconstrucción5,6. Además, se ha descrito que a nivel del codo suele haber mayores tasas de enfermedad residual y, por lo tanto, mayor incidencia de recidiva local7. Los sarcomas extracompartimentales en el miembro superior, entre los que se encuentran los tumores de la fosa antecubital, se asocian con una mayor tasa de recidiva local y metástasis a distancia, así como con una tasa menor de supervivencia6.
El objetivo de este trabajo fue estudiar los sarcomas de partes blandas de la región del codo, sus características epidemiológicas e histopatológicas, particularidades anatómicas, el tratamiento realizado y los resultados obtenidos, en una Unidad de Tumores Musculoesqueléticos.
Material y métodosEstudio retrospectivo, analítico, observacional de los tumores malignos de partes blandas de la región del codo intervenidos en nuestro centro entre los años 2008 y 2016. Se revisaron los 533 pacientes presentados en el Comité multidisciplinario de tumores musculoesqueléticos en este periodo y se seleccionaron los pacientes siguiendo los siguientes criterios de inclusión: 1) sarcomas de partes blandas localizados entre el epicóndilo medial y lateral como límite proximal y la parte distal de la cabeza de radio y el olecranon como límite distal4; 2) intervenidos de forma primaria o secundaria en nuestro centro entre 2008 y 2016. Criterios de exclusión: 1) sarcomas en otras localizaciones; 2) tipos histológicos con comportamiento especial: dermatofibrosarcoma protuberans, tumor desmoide o rabdomiosarcoma; 3) tumores cuyo diagnóstico anatomopatológico definitivo fue de benignidad; 4) tumores de estirpe ósea; 5) metástasis de tumores primarios de otras localizaciones. El tamaño de la muestra viene determinado por estos criterios de inclusión. Se incluyeron en el estudio 10 pacientes con un seguimiento medio de 65,0 ± 11,9 meses (rango 21-132 meses). Todos los pacientes fueron evaluados antes de la intervención por el Comité multidisciplinario de tumores musculoesqueléticos de nuestro hospital. Todos los pacientes firmaron consentimiento informado para los distintos procedimientos diagnósticos y terapéuticos.
Los datos analizados se obtuvieron de la historia clínica: 1) sexo y edad; 2) características clínicas del tumor: lateralidad, ubicación dentro de la región del codo, antecedente de cirugía previa sin criterios oncológicos y estadificación según la American Joint Committee on Cancer Staging System (AJCC); 3) resultado anatomopatológico de la pieza quirúrgica; 4) tratamiento realizado (quirúrgico y/o adyuvante o neoadyuvante a la intervención) y 5) tiempo de seguimiento, recidiva local o sistémica, fallecimiento (y momento en el que se produjo).
Los pacientes que consultaron de forma primaria en nuestra unidad fueron estudiados mediante biopsia de aguja gruesa (seis pacientes). El trayecto de la biopsia fue discutido previamente en el Comité multidisciplinario de tumores musculoesqueléticos para asegurar la extirpación del mismo en la cirugía posterior. Tras la intervención se analizó la pieza quirúrgica. En los pacientes intervenidos previamente en otro hospital se solicitaron las muestras a sus hospitales de origen, para su valoración por parte del equipo de anatomía patológica de nuestro centro.
Histológicamente, los tumores fueron registrados siguiendo la clasificación de la OMS para tumores musculoesqueléticos de partes blandas (cuarta edición del 2013)8. También se utilizó el sistema de la Fédération Nationale des Centres de Lutte Contre le Cancer (FNCLCC) que los divide en tumores G1, G2 o G3, según el grado de diferenciación, número de mitosis por campo y porcentaje de necrosis.
El tratamiento quirúrgico principal fue definido como la primera intervención quirúrgica realizada en nuestro centro. Se dividió en amputación o cirugía de preservación de la extremidad. Se registró también la necesidad de cooperación por otras especialidades: cirugía plástica, cirugía vascular, o ambas. Aquellas intervenciones quirúrgicas realizadas de manera adicional o secundaria a la cirugía principal (ampliación de márgenes, tratamiento de recidiva local o manejo de metástasis), fueron consideradas como cirugía posterior.
El nivel de afectación de los márgenes de la pieza quirúrgica se determinó según la clasificación de la Union for International Cancer Control (UICC) que define como R0 un margen libre de enfermedad ≥ 1 mm, R1 un margen < 1 mm y como R2 a la presencia de contaminación macroscópica de los bordes9. La clasificación utilizada, a diferencia de la clasificación R, resulta más exigente ya que precisa de un margen libre mayor o igual a 1 mm para ser definido como R09.Se registró también el uso de quimioterapia y/o radioterapia como tratamiento adyuvante.
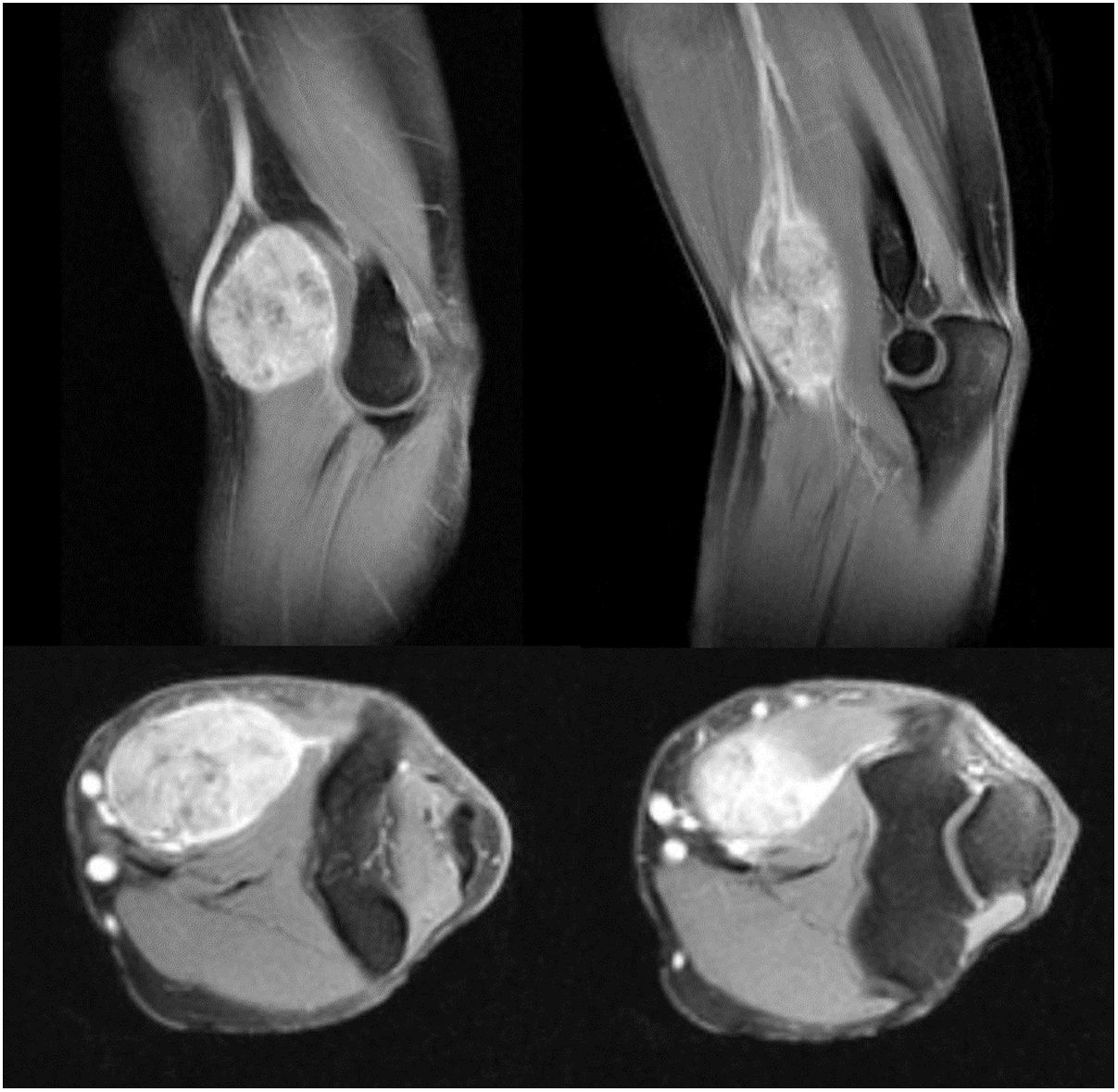
El seguimiento de los pacientes se realizó por parte del equipo de Cirugía Ortopédica -Unidad de Tumores- (control local de la enfermedad) y de Oncología Médica (control de la enfermedad sistémica). El seguimiento incluyó la realización de Resonancia Magnética (RM) con contraste, del codo intervenido, para valorar la recidiva local y Tomografía Computarizada (TC) toracoabdominopélvica para la búsqueda de enfermedad a distancia8. Al encontrar en los controles recidiva local en un caso y sistémica en tres casos, tras valoración en el comité multidisciplinario, se consideró la realización de PET-TC para completar la estadificación y la valoración pronóstica en el seguimiento de cuatro pacientes (casos 2, 6, 7 y 10). No se utilizó en ningún caso la gammagrafía ósea. Una vez completado el seguimiento postoperatorio inmediato, la frecuencia de seguimiento fue de cada tres meses los primeros dos años, cada seis meses hasta cumplir cinco años de evolución y posteriormente un control anual.
Se registraron los datos de recidiva local, recidiva sistémica y fallecimiento de pacientes. La supervivencia libre de recidiva local se definió como el tiempo entre la cirugía y la reaparición de tejido neoplásico en una localización previamente tratada. La supervivencia libre de metástasis se definió como el tiempo entre el diagnóstico y la aparición de enfermedad a distancia. En los casos de fallecimiento, la supervivencia global se consideró el tiempo transcurrido entre el diagnóstico y la muerte del paciente.
Análisis estadísticoA partir de los resultados obtenidos en las variables cuantitativas, se calculó la media aritmética y el error estándar de la media (EEM). Con los datos obtenidos con las variables nominales se realizaron tablas de frecuencia, para calcular el número y porcentaje de los pacientes que presentan cada una de las opciones para cada variable, y tablas cruzadas y test χ2 de Pearson (p < 0,05) para analizar las posibles asociaciones existentes entre variables. El análisis de supervivencia se realizó mediante el método de Kaplan-Meier.
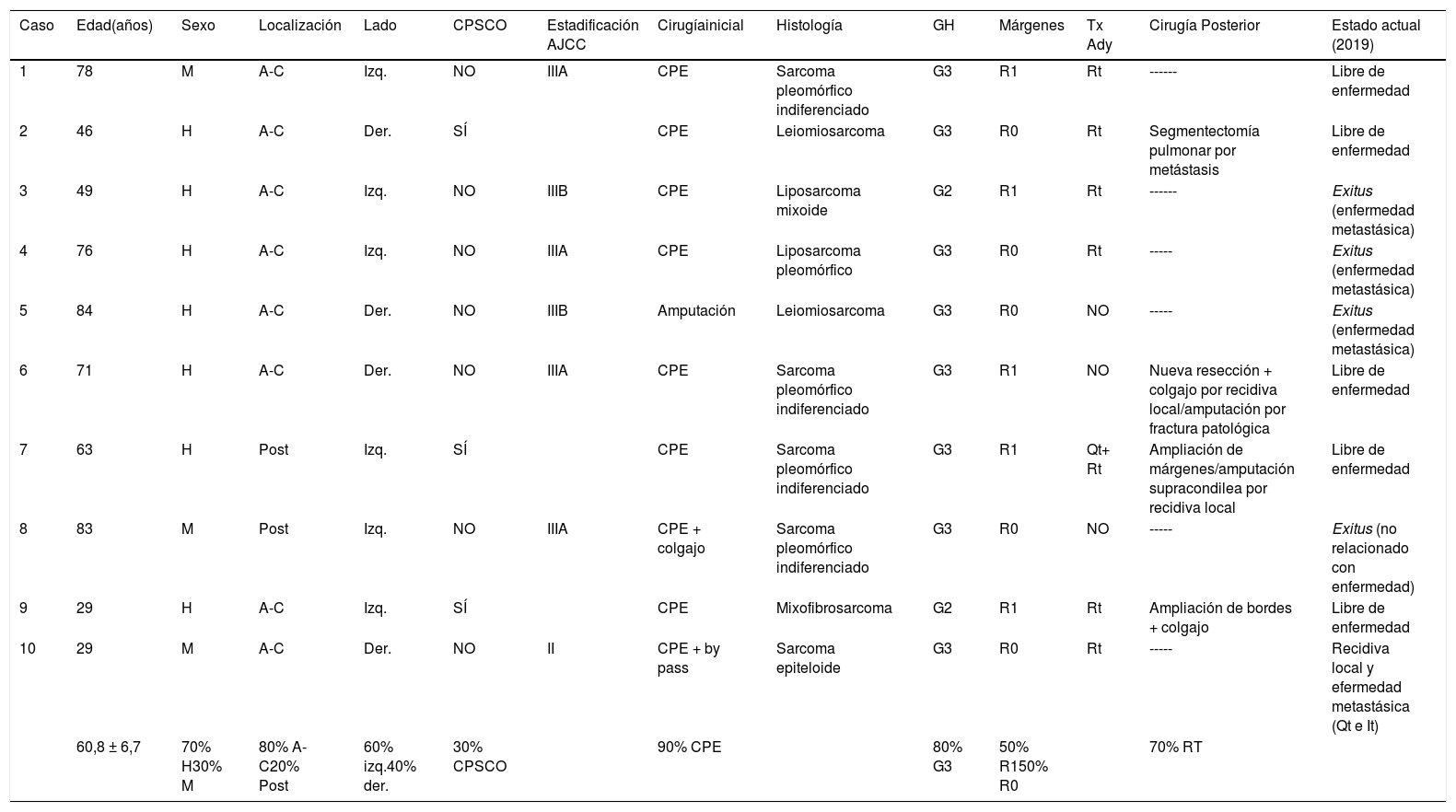
ResultadosLos datos epidemiológicos de la serie se incluyen en la tabla 1.
Casos de nuestra serie de sarcomas de partes blandas en la región del codo (2008-2016)
| Caso | Edad(años) | Sexo | Localización | Lado | CPSCO | Estadificación AJCC | Cirugíainicial | Histología | GH | Márgenes | Tx Ady | Cirugía Posterior | Estado actual (2019) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 78 | M | A-C | Izq. | NO | IIIA | CPE | Sarcoma pleomórfico indiferenciado | G3 | R1 | Rt | ------ | Libre de enfermedad |
| 2 | 46 | H | A-C | Der. | SÍ | CPE | Leiomiosarcoma | G3 | R0 | Rt | Segmentectomía pulmonar por metástasis | Libre de enfermedad | |
| 3 | 49 | H | A-C | Izq. | NO | IIIB | CPE | Liposarcoma mixoide | G2 | R1 | Rt | ------ | Exitus (enfermedad metastásica) |
| 4 | 76 | H | A-C | Izq. | NO | IIIA | CPE | Liposarcoma pleomórfico | G3 | R0 | Rt | ----- | Exitus (enfermedad metastásica) |
| 5 | 84 | H | A-C | Der. | NO | IIIB | Amputación | Leiomiosarcoma | G3 | R0 | NO | ----- | Exitus (enfermedad metastásica) |
| 6 | 71 | H | A-C | Der. | NO | IIIA | CPE | Sarcoma pleomórfico indiferenciado | G3 | R1 | NO | Nueva resección + colgajo por recidiva local/amputación por fractura patológica | Libre de enfermedad |
| 7 | 63 | H | Post | Izq. | SÍ | CPE | Sarcoma pleomórfico indiferenciado | G3 | R1 | Qt+ Rt | Ampliación de márgenes/amputación supracondilea por recidiva local | Libre de enfermedad | |
| 8 | 83 | M | Post | Izq. | NO | IIIA | CPE + colgajo | Sarcoma pleomórfico indiferenciado | G3 | R0 | NO | ----- | Exitus (no relacionado con enfermedad) |
| 9 | 29 | H | A-C | Izq. | SÍ | CPE | Mixofibrosarcoma | G2 | R1 | Rt | Ampliación de bordes + colgajo | Libre de enfermedad | |
| 10 | 29 | M | A-C | Der. | NO | II | CPE + by pass | Sarcoma epiteloide | G3 | R0 | Rt | ----- | Recidiva local y efermedad metastásica (Qt e It) |
| 60,8 ± 6,7 | 70% H30% M | 80% A-C20% Post | 60% izq.40% der. | 30% CPSCO | 90% CPE | 80% G3 | 50% R150% R0 | 70% RT |
A-C, antero-cubital; (AJCC), American Joint Committee on Cancer Staging System; CPE, cirugía de preservación de la extremidad; CPSCO, cirugía previa sin criterios oncológicos; Der, derecho; GH, grado histológico; H, Hombre; It, inmunoterapia; Izq, izquierdo; M, mujer; Post, posterior; Qt, quimioterapia; Rt, radioterapia; Tx Ady, tratamiento adyuvante.
Tres pacientes fueron intervenidos en su hospital de origen sin criterios oncológicos (30%), ya que la sospecha diagnóstica preoperatoria fue de tumor benigno y fueron remitidos a nuestro centro tras el resultado de anatomía patológica de la pieza quirúrgica compatible con malignidad (tabla 1). La estadificación se hizo según la American Joint Committee on Cancer Staging System (AJCC) (tabla 1). Todos los pacientes completaron el tratamiento y seguimiento en nuestro centro, los siete que se atendieron desde el principio del proceso y los tres que fueron derivados.
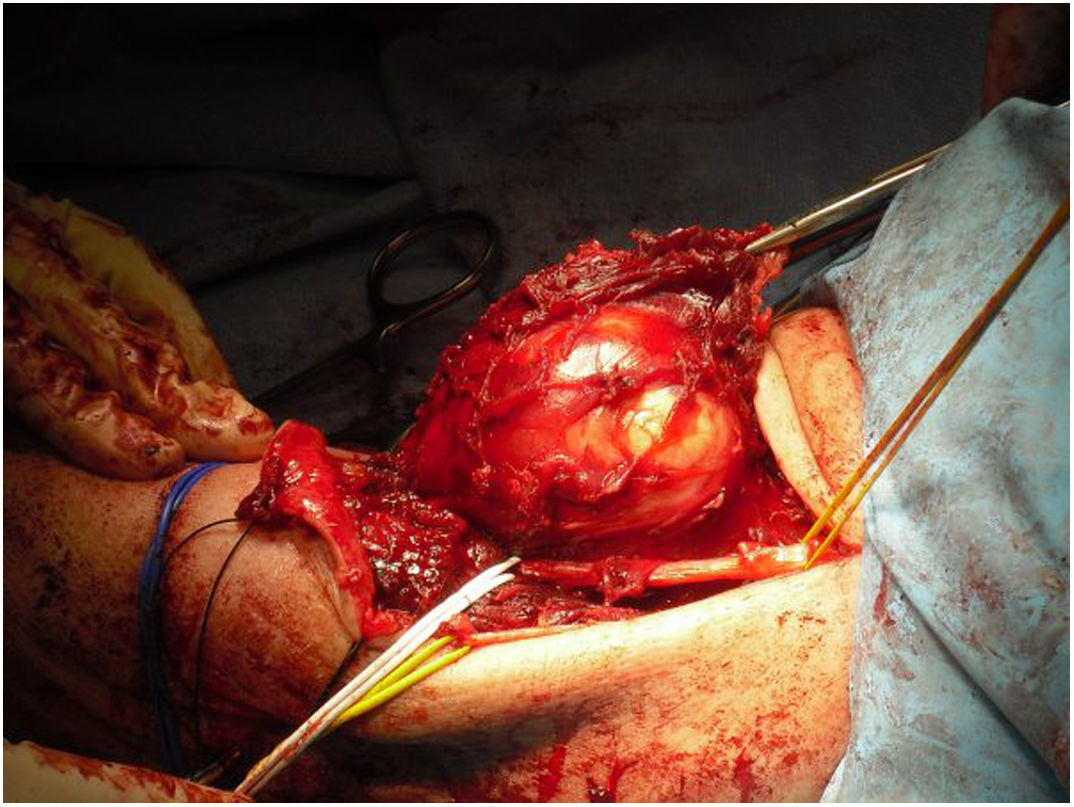
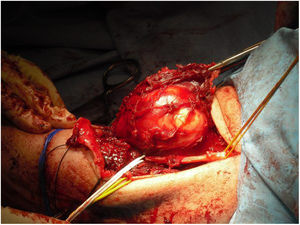
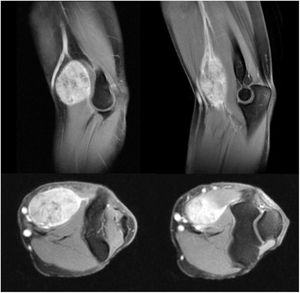
Todos los pacientes de nuestra serie recibieron tratamiento quirúrgico, con preservación de la extremidad en nueve de los 10 pacientes (fig. 1) (tabla 1). Debido a la edad avanzada y comorbilidades asociadas, que hubiesen dificultado las técnicas de reconstrucción posterior, en un paciente se decidió realizar una amputación supracondílea como primera intervención. En cuatro casos se precisó la colaboración de cirugía plástica en algún momento de la evolución, para realizar técnicas de cobertura. Dos de estos pacientes corresponden a pacientes intervenidos previamente en otro centro sin criterios oncológicos. Se observa una asociación entre la localización del tumor a nivel posterior y la necesidad de colaboración en la intervención por parte de cirugía plástica, aunque no alcanza el nivel de significación estadística (p = 0,053). En uno de los casos se requirió la ayuda del equipo de cirugía vascular para realizar un bypass de la extremidad. De los nueve pacientes en los que se realizó cirugía de preservación de la extremidad dos fallecieron por metástasis, uno falleció por un motivo distinto a su lesión en el codo, uno recidivó localmente y tiene metástasis y cinco están libres de enfermedad (56%). El paciente amputado inicialmente falleció por metástasis.
De los seis pacientes en los que se realizó biopsia con aguja gruesa, previa a la intervención en nuestro centro, en cuatro casos (67%) coincidió el diagnóstico con el obtenido con el estudio anatomopatológico de la pieza quirúrgica, aunque en los seis casos se sospechó malignidad. Los resultados anatomopatólógicos e histológicos se incluyen en la tabla 1. Dentro del grupo de pacientes con bordes catalogados como R0, en dos de ellos no se realizó ningún tipo de tratamiento adicional (40%), y los otros tres pacientes fueron sometidos a radioterapia adyuvante (60%). Respecto de los pacientes con márgenes R1, en dos casos se realizó una nueva cirugía de ampliación de bordes (40%), asociando radioterapia en uno de ellos y quimioterapia más radioterapia en otro. Otros dos pacientes fueron manejados solo con radioterapia adyuvante sin cirugía adicional (40%) y en uno de ellos se mantuvo a petición del paciente solo una conducta expectante (20%). En total se realizó radioterapia adyuvante en siete pacientes (y en uno de ellos se asoció también quimioterapia) (tabla 1). La decisión sobre la terapia adyuvante en cada caso se tomó en un comité multidisciplinario teniendo en cuenta los márgenes de resección, el tipo y el grado histológico del tumor, el estado general del paciente, la localización del tumor y su relación con estructuras adyacentes y los deseos del paciente una vez explicadas las opciones. Se observó una posible asociación entre la localización del tumor a nivel antecubital y la necesidad de tratamiento adyuvante con radioterapia, sin alcanzar el nivel de significación estadística (p = 0,054). Ninguno de los pacientes de nuestra serie fue sometido a tratamiento neoadyuvante.
En dos de los pacientes intervenidos se produjeron alteraciones sensitivas distales que se resolvieron de forma espontánea y sin secuelas. No se produjeron otras complicaciones quirúrgicas en los pacientes de la serie.
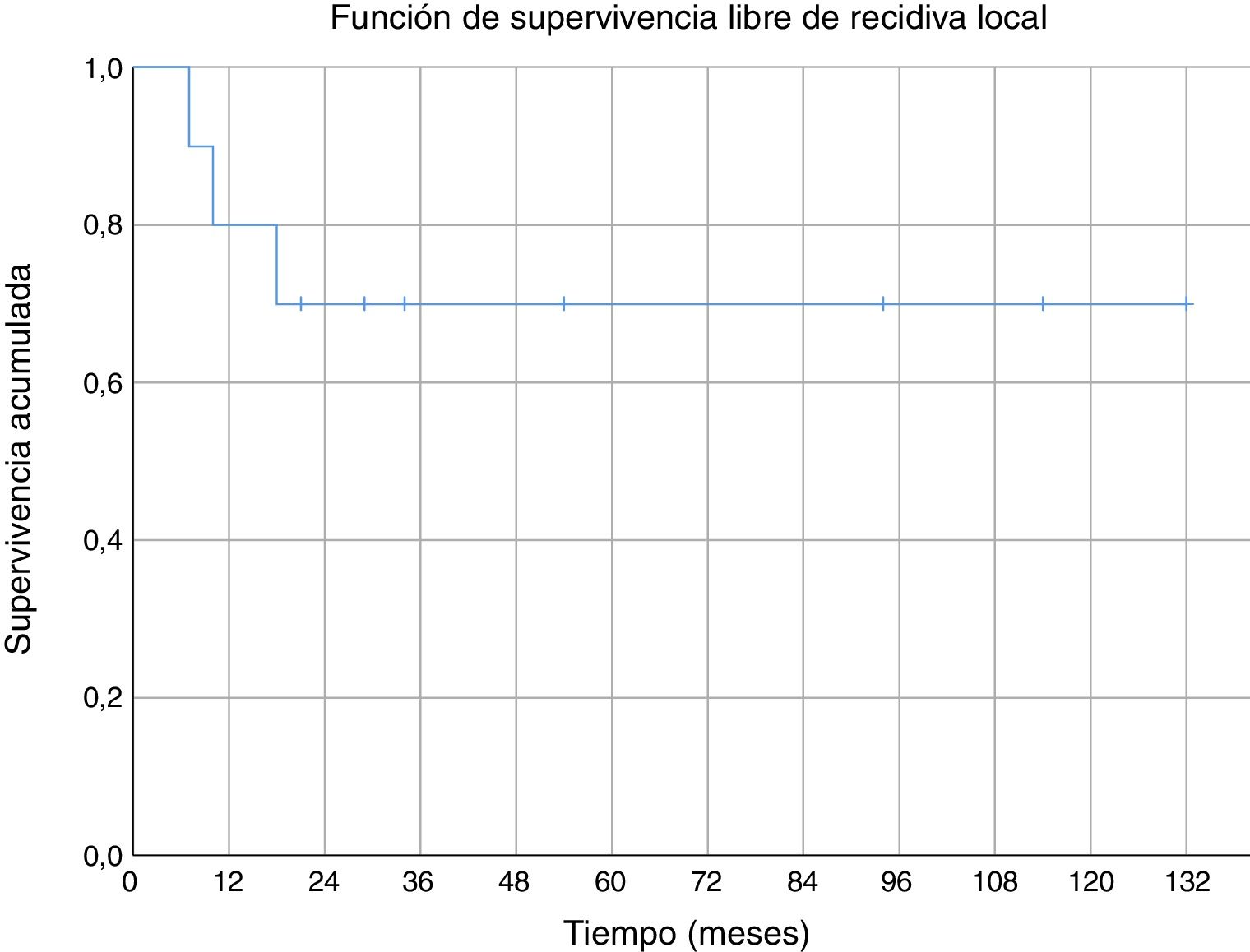
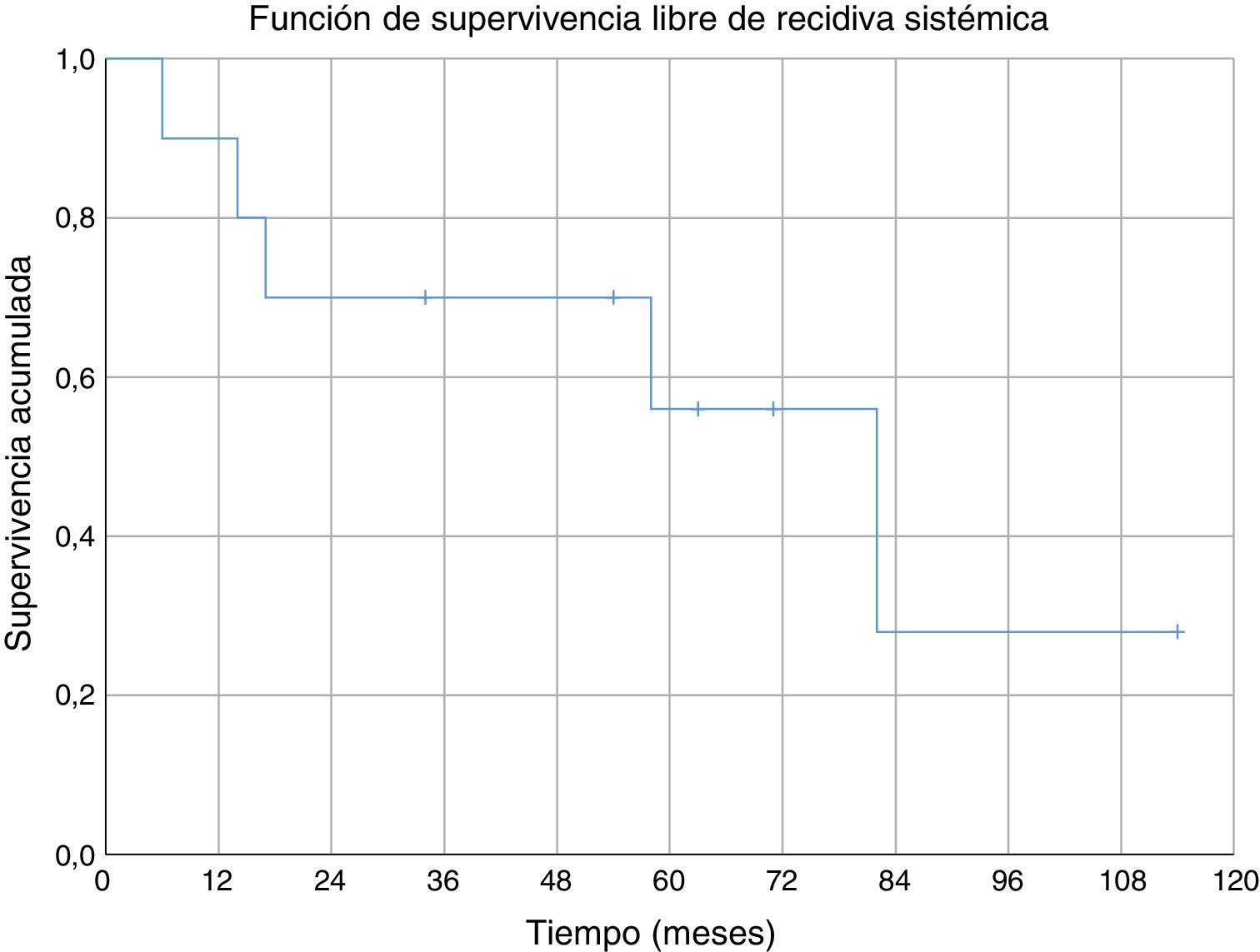
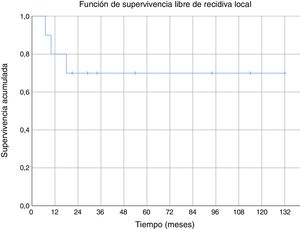
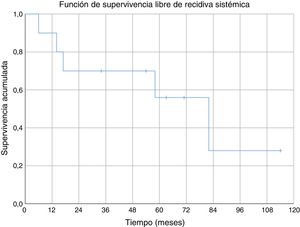
Tres de los pacientes estudiados presentaron recidiva local de la enfermedad (30%), en dos de los casos se habían obtenido márgenes R1 en la cirugía inicial y en el tercer caso márgenes R0. No se ha observado una relación estadísticamente significativa entre los márgenes obtenidos y la recidiva local. En uno de los casos la recidiva fue detectada siete meses después de la intervención inicial, en otro a los 10 meses y en el tercer paciente la recidiva local se presentó a los 18 meses de evolución (media de 11,7 ± 3,3 meses) (fig. 2). En el primero de estos pacientes se realizó una nueva resección tumoral asociada a un colgajo para cobertura, en el segundo caso se decidió realizar una amputación supracondílea y en el tercer caso no se realizó una nueva intervención por presentar, además de la recidiva local, enfermedad metastásica. Durante el seguimiento se detectaron cinco casos de enfermedad a distancia, cuatro de ellos presentaban tumores con graduación histológica G3 y el caso restante G2. El momento de aparición de las metástasis fue a los 6, 14, 17, 58 y 82 meses del diagnóstico, respectivamente (media de 35,4 ± 14,7 meses) (fig. 3). Los cinco pacientes presentaron metástasis pulmonares: uno fue tratado mediante segmentectomía pulmonar y pasados cuatro años se encuentra libre de enfermedad; en los otros cuatro pacientes, tras valorarlo en el comité de tumores musculoesqueléticos, se consideró que no eran resecables10, se trató de forma paliativa a tres pacientes (dos con metástasis en varias localizaciones [pulmonares, óseas y hepáticas] y otro pluripatológico y con mal estado general) y mediante quimioterapia e inmunoterapia al otro paciente.
Del total de pacientes estudiados cuatro requirieron de una o más intervenciones quirúrgicas tras la cirugía inicial para el control local o sistémico de la enfermedad. Dos pacientes fueron sometidos a una ampliación de márgenes (ambos asociados a colgajo), un paciente fue sometido a una segmentectomía pulmonar y un paciente fue sometido a una nueva resección por presentar recidiva local (tabla 1). De estos cuatro pacientes tres fueron remitidos de otro centro ya intervenidos, existiendo una relación estadísticamente significativa (p = 0,04) entre la cirugía previa en otro centro y la necesidad de cirugía posterior.
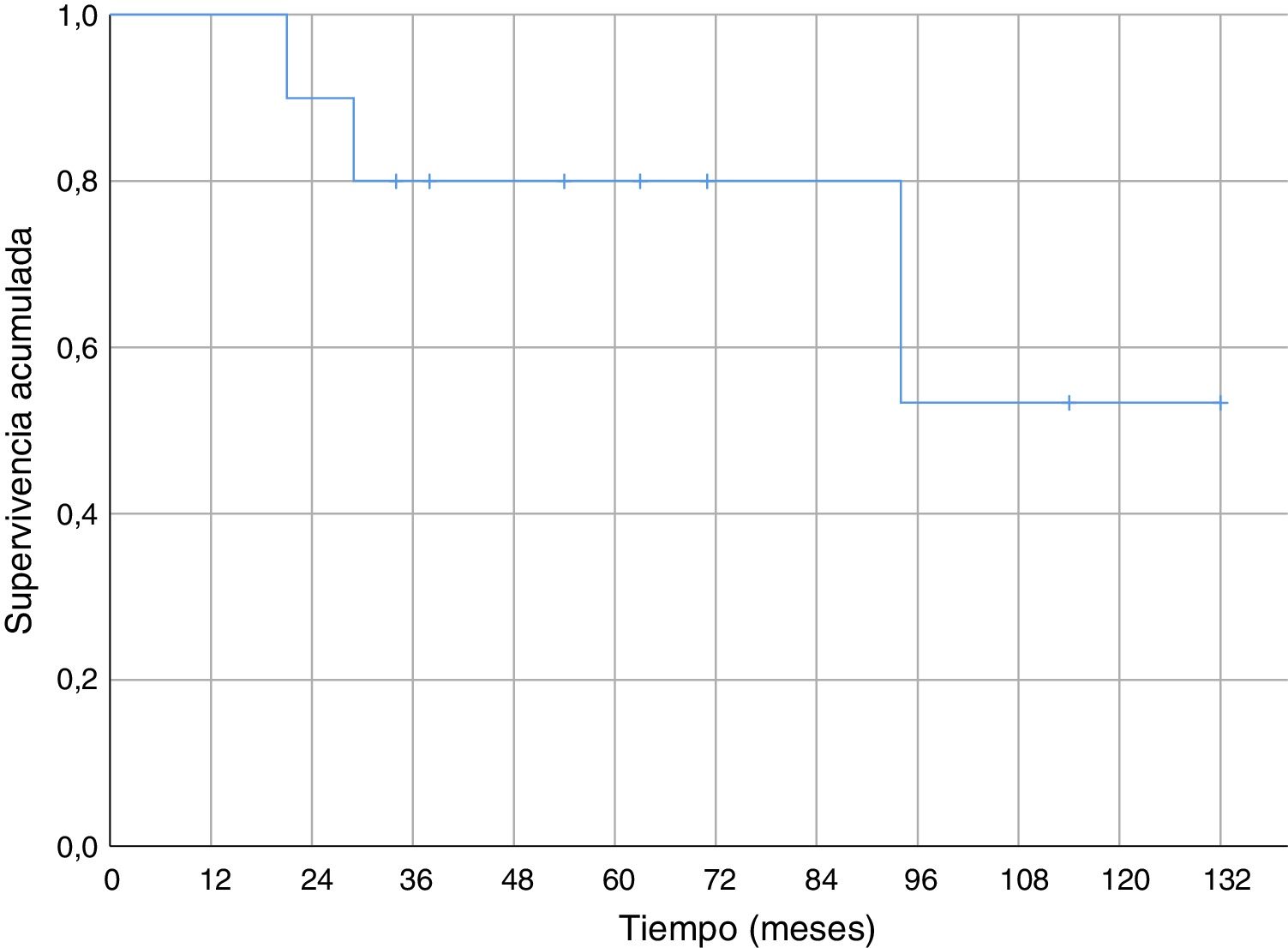
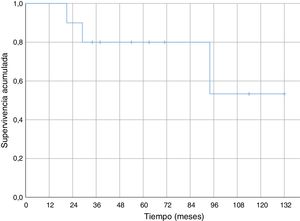
Respecto de la supervivencia general a lo largo del seguimiento fallecieron cuatro pacientes (40%), tres de ellos debido a enfermedad metastásica (30% de fallecimiento por la enfermedad oncológica) y uno de ellos debido a una neumonía sin evidencia de enfermedad a distancia. En los casos de metástasis la muerte se produjo a los 21, 29 y 94 meses del diagnóstico. La muerte secundaria a neumonía sin enfermedad diseminada ocurrió a los 34 meses de evolución. La supervivencia al año fue del 100% y del 80% a los cinco años (fig. 4).
DiscusiónEl área del codo es una ubicación excepcional entre los sarcomas de partes blandas. Se estima que, al considerar en conjunto los sarcomas óseos y de partes blandas, aproximadamente el 1% de ellos se origina en la región del codo3. Creighton et al. reportaron 10 pacientes con tumores a nivel del codo en su serie de 61 sarcomas de partes blandas de la extremidad superior11. A pesar de que nuestro hospital es centro de referencia para el tratamiento de sarcomas en la Comunidad Valenciana, a lo largo de ocho años de revisión solo hemos tenido 10 casos de sarcomas de partes blandas situados en la región del codo, de los 533 casos presentados en el Comité multidisciplinario de tumores musculoesqueléticos (1,8%). La baja frecuencia de la localización anatómica descrita por otros autores3,11 resulta comparable con nuestra serie.
Las recomendaciones generales en el diagnóstico y tratamiento sugieren remitir a un centro especializado en tumores musculoesqueléticos, a todos aquellos pacientes con una masa de partes blandas profundas a la fascia sin etiología clara, y también a aquellos con tumoraciones superficiales al plano fascial pero de más de 5 cm de diámetro1. Debido a la baja frecuencia de estos tumores, no es raro que los pacientes sean remitidos tras haber sido sometidos previamente a una cirugía sin criterios oncológicos. Diferentes series sitúan entre un 18 y 30% el porcentaje de pacientes en quienes el hallazgo de malignidad se presenta de manera inesperada tras la extirpación de un tumor considerado benigno antes de la intervención12-14, lo que coincide con lo observado en nuestra serie (30%). Debido a su ubicación más superficial y al menor diámetro al momento del diagnóstico, la sospecha de patología maligna en las tumoraciones de extremidad superior suele ser baja y se ha visto que tienen hasta el doble de riesgo de ser sometidos a exéresis sin criterios oncológicos respecto de aquellos tumores que se presentan en extremidades inferiores7. En nuestra serie, tres de los 10 pacientes (30%) habían sido previamente intervenidos en otro centro sin criterios oncológicos. El impacto en el pronóstico a largo plazo de los pacientes reintervenidos, por un sarcoma de partes blandas erróneamente diagnosticado como benigno en un inicio, sigue siendo motivo de debate15,16. Bianchi et al. afirman que la reintervención en estos pacientes puede ser particularmente difícil en áreas anatómicas complejas como la axila o la fosa poplítea16. A nuestro entender, la región anterior del codo resulta anatómicamente similar a las zonas mencionadas y una resección previa, sin criterios oncológicos, podría condicionar también una cirugía posterior de mayor dificultad. En nuestro caso se ha observado una relación estadísticamente significativa entre el antecedente de intervención previa en otro centro sin criterios oncológicos y la necesidad de requerir al menos una cirugía adicional a la intervención principal, para el control local y sistémico de la enfermedad.
A la hora de plantear el tratamiento de tumores malignos situados en la extremidad superior, el principal objetivo es el control oncológico de la patología. En segundo lugar, y siempre que no se ponga en peligro el control de la enfermedad, se intentará obtener el mayor nivel de funcionalidad posible17. La cirugía de preservación de la extremidad es actualmente el tratamiento de elección, siendo esta técnica la utilizada entre el 85 y el 95% de los casos diagnosticados con esta afección12,18,19. En nuestra serie se mantiene este porcentaje descrito; la cirugía de preservación de la extremidad fue de elección (nueve casos), y solo un caso, debido a las importantes comorbilidades asociadas, fue sometido a una amputación directa. Se ha obtenido un estado libre de enfermedad en el 56% de los pacientes con cirugía de preservación de la extremidad. No obstante, a pesar de que el tratamiento inicial de elección fue la cirugía de preservación de la extremidad en el 90% de los casos, dos pacientes necesitaron una amputación en una segunda intervención, por lo que la preservación de la extremidad a fin de seguimiento se logró en el 70% de los pacientes.
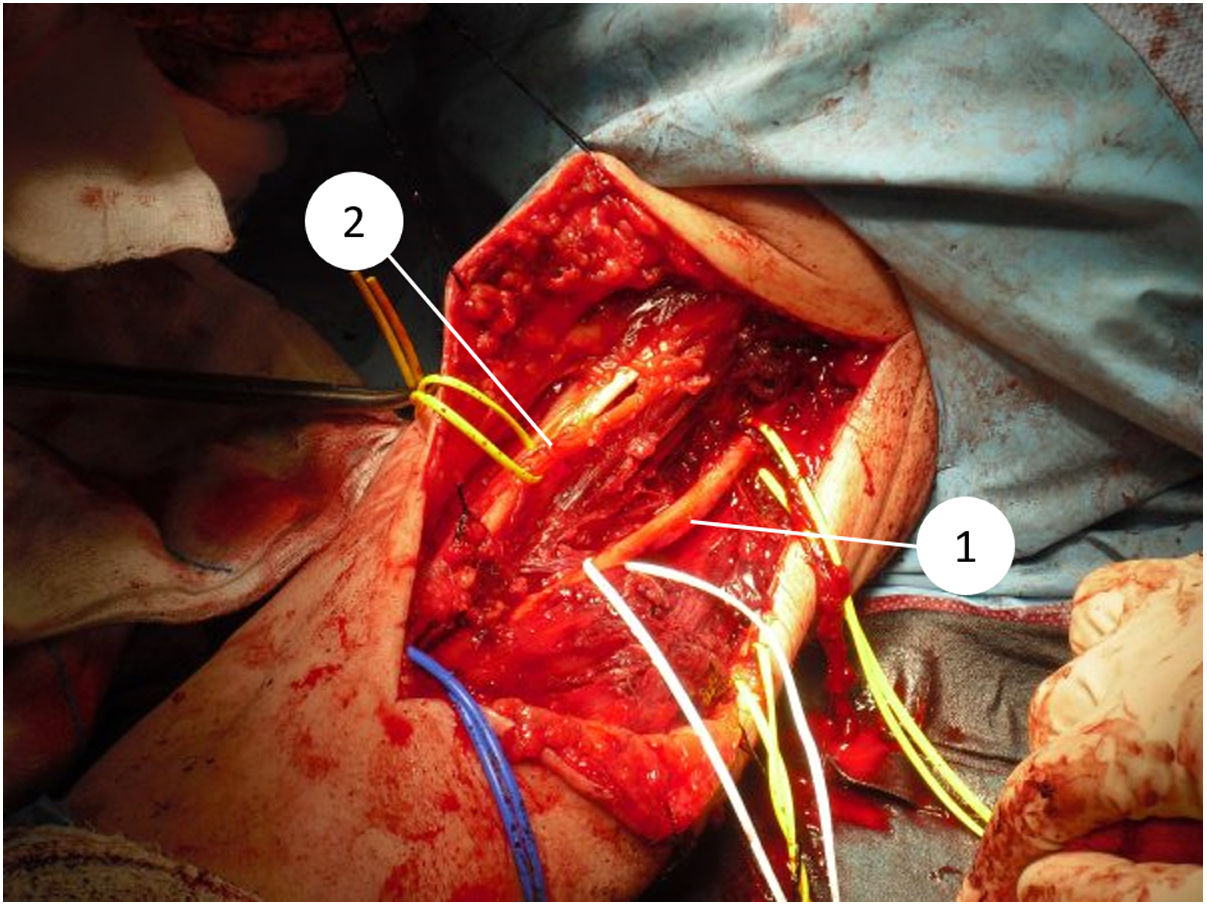
Desde que en 1985 el National Institute of Health (NIH) recomendara en su consenso la cirugía de preservación de extremidad para el tratamiento de los sarcomas de alto grado14, el concepto de los márgenes quirúrgicos ha cobrado una importancia creciente. A pesar de esto, aún no se ha definido en la bibliografía qué tan amplios deben ser estos márgenes para ser considerados como óptimos1,8,20. Debido a la cercanía de estructuras vasculonerviosas a nivel del codo, quirúrgicamente es muy difícil obtener márgenes amplios (fig. 5 y fig. 6). En nuestra opinión, lo complejo del área anatómica a estudio puede explicar el alto porcentaje de pacientes con márgenes R1 de nuestra serie (50%). Aunque hay un mayor porcentaje de pacientes con márgenes R1 en los casos intervenidos inicialmente sin criterios oncológicos (67%), no hemos podido demostrar diferencias estadísticamente significativas si los comparamos con los casos intervenidos tras valoración por el comité multidisciplinario (43%); probablemente porque la serie no es lo suficientemente larga y también porque existe el sesgo a la hora de lograr márgenes R1 de aquellos pacientes intervenidos sin criterios oncológicos. Por un lado, en estos casos es más difícil determinar cuál es la zona a resecar para obtener unos márgenes de seguridad adecuados porque en la prueba de imagen tenemos imágenes de un tejido posquirúrgico y no de una tumoración delimitada. Y en segundo lugar, estos pacientes no fueron remitidos para valoración por parte del comité porque tras estudio inicial de la enfermedad no se sospechó malignidad, motivo por el cual no se consideró oportuno la derivación a nuestro centro; por tanto, es posible que estos tres pacientes presentasen tumores menos agresivos localmente o menos evolucionados y por ello con menos afectación o menos próximos a estructuras neurovasculares, que aquellos que fueron remitidos inicialmente a la unidad de tumores musculoesqueléticos, donde sí que se sospechó la malignidad por el equipo que realizó la primera valoración. Esto mismo podría explicar por qué no se han observado diferencias estadísticamente significativas en cuanto a la recidiva local entre los pacientes con cirugía no planificada respecto a aquellos en los que sí que se realizó una cirugía con criterios oncológicos. Dos pacientes con márgenes R1 tuvieron recidiva local (2/5) y un paciente con margen R0 tuvo recidiva local (1/5), por lo que, a pesar de que pensamos que la ausencia de márgenes libres sí que está directamente relacionado con la recidiva local, no hemos podido establecer esta relación de forma estadísticamente significativa en esta serie.
Ante la dificultad que supone la obtención de márgenes amplios, el uso de terapias complementarias tras el tratamiento quirúrgico resulta de gran importancia. La eficacia de la radioterapia adyuvante en el control local de la enfermedad ha quedado bastante establecida21, pero su importancia a la hora de disminuir las tasas de metástasis a distancia y la supervivencia general no ha sido del todo confirmada22,23; a pesar de esto, cada vez hay más trabajos que hacen referencia a una posible asociación entre la radioterapia postoperatoria y un impacto positivo en las tasas de supervivencia general23-26. De acuerdo con la bibliografía, y tras el estudio de cada caso concreto por parte del comité multidisciplinario, teniendo en cuenta los márgenes de resección, el tipo y el grado histológico del tumor, el estado general del paciente, la localización del tumor y su relación con estructuras adyacentes y los deseos del paciente una vez explicadas las opciones, en dos casos con márgenes R1 se decidió ampliar los bordes asociando radioterapia en uno de ellos y quimioterapia más radioterapia en otro; dos pacientes fueron tratados solo con radioterapia adyuvante sin cirugía adicional y en uno de ellos se mantuvo, a petición del paciente, solo una conducta expectante. El hallazgo de una posible relación, aunque sin significación estadística, entre la ubicación del tumor en la zona antecubital y la indicación de radioterapia adyuvante tiene, en nuestra opinión, sentido desde el punto de vista clínico, ya que precisamente en la cara anterior del codo las estructuras vasculonerviosas pueden dificultar la posibilidad de obtener márgenes amplios libres de enfermedad y, por lo tanto, esto puede haber influido en la indicación de radioterapia postoperatoria; esta decisión sigue las tendencias de las guías clínicas actuales1.
Por otra parte, la zona posterior del codo puede suponer una localización donde la obtención de márgenes amplios resulte más sencilla por encontrarse alejada de estructuras neurovasculares, pero que resulte más compleja a la hora de obtener una adecuada cobertura. Por este motivo, pensamos que en nuestra serie se ha observado una tendencia entre la localización posterior del tumor y la necesidad de colaboración con cirugía plástica, aunque hay que tener en cuenta que solo se presentan dos casos de localización posterior y no se ha obtenido significación estadística para esta asociación, por lo que debemos ser cautos con esta afirmación, que deberá ser confirmada o rechazada por estudios más amplios.
A lo largo de los últimos años han surgido más evidencias que sugieren el uso de las técnicas neoadyuvantes en pacientes con sarcoma de partes blandas1,8,27,28. La justificación para su uso radica en un potencial incremento en la posibilidad de obtener márgenes negativos, realizando al mismo tiempo una cirugía que permita conservar estructuras neurovasculares de importancia. Esto supone una gran ventaja en el tratamiento de los sarcomas de codo, debido a la proximidad de estructuras neurovasculares fundamentales para la funcionalidad de la extremidad27. Actualmente, las guías clínicas de la SEOM (Sociedad Española de Oncología Médica) indican que la quimioterapia y la radioterapia neoadyuvante no se consideran tratamientos estándar (se consideran opcionales) para los sarcomas de partes blandas y no hay un consenso en su utilización o no; sin embargo, recomiendan considerar la quimioterapia y la radioterapia neoadyuvante en pacientes con sarcomas de alto grado, tumores mayores de 5 cm de diámetro o en aquellos pacientes en quienes una resección con márgenes amplios es difícil de asegurar o resultaría muy agresiva1. En nuestra serie, tras considerar cada caso en el comité multidisciplinario, ninguno de los pacientes fue sometido a quimioterapia ni radioterapia antes de la intervención (hay que tener en cuenta la fecha de los trabajos referenciados1,8,27,28 y que la serie incluye tumores intervenidos entre 2008 y 2016), aunque quizás en un futuro, y a medida que la bibliografía vaya dando respuestas más concretas respecto de su utilidad, podría considerarse el uso de estos tratamientos según las características del tumor, en áreas anatómicas complejas como son la cara anterior del codo y ampliar su uso e indicaciones.
No hemos encontrado datos específicos de ninguna serie de sarcomas de partes blandas a nivel del codo, pero la supervivencia acumulada a cinco años (80%) de nuestra serie, fue similar a la supervivencia de otras series de sarcomas de partes blandas (donde mezclan varias localizaciones)6,29-31. La supervivencia acumulada libre de recidiva sistémica (56%) y de recidiva local (70%) a cinco años también son equiparables a las descritas en otras series de sarcomas de partes blandas en miembros superiores6,31. En nuestra serie todas las recidivas locales se dieron en los primeros 18 meses; sin embargo, aparecieron metástasis con poco tiempo de seguimiento (seis meses la más temprana), pero también a medio-largo plazo (58 y 82 meses).
Este trabajo presenta las limitaciones propias de un estudio retrospectivo: es una serie relativamente corta (aunque relevante, dada la baja incidencia de sarcomas de partes blandas en esta localización); al estar recogidos los casos en un período largo de tiempo, los protocolos clínicos de actuación han ido cambiando, así como los componentes del equipo multidisciplinar, lo que ha podido condicionar el resultado de los diferentes casos; el tiempo de seguimiento es variable; por las propias características de los diferentes sarcomas de partes blandas, se presenta una serie de casos heterogénea, teniendo un solo caso de algunos tipos histológicos.
En conclusión, el codo es una zona de presentación poco frecuente de sarcomas de partes blandas, pero que tiene gran importancia debido a sus características anatómicas. En su cara antero-cubital presenta dificultad para lograr márgenes amplios por la proximidad de estructuras neurovasculares, por lo que las terapias adyuvantes y neoadyuvantes podrían tener un papel importante para poder realizar una cirugía de preservación de la extremidad. La cirugía de preservación de la extremidad es actualmente el tratamiento quirúrgico de elección, siendo importante realizar desde el principio una cirugía con criterios oncológicos, por lo que sería recomendable que los tumores en el codo sean remitidos a unidades especializadas con equipos multidisciplinares. Con un tratamiento planificado y adecuado, los resultados de supervivencia acumulada, supervivencia libre de recidiva local y de recidiva sistémica de los sarcomas de partes blandas a nivel del codo, en nuestra serie, son similares a lo observado en sarcomas de partes blandas de otras localizaciones.
Nivel de evidenciaNivel de evidencia IV.
Fuentes de financiaciónNinguna.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.