En occidente, más del 10% de las personas mayores de 65 años padecen anemia. Hasta en un tercio de los mismos esta es inexplicada. La anemia inexplicada de la persona mayor (AI) se considera un diagnóstico de exclusión, sin que exista un consenso en los criterios para su abordaje clínico o experimental. En estudios en animales y humanos se ha evidenciado que existe un vínculo entre envejecimiento y anemia.
ObjetivosConocer si existe evidencia en la literatura que soporte como causa de AI al agotamiento de células madre hematopoyéticas (CMH) y al acúmulo de productos finales de la glicación avanzada (AGE).
MétodoTras una revisión exhaustiva de la literatura se seleccionaron 32 trabajos de investigación (28 para agotamiento de CMH y 4 para AGE). Se vincularon sus conclusiones a los mecanismos y efectos tanto del agotamiento de CMH como del acúmulo de AGE sobre el envejecimiento y la anemia.
ResultadosÚnicamente 3 trabajos relacionaron la AI con el agotamiento de CMH y 2 de ellos difirieron en sus conclusiones, el tercero difirió en el tipo de estudio. Existe relación del incremento y acúmulo de AGE con anemia en la persona mayor.
ConclusiónExiste evidencia en la literatura que vincula los mecanismos moleculares y celulares del envejecimiento con el agotamiento de CMH y el acúmulo de AGE, también existe evidencia de que ambas entidades condicionan anemia relacionada a la edad en animales y humanos. Hay una pobre evidencia en la literatura que determine una relación entre envejecimiento y AI.
More than 10% of the aged 65 years and over in the western world suffers anemia and in one third of them the cause of the anemia remains obscure. The unexplained anemia of the elderly (UAE) is considered an exclusion diagnosis, without the existence of a clear consensus to its clinical or experimental approach. There is an association between aging and anemia in studies performed in animals and in humans.
ObjectivesTo determine if there is evidence in the literature that supports hematopoietic stem cells (HSC) exhaustion and the advanced glycation end-products (AGE's) as a cause of UAE.
MethodA total of 32 combined texts (28 for HSC exhaustion and 4 for AGEs) were selected after an intensive review. Conclusions were associated with causes and effects of the HSC exhaustion and circulating AGE's over aging and anemia.
ResultsOnly three works try to establish an association between UAE and HSC exhaustion, two of them disagreed in their conclusions, with the third one differing in the type of study. There is a relationship between anemia and AGEs increase and accumulation.
ConclusionsThere is evidence in the literature that links the aging molecular and cellular mechanisms with the HSC exhaustion and the increase of AGE's. Furthermore; there is some evidence that both conditions determine the emergence of anemia associated with age in animals and in humans. There is little evidence in the literature to clarify the relationship between aging and UAE.
Gracias a los avances de la medicina en las últimas décadas, la población de mayores de 65 años aumenta rápidamente en los países desarrollados, traduciéndose este aumento en la expectativa de vida, en un aumento en la frecuencia de enfermedades crónicas, degenerativas, oncológicas y por tanto de los procesos anémicos secundarios. A pesar de que esta relación está documentada en la literatura, existe un grupo de anemias que no ha podido vincularse causalmente a las patologías geriátricas1–7.
Anemia en la persona mayor de 65 añosSe le suele definir de acuerdo con los criterios de la Organización Mundial de la Salud (OMS), como la concentración plasmática de hemoglobina (Hb) en el hombre inferior a 13g/dl y en la mujer inferior a 12g/dl.
La anemia en la persona mayor (AM) afecta a más del 10% de los mayores de 65 años de edad1,3,8–15 y casi a un 30% de los mayores de 85 años de edad1,16, aumentando su prevalencia y su incidencia con la edad5,11,15,17,18. En una población de octogenarios y centenarios radicados en la comunidad, se encontró una prevalencia de anemia de 26,2 y 52,1% respectivamente19. En pacientes con enfermedades crónicas e institucionalizados la anemia alcanza una prevalencia cercana al 50%20 y en este mismo subgrupo poblacional (institucionalizados y frágiles) se ha observado que mayores concentraciones plasmáticas de Hb se relacionan con una mayor supervivencia21.
En un estudio realizado sobre la base de datos National Health and Nutrition Examination Survey 2nd phase (NHANES III)1, se clasificó la AM de acuerdo a su distribución porcentual en 3 grupos casi idénticos (33% para cada uno aproximadamente), 1) anemias relacionadas con la deficiencia de nutrientes (ADN), 2) anemias relacionadas con enfermedad renal crónica (AERC) y anemia de la inflamación crónica (AIC) y 3) anemia inexplicada en la persona mayor (AI), manteniendo una proporción semejante en los estudios Scripps-Kaiser22, InCHIANTI3 y Women's Health and Aging Study I (WHAS)23, discretamente menor para la AI en el Health and Anemia population-based study (26,4%)5.
Asociación con morbilidadEl potencial impacto negativo de bajos niveles de Hb sobre el rendimiento físico, la fisiología y la independencia funcional parece ser mayor en las personas mayores.
De acuerdo con una revisión efectuada por Steensma y Tefferi24, en los mayores de 65 años de edad la anemia incluso leve se ha asociado con un aumento en la fragilidad, peor desempeño durante el ejercicio, disminución del nivel cognitivo, riesgo de desarrollar demencia, disminución en la movilidad, aumento del riesgo de caídas recurrentes, menor densidad ósea y muscular, y una mayor frecuencia de depresión. A nivel hospitalario pasan casi el doble de días hospitalizados y precisan hospitalización con mayor frecuencia y la anemia será un factor de riesgo para desarrollar delirium.
En los mayores de 85 años con anemia leve, parece que la comorbilidad sobrepasa el peso de la propia anemia y se torna la causa primordial de déficit funcional asociando el doble de riesgo para mortalidad al comparar los pacientes que desarrollaron anemia contra los que no lo hicieron durante un seguimiento a 5 años25.
Asociación con mortalidadAl comparar un grupo de pacientes con anemia y otro grupo de pacientes no anémicos se detectó un riesgo relativo (RR) de mortalidad asociado con la AM de 1,8 y una vez ajustado el riesgo para la edad, el sexo y la raza fue del 1,626.
Se ha detectado una relación entre la concentración de Hb y la mortalidad general en mujeres mayores dependientes residentes en la comunidad27 y en otro estudio se observó que la mortalidad total o de origen cardiovascular era significativamente más elevada entre aquellos en los que se había diagnosticado anemia (criterios OMS) al inicio del estudio, respecto a los no anémicos (57 frente a 39%)9. En el WHAS se asoció un mayor riesgo de mortalidad en pacientes que presentaron AERC (64,3%) o AIC (38,6%) y la ADN y la AI no presentaron un riesgo estadísticamente significativo versus pacientes sin anemia23. En mayores de 85 años no se evidenció mayor mortalidad para los pacientes con AI en comparación con los no anémicos28 y los investigadores del Life Expectancy Project calcularon un RR de mortalidad para la AI de 1,2626.
Anemia inexplicada en la persona mayorLa AI es comúnmente una anemia leve con niveles de Hb menores en aproximadamente 1g/dl con respecto a los estándares de la OMS. Típicamente los eritrocitos son de tamaño normal y el examen de frotis de sangre periférica no evidencia destrucción intravascular o cambios morfológicos sugestivos de síndrome mielodisplásico (MDS)2.
De forma genérica los cuadros de anemia que no puedan clasificarse en ADN, AERC o AIC se corresponden con AI. Makipour et al. proponen 5 factores que contribuyen al fenotipo de la AI2.
- 1.
Deterioro de la función renal y endocrina.
- 2.
Reducción de los niveles de andrógenos tanto en hombres como en mujeres.
- 3.
Anemia atribuible a desregulación de las citocinas.
- 4.
Disminuida capacidad proliferativa de las CMH.
- 5.
MDS temprano que se presenta como anemia sin alteraciones en la serie leucocitaria o plaquetaria.
Estos factores (a excepción del MDS) se relacionan con el proceso de envejecimiento y no requieren o incluso implican la presencia de enfermedad concurrente.
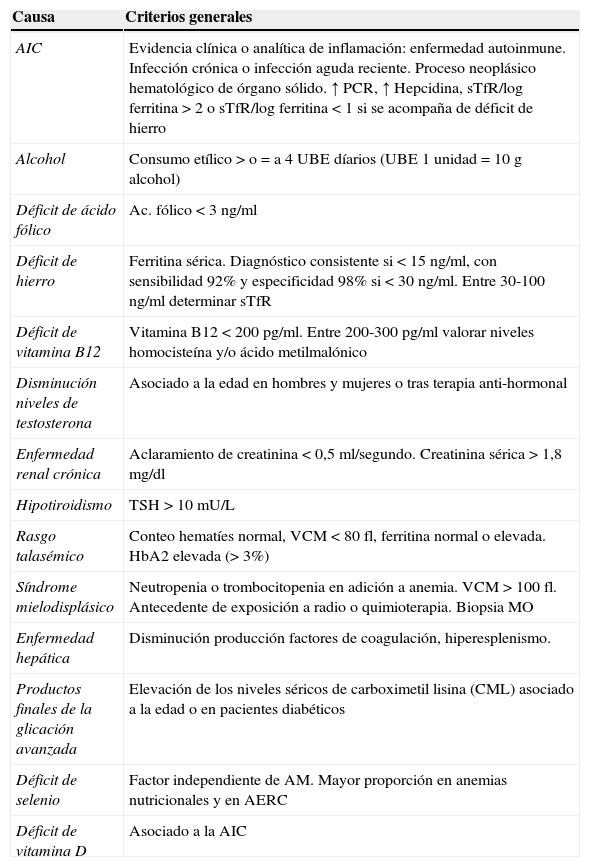
La AI se considera clínicamente un diagnóstico de exclusión, y los referentes diagnósticos varían sustancialmente de un estudio a otro, dependiendo de los criterios diagnósticos específicos seleccionados por cada grupo de investigadores, sin que exista un consenso entre los expertos29. Se proponen en la tabla 1 los criterios de abordaje para descartar las condiciones clínicas y analíticas subyacentes a la AM. Adicionalmente, y de ser posible, deben incluirse también los niveles séricos de selenio30, vitamina D31 y carboximetil lisina (CML)32,33.
Valoración de las causas subyacentes de AM
| Causa | Criterios generales |
|---|---|
| AIC | Evidencia clínica o analítica de inflamación: enfermedad autoinmune. Infección crónica o infección aguda reciente. Proceso neoplásico hematológico de órgano sólido. ↑ PCR, ↑ Hepcidina, sTfR/log ferritina >2 o sTfR/log ferritina<1 si se acompaña de déficit de hierro |
| Alcohol | Consumo etílico>o=a 4UBE díarios (UBE 1 unidad=10g alcohol) |
| Déficit de ácido fólico | Ac. fólico<3ng/ml |
| Déficit de hierro | Ferritina sérica. Diagnóstico consistente si <15ng/ml, con sensibilidad 92% y especificidad 98% si<30ng/ml. Entre 30-100ng/ml determinar sTfR |
| Déficit de vitamina B12 | Vitamina B12<200pg/ml. Entre 200-300pg/ml valorar niveles homocisteína y/o ácido metilmalónico |
| Disminución niveles de testosterona | Asociado a la edad en hombres y mujeres o tras terapia anti-hormonal |
| Enfermedad renal crónica | Aclaramiento de creatinina<0,5ml/segundo. Creatinina sérica>1,8mg/dl |
| Hipotiroidismo | TSH>10mU/L |
| Rasgo talasémico | Conteo hematíes normal, VCM<80fl, ferritina normal o elevada. HbA2 elevada (>3%) |
| Síndrome mielodisplásico | Neutropenia o trombocitopenia en adición a anemia. VCM>100fl. Antecedente de exposición a radio o quimioterapia. Biopsia MO |
| Enfermedad hepática | Disminución producción factores de coagulación, hiperesplenismo. |
| Productos finales de la glicación avanzada | Elevación de los niveles séricos de carboximetil lisina (CML) asociado a la edad o en pacientes diabéticos |
| Déficit de selenio | Factor independiente de AM. Mayor proporción en anemias nutricionales y en AERC |
| Déficit de vitamina D | Asociado a la AIC |
AERC: anemia de la enfermedad renal crónica; AIC: anemia de la inflamación crónica; AM: anemia en la persona mayor; Hb: hemoglobina; MO: médula ósea; PCR: proteína C reactiva; sTfR: receptor soluble de transferrina; TSH: hormona estimulante del tiroides; UBE: unidad de bebida estándar; VCM: volumen corpuscular medio.
Las células sanguíneas tienen vidas limitadas y deben reponerse en la médula ósea (MO) continuamente durante la vida del sujeto a partir de una pequeña reserva de CMH. A pesar de que los resultados experimentales del trasplante seriado de MO en el ratón sugieren que el potencial replicativo de las CMH es finito, existe alguna evidencia de que la senescencia replicativa causa depleción de la reserva de células madre durante el desarrollo normal de la vida del ratón o el hombre34.
En el caso concreto de las CMH, los investigadores han demostrado que existen factores extrínsecos (microambiente) e intrínsecos a las CMH que se ven modificados con la edad y que pueden resumirse de la forma siguiente. Primero, aumento en el número de CMH fenotípicamente definidas; segundo, localización más distante de las CMH con respecto al endostio; tercero, menos tejido estromal de soporte; cuarto, acúmulo de adipocitos en la MO; quinto, cambios en los niveles de citocinas; sexto, aumento en el daño del ácido desoxirribonucleico (DNA); séptimo, exposición aumentada a especies reactivas de oxígeno (ROS); y octavo, cambios en la expresión génica y alteraciones epigenéticas35.
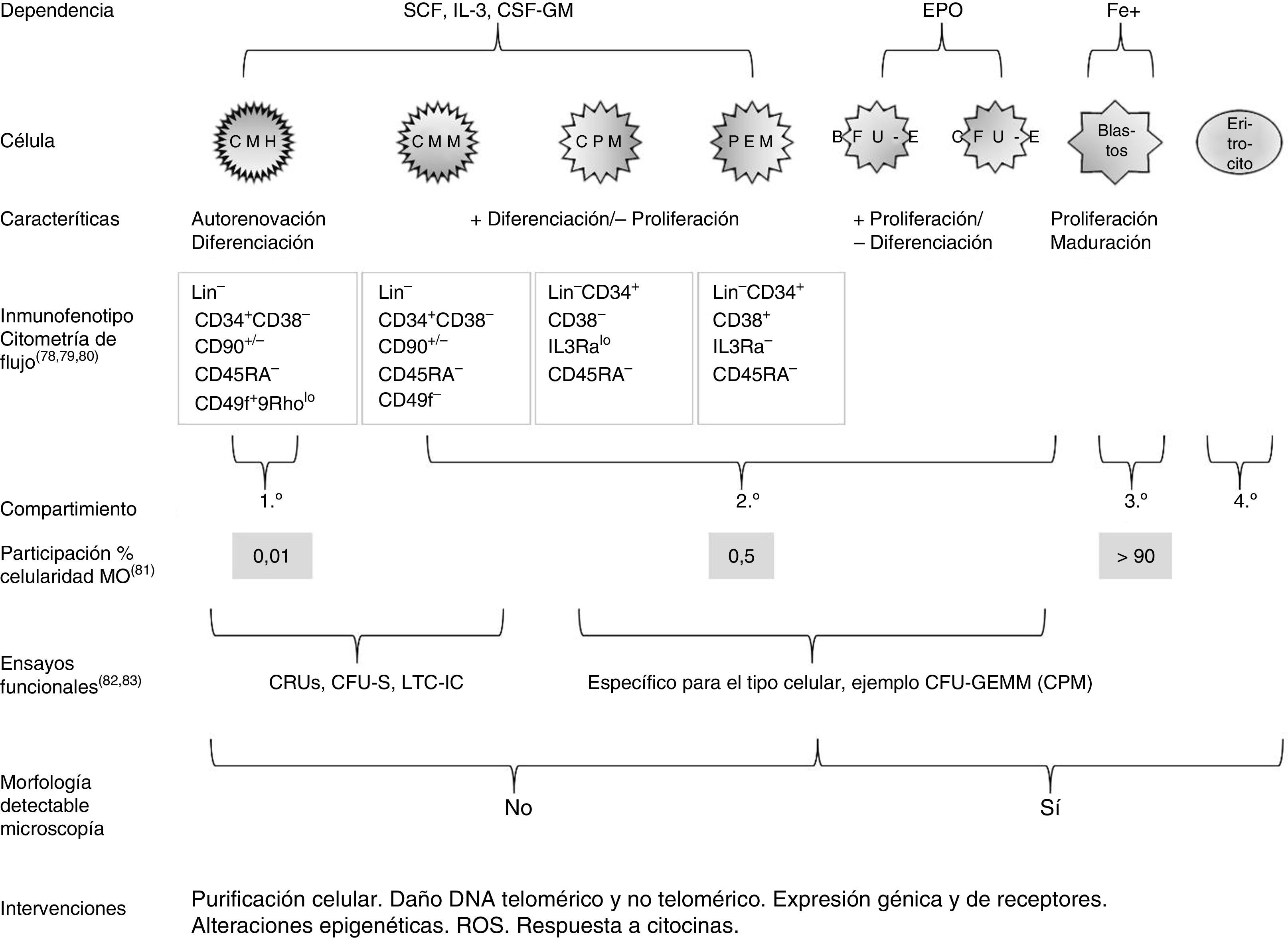
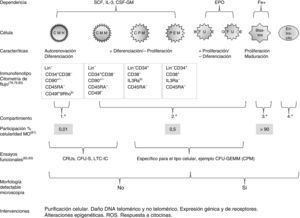
Está demostrado que las características centrales del envejecimiento del sistema hematopoyético se originan en el compartimento de las células madre y están mediadas por la expansión clónica de un subgrupo de células madre de sesgo mieloide, condicionando un déficit potencial del linaje linfoide36. Un breve resumen del estudio de la fisiología de la eritropoyesis se esquematiza en la figura 1.
Esquema que resume algunas características de la eritropoyesis humana y del estudio de su fisiología78–83. +: mayor; -: menor; BFU-E: unidad formadora de coloniaseritrocitarias de crecimiento rápido; Blastos:el conjunto de células precursoras: proeritroblasto, eritroblasto basófilo, eritroblasto policromático y eritroblasto ortocromático; CFU-E: unidad formadora de colonias eritrocitarias de crecimiento lento; CFU-GEMM: unidad formadora de colonias granulocito-eritrocito-monocito-megacariocito; CFU-S: unidad fromadora de colonias esplénicas; CMH: célula madre hematopoyética; CMM: célula madre multipotente; CPM: célula progenitora mieloide; CRU: unidad derepoblación competitiva; CSF-GM: factor estimulante de colonias granulocito-macrófago; DNA: ácido desoxirribonucleico; EPO: eritropoyetina; Fe+: hierro; IL-3: interleucina3; LTC-IC: célula iniciadora de cultivo a largo plazo; PEM: progenitor eritrocito-megacariocito; ROS: especies reactivas de oxígeno; SCF factor de células madre.
De acuerdo con Brusnahan et al.37, en los seres humanos las deficiencias hematológicas se hacen más evidentes con la edad, esto incluye a las anemias asociadas con un decremento en el compartimento precursor eritrocitario, describiéndose un declinar generalizado en la capacidad de reserva hematopoyética en la persona mayor, siempre considerando que la comorbilidad afecta significativamente el estatus hematopoyético en el mayor. La hematopoyesis basal suele ser adecuada en la mayoría de los mayores, pero la capacidad de respuesta al estrés, como por ejemplo a la quimioterapia, está comprometida y el MDS incrementa su incidencia en individuos mayores. Una explicación probable a esta problemática diversa es que el número o la calidad de las CMH se encuentran comprometidas por el proceso de envejecimiento, si bien, los cambios en el microambiente también pueden tener un papel.
Productos finales de la glicación avanzadaLos productos finales de la glicación avanzada (AGE) son el resultado de la unión espontánea de un azúcar reductor y los grupos amino de las proteínas, pudiendo también ocurrir con lípidos y ácidos nucléicos. Esta unión pasa por distintas etapas en su proceso de maduración y es tiempo-dependiente. Su depósito en el espacio intercelular y los entrecruzamientos entre ellos condicionan alteraciones en la elasticidad de los tejidos (colágeno, elastina, etc.), o bien, su unión a los receptores específicos en la célula (RAGE) alterará entre otras la transcripción de citocinas y de factores de crecimiento. En resumidas cuentas la producción, acúmulo y metabolismo de AGE condicionan una marcada respuesta proinflamatoria celular en diversos tejidos y órganos, la cual se ha visto asociada al envejecimiento.
Muy recientemente se han asociado los AGE y la anemia, tras evidenciarse que los AGE pueden disminuir la vida media del eritrocito30.
ObjetivosEncontrar evidencia en la literatura que soporte la participación de:
- 1.
El agotamiento de las células madre hematopoyéticas y,
- 2.
Los productos finales de la glicación avanzada, en la anemia inexplicada de la persona mayor.
Para obtener la información relacionada tanto con el agotamiento de CMH, como de los AGE, se realizan búsquedas en las bases de datos de la National Center for Biotechnology Information (NCBI), EBSCOhost Online Research Databases y LILACS entre los meses de Febrero y Octubre de 2014.
Agotamiento de células madre hematopoyéticasSe utilizó la estrategia siguiente para NCBI y EBSCO:
«Hematopoietic Stem Cells»[Mesh] AND «Aging»[Mesh] AND Anemia [ALL] AND Unexplained [ALL]. Solo 5 textos resultantes.
Por lo que se desestima el uso de los filtros para edad y especies, se elimina el descriptor “unexplained” y se complementa y amplia la búsqueda a las 4 estrategias siguientes; cuantificando los textos resultantes:
«Hematopoietic Stem Cells»[Mesh] AND «Aging»[Mesh] AND Anemia [ALL]. Textos 60.
«Hematopoietic System»[Mesh] AND «Cell Aging»[Mesh] AND Anemia [TIAB]. Textos 120
«Hematopoietic System»[Mesh] AND «Aging»[Mesh] AND Anemia [ALL]. Textos 93.
«Erythropoiesis»[Mesh] AND «Aging»[Mesh] AND «Anemia»[ALL]. Textos 54.
Y en LILACS ajustándose a las siguientes estrategias y resultados:
Hematopoietic Stem Cells AND aging. Textos 3.
Hematopoietic system AND cell aging. Textos 2.
Hematopoietic system AND aging. Textos 3.
Erythropoiesis AND aging. Textos 0.
Criterios de inclusión- 1.
Resultados de la investigación en humanos o animales que vincularon las características moleculares y/o celulares del envejecimiento primario con la función de las CMH y/o la eritropoyesis, asociando la presencia de anemia.
- 2.
Resultados de estudios clínicos o experimentales que relacionaron la edad con la eritropoyesis o el funcionamiento de la MO y/o de las CMH en humanos o animales.
- 3.
Resultados de estudios clínicos que evidencian la utilidad de pruebas clínicas o analíticas para la clasificación de las anemias en el paciente mayor.
- 1.
De artículos de revisión.
- 2.
Que presentan resultados de estudios de anemias de origen periférico, anemias en insuficiencia renal crónica y hemodiálisis, anemias hereditarias, anemias oncológicas, anemias secundarias a fármacos, quimio o radioterápicos, anemias causadas por enfermedades infecciosas y modelos animales que no remedan el proceso de envejecimiento.
Se utilizó la siguiente estrategia de búsqueda para las bases de datos NCBI, EBSCO; cuantificando los textos resultantes:
«Glycosilation End Products, Advanced»[Mesh] AND «Anemia» [ALL]. Textos 14.
Y en LILACS ajustándose a la siguiente estrategia y resultados:
Glycosilation end products AND anemia. Textos 0.
Criterios de inclusión1- Estudios en humanos que vinculen el envejecimiento y los AGE con AM.
Criterios de exclusión- 1.
Estudios de anemias en insuficiencia renal crónica y hemodiálisis, anemias hereditarias, anemia asociada a diabetes mellitus, anemias oncológicas, anemias inducidas o secundarias a fármacos, quimio o radioterápicos.
- 2.
Artículos de revisión.
Búsqueda y selección bibliográfica agotamiento de CMH y AGE.
-Búsqueda electrónica:
Resultados por estrategia de búsqueda (número de artículos) NCBI/EBSCO/LILACS:
5, 63, 122, 96, 54. Total 340 textos para CMH y un total de 14 textos para AGE.
-Búsqueda manual:
Artículos identificados en las referencias de los artículos resultantes y en artículos de revisión, para CMH 31 textos, para AGE un texto.
-Total de textos:
Tras aplicar los criterios ya descritos para cada una de las condiciones y eliminar los artículos repetidos.
- a.
Búsqueda electrónica y manual CMH, seleccionados 10 y 18 textos respectivamente. Gran total=28 textos.
- b.
Búsqueda electrónica y manual AGE, seleccionados 3 y un textos respectivamente. Gran total=4 textos.
El número total de artículos incluidos en esta revisión fue de 28, de los que se desprendieron 37 trabajos (algunos artículos analizan más de una relación de variables en 2 o 3 poblaciones distintas). El número total de trabajos en humanos fue de 22 (59%) y el número total en animales de 15 (41%). Con un número total de estudios de 53 (algunos investigadores realizaron 2 o 3 tipos de estudio en un mismo trabajo, ejemplo: ensayo clonogénico y expresión génica), 27 en humanos y 26 en animales.
A continuación se clasificó el tipo de anemia declarada en el trabajo, realizándose la mayoría de los trabajos en individuos sanos (40%), seguidos en frecuencia por la anemia inducida en modelo animal (32%), luego con igual participación (8%) y 3 estudios respectivamente la AI y las anemias que simplemente cumplieron criterios diagnósticos de la OMS. En los restantes trabajos, uno por condición, uno se valoró mediante volumen corpuscular medio (VCM), otro proponiendo un modelo de envejecimiento mediado por ROS que condicionó anemia, uno más en el que esta no fue valorada y un último en el que esta condición no fue aplicable ya que se partió de la comparación de la determinación de diana terapéutica de rapamicina en mamíferos (mTOR) en CMH de ratones viejos vs jóvenes sin determinarse la existencia de anemia.
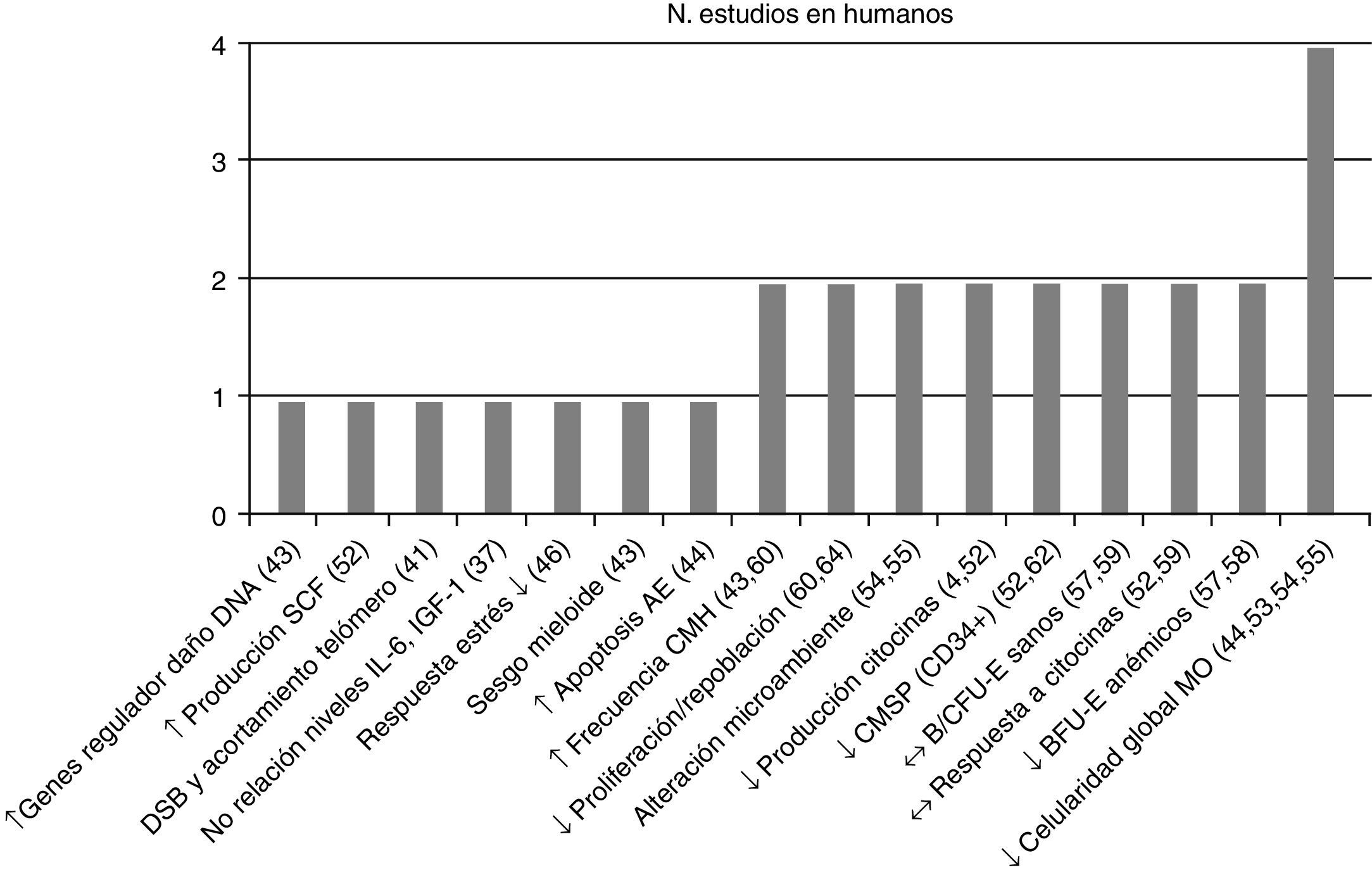
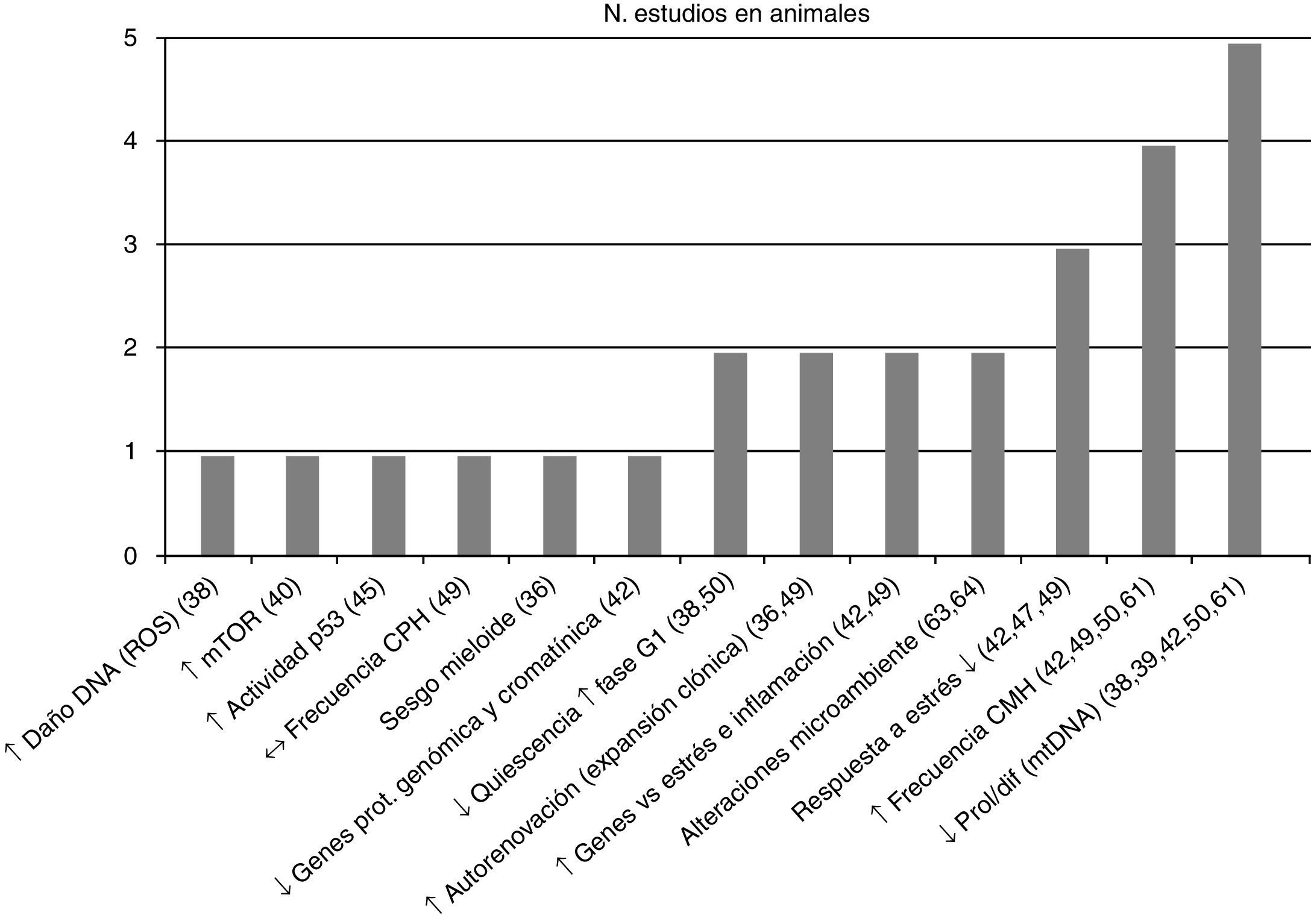
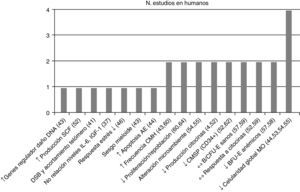
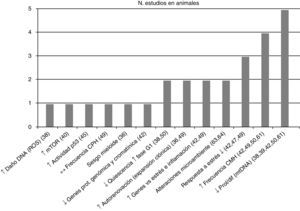
Posteriormente se separaron las conclusiones de los estudios efectuados por tipo de población vinculándolas con su respectiva referencia bibliográfica –en la figura 2 estudios en humanos y en la figura 3 en animales– y se asoció con el número de estudios que sustentaron la misma conclusión, todas ellas relacionadas con el proceso de envejecimiento primario y su probable causa/asociación con el agotamiento de CMH.
Conclusiones y número de estudios en CMH de humanos. ↑: incremento; ↓: reducción; ↔: sin cambios; AE: asociado a la edad; B/CFU-E: unidades formadoras de colonias eritroides, de respuesta rápida/lenta; BFU-E: unidades formadoras de colonias eritroides de respuesta rápida; CMSP: célula madre en sangre periférica; CMH: célula madre hematopoyética; DNA: ácido desoxirribonucleico; DSB; rotura de la doble cadena de DNA; IGF-1: factor de crecimiento insulínico tipo 1; IL-6: interleucina 6; MO: médula ósea; SCF: factor de células madre.
Conclusiones y número de estudios en CMH de animales. ↑: incremento; ↓: reducción; ↔: sin cambios; CMH: células madre hematopoyéticas; CPH: células progenitoras hematopoyéticas; DNA: ácido desoxirribonucleico; mtDNA: DNA mitocondrial; Mtor: diana de Rapamicina, mamíferos; prol/dif: proliferación/diferenciación; ROS: especies reactivas de oxígeno.
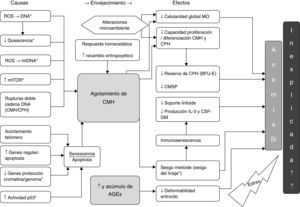
La CMH con la edad se ve expuesta a daño oxidativo (en el DNA) (fig. 4), asociando disminución de la quiescencia38, incluso se ha probado la existencia de daño oxidativo a nivel del DNA mitocondrial39, con incremento en la expresión de mTOR40, acúmulo de rupturas de la doble cadena de DNA y acortamiento del telómero (incluidas las células progenitoras hematopoyéticas –[CPH])41, disminución de genes reguladores del remodelado cromatínico y de protección genómica no telomérica42, favoreciendo la senescencia y apoptosis celular43,44 con un demostrado incremento lineal relacionado a la edad en la actividad de p5345 condicionando estos mecanismos una pobre respuesta al estrés y dificultando el retorno a la homeostasis de la CMH43,46,47, todo lo cual está en línea con las características del envejecimiento que condicionan el fenotipo actual de agotamiento de las células madre48.
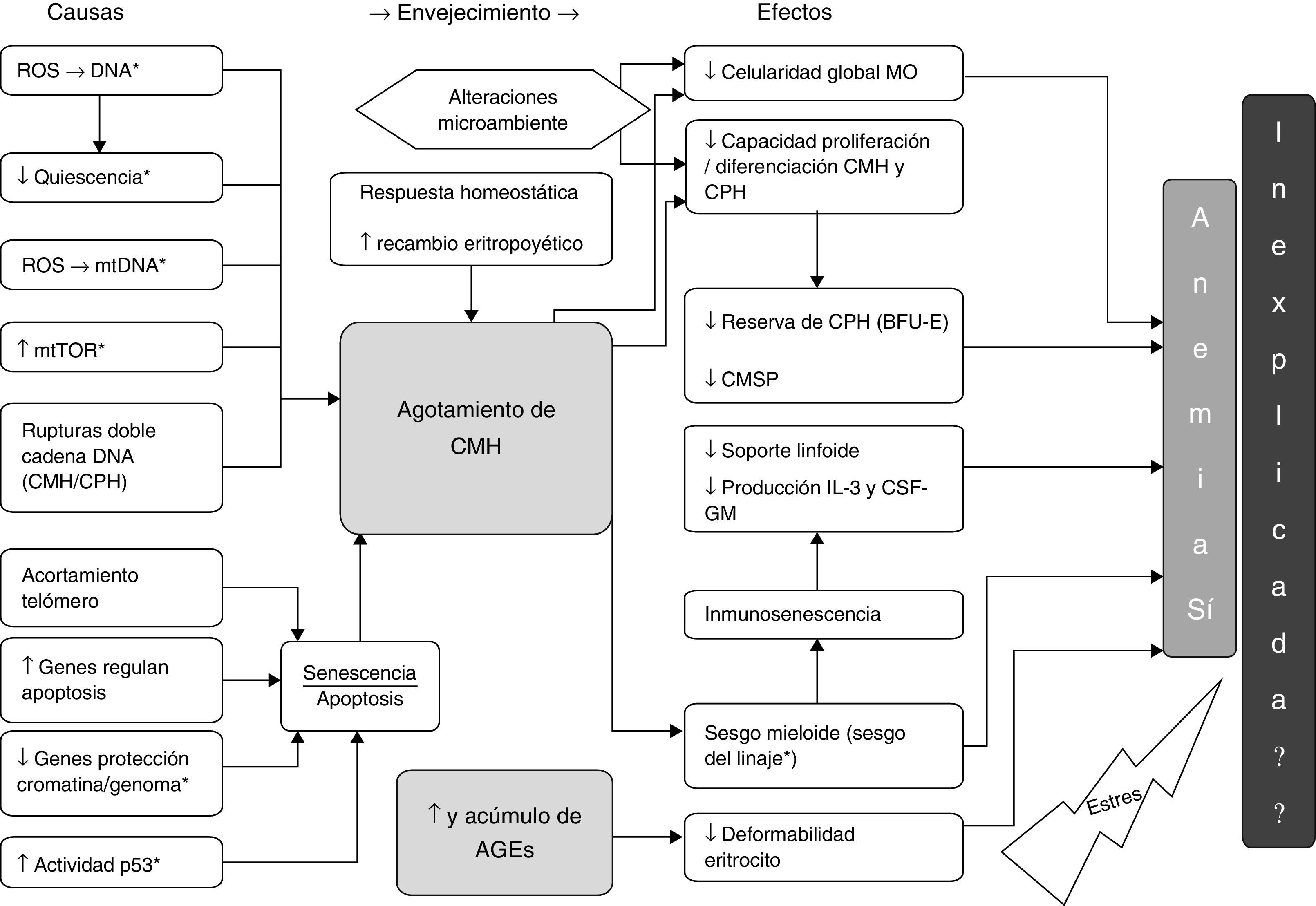
Causas y efectos hallados en la revisión en relación con el agotamiento de CMH y los AGE y su probable asociación con la AM y la AI. *: modelo animal; AGE: productos finales de la glicación avanzada; BFU-E: unidad formadora de colonias de eritrocitos de respuesta rápida; CMH: célula madre hematopoyética; CPH: célula progenitora hematopoyética; CMSP: célula madre en sangre periférica; CSF-GM: factor estimulante de colonias granulocito/monocito; IL-3: interleucina 3; MO: médula ósea; mtDNA: DNA mitocondrial; mTOR: diana de Rapamicina, mamíferos; ROS: especies reactivas de oxígeno.
También existe evidencia de respuestas homeostáticas, como son, el aumento en la expresión de genes versus el estrés y la inflamación42,49, y de genes que regulan el daño en el DNA43. Aumentan la autorenovación (por expansión clónica)36,49 y la proporción de CMH en fase G1 del ciclo celular50, esto recientemente apoyado por la evidencia de que la CMH repara el daño adquirido con el envejecimiento en el DNA cuando reentra en el ciclo celular51 y finalmente asociando un aumento en la producción de factor de células madre (SCF)52.
El daño de la CMH asociado a la edad repercute en agotamiento de la CMH y las respuestas al mismo favorecen, entre otros, un aumentado recambio eritropoyético, el cual finalmente incide también en el agotamiento de las CMH.
Como efecto de los mecanismos mencionados sobre la CMH se ha detectado una disminución global de la celularidad de la MO44,53,54, de hecho, esta es dependiente de una disminución de la celularidad estromal y hematopoyética con un aumento asociado del tejido adiposo55, por desgracia estas determinaciones estáticas y únicas suelen estar sujetas a errores en la toma de muestras y estas estimaciones no aportan datos sobre la dinámica celular en la eritropoyesis56.
Existe discrepancia en los estudios realizados por Baraldi-Junkins, Hirota y Lipschitz57–59 con respecto a la frecuencia de unidad formadora de colonias eritrocitarias de respuesta rápida (BFU-E) y unidad formadora de colonias eritrocitarias de respuesta lenta (CFU-E) cuando se comparan en ancianos sanos y anémicos, aunque prevalece el consenso sobre una disminución en la frecuencia de BFU-E con la edad en personas mayores anémicas.
Por otro lado, se ha evidenciado un aumento en la frecuencia de CMH en MO de humanos43,60 y de ratones42,49,50,61, pero con una disminuida capacidad proliferativa y de diferenciación (CPH, BFU-E)38,39,42,50,60,61, lo cual podría justificar la disminución de células madre en sangre periférica (CMSP)52,62. A pesar de lo anterior, las CMH mantienen una adecuada respuesta a eritropoyetina (EPO), intereIeucina-3 (IL-3) y factor estimulante de colonias-granulocito-macrófago (CSF-GM)52,59.
A la disminuida capacidad proliferativa se suma la tendencia de las CMH a un sesgo mieloide, presumiéndose ésta como un intento por mantener la homeostasis en la eritropoyesis, pero con una sensible afectación sobre la serie linfoide, la que a su vez favorece la inmunosenescencia36,43, condicionando esta un pobre soporte linfoide (mononuclear) de la eritropoyesis4 y una disminución en la producción de IL-3 y GM-CSF fundamentales para la diferenciación celular eritroide52.
Más aún, la CMH con la edad se ve afectada por otras alteraciones del microambiente como el distanciamiento de las CMP respecto al endostio alterando el vínculo CMH/CPH tempranas con el nicho hematopoyético y la consecuente disminución en la hematopoyesis63,64, no asociada a disminución significativa de las células madre mesenquimales-estromales (CMME), ni asociada con niveles séricos elevados de interleucina-6 (IL-6) o factor de crecimiento insulínico tipo 1 (IGF-1)37.
Resulta interesante mencionar que el único trabajo experimental que intenta relacionar la longitud del telómero directamente con la AM no encuentra justificación para sus hallazgos, quizá, debido a un error de diseño65.
Un 8% de los textos seleccionados (3 estudios) para el agotamiento de CMH relacionan este agotamiento y la AM, basados únicamente en los criterios para anemia de la OMS y no efectúan un despistaje para la AI. Únicamente en 3 de los estudios seleccionados, los investigadores intentan vincular el agotamiento de CMH con la AI (Hirota, 1988, Lipschitz, 1984, Lipschitz, 1981), siguiendo estrictos criterios de inclusión para la AI, sobre todo en el efectuado por Lipschitz en 1984, pero a su vez entre ellos no existe homogeneidad en estos criterios. En el trabajo de Lipschitz de 1981 no se utiliza ensayo clonogénico y el siguiente (Lipschitz) de 1984 difiere en sus conclusiones con el de Hirota de 1988 en la disminución de la frecuencia de BFU-E cuando se comparan ancianos anémicos contra jóvenes sanos, este punto crucial encuentra respaldo para la disminución de BFU-E en el trabajo de Bagnara et al. en el año 2000, pero este a su vez adolece de cribado para AI. Es cierto que en otros trabajos de investigación y en múltiples revisiones se hace referencia y se señala a la disfunción o al agotamiento de las CMH como causa probable de AI2,8,29,34,48,66–74, pero en estos textos o en cualquiera de los trabajos seleccionados para esta revisión no se aportan datos sobre la incidencia o prevalencia del agotamiento de CMH en la AI o en la AM.
Productos finales de la glicación avanzadaEn extensos estudios en mayores, los AGE (específicamente CML) y sus receptores se han visto relacionados con AM en mujeres mayores de 65 años que viven en la comunidad32, vinculándose a una Hb disminuida y a un incremento de la CML en mayores anémicos33, consolidándose la CML como un predictor independiente de AM75, etiológicamente esta anemia se cree fundamentalmente relacionada con la disminución en la deformabilidad del eritrocito76.
Hasta mediados de la década pasada el consenso general cuando se hablaba de anemia en el anciano era fundamentalmente que esta no tenía una relación directa con el envejecimiento, pero se aceptaba (y está demostrado) que la CMH envejecida y su descendencia tenían una respuesta limitada al estrés42,46,49,77. A partir de finales de la década pasada y hasta hoy cada vez hay más evidencias de que el mero proceso de envejecimiento puede condicionar anemia en animales, como lo demuestran los estudios de Rossi et al.47 que evidencian que existe disminución de la capacidad de reparación del DNA a través de la pérdida asociada a la edad de reparación por escisión de nucleótido (NER), de unión de bases no homólogas al final de la cadena (NHEJ) y de mantenimiento del telómero (mTR), también participan mecanismos clásicos, como lo es la exposición a las ROS a lo largo de la vida, como demuestran Ito et al.38 y el aumento relacionado a la edad de la expresión de mTOR por la CMH40. Y en humanos, Rübe et al. demuestran acúmulo de rupturas de la doble cadena DNA y acortamiento del telómero en CMH41.
Desde el punto de vista de los trabajos seleccionados sobre AGE y AM, su relación parece entrar en un terreno menos especulativo, a pesar de que los autores proponen este mecanismo como una probable causa de AI, tampoco se aporta en ningún estudio una aproximación epidemiológica que sitúe la incidencia o la prevalencia de este mecanismo dentro de la AI o la AM.
Conclusiones-La falta de consenso en los criterios de inclusión y exclusión para la AI pudo favorecer los resultados dispares en 2 de los 3 estudios que vinculan directamente la anemia inexplicada de la persona mayor con el agotamiento de las células madre hematopoyéticas, sin embargo:
- 1)
Existe evidencia clara en la literatura de que algunos de los procesos moleculares y celulares característicos del envejecimiento primario condicionan agotamiento de las células madre hematopoyéticas.
- 2)
Existe evidencia en la literatura de que el agotamiento de las células madre hematopoyéticas y los productos finales de la glicación avanzada pueden condicionar AM.
- 3)
Existe cierta evidencia y se presume que tanto el agotamiento de células madre hematopoyéticas y los productos finales de la glicación avanzada se pueden considerar como causas de AI.
El autor declara no tener ningún conflicto de intereses.