INTRODUCCIÓN
Los organismos vivos, desde las bacterias a los seres humanos y plantas, responden a la hipertermia sintetizando un grupo de proteínas conocidas como «proteínas de choque térmico» (heat shock proteins, Hsp). Éstas existen en todas las células en condiciones normales y están localizadas en el citosol, en las mitocondrias, en el retículo endoplasmático o en el núcleo. Se dividen en familias en función del peso molecular (de unos 15 a 110 kD) y la misión que desempeñen. La Hsp27 pertenece al grupo de las small Hsp1.
Varios estudios han demostrado que la sobreexpresión de Hsp27 en células de mamíferos es suficiente condición para conferir termorresistencia2,3.
La síntesis de Hsp es inducida no sólo ante el estrés térmico, sino también tras la exposición a quimioterapéuticos, etanol, metales pesados, análogos de aminoácidos o radicales libres, entre otros4.
Uno de los mecanismos por los que el estrés térmico o químico daña a los seres vivos es la desnaturalización proteica. Las Hsp son las encargadas de reparar el daño proteotóxico originado por estos agentes. Su misión es conservar las proteínas celulares en la configuración y concentración apropiada para desarrollar adecuadamente su función. Están implicadas en el plegamiento de las proteínas recién formadas y en la reestructuración de las deterioradas, previenen la agregación proteica, seleccionan las que los proteasomas y los lisosomas deben eliminar, participan en el proceso de apoptosis y están relacionadas con el control de la respuesta inmune y la inflamación5.
Una de las primeras consecuencias del estrés térmico en eucariotas es la disrupción del citoesqueleto y la inestabilidad de los filamentos de actina, factor importante en la supervivencia de las células expuestas a hipertermia y otras tensiones6-10. La termorresistencia celular se correlaciona con la cantidad de Hsp27 presente en el momento del estrés térmico, ya que la sobreexpresión de Hsp27 confiere una gran estabilidad a las fibras de actina durante la hipertermia permitiendo la supervivencia celular3. Recientemente se ha descubierto además que tanto la Hsp27 como las Hsp70 y Hsp90 son moléculas inhibidoras de la apoptosis celular11,12. También hay que destacar el papel de la Hsp27 como marcador pronóstico de ciertos tumores, como el hepatocarcinoma (CHC), el cáncer de mama, el astrocitoma cerebral o el fibrohistiocitoma maligno13-16.
Por otra parte, determinados cambios en la expresión de las Hsp pueden ser importantes para que un individuo envejezca, ya que la senescencia se caracteriza fisiológicamente por una disminución en la capacidad de los organismos para defenderse del estrés ambiental17. El envejecimiento lleva consigo un aumento en la tasa de modificación proteica: en un anciano de 80 años, una proporción importante de sus proteínas pueden llegar a estar oxidadas en el caso de un estrés oxidativo suficientemente intenso18-20.
Estudios experimentales en animales han demostrado que, aunque el envejecimiento no modifica o en algunos casos aumenta per se el nivel basal de Hsp (respuesta adaptativa), sin embargo provoca un defecto en la producción de Hsp inducida por el estrés de hasta un 50% en comparación con animales jóvenes1,11,21-24. Y si el sistema que repara el daño proteotóxico está mermado o no funciona correctamente, a medida que envejecemos se produce una acumulación de proteínas alteradas que da lugar a muchas de las enfermedades relacionadas con la edad como la enfermedad de Alzheimer, el Parkinson y otros procesos neurodegenerativos, las cataratas, la ateroesclerosis o el cáncer5,19,25.
Hay pocos estudios que investiguen sobre la expresión de la Hsp27 en muestras hepáticas humanas13,26-30.
Nuestro estudio pretende describir las diferencias en la expresión de la Hsp27 entre hígados con y sin patología y la variación de ésta con el envejecimiento en muestras humanas.
MATERIAL Y MÉTODO
Población y procesamiento de muestras
Se trata de un estudio de carácter observacional y retrospectivo. Se incluyó 33 biopsias hepáticas consecutivas realizadas en el Hospital Gregorio Marañón en el año 2003, identificadas tras obtener un listado del GRD (grupos relacionados de diagnósticos o sistema de clasificación de pacientes que permiten agruparlos según complejidad o gravedad) de procedimiento «biopsia hepática» y cuyas muestras permanecen en el archivo histórico del servicio de anatomía patológica de este hospital. Los criterios de inclusión en el estudio fueron: toda biopsia hepática de paciente con edad ≥ 18 años, sea cual fuere la patología diagnosticada. Se excluyó a los pacientes en los que, por algún motivo excepcional, no se tuvo acceso a sus datos clínicos.
Las muestras se clasificaron según el grupo diagnóstico al que pertenecían. Distinguimos dos grupos:
Biopsias con resultado normal (ausencia de hallazgos histológicos patológicos)
Biopsias con patología de carácter inflamatorio, entre las que distinguimos: hepatitis agudas de diferentes orígenes como virales, medicamentosas, alcohólicas, etc., hepatitis crónicas de origen viral, tuberculoso, tóxico y autoinmune y, por último, cirrosis sobre hepatitis crónicas por el virus de la hepatitis B (VHB) o el virus de la hepatitis C (VHC), alcohólicas o criptogenéticas.
Respecto a las biopsias de injerto hepático (postrasplante), en este estudio sólo analizaremos aquéllas con patología inflamatoria (hepatitis aguda o crónica sobre injerto) o con hallazgos histológicos de rechazo, y se incluirán en el grupo previamente mencionado de biopsias con patología inflamatoria, en los dos primeros análisis. En las dos últimas comparaciones, puesto que no hay biopsias de injerto hepático en ancianos y para hacer los grupos comparables, únicamente se analizarán en los dos grupos («adultos de mediana edad» y «ancianos», y en la última comparación «ancianos de 65-75 años» y «ancianos de 75 años o más») los hígados inflamatorios no procedentes de biopsias de injerto.
Los cortes histológicos se recogieron en portaobjetos silanizados. El procesamiento para las tinciones inmunohistoquímicas se realizó automáticamente en un equipo Techmate de acuerdo con un protocolo que, de modo resumido, consiste en desparafinar los cortes en xileno e hidratarlos en alcoholes de graduación decreciente. Posteriormente, las muestras se sumergieron en búfer citrato (10 mmol/l, pH = 6) y se calentaron en un microondas de 500 watios de potencia durante 15 min. A continuación se les aplicó suero no inmune durante 10 min, seguido de una incubación con anticuerpo anti-Hsp27 humana (clon SX53G8, Dako, Cal.) a una dilución de trabajo 1:100. Posteriormente se lavaron con búfer fosfato salino durante 5 min. El revelado se realizó mediante Emvision® (Dako). Posteriormente se tiñeron con hematoxilina-eosina y se montaron en gelatina de glicerol.
La cuantificación de la positividad para Hsp27 de las biopsias teñidas fue realizada por un patólogo, y se calculó el porcentaje de hepatocitos con expresión positiva en campos microscópicos no solapados. Se utilizó los rangos arbitrarios que se muestran a continuación:
0: 0-5% de hepatocitos con tinción positiva para Hsp27.
1: 6-25% de hepatocitos con tinción positiva para Hsp27.
2: 26-50% de hepatocitos con tinción positiva para Hsp27.
3: 51-75% de hepatocitos con tinción positiva para Hsp27.
4: > 75% de hepatocitos con tinción positiva para Hsp27.
Como resumen de los anteriores, y a partir de los rangos utilizados previamente en otros estudios, simplificamos la expresión en dos:
Porcentaje «alto» de hepatocitos con Hsp27 (rangos 2, 3 y 4 previos): > 25% de hepatocitos expresan la Hsp27.
Porcentaje «bajo» de hepatocitos con Hsp27 (rangos 0 y 1 previos): ¾ 25% de hepatocitos la expresan.
El grado de intensidad de la expresión de la Hsp27 en hepatocitos también se evaluó de forma semicuantitativa por el patólogo, de forma que se consideró:
Ausencia de intensidad o intensidad débil: grados 0 y 1.
Intensidad fuerte: grados 2 y 3.
Dos patólogos especialmente entrenados leyeron cada muestra en el microscopio, y se alcanzó un diagnóstico de consenso.
Se tomó fotografías de cada espécimen una vez completada la tinción.
Variables del estudio
Se revisó retrospectivamente las historias clínicas de los pacientes. Las principales variables recogidas en este estudio fueron:
Variables demográficas: fecha de nacimiento, sexo.
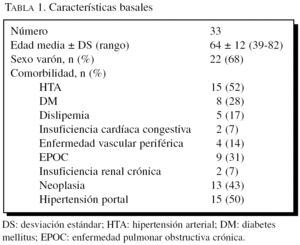
Comorbilidad: existencia o no de antecedentes personales de hipertensión, diabetes mellitus, dislipemia, insuficiencia cardíaca, enfermedad vascular periférica, enfermedad pulmonar obstructiva crónica (EPOC), insuficiencia renal crónica, neoplasia y datos de hipertensión portal: historia previa de descompensación edemoascítica, encefalopatía hepática o varices esofágicas.
Respecto a las variables relacionadas con las biopsias hepáticas, analizamos:
Presencia o no de la proteína de choque Hsp27.
Área predominante de expresión dentro del lobulillo hepático:
1. Central: se expresa en área 3 o centrolobulillar.
2. Difusa: se expresa de forma homogénea en todo el lobulillo.
3. Asociada a lesión: expresión asociada a una estructura concreta, como puede ser un granuloma, los septos fibrosos o peritumoral.
Porcentaje de hepatocitos en que la proteína se expresa:
1. Porcentaje alto: > 25% de hepatocitos expresa la Hsp27.
2. Porcentaje bajo: ¾ 25% de hepatocitos la expresa.
Intensidad de la expresión en los hepatocitos:
1. Ausencia de intensidad o intensidad débil: grados 0 y 1.
2. Intensidad fuerte: grados 2 y 3.
Análisis estadístico
Para evaluar si había diferencias entre grupos respecto a sus características basales, se analizaron las variables continuas mediante la t de Student, y para las variables categóricas se usó la prueba de la χ2.
La expresión de la proteína de choque Hsp27 entre hígados con/sin patología y en función del grupo de edad al que pertenecían se comparó mediante el test exacto de Fisher.
Se analizaron los datos con el programa estadístico SPSS® versión 11.5. Un valor de p < 0,05 fue considerado estadísticamente significativo.
RESULTADOS
De las 33 biopsias hepáticas incluidas en el estudio, un 68% pertenece a varones. Las características basales se presentan en la tabla 1. La edad media es de 64 ± 12 años (39-82). La edad media por subgrupos es 55 ± 9 años en el grupo de «adultos de mediana edad» (65 años o menores, n = 18) y 75 ± 3 años en el de «ancianos» (mayores de 70 años, n = 15). No hay diferencias significativas en las características basales de los subgrupos en ninguna de las comparaciones realizadas (hígados normales frente a patológicos y entre los diferentes grupos de edad), salvo por la mayor presencia de EPOC en el grupo de pacientes «ancianos» (el 53% [8/15] frente al 7% [1/14]; p < 0,05) (tabla 2).
Las biopsias hepáticas se clasifican por patología en: normal (21%) e inflamatoria (79%) (inflamatoria sobre injerto [30%]). La zona captante predominante es la central (33%) seguida de la asociada a lesión (27%). La intensidad es fuerte (2 o 3) en el 61%. El porcentaje de hepatocitos que expresa la Hsp27 es alto (más del 25%) en un 33%.
El tipo de patología y la distribución de la expresión de Hsp27 en la biopsias hepáticas en función de la edad se presentan en la tabla 3. El porcentaje de hepatocitos que expresa la Hsp27 por análisis inmunohistoquímico según la patología se presenta en la tabla 4. En la figura 1 podemos apreciar las diferencias en los porcentajes de hepatocitos que expresan la proteína Hsp27 entre el tejido hepático normal y la hepatitis crónica C evolucionada.
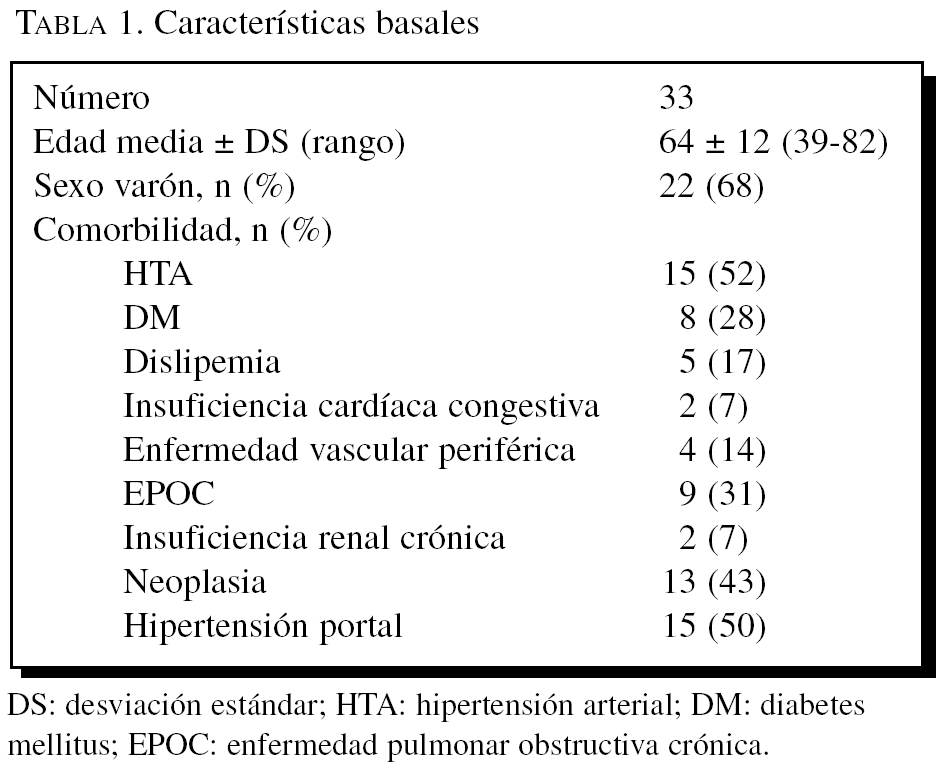
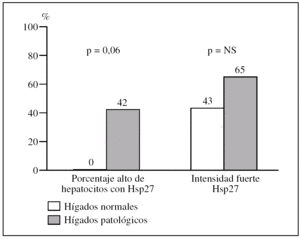
Figura 1.Diferencias en intensidad y en porcentaje de hepatocitos que expresa la proteína de choque Hsp27 al comparar biopsias normales con biopsias con patología inflamatoria.
Para analizar las diferencias en intensidad y porcentajes de hepatocitos que expresan la proteína de choque Hsp27 se realizan las siguientes comparaciones:
1. Hígados normales frente a patológicos.
Los hígados patológicos presentan un porcentaje alto de hepatocitos con Hsp27 con mayor frecuencia que los normales (11/26, 42% frente a 0/7, 0%, p = 0,06) (fig. 2).
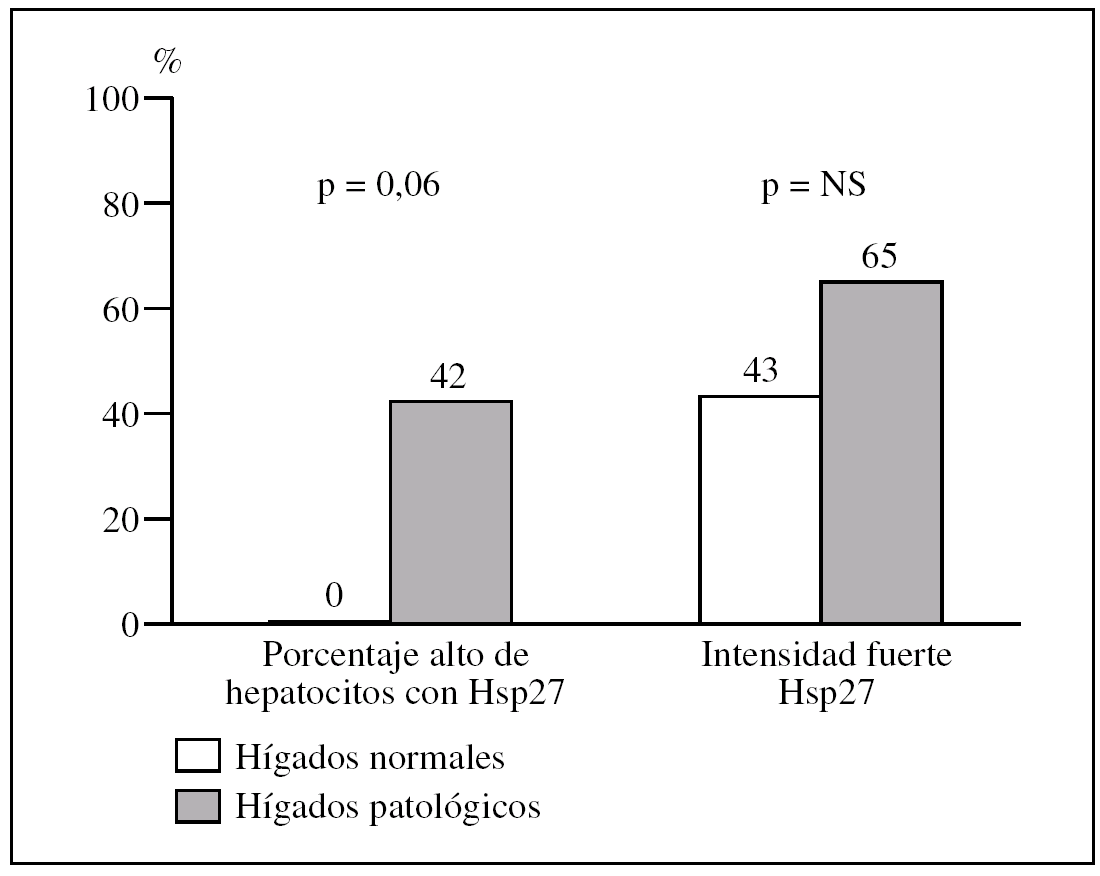
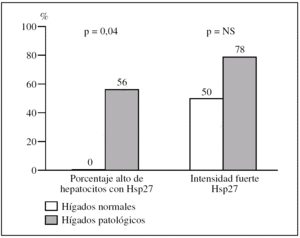
Figura 2.Diferencias en intensidad y en porcentaje de hepatocitos que expresa la proteína de choque Hsp27 al comparar biopsias normales con biopsias con patología inflamatoria en el subgrupo de pacientes mayores de 70 años.
2. Hígados normales frente a patológicos en pacientes mayores de 70 años.
En pacientes mayores de 70 años, los hígados con patología inflamatoria presentan un porcentaje alto de hepatocitos con Hsp27 con mayor frecuencia que los normales (5/9, 56% frente a 0/6, 0%, p = 0,04) (fig. 3).
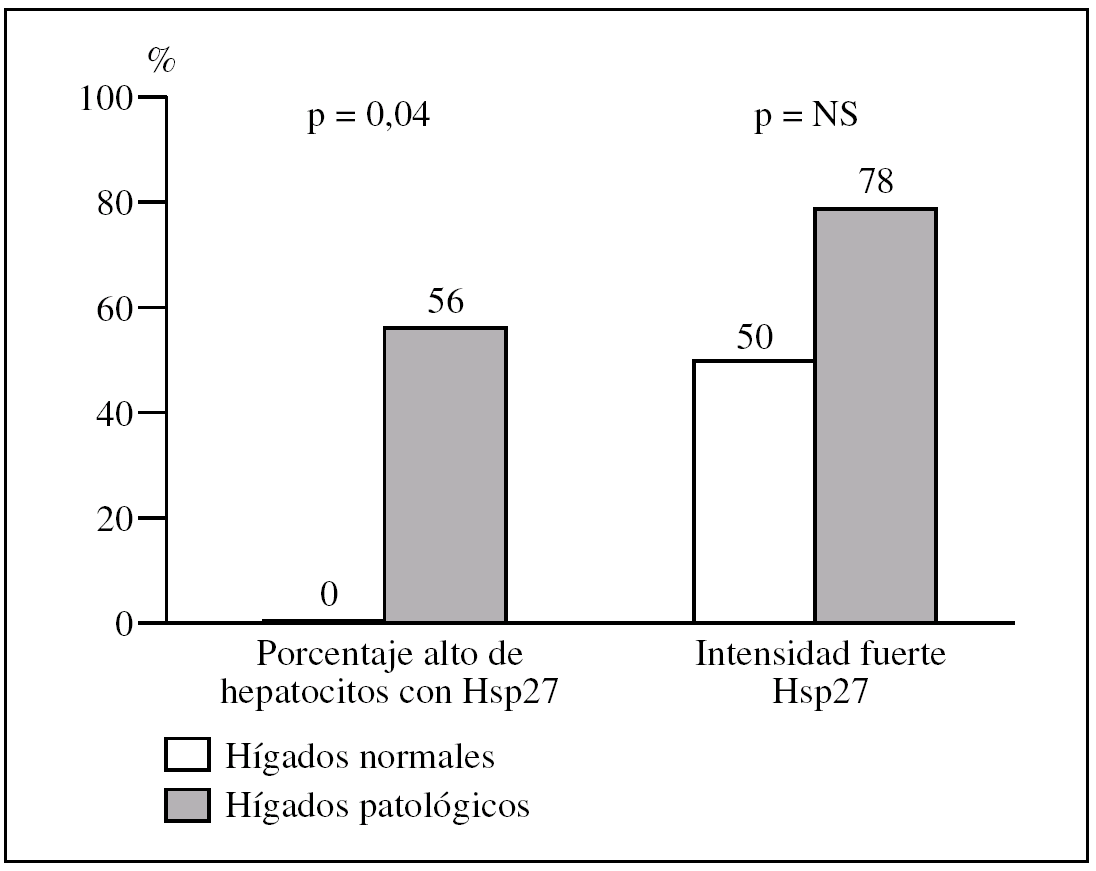
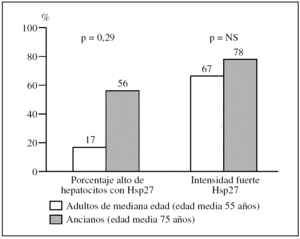
Figura 3.Diferencias en intensidad y en porcentaje de hepatocitos que expresa la proteína de choque Hsp27 al comparar biopsias con patología inflamatoria de adultos de mediana edad con las de ancianos mayores de 65 años.
3. En hígados con patología inflamatoria, los «adultos de mediana edad» (65 años o menores, edad media: 55 ± 9 años) frente a «ancianos» (mayores de 70 años, edad media: 75 ± 3 años).
El porcentaje de «adultos de mediana edad» con un porcentaje alto de hepatocitos con Hsp27 respecto al de «ancianos» es del 17% (1/6) frente al 56% (5/9) (p = 0,29) (fig. 4).
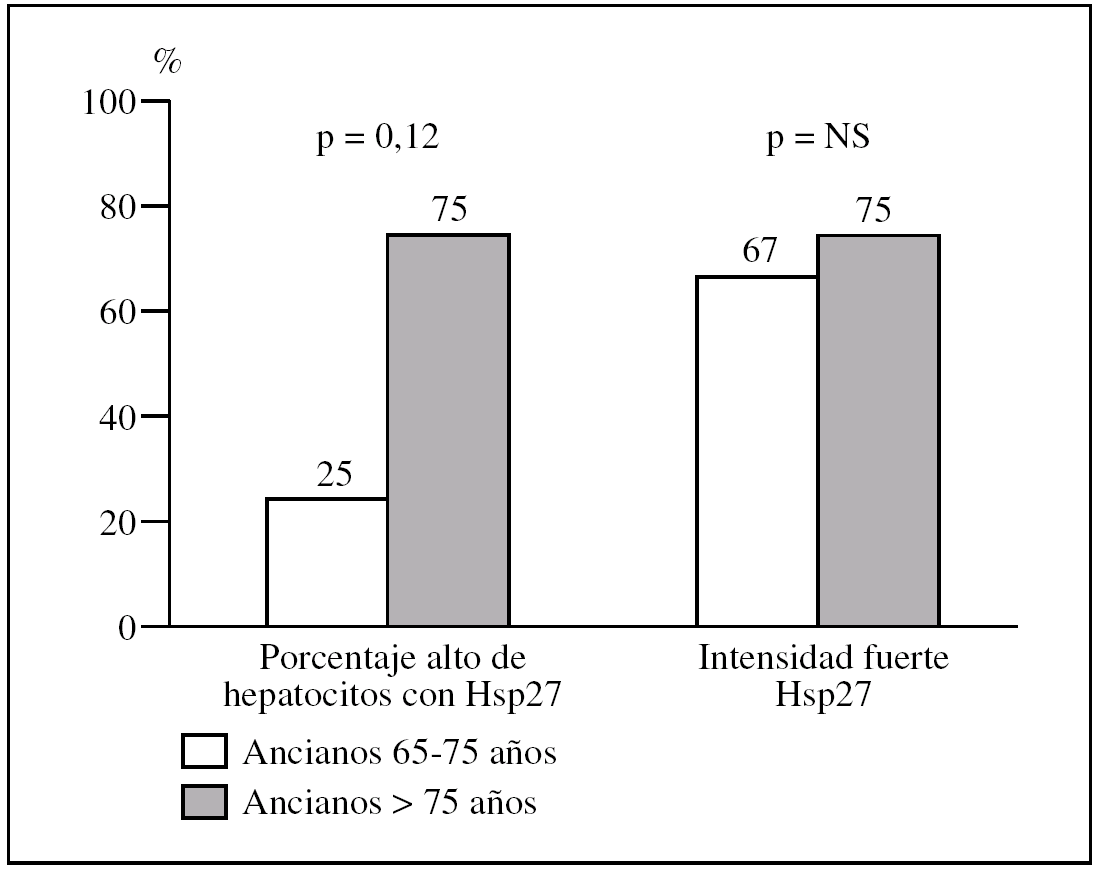
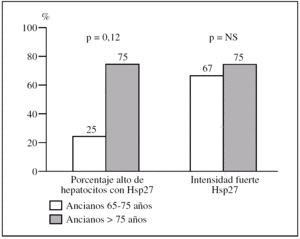
Figura 4.Diferencias en intensidad y en porcentaje de hepatocitos que expresa la proteína de choque Hsp27 al comparar biopsias con patología inflamatoria de ancianos con edades comprendidas entre 65 y 75 años con las de ancianos mayores de 75 años.
4. En hígados con patología inflamatoria, el grupo de mayores de 65 años por rangos de edad.
El porcentaje de «ancianos de 65-75 años» con un porcentaje alto de hepatocitos con HSP27 respecto al de «ancianos de 75 años o más» es del 25% (3/12) frente al 75% (3/4) (p = 0,12) (fig. 5).
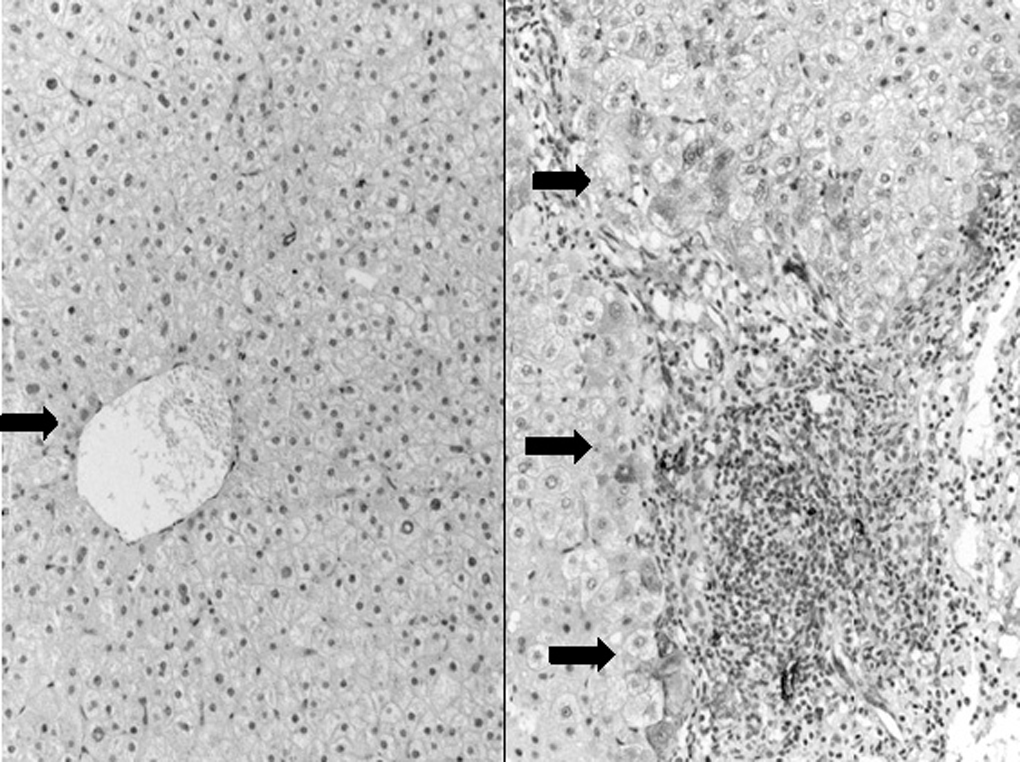
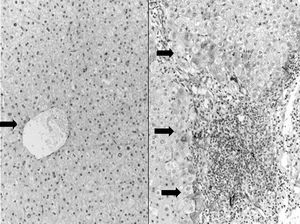
Figura 5.Izquierda: hígado normal. Ausencia de expresión de Hsp27 en el lóbulo hepático a excepción de alguna célula aislada en las inmediaciones de la vena central (flecha) (x40). Derecha: expresión incrementada de Hsp27 en la hepatitis C crónica evolucionada. Se observan células teñidas en la interfaz y en las proximidades de los puentes (flecha) (x100). Demostración inmunohistoquímica de la proteína mediante avidina-biotina y contraste nuclear con hematoxilina.
Hemos expuesto las diferencias entre grupos en cuanto a porcentaje de hepatocitos que expresan la Hsp27. No hay diferencias entre grupos en la intensidad de la expresión o la zona predominante.
DISCUSIÓN
Los resultados de nuestro estudio sugieren que la proteína de choque Hsp27 se expresa en un porcentaje mayor de hepatocitos en los hígados patológicos frente a los normales y esta diferencia es más acusada y alcanza la significación estadística cuando analizamos el grupo de pacientes mayores de 70 años. Hay escasos estudios que determinen el grado de expresión de la Hsp27 en biopsias hepáticas humanas normales, en comparación con biopsias correspondientes a otras patologías. Ciocca et al27 examinan la expresión de Hsp27 en muestras hepáticas de pacientes con/sin infección por el VHB. La mayor parte de las biopsias mostraba una expresión baja de la Hsp27. Los mismos hallazgos se encontraron en el estudio de King et al13, que describía la relación entre la expresión de la Hsp27 en CHC y el grado histológico y la supervivencia de los pacientes. La mayor parte de ellos eran portadores del VHB, además de haber desarrollado un CHC y el tejido circundante expresaba pobremente la Hsp27. El estudio extraía las siguientes conclusiones sobre la expresión de la Hsp27: es mayor en el CHC que en el tejido circundante, es mayor a mayor grado histológico del tumor, cuanto mayor es hay una menor supervivencia libre de enfermedad a los 5 años y una menor supervivencia global. Otro estudio, el de Delahye et al26 con una muestra de sólo 12 pacientes, también encontraba diferencias en la expresión de Hsp27 entre tejidos no neoplásicos y CHC (mayor expresión en estos últimos). Por último reseñar que Lim et al28, en un trabajo muy reciente, no solamente describe la expresión de la Hsp27 en pacientes con infección por el VHB en tejidos normales, nódulos hepáticos displásicos y CHC divididos en 3 grados de diferenciación histológica, sino que demuestra que hay una correlación moderada (Spearman's r = 0,4-0,75) entre la expresión de Hsp27 y la hepatocarcinogénesis (a mayor expresión de Hsp27, mayor agresividad de la lesión). En relación también con la significación pronóstica de la Hsp27, Harimoto et al30 describían cómo la expresión alta de Hsp27 se asociaba a mal pronóstico del CHC en presencia de VHB y, sin embargo, a buen pronóstico del CHC en caso de VHC. En nuestro estudio también disponíamos de biopsias de CHC, pero el reducido tamaño de la muestra no permitía realizar análisis más en profundidad. Tampoco había suficientes muestras de hígados normales como para hacer una comparación de la expresión de Hsp27 en hígados normales entre ancianos y jóvenes, que hubiera sido de gran interés, puesto que tampoco hay estudios al respecto.
No hemos encontrado en la literatura científica ningún trabajo que describa la diferencia en la expresión de la Hsp27 con el envejecimiento. Hay múltiples estudios que apoyan la hipótesis de que aunque la expresión basal de las Hsp no disminuye con la edad, sí lo hace la expresión inducida por el estrés1,11,19,21-24 y, así, individuos más ancianos expresarían menos proteínas de choque (sistema antiestrés) en respuesta a un estímulo estresante. Es posible que nuestros resultados, «mayor expresión a mayor edad», se debieran al azar dado el carácter reducido de la muestra, pero las tres comparaciones que relacionan edad y expresión muestran la misma tendencia e, incluso, a pesar del tamaño muestral, una de ellas alcanza la significación estadística, por lo que por lo menos nos invita a realizar estudios más amplios que confirmen o rechacen esta hipótesis. Todo ello teniendo en cuenta como factor estresante la propia patología inflamatoria. Quizá si sometiéramos a estas muestras a un nuevo estrés térmico, como en el estudio de Delahye et al26, entonces se evidenciaría una disminución de la inducción de Hsp27 en los individuos de más edad.
El principal punto fuerte del estudio es que por primera vez se analiza no sólo la expresión de la Hsp27 en biopsias hepáticas humanas, sino también su variación con el envejecimiento en el caso concreto de los pacientes con patología hepática inflamatoria.
Entre las limitaciones del estudio, cabe destacar el reducido tamaño muestral al que hemos hecho referencia previamente y la heterogeneidad de la patología, ya que dentro de la patología inflamatoria hay un amplio espectro de diagnósticos que requerirían un análisis por separado de la expresión de Hsp27 para comprobar si hay diferencias, según el diagnóstico. Además, sería conveniente introducir como información sobre la afectación hepática de los pacientes una gradación mediante la escala de Child, de interés pronóstico. Por último, cabe destacar que la técnica inmunohistoquímica utilizada debería de complementarse con otra, el análisis inmunoblot, que resulta más adecuada para realizar la comparación cuantitativa de la expresión de la proteína Hsp27 entre tejidos28, si bien es inapropiado usar el inmunoblot únicamente, ya que su medición se realiza sobre el total de los componentes del tejido, sin permitir la localización precisa de las estructuras expresantes, cosa que sí permite el análisis inmunohistoquímico.
CONCLUSIONES
Los resultados sugieren que la proteína de choque Hsp27 se expresa en mayor porcentaje de hepatocitos en los hígados patológicos frente a los normales, tanto en población general como en el grupo de pacientes mayores de 70 años.
Correspondencia: Dra. M.L. Álvarez Nebreda.
Servisio de Geriatría. Hospital General Universitario Gregorio Marañón.
C/ Doctor Esquerdo, 46. 28007 Madrid. España.
Correo electrónico: alvareznebreda@yahoo.es
Recibido el 5-07-05; aceptado el 3-01-06.