INTRODUCCIÓN
Sabemos que los trastornos hidroelectrolíticos, particularmente la hiponatremia, son un hallazgo frecuente en pacientes geriátricos. Asimismo, se sabe que la hiponatremia acarrea peor pronóstico con independencia de la enfermedad subyacente. Los no familiarizados con el proceso de envejecimiento renal las interpretan como secundarias a un síndrome de secreción inapropiada de hormona antidurética que, si bien es cierto para adultos con una capacidad tubular renal adecuada a su edad, no lo es tanto para personas mayores de 65 años. Por ello, pensamos que es útil una puesta al día de los mecanismos que controlan el manejo renal del sodio en el adulto sano y las modificaciones que acompañan al proceso de envejecimiento fisiológico renal para de esta forma interpretar adecuadamente las hiponatremias de los ancianos y su tratamiento correcto. Con esa intención revisaremos sucintamente la anatomía y la fisiología de los mecanismos implicados en la reabsorción tubular de agua y sodio en adultos y los compararemos con los de personas sanas mayores de 65 años. En segundo lugar, nos ocuparemos de interpretar funcionalmente la prueba de Chaimowitz, herramienta utilizada por los escasos autores que se han ocupado de este tema, casi siempre pediatras. Esta prueba permite localizar el segmento nefronal afectado lo que sin duda ayuda a entender el manejo tubular renal del sodio que acompañan al proceso de envejecimiento fisiológico y la etiología de gran parte de las hiponatremias observadas en ancianos.
Estructura de la nefrona
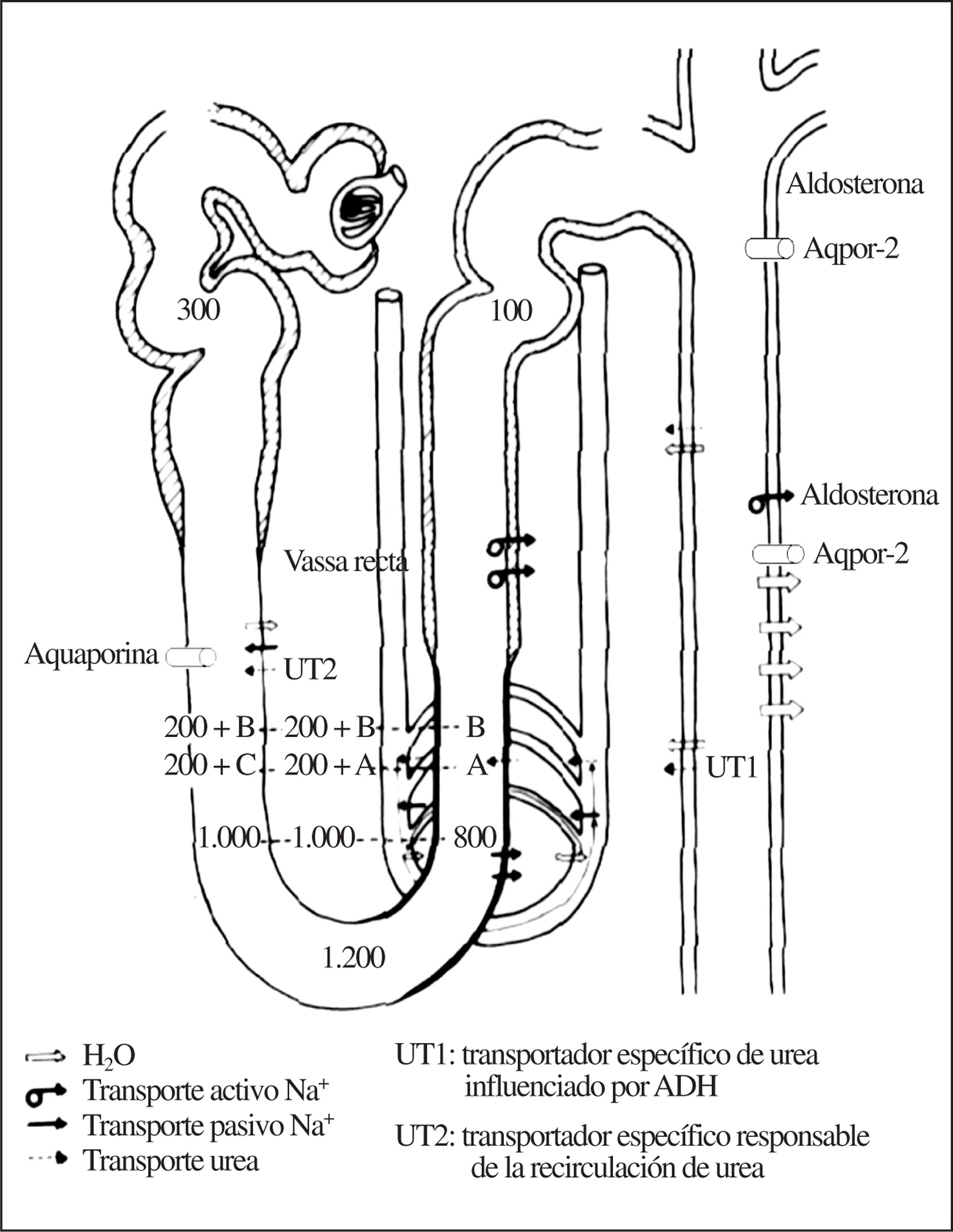
Las nefronas son las unidades funcionales del riñón. Cada riñón tiene alrededor de un millón de nefronas. Cada nefrona consta de un ovillo de capilares rodeado por una cápsula (corpúsculo glomerular) y un tubo formado por células epiteliales, que a su vez se divide en varias partes: el túbulo proximal, con sus segmentos contorneado y rectos; el asa de Henle, con sus ramas descendente y ascendente (partes delgada y gruesa); el túbulo contorneado distal, y los túbulos colectores1 (fig. 1).
Figura 1.Resumen de la anatomía y fisiología de la nefrona del adulto sano.
En el conjunto de los glomérulos se filtran unos 180 l de plasma al día (algo menos en los ancianos), que pasan a los túbulos. En ellos se produce la reabsorción de más del 99% de esta cantidad, de forma que se eliminará solamente una cantidad de agua y de solutos equivalente a la ingesta. La regulación de la excreción de agua y de solutos no se hace normalmente mediante regulación de la cantidad filtrada, sino de la cantidad reabsorbida por los túbulos2.
Regulación de la resorción tubular de sodio y agua
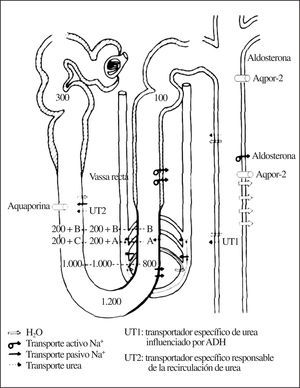
En el túbulo proximal se reabsorbe pasivamente un 60-80% del sodio,el agua y otros elementos filtrados, y la casi totalidad del bicarbonato, la glucosa, los aminoácidos y las proteínas pequeñas2. La reabsorción en el túbulo proximal es un mecanismo activo basado en la presencia en las membranas basolaterales de las células tubulares de la ATP-asa-Na/K o bomba de sodio. Esta bomba, que saca sodio activamente del citoplasma celular al líquido intersticial, genera un gradiente electroquímico que permite la entrada pasiva de sodio desde el fluido tubular al interior de la célula tubular atravesando la membrana luminar. Esta entrada ocurre sobre todo mediante cotransportadores que, al mismo tiempo que sodio, reabsorben azúcares, péptidos o aminoácidos. El transporte en el túbulo proximal es isoosmótico, de forma que por cada 300 mOsm de solutos reabsorbidos se reabsorbe 1 l de agua. Traducido al lenguaje práctico, el túbulo proximal no concentra ni diluye la orina.
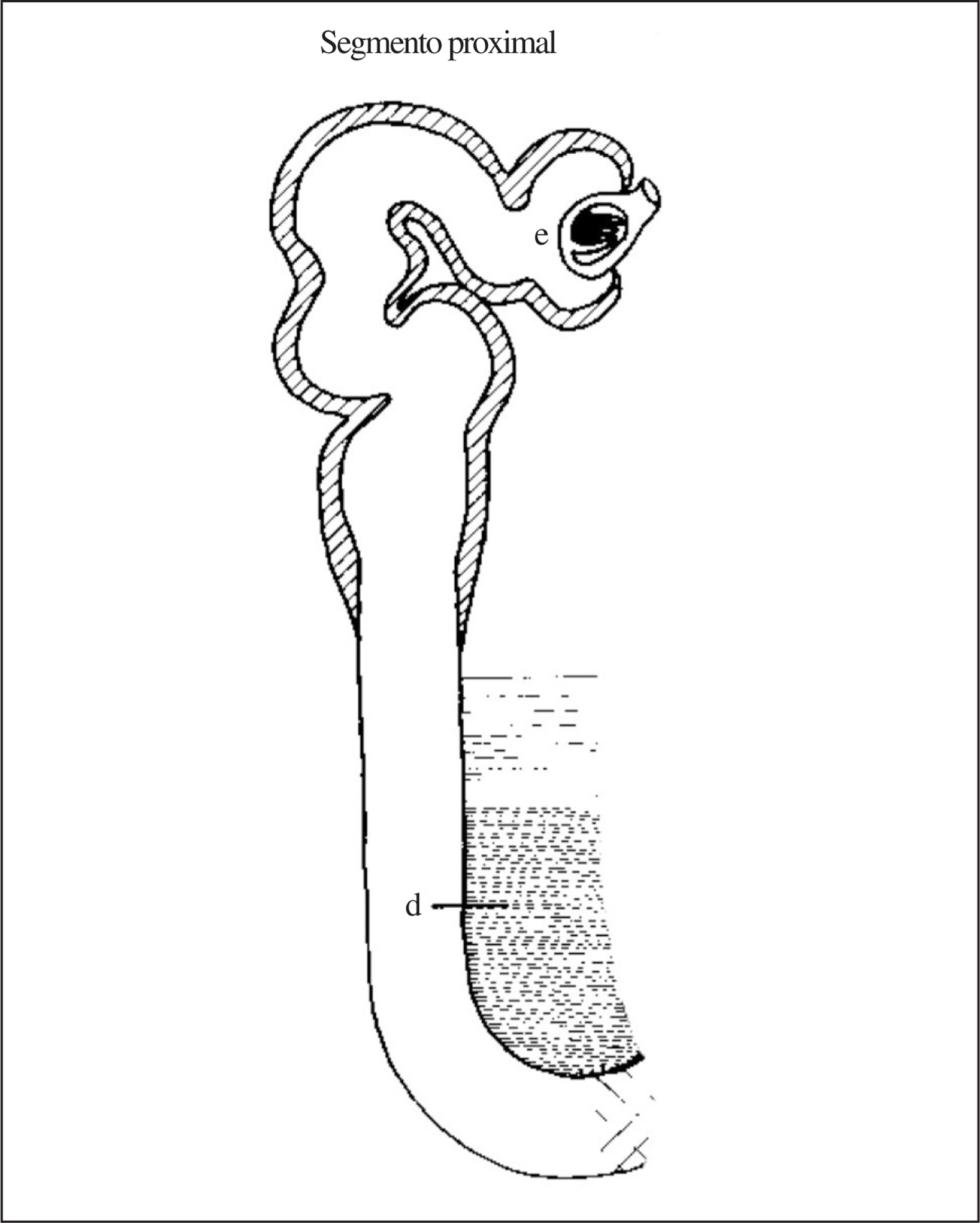
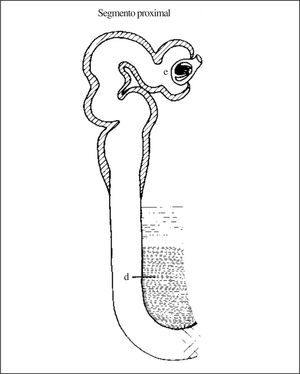
La rama descendente del asa de Henle es impermeable al paso del sodio desde la luz tubular al intersticio y permeable al agua (debido a la presencia de canales de agua aquaporina 1 (fig. 1). También es permeable a la urea desde el intersticio a la luz tubular, mediante transportadores específicos de urea UT2. Por tanto, conforme el fluido tubular va «descendiendo» por la rama descendente va perdiendo agua y acumulando sodio y urea, lo que hace que al llegar el fluido al pico (horquilla) del asa de Henle posea una elevadísima concentración de sodio y urea, alcanzando los 1.200 mOsm en este punto. Desde la salida del túbulo proximal del glomérulo hasta la «horquilla» de la rama descendente del asa de Henle se conoce como «segmento proximal» (fig. 2) para cuya exploración funcional es necesario utilizar la prueba de Chaimowitz, que posteriormente se detallará.
Figura 2.«Segmento proximal» de la nefrona proximal.
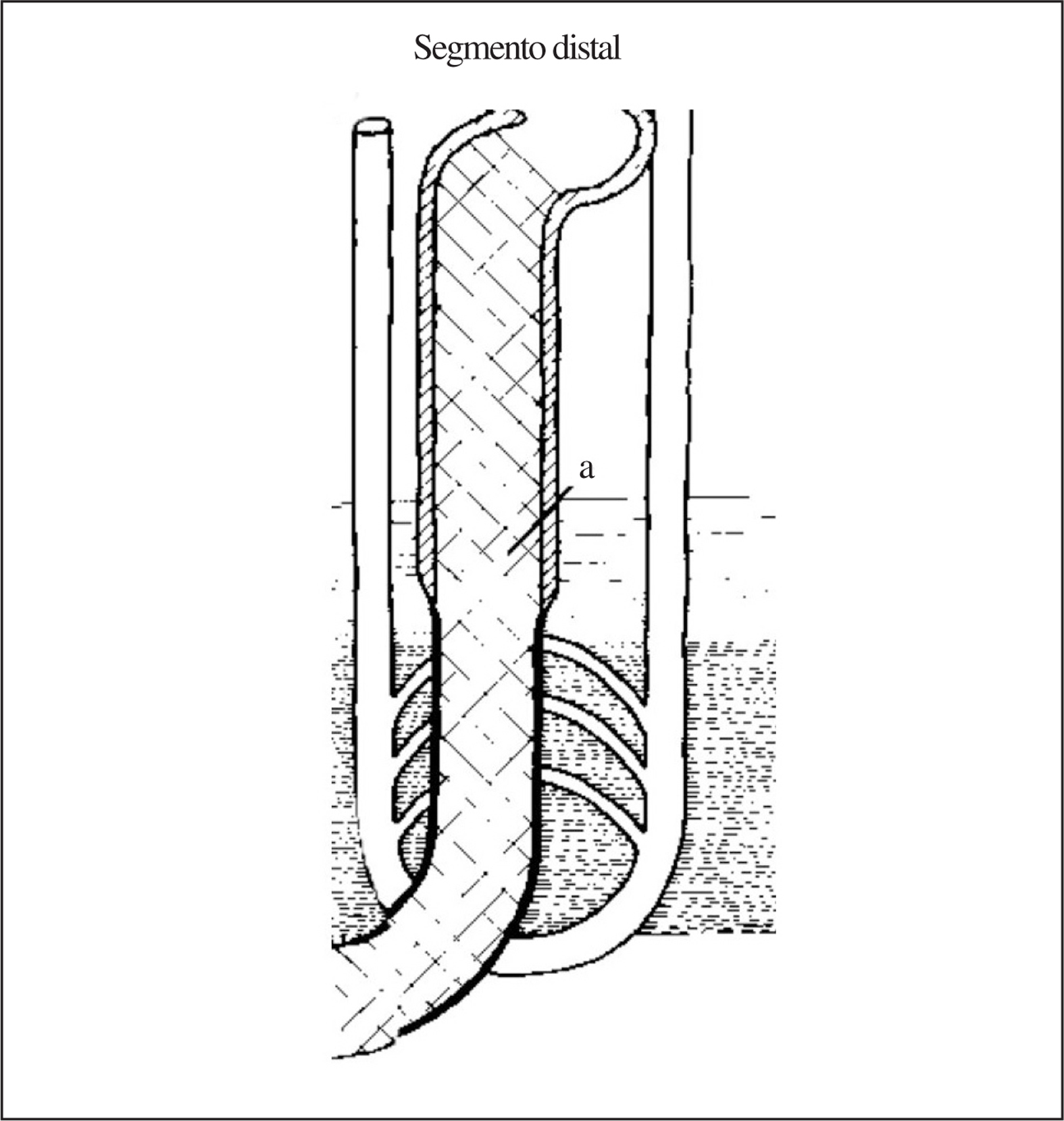
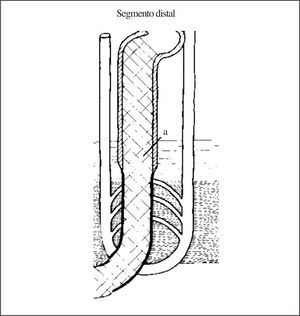
Al dar «la vuelta hacia arriba» la primera parte delgada de la rama ascendente del asa de Henle continúa permeable a la urea (por la presencia de canales UT2) pero se vuelve completamente impermeable al agua. Esto hace que salga sodio pasivamente a favor de un gradiente de concentración y siga entrando urea al fluido tubular (fig. 1). Al alcanzar la parte gruesa de la rama ascendente del asa de Henle («segmento distal» de la nefrona proximal) identificado también mediante la prueba de Chaimowitz, (fig. 3) el fluido tubular se encuentra con un epitelio de características opuestas al del «segmento proximal», aquí la célula tubular es impermeable al agua y a la urea pero permeable al paso de sodio desde la luz al intersticio. En este segmento, el sodio utiliza el gradiente electroquímico generado por la ATP-asa-Na/K de la membrana basolateral y un cotransportador de sodio, cloro y potasio presente en el borde en cepillo de las células tubulares de esta parte de la nefrona. Este cotransportador se conoce como NKCC2 o Cl-Na-2K, y está codificado por el gen SCL12A1 situado en 5q15-21. La actividad de este transportador aumenta por acción de la ADH3 .Ello permite que el sodio que alcanza la parte gruesa vaya expulsándose desde la luz tubular al intersticio quedando, por tanto, un fluido tubular pobre en sodio. Al tiempo que se expulsa 300 mmol de ClNa al intersticio, queda en la luz tubular 1 l de agua desprovista de sodio o «agua libre» de sodio, por lo que este segmento es el que forma «agua libre» (fig. 3). Al ir repitiéndose este proceso interrumpidamente, cada vez hay menos sodio en el túbulo y el fluido tubular se vuelve consecuentemente más diluido, por eso se conoce también a la rama ascendente del asa de Henle como segmento dilutor y su capacidad funcional se mide como la capacidad de formar agua libre. Es precisamente la parte gruesa de la rama ascendente del asa de Henle la que disminuye su competencia para reabsorber sodio tanto en personas de edad avanzada4 como en muy ancianos, como comunicamos por primera vez en esta revista5.
Figura 3.«Segmento distal» de la nefrona proximal.
Al salir la orina de la rama ascendente del asa de Henle tiene una osmolaridad de alrededor de 100 mOsm y comienza el proceso de concentración de la orina en los segmentos siguientes de la nefrona. La capacidad de concentrar orina viene condicionada por: a) la osmolaridad del intersticio renal mantenida en parte por el sodio, que se expulsa desde la rama ascendente del asa de Henle al intersticio (que ya sabemos que funciona mal en el viejo y muy viejo) y en otra parte por la urea que difunde desde el túbulo colector a través de canales específicos de urea (UT1) también al intersticio; b) del agua que pasa desde la parte cortical y medular del túbulo colector bajo el control de la ADH; c) de la recirculación de urea, y d) el mecanismo de concentración a contracorriente6.
En el túbulo distal y en el túbulo colector existe una reabsorción activa de Na+ que está mediada por la ATP-asa Na+/K+ del lado basolateral de la célula. Esta reabsorción activa se ve favorecida por la aldosterona (fig. 1), que facilita también la excreción activa de K+ y H+, en relación con el Na+ reabsorbido. Aunque parece que ambos procesos ocurren por mecanismos diferentes, los 3 están acoplados y modulados por la concentración intracelular de estos cationes. Se ha observado una reabsorción activa electrogénica de Na+ que genera un potencial negativo en la luz tubular, la cual es causa del transporte pasivo de Cl. El mecanismo de transporte de Na+ en el túbulo colector medular es capaz de transportar Na+ frente a un elevado gradiente de concentración. La aldosterona ejerce su efecto combinándose con receptores intracelulares y estimulando, en el núcleo, la síntesis de ARNm. Sin embargo, también tiene efectos más rápidos aumentando el número de transportadores de sodio presentes en la membrana luminar de las células tubulares. Esto permite la entrada de mayor cantidad de Na+ a la célula, un incremento en su concentración intracelular y un aumento del bombeo de Na+ a través de la membrana basolateral por la bomba ATP-asa-Na+/K+. Después de un tiempo más prolongado, también se incrementa la síntesis de bombas ATP-asa-Na+/K+. En el control de la secreción de aldosterona se conocen varios estímulos directos a la glándula suprarrenal:
1. Angiotensina-II: cuando se reduce el volumen extracelular por balance negativo de Na+, hemorragia, diarrea, etc., se estimula la secreción de renina, lo que produce, por medio de la angiotensina-II, un incremento en la secreción de aldosterona.
2. Concentración plasmática de Na+ y de K+: en el hombre, el Na+ tiene poca importancia en la regulación de la secreción de aldosterona. Sin embargo, las células secretoras de aldosterona de la corteza suprarrenal son sensibles a la concentración de K+ en el líquido extracelular que las baña. El aumento en el ingreso de K+ produce un incremento de la concentración extracelular de este ión que, a su vez, estimula directamente la producción de aldosterona por la corteza suprarrenal. El incremento resultante en la concentración plasmática de aldosterona estimula la secreción de K+ en los conductos colectores corticales y, por tanto, elimina el exceso de K+ del cuerpo.
3. Corticotropina (ACTH): la secreción de ACTH en grandes cantidades, como en el traumatismo físico, también estimula la secreción de aldosterona.
En la parte final del túbulo distal (túbulo conector) y en el túbulo colector se produce el ajuste final de la osmolaridad urinaria, mediada por la ADH (fig. 1). La ADH es secretada por la hipófisis en respuesta a la osmolaridad del líquido extracelular. Si la osmolaridad es alta se secreta en grandes cantidades, y si es baja, se secreta poco. Los valores circulantes de ADH regulan la eliminación urinaria de agua. El túbulo distal es prácticamente impermeable al agua. La permeabilidad al agua del túbulo colector es baja en ausencia de ADH y alta en su presencia. La reabsorción del ClNa en ausencia de ADH tiene como consecuencia la formación de un líquido hipoosmótico con respecto al plasma y por lo tanto la eliminación de una gran cantidad de agua. En presencia de ADH, el fluido tubular se hace isotónico con el intersticio tubular, lo que significa que en la médula y en la papila se reabsorbe una gran cantidad de agua y, por tanto, la eliminación urinaria de agua, es baja. Los valores circulantes de ADH también regulan el grado de osmolaridad de la médula y la papila. La permeabilidad al agua en el túbulo colector la controla la ADH mediante la inserción en la membrana basolateral de canales permeables al agua (aquaporina 2). (fig. 1).
Manejo de urea
La urea se reabsorbe en gran parte en el túbulo proximal en los segmentos contorneados y rectos anteriores a la rama descendente del asa de Henle, y recordemos que la parte gruesa de la rama ascendente del asa de Henle, el túbulo distal y el segmento cortical de los túbulos colectores medulares son impermeables a la urea; por el contrario, el segmento medular de los túbulos colectores es permeable a la urea6,7. Por lo anterior, la concentración intratubular de urea aumenta a lo largo del túbulo distal y porción medular del túbulo colector de forma que al llegar el fluido tubular al segmento medular del túbulo colector su concentración es elevadísima, por ello la urea atraviesa pasivamente (a favor de gradiente) la luz tubular llegando al intersticio. Este transporte está mediado por la inserción de 2 transportadores específicos de urea (UT1 y UT2), que se han identificado y clonado8. El UT1 responsable del transporte de urea desde la luz tubular del segmento medular de los túbulos colectores al intersticio modulada por la ADH, de forma que cuando aumenta la ADH se insertan (expresan) más transportadores específicos de urea UT1. El UT2 no está influenciado por la ADH, es el responsable de la recirculación de urea, ya que regula la entrada de urea acumulada en el intersticio en la rama descendente del asa de Henle, y en la parte delgada de la rama ascendente la elevada concentración de urea en el intersticio o «atrapamiento» de urea en el intersticio es posible debido a la recirculación medular y el mecanismo de intercambio contracorriente.
Recirculación
Es posible, gracias a la configuración en orquilla de los vasos rectos, que «como si de un movimiento circular» se tratara mantener a la urea, el sodio y el agua «dando vueltas desde la parte ascendente a la descendente de los vaso rectos ininterrumpidamente», lo que permite que sólo una pequeña cantidad abandone los vasos rectos. Esta pequeña cantidad que abandona el sistema de recirculación se repone simultáneamente por el paso de urea a través de los UT2 desde los túbulos colectores al intersticio.
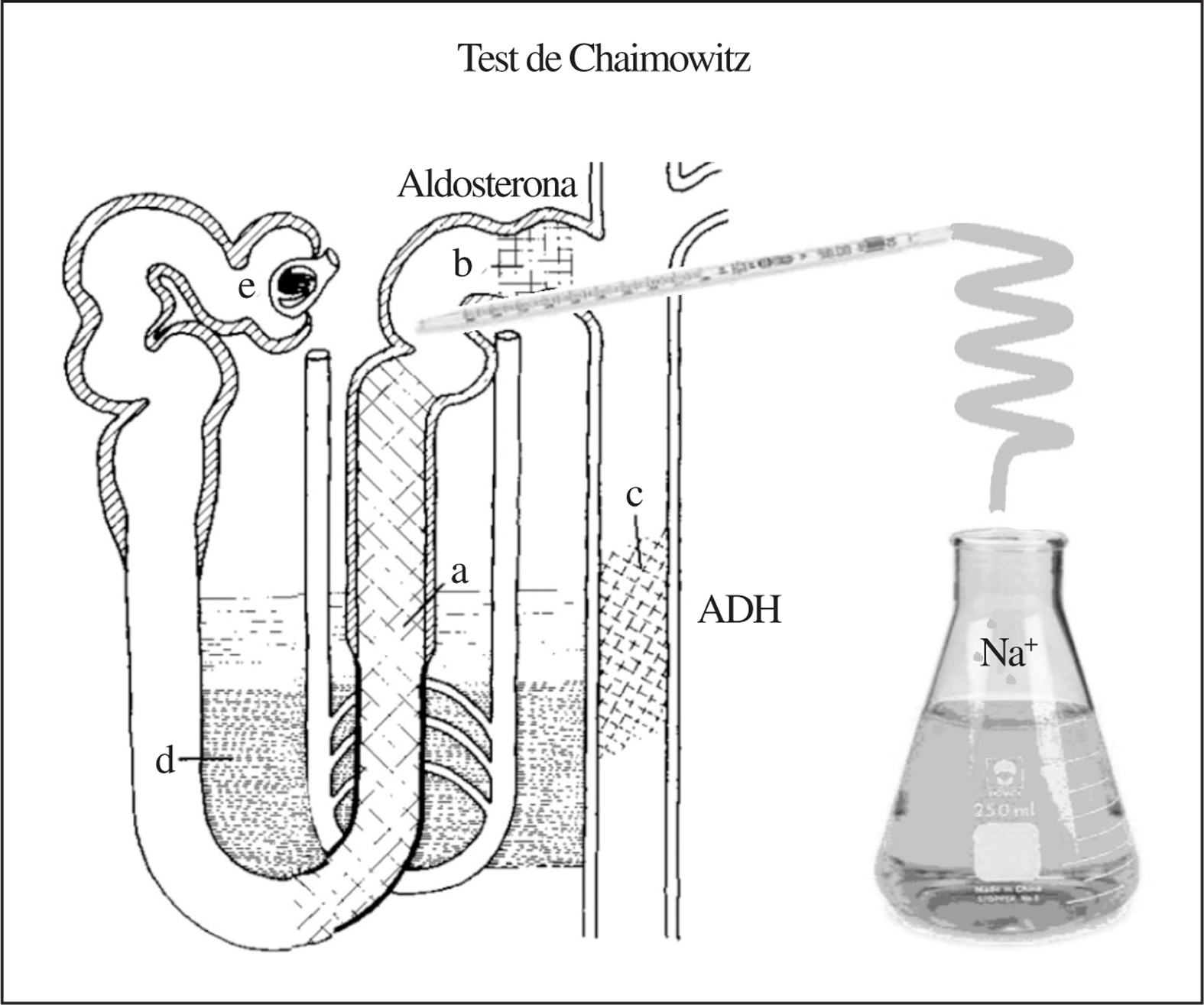
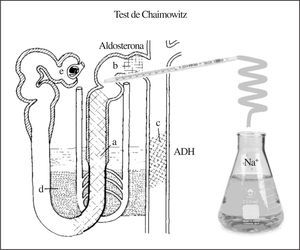
Interpretación de la valoración funcional mediante técnicas de aclaramiento en respuesta a sobrecarga hiposalina (prueba de Chaimowitz).
Objetivos de la prueba. Valorar mediante técnicas de aclaramiento convencional, la reabsorción de agua y de fluidos en diversas partes de la nefrona. Para ello se realizan las maniobras siguientes:
1. Anular/minimizar la acción de la aldosterona en el túbulo contornado distal mediante expansión aguda de volumen conseguida con la administración de los líquidos por vía oral e intravenosa en los tiempos mencionados.
2. Anular/minimizar la acción de la ADH en el túbulo distal y colector al administrar agua y solución hiposalina y utilizando para los cálculos de aclaramiento la muestra de orina con menor osmolaridad siempre < 100 mOsm, situación en la que prácticamente la acción de la ADH queda abolida9. Por tanto, hemos conseguido «anular funcionalmente» la nefrona distal (túbulo contorneado distal, segmento conector y túbulo colector) y razonablemente podemos aceptar que el sodio y el agua eliminados por la orina en estas circunstancias son el resultado del manejo que de ambos haga la nefrona proximal. En otras palabras, es como si insertáramos una pipeta al final de la rama ascendente del asa de Henle y recociéramos orina desde ese punto (fig. 4). Bajo estas condiciones podemos «disecar funcionalmente a la nefrona proximal» en 2 segmentos: uno que anatómicamente va desde inmediatamente después del glomérulo hasta el pico del asa de Henle, conocido como «segmento proximal» (fig. 2), y otro que es la parte gruesa de la rama ascendente de Henle, o «segmento distal» (naturalmente de la nefrona proximal) (fig. 3).
Figura 4.«Anulación funcional» de los túbulos distales y colectores tras la sobrecarga hiposalina en la prueba de Chaimowitz.
Técnica para conseguir los objetivos anteriores. Se realiza una ingesta de 20 ml de agua/kg de peso en un tiempo de 20 min, seguido de infusión intravenosa 2 l/1,73 m2 de superficie corporal de una solución hipotónica (solución fisiológica al 0,45%) durante 2 h.
Para valorar el manejo del sodio, se toman muestras de sangre inmediatamente antes del inicio de la infusión intravenosa, a la mitad del estudio y al finalizarlo. Se recogen además muestras de orina de la micción previa al comienzo del estudio (basal) y de todas aquellas que emita espontáneamente durante la infusión hiposalina. En cada una de las muestras de orina se mide el sodio, el potasio, la urea, la creatinina y la osmolaridad, según las cuales, mediante fórmulas, calculamos la competencia de los segmentos «proximal» y «distal» según las fórmulas siguientes:
Fórmulas utilizadas
-- Volumen de líquido filtrado por 100 ml de filtrado glomerular (V%): creatinina en plasma x 100/creatinina en orina.
-- Aclaramiento osmolar (Cosm): osmolalidad urinaria/osmolalidad plasmática x V%.
RESULTADOS
-- Aclaramiento de agua libre (CH2O): V% Cosm.
Jóvenes: 15,36; ancianos: 11,7.
-- Aclaramiento de sodio (CNa): sodio urinario/sodio plasmático x V%.
Jóvenes: 2,6; ancianos: 8,6 (p < 0,05)
-- Reabsorción de sodio «segmento proximal»: CNa + CH2O.
Jóvenes: 17,9; ancianos: 20,3.
-- Reabsorción de sodio «segmento distal»: CH2O x 100/CNa + CH2O.
Jóvenes: 85,72%; ancianos: 56,6% de lo que le llega del «segmento proximal», también conocido como «carga distal» (p< 0,05).
En consecuencia, vemos cómo la merma de rendimiento funcional de la parte gruesa de la rama ascendente del asa de Henle conduce a que se pierda más sodio por orina que en jóvenes y que, por tanto, las hiponatremias de los ancianos se deban a depleción real de sodio más que a dilución, que serían las originadas por un síndrome de secreción excesiva de ADH, frecuente en adultos jóvenes.
CONCLUSIONES
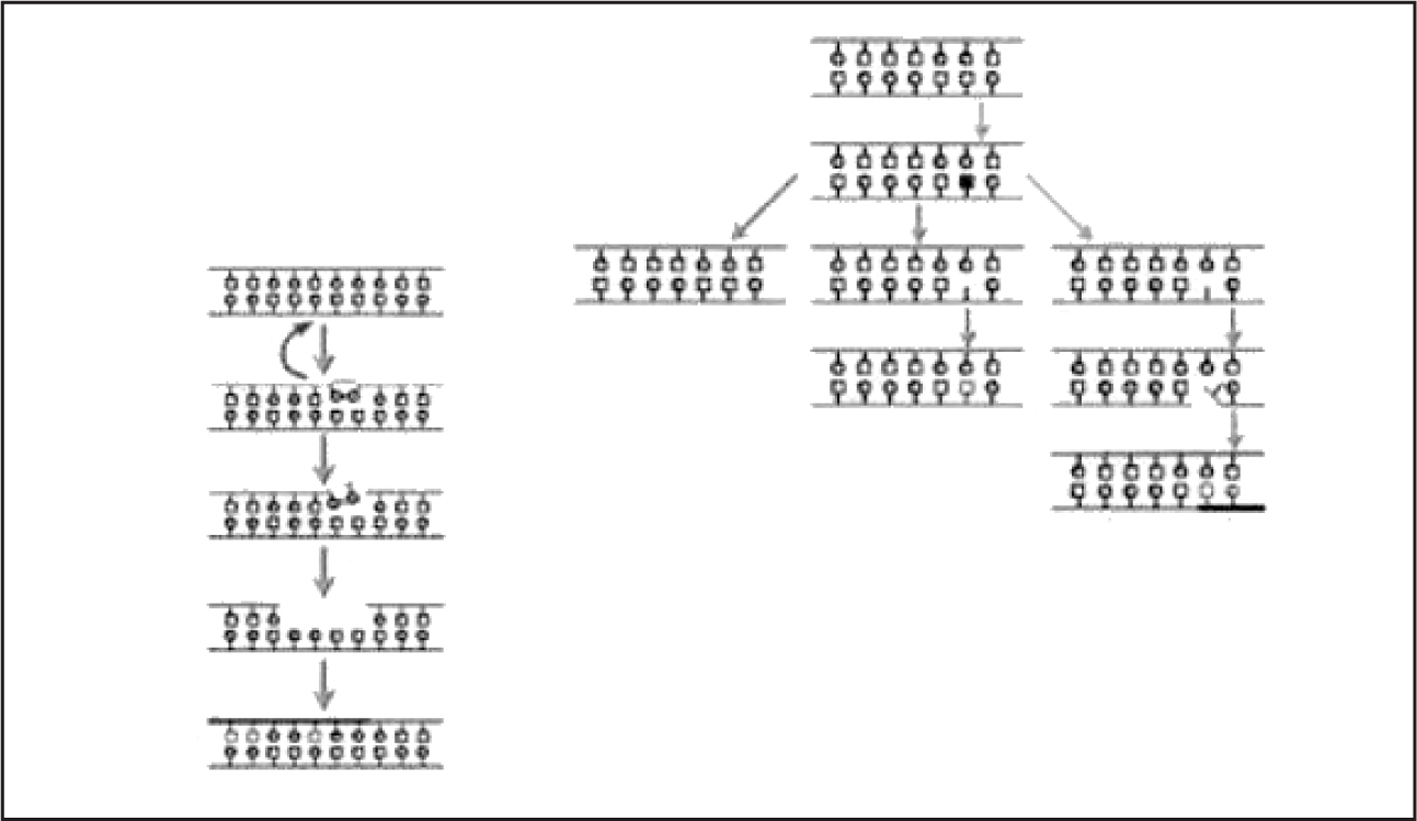
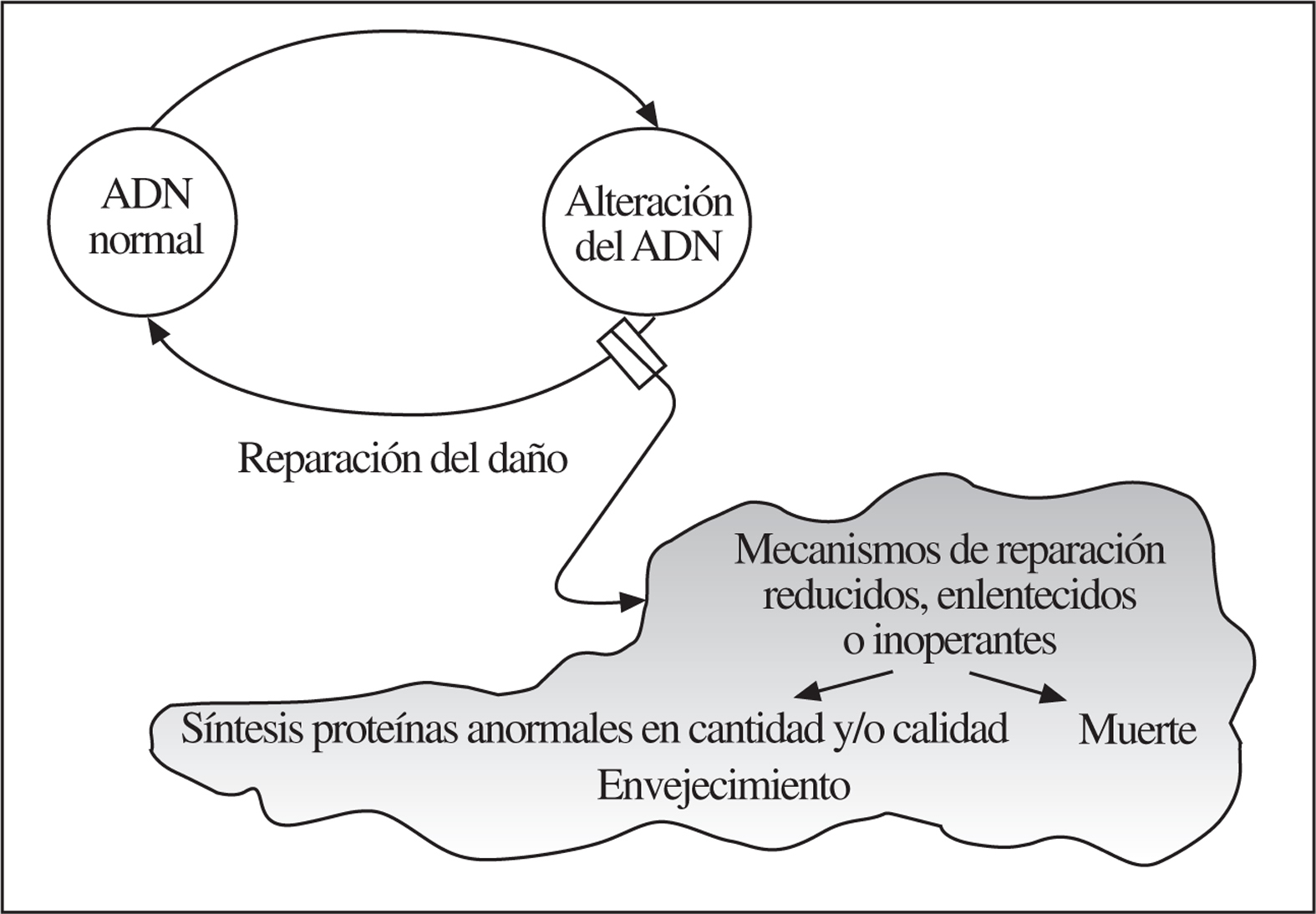
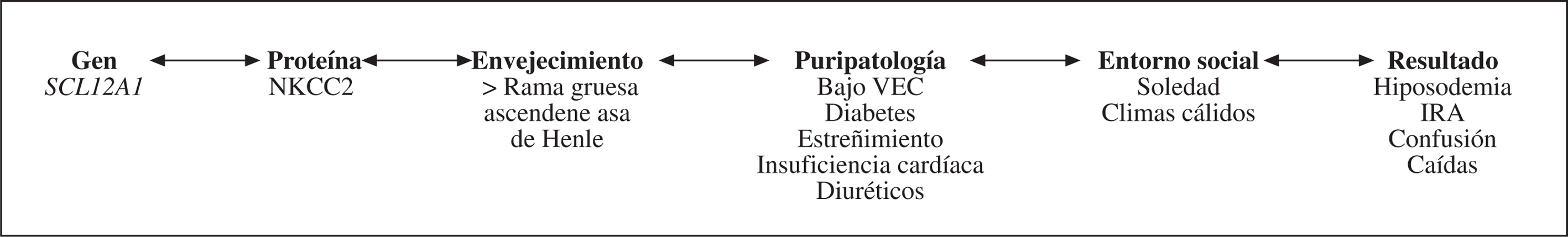
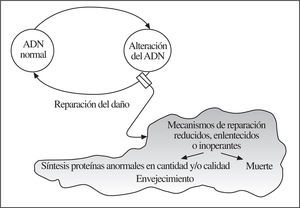
Las 2 particularidades anteriores pueden explicarse como consecuencia del envejecimiento fisiológico en el que hay más lesiones que capacidad reparadora en el ADN (fig. 5). Sabemos que las lesiones moleculares no adecuadamente reparadas conllevan bien a la muerte o a la «disfunción» (fig. 6), con lo que se cierra el círculo de correlaciones clinicobiológicas propias de la Geriatría (fig. 7).
Figura 5.Lesión del ADN.
Figura 6.Importancia de la reparación del ADN en las «disfunciones» del envejecimiento normal.
Figura 7.Correlaciones clinicobiológicas: desde el gen a la dependencia.
Ello hace que a la hora de establecer la estrategia terapéutica y utilizar restricción de sodio y diuréticos debamos tenerlo presente para prevenir los efectos secundarios que, con no poca frecuencia, aparecen en la ancianidad10.
Comentarios sobre la utilización de la prueba de Chaimowitz
Esta prueba se ha utilizado en investigación clínica para esclarecer el segmento nefronal lesionado en casos de pérdidas anormales de agua y/o sodio. En mayores de 65 años no hay que utilizarla sistemáticamente, ya que está demostrada desde 1978 la incompetencia de la rama ascendente del asa de Henle para reabsorber sodio en ancianos sanos9 y en 2004, en esta misma revista, que esta incompetencia se mantiene en muy ancianos sanos (edades de 80 a 103 años)5.
Si en algún caso fuera necesario hacerla, es imprescindible asegurarse que no hay insuficiencia cardíaca, hepática, renal o síndrome edematoso.
A fuer de ser repetitivo, la combinación de diurético-dieta hipo o asódica es potencialmente peligrosa para desarrollar hiponatremia e insuficiencia renal aguda, por lo que en los casos en los que esta estrategia terapéutica esté indicada es imprescindible monitorizar como mínimo cada 3 meses los electrolitos y la creatinina plasmática.
AGRADECIMIENTOS
Los autores quedan muy agradecidos a Don Joaquín Álvarez Gregori por la ayuda en la preparación del manuscrito.