Las personas mayores son uno de los grupos poblacionales de mayor riesgo de reacción adversa a medicamentos (RAM). Su prevalencia media en el anciano es del 30%. La demencia no es un factor de riesgo independiente de RAM pero, sin embargo, es la principal situación que favorece y multiplica todos los factores de riesgo (polifarmacia, comorbilidad, prescripción inadecuada, interacción medicamentosa, edad avanzada y adherencia terapéutica). Se exponen recomendaciones revisadas y consensuadas para prevenir las RAM en las personas mayores, a la vez que las propias de las personas con demencia en relación con el manejo de la comorbilidad y de los síntomas cognitivos, psicológicos y conductuales.
The elderly are one of the groups at greatest risk for adverse drugs reactions (ADR). The mean prevalence of these reactions in this population is 30%. Dementia is not an independent risk factor of ADR, but is the main condition that increases all risk factors (polypharmacy, comorbidity, inappropriate prescribing, drug–drug interactions, advanced age, and treatment adherence). The present article discusses revised and consensual recommendations for the prevention of ADR in the elderly, as well as recommendations specifically for dementia patients in relation to the management of comorbidity and cognitive, behavioral and psychological symptoms.
El de los ancianos es uno de los grupos poblaciones con mayor riesgo de reacción adversa a medicamentos (RAM). Su prevalencia media es del 30%, aunque los diferentes estudios1–5 presentan un amplio abanico tanto en el medio comunitario (prevalencia del 2 al 30%, con riesgo de hospitalización 4 veces superior) como en el medio hospitalario (del 1,5–35% de los pacientes mayores hospitalizados). Las RAM suponen la cuarta causa de muerte en el anciano tras la cardiopatía isquémica, el cáncer y el ictus5, y constituyen una fuente importante de dependencia en su mayor parte reversible6.
Los principales factores asociados a riesgo de producir RAM en el anciano son7–15 la polifarmacia excesiva (el factor que más se repite y que a la vez es causado por los otros factores), la prescripción inadecuada, la comorbilidad, la edad avanzada, las interacciones medicamentosas y la falta de adherencia al tratamiento.
La gravedad de las RAM es mayor cuanto más edad y cuanta mayor sea la comorbilidad16. Una revisión sistemática de 14 estudios prospectivos17 muestra que los fármacos responsables del 51% de las RAM que motivan hospitalización pertenecen básicamente a cuatro grupos farmacológicos: antiagregantes (16%), diuréticos (16%), AINE (11%) y anticoagulantes (8%). Los fármacos que suelen provocar las RAM más graves también pueden agruparse en cuatro categorías16: los cardiovasculares (diuréticos y digoxina, principalmente), AINE, antiagregantes y anticoagulantes y fármacos que actúan sobre el sistema nervioso central (neurolépticos, antidepresivos, ansiolíticos y anticomiciales).
En los diferentes estudios, incluidos los realizados en el medio geriátrico, la demencia no es un factor de riesgo independiente de RAM pero, sin embargo, favorece los factores de riesgo anteriormente descritos7–15. Las RAM en mayores con demencia suelen manifestarse con sintomatología del sistema nervioso central. Esta especial susceptibilidad, sobre todo a fármacos anticolinérgicos y a psicotropos, se debe a18–31:
- •
Alteraciones farmacocinéticas (en la absorción por problemas de deglución, sonda nasogástrica o gastrostomía y en la distribución por la desnutrición frecuente en pacientes con demencia, sobre todo en estadios avanzados)18,19.
- •
Alteraciones farmacodinámicas, con alteraciones estructurales histológicas y metabólicas e inflamatorias que producen disfunción de neurotransmisores, con disminución global de la actividad sináptica neuronal19,20.
- •
Menor reserva cognitiva, es decir, reducción de los recursos cerebrales disponibles para compensar factores estresantes, como en este caso la acción de un medicamento21,22.
- •
Polifarmacia23,24, con alto riesgo de la cascada farmacológica, con uso frecuente de fármacos anticolinérgicos25 (su uso prolongado produce efectos deletéreos de la función ejecutiva y de la memoria verbal) y de fármacos psicotropos26 (en muchas ocasiones potencialmente inapropiados)27,28.
- •
Comorbilidad similar a la de los ancianos sin demencia, pero con peor estado nutricional y funcional que facilita las RAM29,30.
- •
Dificultad diagnóstica por presentación clínica más compleja de las RAM, confundiéndolas (síntomas de sedación, confusión, delírium, alteraciones de la marcha, caídas, deterioro funcional) con el progreso inherente de la demencia31.
- •
Peor adherencia terapéutica con pobre soporte social18 (el principal factor asociado a mala adherencia al tratamiento en el deterioro cognitivo).
El coste debido a la morbimortalidad asociada a RAM es de aproximadamente 177.400 millones de dólares al año en pacientes ambulatorios con necesidad de hospitalización, y alrededor de 4.000 millones de dólares al año en pacientes institucionalizados32,33. Por todo lo anteriormente expuesto, las RAM en la población geriátrica y especialmente en los pacientes con demencia están consideradas como una cuestión de salud pública, relacionada con la morbilidad, la mortalidad y el uso de recursos sanitarios, aún más cuando dichas RAM podrían ser prevenibles desde un 13 hasta un 80% de los casos7.
Recomendaciones para prevenir reacciones adversas a medicamentos en las personas mayores con demenciaMedidas generalesLa mejora de la prescripción y la disminución de la prescripción inadecuada (prescripción que no está de acuerdo con los estándares médicos aceptados, incluyendo fármacos contraindicados o no indicados, fármacos innecesarios, instrucciones incorrectas y poco prácticas, uso de fármacos caros y dosificación incorrecta) es, sin duda, el pilar fundamental en la prevención de las RAM en el anciano. A este respecto, las principales recomendaciones para las personas mayores son las recientemente publicadas como criterios STOPP-START (Screening Tool of Older Person's potentiall inappropriate Prescriptions/Screening Tool to Alert doctors to the Right, i.e. appropriate, indicated Treatment)34,35, cuyo desarrollo clínico ha sido asumido por la European Union Geriatric Medicine Society. Las principales medidas para tener en cuenta para prevenir las RAM en el anciano se resumen en la tabla 136–39.
Medidas generales en la prevención de reacción adversa a medicamentos en las personas mayores con demencia36–39
| Enfermedad por tratar: |
|
| Presencia de otras enfermedades: |
|
| Función renal: |
|
| Objetivo terapéutico: |
|
MDRD: modification of diet in renal disease; RAM: reacción adversa a medicamentos.
En estadios leves y moderados el perfil de comorbilidad asociado a demencia es similar al de la población de la misma edad sin demencia, y la principal causa de muerte es la enfermedad cardiovascular, incluyendo la cerebrovascular. Sin embargo, a medida que progresa el deterioro de las funciones superiores aumenta la comorbilidad, varía su perfil y se objetiva repercusión sobre la tasa de mortalidad, siendo mayor que la de pacientes sin demencia40: en la enfermedad de Alzheimer avanzada la mayoría de las muertes son consecuencia de una neumonía, favorecida por los trastornos deglutorios y alimentarios41.
En todo paciente con demencia es necesario controlar los factores de riesgo cardiovascular, especialmente hipertensión y diabetes, por ser un factor de riesgo independiente de muerte en cualquier estadio42, y asociarse en la enfermedad de Alzheimer a un empeoramiento cognitivo y a deterioro funcional43. Pero, sin olvidar en todo momento que la consideración del tratamiento debe ser global y coherente con las expectativas del paciente y con su esperanza de vida. Hay que tratar la comorbilidad susceptible de mejoría siempre que tenga repercusión clínica.
En fases avanzadas de la demencia merecen especial consideración algunas enfermedades comórbidas especialmente prevalentes:
- •
Malnutrición y trastornos de la alimentación y la deglución: la alimentación artificial mediante sonda nasogástrica o gastrostomía percutánea no ha demostrado resolver la malnutrición, mejorar las úlceras por presión, reducir el riesgo de broncoaspiración ni tampoco aumentar la supervivencia44.
- •
Trastorno de la marcha y caídas: en los pacientes con demencia el riesgo de caídas y, por tanto, de fracturas está aumentado45. La utilización de psicofármacos, frecuente en los pacientes con demencia, aumenta el riesgo de alteraciones de la marcha y caídas. Asimismo, habrá que ser especialmente cauteloso en la utilización de fármacos hipotensores en pacientes con demencia que presentan alteraciones de la marcha.
- •
Una vez que se produce la fractura, el tratamiento quirúrgico de ésta es básicamente similar al del paciente sin demencia, teniendo en cuenta cuál es la expectativa de vida a la hora de pautar el tratamiento médico para la prevención secundaria, calcio y vitamina D, y especialmente el uso de bifosfonatos46, cuya forma de administración debe ser entendida por el paciente y cuyo beneficio se produce a largo plazo. En caso de que se produzca una fractura de la cadera subcapital y el paciente previamente no deambulaba, puede no recomendarse su intervención. Sin embargo, en el caso de que la fractura sea de localización subtrocantérea, es más conveniente intervenirla a pesar de su inmovilidad previa, ya que la cirugía se asocia a una reducción del dolor y, por ende, a una mejoría en la calidad de vida47.
- •
Dolor-disconfort: aunque suele subestimarse en los pacientes con demencia debido a las dificultades de comunicación, la utilización de herramientas de valoración adecuadas ha demostrado que las personas con demencia sufren dolor con una prevalencia bastante similar a la de las personas cognitivamente intactas48. El dolor en el paciente con demencia se asocia, además, a trastornos del comportamiento y del estado de ánimo. Debe identificarse la causa del dolor, y éste debe ser tratado y controlado como en cualquier otro paciente, con especial atención a la monitorización de los efectos secundarios de los fármacos analgésicos, especialmente opioides.
- I.
Los efectos secundarios de los inhibidores de la acetilcolinesterasa (IACE) por identificar y conocer incluyen:
- •
Intolerancia digestiva (anorexia, náuseas, vómitos, diarrea, etc.). Es el efecto secundario más frecuente. Para evitarlo conviene ir titulando el fármaco lentamente. En caso de que aparezcan, disminuir la dosis, tomar el fármaco con alimentos, cambiar de vía de administración o de fármaco. No se recomienda el uso de antieméticos como norma por sus efectos anticolinérgicos.
- •
Aparición/empeoramiento de incontinencia urinaria.
- •
Pérdida de peso.
- •
Sensación de inestabilidad/mareo, raramente síncope.
- •
Alteraciones del sueño, incluyendo insomnio, sueños vívidos y alucinaciones hipnopómpicas (alucinaciones visuales al despertarse, generalmente una persona a su lado, cerca de él, etc.) (donepezilo).
- •
- II.
En cuanto a la tolerancia a los diversos fármacos, para minimizar la RAM es necesario tener en cuenta:
- •
Los IACE están contraindicados en pacientes con alteraciones de la conducción cardíaca (salvo bloqueo de rama derecha) o síncope de origen no aclarado.
- •
Los IACE deben utilizarse con precaución en pacientes con riesgo de sangrado digestivo, con antecedentes de crisis comiciales, con asma o enfermedad pulmonar obstructiva crónica.
- •
Todos los IACE pueden aumentar los efectos de los relajantes musculares de tipo succinilcolínico, por lo que ante una cirugía debe informarse de su uso al anestesista.
- •
Donepezilo no es de elección en pacientes con bajo peso, aunque con todos los IACE debe vigilarse el peso del paciente.
- •
Galantamina está contraindicada en pacientes con deterioro severo de la función renal o hepática.
- •
Rivastigmina está contraindicada en pacientes con insuficiencia hepática severa.
- •
En el caso de la memantina, está contraindicada en caso de insuficiencia renal severa, debe utilizarse con precaución en pacientes con enfermedad cardiovascular o historia de crisis comiciales, no debe asociarse a fármacos relacionados, como el dextrometorfano, la amantadina o la ketamina, y los pacientes que la toman deben seguir una revisión oftalmológica periódica.
- •
- III.
Cuando se inicie tratamiento con cualquier fármaco para los síntomas cognitivos de la demencia se recomienda revaluar al paciente en un período de tiempo máximo de 3 a 6 meses. Si existen problemas de tolerancia o falta de efectividad, puede cambiarse de fármaco o combinarse un IACE con memantina. Se considera que el fármaco es eficaz cuando se evidencie la estabilización o la mejoría de los síntomas que hayamos elegido como diana, que pueden ser cognitivos, conductuales o funcionales. En caso de respuesta favorable libre de efectos colaterales, el tratamiento se mantendrá, efectuando las revisiones cada 6–12 meses.
- IV.
Se recomienda suspender el tratamiento en caso de que el paciente/cuidador lo decida, en caso de rechazo a la toma de fármacos, falta de adherencia terapéutica, ineficacia del fármaco, efectos secundarios intolerables, presencia de comorbilidad severa que invierta la relación riesgo/beneficio y progreso de la enfermedad hasta un estadio en el que no haya beneficio significativo derivado del tratamiento. Siempre que se suspenda el fármaco se recomienda seguir al paciente, ya que en ocasiones se observa un empeoramiento significativo y debe valorarse reiniciar el tratamiento.
- V.
No existe evidencia científica que permita recomendar el uso de nicergolina57, nimodipino58, piracetam59, ginkgo biloba60, selegilina61, vitamina E62, estrógenos63, antiinflamatorios o estatinas64 para el tratamiento o la prevención de la enfermedad de Alzheimer.
- VI.
No existe evidencia científica que permita recomendar el uso de ginkgo biloba60, nimodipino65 o pentoxifilina66 en el tratamiento de la demencia vascular.
- VII.
Hay evidencia muy limitada de que la aspirina sea eficaz en pacientes con un diagnóstico de demencia vascular67, por lo que las recomendaciones actuales para el uso de AAS en el paciente con demencia son, en general, las mismas de la prevención cardiovascular, asociadas al control del resto de los factores de riesgo cardiovascular.
Los síntomas psicológicos y conductuales de la demencia (SPCD) pueden agruparse según la clasificación sintomática del inventario neuropsiquiátrico de Cummings68 en anímicos (ansiedad y depresión), psicóticos (agitación, alucinaciones, delirios e irritabilidad) y de conducta frontal (apatía, euforia y desinhibición). Los SPCD psicóticos son los más estudiados por su gran prevalencia y por ser los grandes responsables de la claudicación familiar y de la institucionalización. En ausencia de fármacos más efectivos, más seguros y mejor tolerados, los neurolépticos siguen utilizándose para el tratamiento de estos síntomas en la demencia69–79, a pesar de no tener tal indicación en ficha técnica y de las advertencias en relación con su seguridad, con un aumento de mortalidad tanto con el uso de neurolépticos atípicos como con los convencionales73–77, e incluso en algunos estudios con mayor riesgo en estos últimos77.
Sin duda, los resultados más controvertidos han sido los del estudio CATIE-AD71,72, multicéntrico, aleatorizado, doble ciego, controlado frente a placebo, que engloba a 421 pacientes con Alzheimer y síntomas psicóticos, residentes en la comunidad, a los que se les asignó tratamiento con risperidona (dosis media: 1mg/día), quetiapina (dosis media: 56,5mg/día), olanzapina (dosis media: 5,5mg/día) o placebo. Los resultados muestran utilidad en el control de síntomas no cognitivos, como las ideas paranoides o la agresividad, con un aumento considerable en abandonos y efectos secundarios, pero sin mejoría en funcionalidad, necesidad de cuidados o calidad de vida72. Los autores71 destacan que “aunque los antipsicóticos atípicos son más efectivos que el placebo, los efectos adversos limitan su efectividad global y su uso debe restringirse a aquellos pacientes que tienen escasos o nulos efectos secundarios o a los que se puede encontrar un beneficio, siendo los clínicos, pacientes y familiares quienes deben considerar tanto el riesgo como el beneficio para optimizar el cuidado del paciente”.
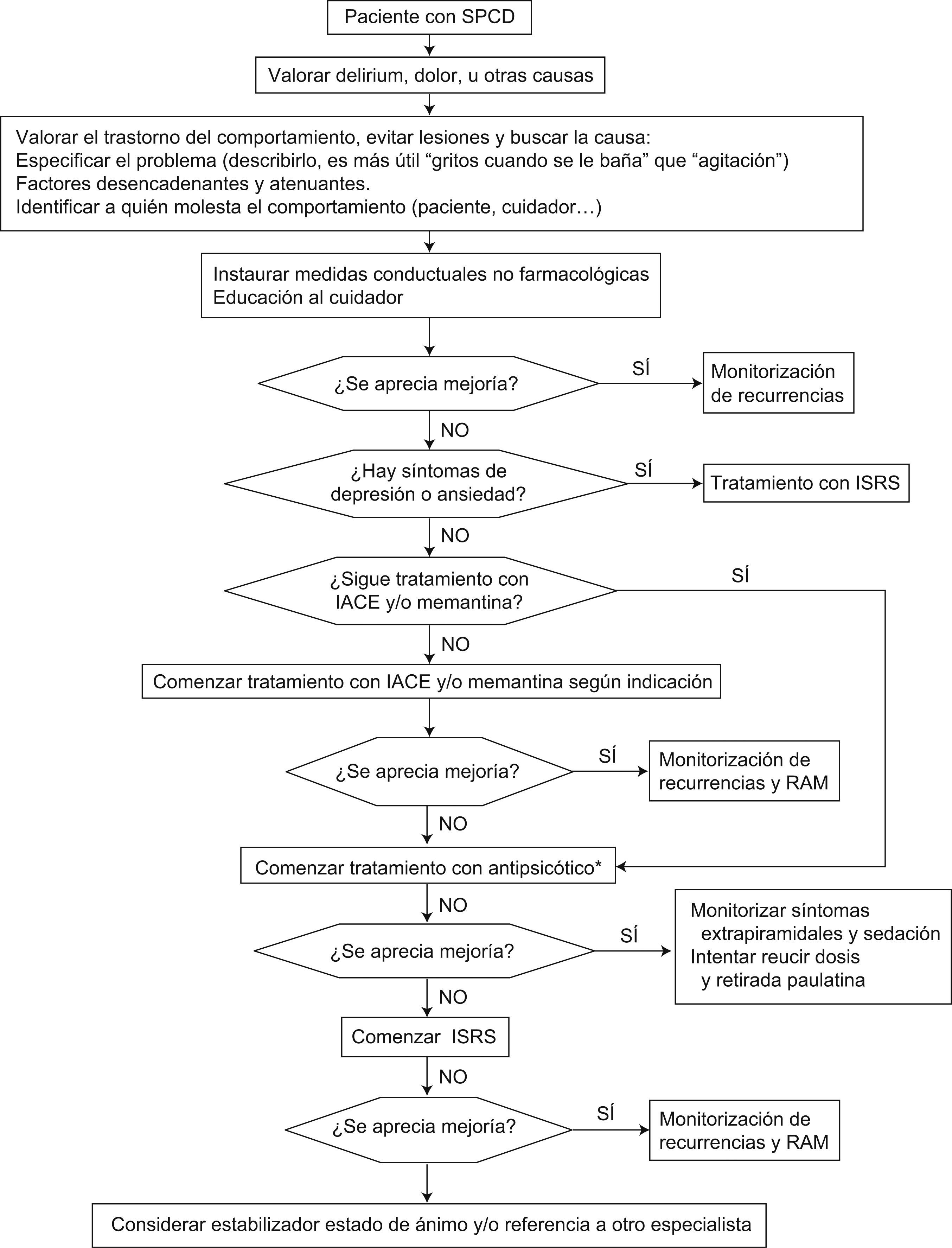
Lo anteriormente expuesto ha abierto nuevas líneas de investigación. Así, diversos estudios, incluyendo revisiones sistemáticas recientes80, muestran un efecto favorable del tratamiento con IACE y/o memantina sobre los síntomas no cognitivos de la demencia80–83, por lo que actualmente aunque su evidencia es limitada, por su perfil de seguridad, y en ausencia de otros tratamientos alternativos seguros y efectivos, su uso puede ser considerado como una opción terapéutica apropiada, especialmente en SPCD intensos, persistentes y/o recurrentes de la demencia (fig. 1)83.
Algoritmo del manejo de síntomas psicológicos y conductuales en la demencia psicóticos (agitación, alucinaciones, delirios e irritabilidad). Modificado de Sink et al83.
IACE: inhibidor acetilcolinesterasa; ISRS: inhibidor selectivo recaptación serotonina; RAM: reacciones adversas a medicamentos: SPCD: síntomas psicológicos y conductuales de la demencia.
¿SPCD consistentes en episodios graves de agresividad o cuadros psicóticos severos, comenzar a la vez tratamiento con antipsicóticos que con el tratamiento de sintomas cognitivos (IACE y/o memantina).
Las actuales recomendaciones ante SPCD para disminuir las RAM en pacientes mayores con demencia son78,79,83–86:
- I.
Como primera opción debe intentarse el manejo no farmacológico de los SPCD del paciente con demencia, aunque los beneficios demostrados son modestos.
- II.
Es prioritario descartar causas orgánicas que puedan contribuir a la aparición o el empeoramiento de los SPCD en el paciente con demencia previamente bien controlado: dolor-disconfort, infecciones, estreñimiento, disnea, prurito, soledad, estresantes ambientales, depresión, etc.
- III.
Iniciar simultáneamente tratamiento farmacológico en presencia de agitación asociada a psicosis, a delirio, a comportamientos auto/heteroagresivos o a depresión severa, intentado optimizar el tratamiento de los síntomas cognitivos (tabla 2).
Tabla 2.Principales recomendaciones para disminuir el riesgo de prescripción subóptima en el manejo de los síntomas cognitivos de la demencia50–55
- I.
Antes de pautar un fármaco para el tratamiento sintomático de la demencia, debe informarse al paciente y a su cuidador de manera comprensible y realista acerca de los efectos beneficiosos que esperamos así como de los posibles riesgos, y la decisión de iniciar el tratamiento se basará en los deseos del paciente (o del cuidador en caso de que el paciente no esté capacitado para decidir). La elección del fármaco se basará en factores como la tolerancia, el perfil de efectos adversos, la facilidad de cumplimentación de la pauta, el coste y la familiaridad del médico prescriptor con los medicamentos y la evidencia de beneficio en el rango de edad del paciente50,51
- II.
En pacientes con demencia tipo Alzheimer en estadio leve-moderado deben controlarse HTA y DM, y pautarse un IACE (grado A)51,53–55. Si el paciente no responde de forma adecuada a la monoterapia, existe nivel de evidencia ib de los efectos beneficiosos de asociar memantina y iib de los efectos de cambiar de IACE55
- III.
En demencia mixta en estadio leve-moderado se deben controlar los FRCV y prescribir IACE (grado A)54
- IV.
En demencia de tipo Alzheimer o mixta en estadio moderado-severo deben controlarse los FRCV y prescribirse IACE y/o memantina (grado A)51–54
- V.
En demencia vascular deben controlarse la HTA y la DM (grado A)54. La recomendación sobre el tratamiento con IACE o memantina es no concluyente (grado C)53
- VI.
Existe suficiente evidencia de la efectividad de los IACE en mejorar el control de los síntomas neuropsiquiátricos del paciente con demencia-Parkinson y demencia por cuerpos de Lewy (grado A)53,55. La evidencia sobre la efectividad de la memantina en estos tipos de demencia es insuficiente (grado C)53
- VII.
Debe considerarse siempre el tratamiento no farmacológico de la demencia, que debe incluir50–52:
- •
educación y atención al cuidador;
- •
pauta de ejercicio físico;
- •
terapia de reminiscencia para el paciente,
- •
y referencia del paciente/cuidador a servicios sociales
- •
DM: diabetes mellitus; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; IACE: inhibidores de la acetilcolinesterasa.
Grado de recomendación49: A: extremadamente recomendable; B: recomendación favorable; C: recomendación no concluyente, y D: consenso de expertos.
Niveles de evidencia49: ia: evidencia procedente de metaanálisis de ensayos controlados, aleatorizados, bien diseñados; ib: evidencia procedente de al menos un ensayo controlado aleatorizado; iia: evidencia procedente de un estudio controlado bien diseñado sin aleatorizar; iib: evidencia procedente de un estudio cuasiexperimental bien diseñado, como los estudios de cohortes; iii: evidencia procedente de estudios descriptivos no experimentales bien diseñados, y iv: evidencia procedente de documentos u opiniones de comités de expertos o experiencias clínicas de autoridades o los estudios de series de casos.
Tercera Conferencia de Consenso Canadiense sobre el Diagnóstico y Tratamiento de la Demencia50–52. Federación Europea de Sociedades Neurológicas53. Asociación Americana de Psiquiatría54. Asociación Británica de Psicofarmacología55.
- I.
- IV.
El uso de antipsicóticos debe iniciarse a la mínima dosis disponible con un seguimiento estrecho de los pacientes con el objetivo de mantenerlos el mínimo tiempo posible a la mínima dosis eficaz.
- V.
Siempre que se prescriba un neuroléptico a un paciente con demencia debe informarse al paciente y/o a su cuidador de los posibles riesgos y beneficios del tratamiento así como de las consecuencias de no tratar los síntomas, y se debe reflejar en la historia clínica tanto el hecho de haber proporcionado la información como la conformidad del paciente/familia con el tratamiento.
- VI.
Para la agitación con ideas delirantes la primera opción de tratamiento sería un antipsicótico84,85. Como antipsicóticos recomendados se encuentran la risperidona (0,5–2mg/día), como primera opción, y la quetiapina (50–150mg/día), como segunda opción. El tiempo recomendado de espera para cambio de fármaco si la respuesta es inadecuada es de 5 a 7 días, manteniéndose de 1 a 3 meses una vez logrado el control de síntomas e intentando posteriormente una retirada paulatina lo más precoz posible, según intensidad y recurrencias del síntoma84. Dicha pauta es recomendable igualmente para los puntos vii, viii, xi y xiv.
- VII.
En el caso de agitación sin delirio se recomienda intentar forzar el manejo no farmacológico, introduciendo un antipsicótico sólo en caso de no poder controlar el síntoma con la primera medida o si el síntoma es intenso, persistente o recurrente.
- VIII.
Ante la aparición de ideación delirante sin agitación el antipsicótico sería la primera medida.
- IX.
En pacientes con diabetes, obesidad o dislipidemia se recomienda evitar los neurolépticos típicos, la clozapina y la olanzapina debido a sus efectos orexígenos y sobre los perfiles lipídico y glucémico.
- X.
Si hay insuficiencia cardíaca o prolongación del intervalo QT se deben evitar clozapina, ziprasidona y neurolépticos típicos.
- XI.
En el caso de alteraciones del comportamiento en pacientes con demencia por cuerpos de Lewy o demencia-Parkinson se debe considerar rivastigmina en primera instancia87. Si es imprescindible utilizar un neuroléptico el de elección será la quetiapina, por su baja afinidad por los receptores D2.
- XII.
Para el trastorno depresivo no delirante el tratamiento de elección recomendado es un antidepresivo. Un metaanálisis de ensayos clínicos aleatorizados, doble ciego, controlados con placebo88 concluye que a pesar de una muestra relativamente pequeña, los antidepresivos son eficaces en el tratamiento de la depresión en enfermos con demencia, con una buena tolerancia. Aunque debido al tamaño de los estudios no se pueden establecer diferencias en cuanto a la eficacia del tratamiento, los antidepresivos recomendados como primera opción serían los inhibidores de la recaptación de la serotonina por su perfil menor de efectos secundarios. Les seguirían la venlafaxina o la mirtazapina. No se recomienda por sus efectos anticolinérgicos86 el uso de amitriptilina, doxepina, inhibidores de la monoaminooxidasa y clomipramina, y por la falta de estudios el uso de duloxetina88. La duración del tratamiento debe extenderse al menos 9–12 semanas antes de concluir que el fármaco elegido no ha sido eficaz. En caso de que los síntomas depresivos no mejoren con el tratamiento debe considerarse la indicación de remitir al paciente al psiquiatra.
- XIII.
En caso de que el paciente presente ansiedad importante, el fármaco indicado sería también un antidepresivo, utilizando las benzodiacepinas sólo en caso de urgencia y durante períodos cortos de tiempo. Serían de elección el loracepam o similares (vida media corta).
- XIV.
Para el trastorno depresivo delirante estaría indicado asociar un neuroléptico al antidepresivo.
- XV.
Los antidepresivos con mayor seguridad en la combinación con fármacos antipsicóticos son citalopram, sertralina, venlafaxina, mirtazapina y trazodona. Fluoxetina, fluvoxamina y paroxetina presentan más interacción fármaco-fármaco por tratarse de inhibidores potentes de las enzimas del citocromo P450.
- XVI.
En pacientes con labilidad emocional, risa o llanto patológicos, debe valorarse realizar una prueba terapéutica con un antidepresivo o un estabilizador del estado de ánimo.
- XVII.
De los estabilizadores del estado de ánimo (carbamacepina, ácido valproico, gabapentina, pregabalina, lamotrigina, topiramato, oxcarbacepina), una reciente revisión sistemática89 concluye que con la pobre información acumulada hasta la fecha (2 ensayos con carbamacepina y cinco con ácido valproico), el uso rutinario de los anticomiciales en el tratamiento de los SPCD como primera opción no puede ser recomendado, con beneficios inconsistentes y efectos secundarios significativos. Así, la carbamacepina ha demostrado eficacia en el manejo de los SPCD en estudios controlados90,91, aunque su uso se ve limitado por su perfil de efectos secundarios (sedación, hiponatremia, alteraciones de la conducción cardíaca) y de interacciones con otros fármacos92. Aunque aún no se han publicado estudios al respecto, la oxcarbacepina podría ser una alternativa a la carbamacepina, puesto que su perfil terapéutico es el mismo y se tolera mucho mejor, sin olvidar que precisa monitorizar los niveles de sodio por el mayor riesgo de hiponatremia. El ácido valproico ha mostrado en un estudio controlado, doble ciego con placebo93, y en otro abierto94 tendencia a la mejoría, sin llegar a ser concluyente, mostrando en dos últimos estudios95,96 ser ineficaz en el tratamiento de la agitación, con un perfil de efectos secundarios significativamente mayor que placebo. La gabapentina se tolera bien y se ha publicado un estudio abierto de serie de casos (12 pacientes)97 con buenos resultados para esta indicación, especialmente a largo plazo. La pregabalina con un perfil de tolerancia mejor que la gabapentina podría ser otra alternativa, aunque hasta el momento no se dispone de información sobre su eficacia en los SPCD. Sobre la lamotrigina, sólo se han publicado casos aislados retrospectivos sin eficacia claramente contrastada98. El topiramato empeora severamente la función cognitiva99. Así, pues, aunque los estabilizadores del estado de ánimo no pueden recomendarse como tratamiento único de elección de los SPCD89, podrían ser de utilidad añadidos a los neurolépticos, atendiendo a las anteriores especificaciones92.
- XVIII.
Precisa monitorización estrecha la asociación de cualquier antipsicótico a litio, a carbamacepina, a lamotrigina y a valproato, aunque parece seguro asociar valproato a risperidona, a aripiprazol o a los antipsicóticos típicos de alta potencia.
- XIX.
En relación con el uso de antidepresivos y SPCD, los estudios son poco numerosos, aunque pueden abrir nuevas opciones terapéuticas, especialmente el citalopram. Así, un estudio aleatorizado, doble ciego, de 12 semanas de duración en 103 pacientes con demencia hospitalizados por SPCD que compara la eficacia del citalopram (dosis media: 31mg/día) y la risperidona (dosis media:2,7mg/día) muestra que los síntomas agitación y delirios mejoraron globalmente en ambos grupos, sin diferencias significativas en cuanto a eficacia, pero sí en cuanto a los efectos secundarios, más frecuentes con risperidona100.
- XX.
En los otros SPCD no psicóticos, como euforia, desinhibición, conducta motora aberrante o apatía, apenas si hay estudios y no son concluyentes, sin demostrar clara eficacia de neurolépticos, estabilizadores del ánimo, antidepresivos, IACE, memantina u otros fármacos.
Los autores declaran no tener ningún conflicto de intereses.