El resveratrol es un polifenol natural presente en numerosas plantas y frutos como cacahuetes, moras, arándanos y, sobre todo, en la uva y el vino tinto. Su síntesis está condicionada por la presencia de factores estresantes, tales como la contaminación fúngica o la radiación ultravioleta. En las plantas actúa como fitoalexina, es decir, posee la capacidad de inhibir el progreso de ciertas infecciones. La medicina antigua ha utilizado extractos de plantas que contienen resveratrol desde hace más de 2.000 años y hace más de 30 años que se aisló y se comenzaron a estudiar sus propiedades con métodos científicos. Sus propiedades in vitro han sido ampliamente estudiadas y contrastadas, entre ellas cabe destacar su actividad como anticancerígeno, antiagregante plaquetario, antiinflamatorio, antialérgico, etc. En cuanto a sus propiedades in vivo su actividad no está tan clara; existen numerosos estudios que encuentran beneficios sobre el sistema cardiovascular, enfermedades como la diabetes y sobre la longevidad; sin embargo, otros autores no encuentran una equivalencia de los estudios in vitro a in vivo. Esta discrepancia es debida a la biodisponibilidad que tiene el resveratrol. Tras un consumo oral se ha comprobado que la absorción es muy buena, pero las vías metabólicas dejan solo una pequeña fracción de resveratrol libre en sangre, por lo que la disponibilidad en los tejidos diana es muy baja y no se llegan a las concentraciones empleadas en los estudios in vitro. Así pues, aunque los estudios in vitro indican que se trata de una molécula biológicamente activa con propiedades saludables, los estudios realizados in vivo hasta el momento no pueden confirmar parte de estos resultados, lo cual puede atribuirse a su baja biodisponibilidad.
Resveratrol is a natural polyphenol which can be found in many plants and fruits, such as peanuts, mulberries, blueberries and, above all, in grapes and red wine. Its synthesis is regulated by the presence of stressful factors, such as fungal contamination and ultra-violet radiation. In plants, it plays a role as a phytoalexin, showing a capacity to inhibit the development of certain infections. Plant extracts which contain resveratrol have been employed by traditional medicine for more than 2000 years. Resveratrol was first isolated, and its properties were initially studied with scientific methods, thirty years ago. Its in vitro properties have been extensively studied and demonstrated. It is worth highlighting its activity as an anti-cancer agent, platelet anti-aggregation agent, anti-inflammatory, antiallergenic, etc. The activity of its in vivo properties are not so clear. There are many studies that report benefits on the cardiovascular system, illnesses such as diabetes, and in longevity. However, other authors did not find any agreement between in vitro and in vivo studies. This discrepancy is due to the bioavailability of resveratrol. After an oral dose, it has been demonstrated that the absorption is very high, but the metabolic pathways leave just a little free resveratrol in blood, therefore the bioavailability in the target tissues is very low and the concentrations used in in vitro studies are not found in these tissues. Thus, resveratrol is a very active molecule for maintaining health, but due to the low bioavailability not all the in vitro effects can be translated to in vivo. This opens a new potential approach, seeking derivatives of resveratrol that can be measured in the desired tissues
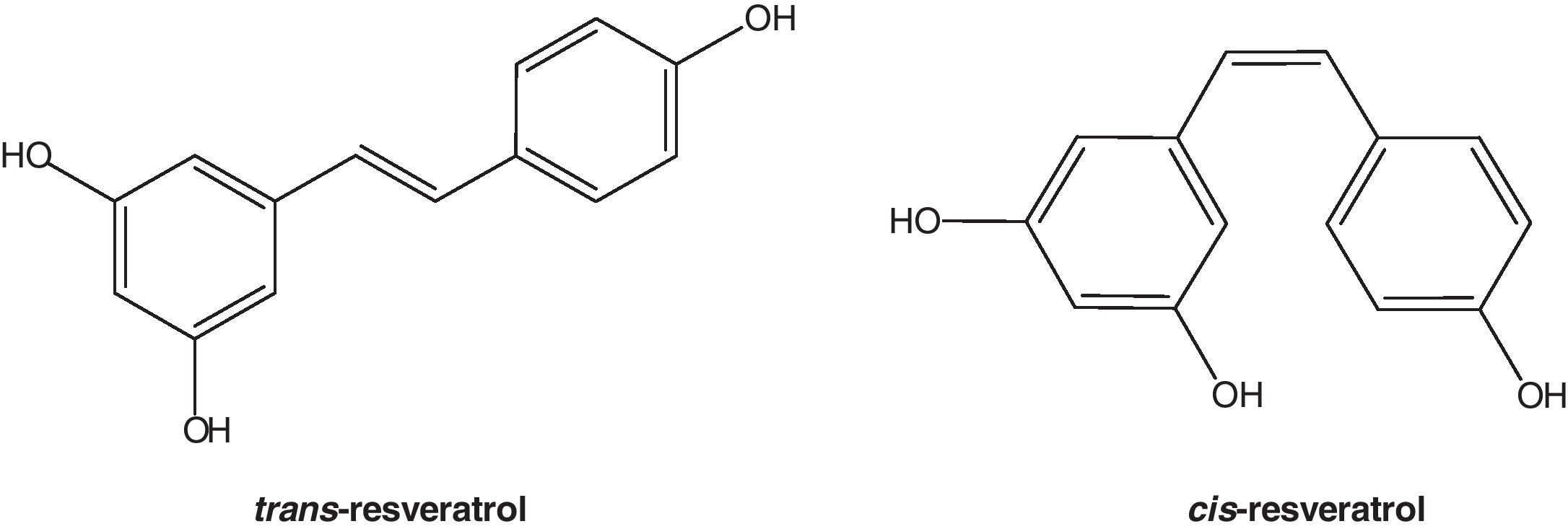
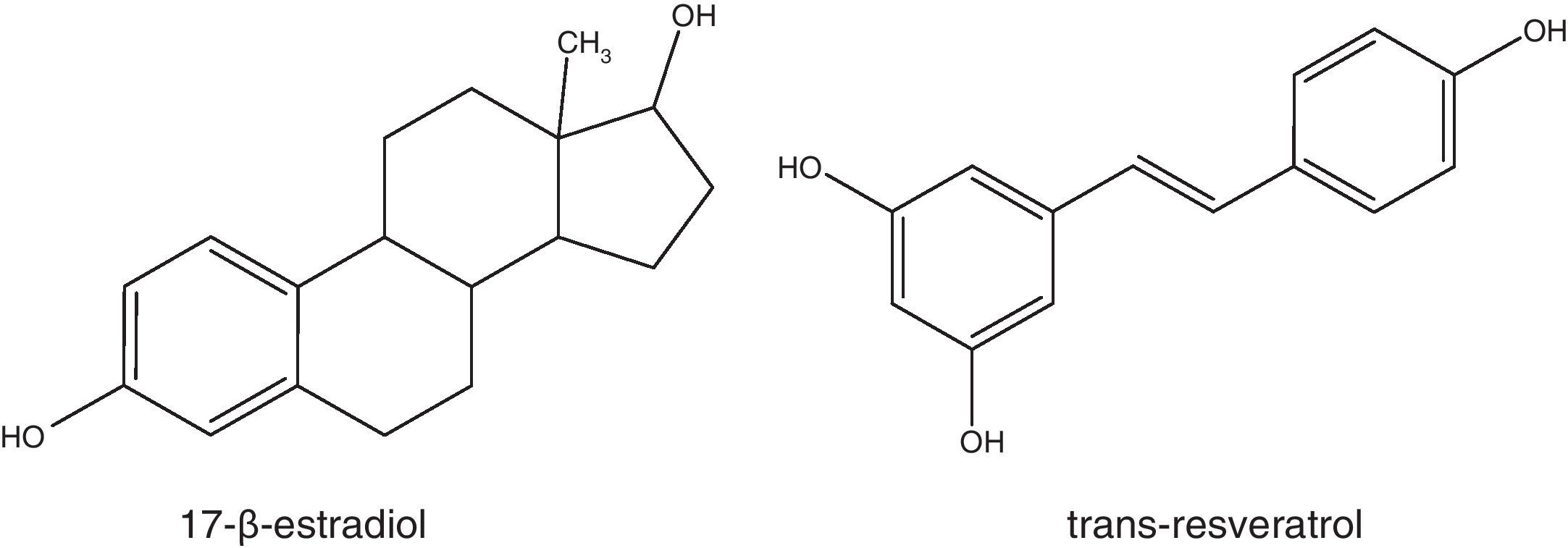
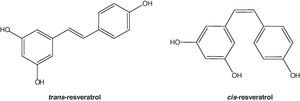
El resveratrol (3,5,4’-trihidroxiestilbeno) es un polifenol natural, con estructura de estilbeno. Su estructura química no fue caracterizada hasta 1940 por Takaoka, quien logró aislarlo de las raíces de Veratrum grandiflorum1. No obstante, hacía más de 2.000 años, que estaba presente en preparados medicinales, como el darakchasava o el manakka2. Su estructura base consiste en la unión de 2 anillos fenólicos por un doble enlace estireno que forman el 3,5,4′-trihidroxiestilbeno (peso molecular: 228,25g/mol). Este doble enlace es el responsable de las formas isoméricas cis y trans del resveratrol (fig. 1). El isómero trans es la forma más estable desde el punto de vista estérico3.
Se conocen multitud de análogos sintéticos o naturales del resveratrol, así como los isómeros, aductos, derivados y conjugados de estos4. Además, en la naturaleza es frecuente encontrar el resveratrol unido a azúcares simples, formando glucósidos.
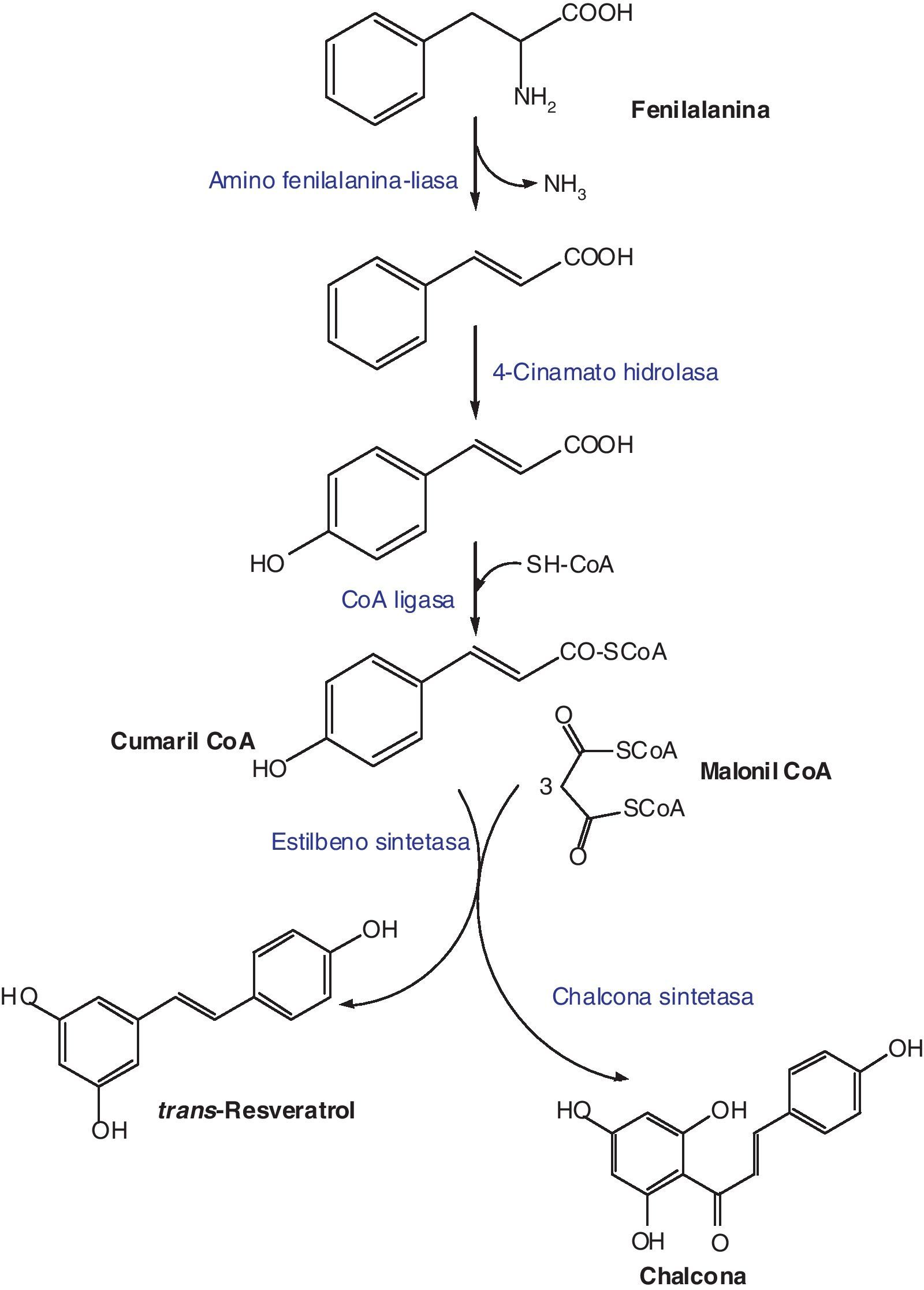
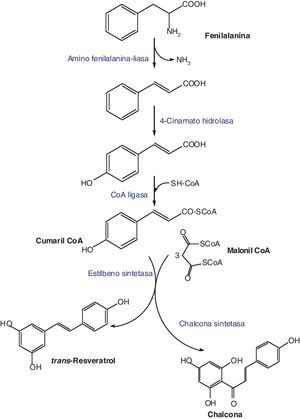
BiosíntesisLa síntesis del trans-resveratrol se inicia con la biotransformación de la fenilalanina y tiene lugar mediante la condensación de una molécula de cumaril-CoA con 3 de malonil-CoA. Esta reacción está catalizada por la resveratrol sintetasa, una enzima que pertenece a la familia de las estilbeno sintetasas (STS) (fig. 2)5.
Las STS, entre las que se encuentra como hemos dicho la resveratrol sintetasa, son enzimas codificadas por una familia multigénica caracterizada por tener secuencias de nucleótidos con alta homología6. Existen 8 genes que codifican la formación de la STS en la vid (pSV21, pSV25, pSV696, pSV368, Vst1, Vst2, Vst3)5. Dichos genes se encuentran agrupados de acuerdo a su sensibilidad hacia señales externas, incluyendo estreses abióticos o señales bióticas originadas por células fúngicas7,8.
La síntesis de resveratrol disminuye regularmente con la maduración de las uvas, en relación con el declinar en la inducción de la expresión genética de la STS. Este hecho explica el aumento de la susceptibilidad de los frutos maduros a la infección por B. cinerea5.
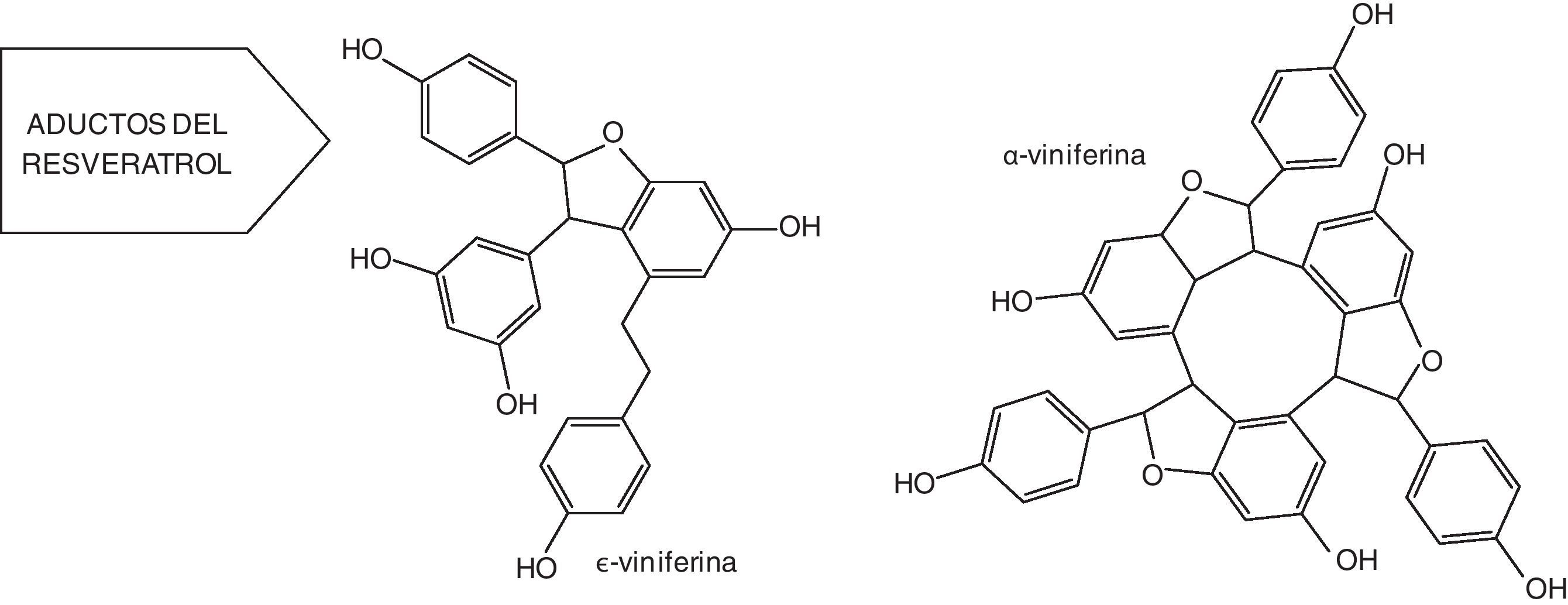
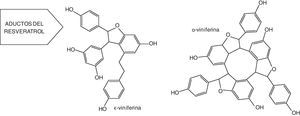
Derivados del resveratrolLa dimerización oxidativa de las unidades de resveratrol conduce a una serie de oligómeros denominados viniferinas9,10. La ¿-viniferina (un dehidrodímero de resveratrol) y la α-viniferina (un dehidrotrímero de resveratrol cíclico) (fig. 3), han sido bien caracterizadas en el vino, aunque también se ha sugerido la presencia de la β-viniferina (un tetrámero cíclico de resveratrol) y de la γ-viniferina (un oligómero de muy alto peso molecular)10. Al parecer, la formación de las viniferinas es producto de la acción de unas enzimas peroxidasas asociadas a la oxidación del trans-resveratrol. La oxidación de los 4-hidroxiestilbenos, incluido el resveratrol, ha sido estudiada extensamente11,12. Los resultados más significantes muestran que la oxidación del resveratrol en la uva está controlada por 3 isoenzimas peroxidasas, denominadas A1, B3 y B5. Estas enzimas parecen estar ligadas tanto a las defensas constitutivas como a las susceptibles de inducción de la uva contra los hongos11.
Fuentes en la naturalezaEl resveratrol es un potente antioxidante producido por más de 70 especies de plantas en respuesta a situaciones estresantes (radiación ultravioleta, infecciones fúngicas, etc.)13.
Está presente en varios frutos que forman parte de la dieta humana. Tales como los arándanos (Vaccinium spp.), la grosella (Vaccinum spp.), las moras (Morus spp.) y los cacahuetes (Arachis hypogaea)14,15. Otro alimento rico en resveratrol es el vino tinto, el cual es el que aporta un mayor contenido de este a nuestro tipo concreto de dieta (dieta mediterránea).
El contenido en resveratrol del vino procede de las uvas (Vitaceae), en concreto de su piel, semillas, peciolos y partes leñosas, que son las más ricas en este compuesto16. Por este motivo, el vino tinto es más rico en resveratrol que el vino blanco, ya que durante la obtención del tinto se maceran las partes de la uva en las que se encuentra el resveratrol, a diferencia de la obtención del blanco, en la que se desechan dichas partes17,18. Además, el alcohol que se forma durante la fermentación de la uva favorece su solubilidad y, por tanto, su extracción.
El isómero más abundante del resveratrol es el trans-resveratrol y, aunque también se ha identificado el cis-resveratrol en el vino, este no se ha encontrado en el extracto de uva19,20, por lo que es probable que la síntesis de cis-resveratrol tenga lugar durante el proceso de vinificación o mediante la acción de la luz ultravioleta. En cualquier caso, el contenido en forma trans es mayoritario. El cis-resveratrol se puede obtener a partir del trans-resveratrol mediante la fotorreacción que se produce cuando se le somete a luz UV16.
La concentración de resveratrol en las plantas depende de varios factores. Por ejemplo, en la vid, las 2 variables más importantes son el clima y la presión fúngica21–24.
Aunque con una menor importancia en nuestra cultura, una de las fuentes más ricas de resveratrol es la hierba Polygonum cuspidatum, los extractos de cuya raíz han desempañado un papel muy importante en la medicina tradicional japonesa y china, siendo el principal principio activo del preparado ko-jo-kon, que se usa para el tratamiento de enfermedades relacionadas con el sistema cardiovascular25.
La presencia de resveratrol está documentada también en algunos árboles como el eucalipto21,26 y el abeto27, así como en el árbol tropical de hoja caduca Bauhinia racemosa28.
También se ha identificado el resveratrol en algunas plantas con flor, concretamente en 2 tipos de liliáceas: Veratrum grandiflorum y Veratrum formosanum, que son capaces de sintetizar este compuesto. La Veratrum grandiflorum presenta un alto contenido de resveratrol en las hojas, cuando la planta es dañada por causa de algún tratamiento químico29. Sin embargo, en la Veratrum formosanum son las raíces y los rizomas los que son ricos en resveratrol y, de hecho, tradicionalmente en Oriente se ha utilizado una preparación en crudo de esta planta para tratar la hipertensión30.
Además, se ha encontrado resveratrol en un tipo de legumbre no comestible, la Pterolobium hexapetallum31.
Así pues, el resveratrol se encuentra en una gran cantidad de plantas, de las cuales puede ser extraído.
Funciones: el resveratrol como fitoalexinaEl resveratrol se acumula en respuesta a una infección por hongo, radiación UV, sustancias químicas y, en general, factores que causan estrés en la planta5,9,32. Por ejemplo, existe una correlación entre la producción de resveratrol en uvas y la resistencia al hongo gris33 y también al hongo negro causado por Rhizopus stolonifer en distintas variedades de uva14.
El resveratrol pertenece al llamado grupo de las fitoalexinas. Estas sustancias químicas se caracterizan por tener bajo peso molecular y ser capaces de inhibir el progreso de ciertas infecciones. La acumulación de estas sustancias en las plantas se produce como consecuencia de un mecanismo de resistencia a los parásitos y otras condiciones adversas17,34–36.
La primera vez que se estudió su actividad biológica9, se estableció que el ED50 (dosis efectiva 50) del resveratrol sobre los conidios latentes de la B. cinerea o sobre esporas de C. cuccumerinum era de más de 200μg/ml. Se concluyó, por tanto, que el resveratrol debido a su baja capacidad antifúngica, debía ser considerado como un precursor de compuestos con mayor fungitoxicidad (viniferinas y pteroestilbenos), más que como una fitoalexina. Sin embargo, estudios posteriores en los que se aseguraba la solubilidad del resveratrol añadiendo una mínima cantidad de etanol (de menos del 4%) establecieron que este ya tenía un efecto real en la inhibición de la germinación de cultivos líquidos de B. cinerea cuando se usaban concentraciones menores5.
No obstante, el pteroestilbeno, derivado dimetilado del resveratrol, es 5 veces más activo que este. Inhibe completamente la germinación de los conidios a concentraciones de entre 52 y 60μg/ml10,32. Estas variaciones en las actividades antifúngicas de los 2 compuestos indican que in vivo la metilación de los grupos hidroxifenilos puede conducir a incrementar la actividad biocida de los fenoles.
El modo de acción de los hidroxiestilbenos en las células fúngicas ha sido muy estudiado. El grupo de Pezet ha sugerido que actúan como agentes desacoplantes de la cadena de transporte electrónico y de la fosforilación37. A nivel subcelular, se ha visto que el resveratrol es capaz de inactivar las ATPasas de algunos hongos y de inducir la disociación de las chaperonas y las co-chaperonas, 2 proteínas frecuentemente asociadas con el citoesqueleto33.
A nivel ultraestructural, Pezet y Pont informaron que el pterostilbeno añadido en concentraciones de 128μg/ml en conidios latentes de B. cinerea, induce fuertes modificaciones en la membrana endocelular, específicamente causa la rápida destrucción del retículo endoplasmático, y de las membranas nucleares y mitocondriales. Todos estos fenómenos aparecen de un modo sincronizado, consiguiendo un completo cese de la respiración entre 5 y 10min después de la adición de pteroestilbeno. Tras 30min, el citoplasma se coagula en numerosas vacuolas y la destrucción de los conidios finaliza (tras 3h) con la disrupción de la membrana plasmática37.
La biosíntesis del pteroestilbeno, el derivado dimetilado del resveratrol con mayor actividad antifúngica, es desconocida. De hecho, actualmente no existe evidencia científica de que el pteroestilbeno derive directamente del resveratrol5.
Metabolismo y biodisponibilidadMetabolismoEstudios en humanos y animales revelan que el resveratrol es principalmente metabolizado a glucurónido y sulfatos conjugados, los cuales podrían retener alguna actividad biológica. Algunas cualidades fisicoquímicas del resveratrol están involucradas en su actividad y captación.
SolubilidadLa estructura química del resveratrol hace que tenga poca solubilidad en agua (<0,05mg/ml), lo cual puede afectar a la absorción. Para incrementar dicha solubilidad se puede utilizar el etanol (50mg/ml) o solventes orgánicos como el DMSO (16mg/ml), aunque esto no es aplicable a su uso en humanos. Otra forma de mejorar la solubilidad del resveratrol en agua es utilizando vectores para formar un complejo con el resveratrol, como puede ser el uso de ciclodextrinas. Cabe destacar su capacidad para formar una amplia gama de complejos orgánicos moleculares38. La esterificación de grupos hidroxilo con moléculas alifáticas puede también ser empleada como herramienta para incrementar su absorción intestinal y permeabilidad celular38 como, por ejemplo, la acetilación del resveratrol, lo cual podría aumentar su absorción38 e incrementar su captación celular sin pérdida de actividad39,40.
Cis-isomerizaciónEn los alimentos naturales, plantas o el vino coexisten los isómeros cis- y trans-, sin embargo, la forma natural mayoritaria y más estable parece ser el isómero trans-. La cis-isomerización puede ocurrir cuando la isoforma trans- es expuesta a la luz solar41 o artificial o radiación ultravioleta42 a 254nm de longitud de onda43 o 366nm44. Los metabolitos cis- han sido identificados en muestras humanas de orina, principalmente como cis-resveratrol-4′-sulfato, cis-resveratrol-3-O-glucurónido y cis-resveratrol-4′-O-glucurónido45,46. La mayoría de las investigaciones han sido con el isómero trans, lo cual es debido, en parte, a la inestabilidad del isómero cis-41. Sin embargo, los datos indican que ambos isómeros pueden tener efectos biológicos distintos47–49.
Reacciones redoxComo otros muchos polifenoles, el resveratrol puede sufrir un proceso de autooxidación, lo cual conlleva a la producción de O2− H2O2 y una mezcla compleja de semiquinonas y quinonas que pueden llegar a ser citotóxicas50,51. Estos hechos se han visto particularmente en medios de cultivo y pueden indicar un fallo de la interpretación de los resultados in vitro. La molécula de resveratrol oxidado puede generar complejos con el cobre capaces de fragmentar el ADN52.
Papel de los transportadores en la absorciónGracias a la propiedad de emitir fluorescencia que presenta el resveratrol, es posible estudiar la capacidad que tiene de alcanzar las células y penetrar dentro de ellas. Para ello, se han utilizado técnicas como la microscopía por fluorescencia, citometría de flujo y espectrofluorimetría, entre otras, las cuales ayudan a estudiar su distribución.
A nivel intestinal, el resveratrol se absorbe, o bien por difusión pasiva o formando complejos con transportadores de membranas, como las integrinas. Una vez en la sangre, el resveratrol se encuentra básicamente en 3 formas distintas: como glucurónido, sulfatado y libre. La forma libre puede ser transportada unida a la albúmina y a lipoproteínas como la LDL (lipoproteínas de baja densidad). Estos complejos, a su vez, pueden ser disociados en membranas celulares que dispongan de receptores para la albúmina y LDL, dejando libre el resveratrol y permitiendo que este penetre en las células. La afinidad y la unión del resveratrol con la albúmina sugieren que podría ser un reservorio polifenólico natural, alcanzando un importante papel en su distribución y biodisponibilidad53.
Debido a sus características químicas el resveratrol es capaz de interaccionar son ácidos grasos. Estudios recientes in vitro, indican que más del 90% del trans-resveratrol libre se une a las lipoproteínas plasmáticas humanas. Esta unión también se produce de forma in vivo, como demuestra la presencia de compuestos polifenólicos dietéticos detectados en LDL aisladas en muestras sanguíneas humanas de voluntarios sanos45,54.
Los ácidos grasos permiten un entorno lipofílico favorable para la unión del resveratrol55. Normalmente, son utilizados como vectores por su alta afinidad por el hígado y por su eficiente captación celular, resultante de interacciones específicas con transportadores transmembrana.
Interacciones del resveratrol con receptores celularesLa absorción del resveratrol en células de hepatoma y hepatocitos implica principalmente a la difusión pasiva, aunque también podría estar mediada por la unión a receptores. Los receptores transmembrana no pueden explicar los efectos pleiotrópicos del resveratrol como parte de la absorción de los polifenoles por un proceso pasivo. Otros objetivos intracelulares podrían contribuir a su transporte intracelular como el receptor aril-hidrocarbonado (AhR)56.
El resveratrol es capaz de unirse a receptores de estradiol alfa y beta (ER-alfa y ER-beta) con afinidades parecidas, pero esta interacción es 7.000 veces menos potente que la correspondiente al estradiol57. Los estudios moleculares han demostrado que la dinámica de unión del resveratrol a ER-alfa es estereoselectiva, con un enlace más débil de la forma cis- en comparación con el isómero trans-58.
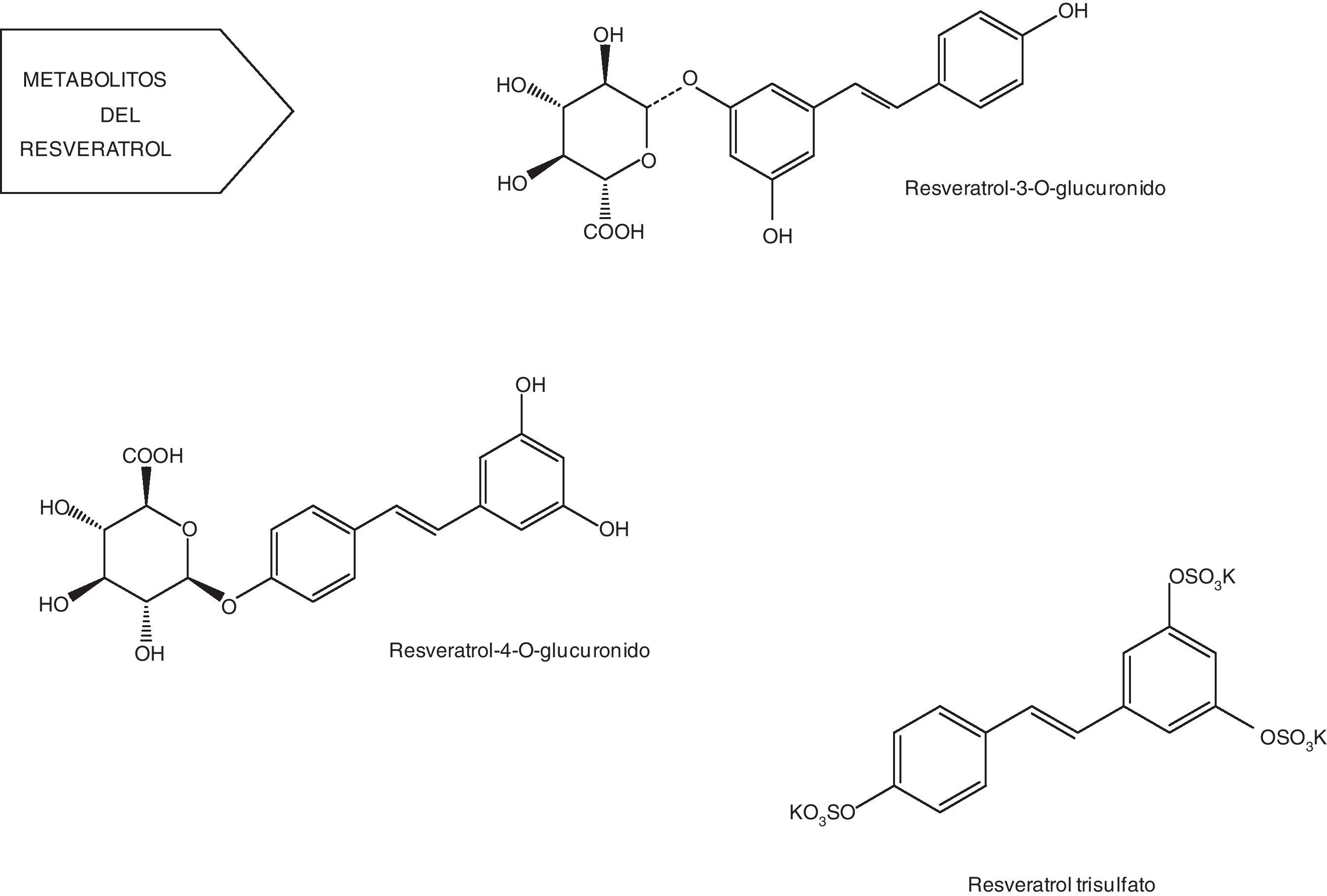
Metabolitos del resveratrolUna vez se encuentran en el torrente sanguíneo, los metabolitos pueden ser sometidos a la fase II del metabolismo con las conversiones que se producen en el hígado, donde el transporte entero-hepático en la bilis puede resultar en algunos ciclos de vuelta al intestino delgado59. Además, el resveratrol es capaz de inducir su propio metabolismo, aumentando la actividad de las enzimas hepáticas detoxificantes de la fase II60.
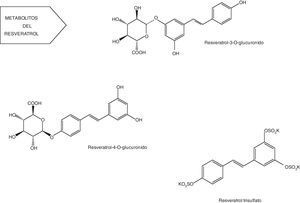
Posee un alto metabolismo que conduce a la producción de sulfatos, glucurónidos (fig. 4) y hasta 5 metabolitos distintos presentes en la orina: monosulfato de resveratrol, 2 formas isoméricas de monoglucurónido de resveratrol, dihidroresveratrol monosulfato y dihidroresveratrol monoglucurónido. Sin embargo, la naturaleza y la cantidad de metabolitos pueden diferir entre sujetos debido a la variabilidad interindividual61-63.
Un aspecto a tener en cuenta es que, en el hígado y tejido duodenal otros flavonoides dietéticos, como la quercetina, podrían inhibir la sulfatación y glucuronidación del resveratrol, incrementando así su biodisponibilidad64.
BiodisponibilidadUno de los puntos clave de la efectividad del resveratrol es su biodisponibilidad. Si bien los estudios in vitro demuestran una alta eficacia del resveratrol en las células, hoy sabemos que su distribución en los tejidos es muy baja y, por tanto, podría no tener las acciones deseadas descritas en los estudios in vitro.
A pesar de su baja biodisponibilidad, el resveratrol posee eficacia in vivo, lo cual podría ser explicada por la conversión de los sulfatos y glucurónidos de nuevo a resveratrol en órganos diana como el hígado64,65, o bien por la recirculación enterohepática de los metabolitos del resveratrol, seguido por la desconjugación de la microflora intestinal y la reabsorción66 y, por último, por las actividades de sus metabolitos. Es necesario tener en cuenta, que la glucuronidación de la forma cis es más rápida (5-10 veces) que la de la forma trans, lo cual llevaría a una menor biodisponibilidad de la forma cis64.
La absorción del resveratrol es altamente variable, en función de la forma en la que se consume y de los alimentos ingeridos. No obstante, en la bibliografía podemos encontrar distintos resultados al respecto67.
También hay que tener en cuenta que la presencia de grupos hidroxilo permite a los polifenoles asociarse con proteínas e hidratos de carbono, reduciendo la disponibilidad de estos macronutrientes. La solubilidad de estos compuestos va a determinar sus efectos fisiológicos. Por ello, los complejos formados entre estos macronutrientes y polifenoles que mantengan la solubilidad tendrán la capacidad de ser absorbidos en el intestino delgado, mientras que los complejos insolubles serán simplemente eliminados con las heces68.
Absorción de resveratrol en humanosDos de los primeros estudios en humanos de la absorción y la biodisponibilidad del resveratrol emplearon dosis orales únicas de 25mg61,69, las cuales corresponden a un consumo moderado de vino tinto. A pesar de la utilización de metodología de alta sensibilidad y de un análisis molecular específico, fue difícil detectar el resveratrol no metabolizado en el plasma circulante. Los cálculos aproximados muestran concentraciones máximas de <10ng/ml, 0,5-2h después de la dosis oral. Las estimaciones de las concentraciones plasmáticas de resveratrol más los metabolitos totales fueron considerablemente más altas, alrededor de 400-500ng/ml (≈2mM)61,69, lo cual indica una biodisponibilidad oral muy baja para el resveratrol libre.
Atendiendo a la excreción urinaria de los metabolitos totales después de una dosis radiomarcada, la absorción oral de resveratrol pareció ser, al menos, de un 75%. Lo cual también se deduce de una comparación de los datos tras las dosis orales o intravenosas61. Esta absorción es inusualmente alta para un polifenol dietético, particularmente cuando se considera la pobre solubilidad acuosa de este compuesto.
Así pues, la absorción del resveratrol es bastante eficaz, sin embargo la biodisponibilidad por los tejidos es muy baja.
Biodisponibilidad en humanos de trans-resveratrol presente en el vinoUn estudio muy interesante para comprobar la biodisponibilidad en humanos de trans-resveratrol libre presente en el vino tino, fue realizado por Vitaglione et al.67. Para testar dicha biodisponibilidad reunieron 3 grupos experimentales. El primer grupo consumió 300ml de vino tinto con una concentración de resveratrol de 0,82mg/ml y con una comida compuesta por ternera, huevo, pan, aceite de maíz y patatas fritas. El segundo grupo consumió 600ml de vino tinto en ayunas (antes del desayuno) con una concentración de 3,2mg/ml de trans-resveratrol; por último, el tercer grupo consumió 2 comidas con diferente contenido lipídico y 600ml de vino tinto, que contenía 480μg de trans-resveratrol. Los resultados mostraron una diferencia entre individuos respecto a la detección de metabolitos muy importante. Los autores concluyeron que el tipo comida no afectaba a la biodisponibilidad y que existía mucha variabilidad entre individuos y, finalmente, atribuyeron el efecto beneficioso del vino tinto a los polifenoles presentes en el. Sin embargo, estos resultados no cuadran con los obtenidos en otros experimentos en los cuales una comida rica en grasa disminuyó su absorción70. Por tanto, concluimos que los métodos de procesamiento de las muestras y el tipo de análisis, son claves para la detección del resveratrol tanto libre como conjugado67.
Estrategias para incrementar la biodisponibilidad de resveratrol en humanosSe han realizado varias aproximaciones para aumentar la biodisponibilidad del resveratrol en humanos. El incremento de la dosis, un enfoque lógico común, ha sido examinado en 2 estudios que emplearon una dosis total de 25 a 5.000mg63,71, cubriendo así el amplio rango utilizado en estudios de quimioprevención. La absorción en estos casos llegó a un máximo de entre 0,3 y 2,4μM, lo cual no alcanza las propiedades anticancerígenas, las cuales se encuentran a concentraciones mayores de 5μM. Además, estos estudios muestran que la biodisponibilidad del resveratrol aumenta durante el tratamiento y no encuentran saturación del metabolismo a las concentraciones más elevadas (500ng/ml)63. Sin embrago, en otros estudios realizados en ratas con tratamientos de 15-20 semanas de administración, comprueban que existe una saturación del metabolismo, lo que conlleva a un aumento de resveratrol en plasma y, por lo tanto, en tejidos72–74.
Un estudio farmacocinético de dosis repetidas durante 2 días, concluye que la tolerancia es buena, que las concentraciones en plasma no son más altas sino que incluso bajan y, que la administración por la mañana tiene mayor biodisponibilidad75.
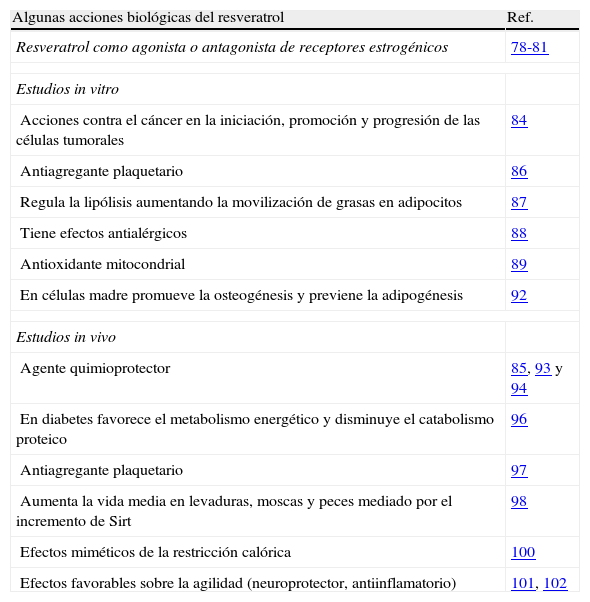
Efectos biológicosEl campo de estudio de las propiedades beneficiosas de los compuestos fenólicos presentes en la uva, ha comenzado a ampliarse más allá de la conocida como «paradoja francesa», de forma que se han desarrollado estudios acerca de la capacidad que presentan los polifenoles de la uva en la protección frente a distintos tipos de enfermedades76,77. Dentro de la uva y sobre todo en el vino tinto se encuentra el resveratrol, que ha sido la molécula presente en el vino más estudiada. En este apartado comentaremos algunas de las propiedades beneficiosas que se atribuyen al resveratrol. En la bibliografía podemos encontrar más de 200 referencias sobre sus propiedades, nosotros comentaremos algunas de ellas, en función de si el tipo de estudio ha sido in vivo o in vitro (tabla 1).
Acciones biológicas del resveratrol
| Algunas acciones biológicas del resveratrol | Ref. |
| Resveratrol como agonista o antagonista de receptores estrogénicos | 78-81 |
| Estudios in vitro | |
| Acciones contra el cáncer en la iniciación, promoción y progresión de las células tumorales | 84 |
| Antiagregante plaquetario | 86 |
| Regula la lipólisis aumentando la movilización de grasas en adipocitos | 87 |
| Tiene efectos antialérgicos | 88 |
| Antioxidante mitocondrial | 89 |
| En células madre promueve la osteogénesis y previene la adipogénesis | 92 |
| Estudios in vivo | |
| Agente quimioprotector | 85, 93 y 94 |
| En diabetes favorece el metabolismo energético y disminuye el catabolismo proteico | 96 |
| Antiagregante plaquetario | 97 |
| Aumenta la vida media en levaduras, moscas y peces mediado por el incremento de Sirt | 98 |
| Efectos miméticos de la restricción calórica | 100 |
| Efectos favorables sobre la agilidad (neuroprotector, antiinflamatorio) | 101, 102 |
La actividad del resveratrol se debe a las distintas propiedades biológicas que posee, tales como: su capacidad de unirse a diferentes receptores como el de estrógenos considerándose como un fitoestrógeno, su capacidad de unirse a otras moléculas o aniones como el cobre, su capacidad antioxidante, etc.
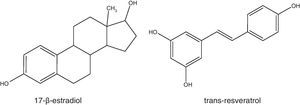
El resveratrol como fitoestrógenoLa estructura química del resveratrol presenta bastantes similitudes con estrógenos sintéticos como el dietilestilbestrol y con el 17-β-estradiol (fig. 5), razón por la cual se han llevado a cabo varios estudios con la finalidad de probar su capacidad para actuar como un fitoestrógeno78-81.
Los estrógenos, y también los fitoestrógenos, actúan mediante los receptores de estrógenos. La unión del estrógeno con estos receptores activa la transcripción de los genes que regula, por lo tanto podrían activar genes beneficiosos para la longevidad como los genes antioxidantes82,83. Se ha determinado que el resveratrol se puede unir a los receptores de estrógenos y, por lo tanto, activar la transcripción de tales genes a concentraciones comparables a aquellas que se requieren para sus otros efectos biológicos. Al respecto, Gehm et al. demostraron en 1997 cómo el resveratrol se comportaba de forma análoga al estradiol81. Para ello, comprobaron paralelamente los efectos de estas 2 moléculas en células tumorales de glándula mamaria humana (MCF-7), ricas en receptores estrogénicos. Primero estudiaron su unión al receptor y comprobaron que la máxima eficacia de unión se encontraba a concentraciones de 10μM. Después comprobaron que existía una activación de los elementos de respuesta a estrógenos (ERE), los cuales se encargan de la activación de los genes sensibles a estrógenos. Además, para confirmar que el resveratrol inicia la activación de los ERE, utilizaron antagonistas estrogénicos los cual inhibió el efecto.
Gehm et al. informaron que en células MCF-7, el resveratrol funciona como un superagonista81, es decir, que produce una mayor respuesta en la transcripción que el mismo estradiol. Sin embargo, estos mismos autores indicaron que este efecto no se daba en otros tipos celulares, en los que sí se observaba una activación transcripcional, pero menor que la producida por los estrógenos.
Por otra parte, también se ha visto que el resveratrol, además de ser un agonista de los receptores de estrógeno, como modulador de los receptores de estrógenos que es, antagoniza el efecto promotor del crecimiento en células MCF-7 que produce el 17-β-estradiol, de un modo dependiente de la dosis, tanto a nivel del crecimiento celular, como a nivel molecular, con la activación los de genes correspondientes80.
Estudios in vitroCabe destacar, que entre los numerosos estudios in vitro que encontramos en la bibliografía, las concentraciones empleadas pueden tener efectos adversos, sobre todo cuando se trata de activar receptores estrogénicos, y que dichas concentraciones son demasiado altas para obtenerlas con el consumo de alimentos como el vino tinto67.
Sin embargo, estos estudios concluyen que respecto a la proliferación celular, el resveratrol produce su inhibición a concentraciones de 10-30μM, concretamente se bloquea el efecto en la fase G/S2 del ciclo celular, sugiriendo una inhibición en las actividades enzimáticas implicadas de la duplicación del ADN. Estos mismos efectos han sido observados en una línea celular de cáncer de próstata a una concentración de 25μM y no de 0,25μM. El efecto antitumoral del resveratrol es bien conocido, de hecho existen numerosos estudios sobre el tema. Se ha visto que este efecto sobre el cáncer tiene efectos en la iniciación, promoción y progresión de las células tumorales84. Así, se ha visto como el resveratrol a 15μM es capaz de inhibir la ciclooxigenasa 1 (COX-1), un enzima muy activo durante la progresión tumoral. Además, el resveratrol a 11μM induce marcadores fenotípicos no proliferativos, como la reducción de la actividad del nitroblue tetrazolium. En la iniciación de células tumorales, actúa inhibiendo la formación de radicales libres a 27μM en células HL-60 de leucemia y en células de hepatoma (Hepa LcLc7) inhibe la actividad de la reductasa hepática, enzima que produce toxicidad hepática, a concentraciones de 21μM. Además, a 18μM, se inhibía la incorporación de timidina, lo cual indica el fin de la diferenciación y, por lo tanto, la transformación a un fenotipo no proliferativo85. Por lo tanto, el resveratrol administrado in vitro tiene efectos antitumorales.
La agregación plaquetaria es inhibida por el resveratrol tanto in vitro como in vivo. Hay estudios que sugieren que el efecto está producido por la unión a los canales de calcio, lo cual produce una inhibición de la trombina a concentraciones de resveratrol de 0,1; 1 y 10μM con inhibiciones del 20, 30 y 50% respectivamente86. Esto se puede traducir en efectos beneficiosos sobre el sistema cardiovascular, por interferir en cierta manera en la formación de trombos.
Otros efectos cardiovasculares atribuidos al resveratrol son los observados en la regulación del acúmulo de triglicéridos y la regulación de la lipólisis en adipocitos murinos. Cuando se incuba las células con resveratrol, se observa una disminución de triglicéridos por un aumento de la lipólisis, aumentando la actividad de la triglicérido lipasa. Dichos estudios, realizados en células de adipocitos humanos (3T3-L1 y SGBS), muestran cómo el resveratrol regula la lipólisis, pudiendo producir una disminución en la acumulación de grasa. Ello es debido, en parte, a un aumento en la movilización de lípidos, por aumento en la expresión de triglicérido lipasa de los adipocitos87. Los autores sugieren un posible tratamiento de la obesidad, empleando concentraciones de 100μM.
En cultivos de RBL-2H3, un modelo celular de leucocitos, se ha visto que, a concentraciones de 15μM, el resveratrol tiene un efecto antialérgico por disminución de la actividad β-hexosaminidasa88.
Su actividad antioxidante ha sido determinada en mitocondrias cerebrales aisladas, las cuales, al ser incubadas con estradiol, muestran una inhibición de la respiración mitocondrial. Además, inhibe la actividad del complejo III por competición con el coenzima Q; este hecho es interesante ya que determina su actividad antioxidante en la mitocondria, lo cual no solo se produce por su actividad en la captación de electrones desapareados, sino además, por actuar sobre un complejo que produce radicales libres89.
En células MCF-7, el resveratrol tiene un efecto agonista y antagonista de receptores estrogénicos, controlando el crecimiento celular, dependiendo de su concentración. Cuando se utilizan concentraciones de 5μM se produce un efecto inhibitorio57. Otros artículos también muestran efectos anticancerígenos del resveratrol, por inhibición in vitro en MCF-790 y por inhibición de un modelo de ratón de cáncer de piel91.
En células madre mesenquimales humanas, el resveratrol promueve una osteogénesis espontánea activando genes relacionados con estos, como la osteocalcina y RUNX2, y previene la adipogénesis suprimiendo la expresión de genes como PPARγ2 y la leptina92, lo cual sugiere efectos beneficiosos sobre la regeneración ósea.
Estudios in vivoNumerosos estudios han demostrado que el resveratrol tiene efectos protectores sobre diversos procesos biológicos, muchos de los cuales apoyan la idea de que este producto natural dietético pueda ser un agente quimioprotector muy útil93,94. Así se ha determinado su efecto protector, en un modelo de cáncer de piel impidiendo la iniciación del mismo, con una concentración comprendida entre 1 y 25μmoles de resveratrol disuelto en acetona y administrado durante 2 veces a la semana85.
Con respecto a su actividad estrogénica, los estudios muestran que no posee efecto alguno sobre el crecimiento y diferenciación en el útero de ratas en crecimiento. Así mismo, no se detectan efectos en el hueso, en los niveles de colesterol plasmático, ni en el peso del animal. Estos estudios, concluyen que no actúa como agonista en ratas a dosis de 1 a 100μg/día, incluso a grandes dosis (1.000μg/día) el efecto no solo es insignificante, sino que podría actuar como antagonista estrogénico95.
Diversos autores han encontrado efectos favorables de esta molécula sobre enfermedades como la diabetes, donde el resveratrol produce una mejora del estado de ratas diabéticas inducidas con estreptozotocina, favoreciendo el metabolismo energético y reduciendo la destrucción proteica96.
Los efectos comentados anteriormente sobre la agregación plaquetaria en los estudios in vitro, también se han visto en estudios in vivo administrando 4mg/kg/día de resveratrol97.
El resveratrol produce un aumento de la vida media en levaduras, moscas y peces, pero no está del todo claro que lo haga en ratones98. Este incremento en la vida media de estos animales, podría estar mediado por el aumento que ejerce en la actividad de un enzima que está directamente relacionado, con la restricción calórica y la longevidad. Esta enzima, llamada siruina (sirt o sir) viene de la traducción de «silent information regulator»99. Las sirtuinas corresponden a una familia de enzimas con actividad desacetilasa. El mecanismo de estas enzimas, consiste en la capacidad que tienen de modificar covalentemente mediante desacetilación las histonas que envuelven al ADN. La actividad de esta enzima impide la transcripción de determinados genes y, además, podría activar o inhibir enzimas mediante desacetilaciones.
Recientemente, se ha publicado un estudio sobre la administración de 150mg/día de resveratrol en individuos obesos durante 30 días. Los estudios concluyen que esta molécula produce un efecto mimético de la restricción calórica. Las determinaciones en músculo mostraron un incremento en los niveles de sirtuinas, concretamente de sirt1 (sirtuina1). Además, encontraron un aumento de lípidos en los miocitos, así como, disminución de lípidos intrahepáticos, de glucosa y de triglicéridos en sangre. Estos resultados, junto con una disminución del metabolismo durante el sueño y el reposo, fueron atribuidos a los efectos miméticos de la restricción calórica, causados por el consumo de resveratrol100.
Efectos del resveratrol en procesos asociados al envejecimientoEstudios recientes hablan del papel protector del resveratrol en la vulnerabilidad asociada a la fragilidad. Parece ser que actúa como neuroprotector debido, en parte, a su actividad antiinflamatoria, por su capacidad de disminuir los niveles de factor de necrosis tumoral, ciclooxigena 2, óxido nítrico inducible e interleucinas101.
Dicha actividad neuroprotectora podría estar mediada también por el aumento de la actividad de la sirt1, ya que, tal y como se comento anteriormente, el resveratrol activa sirt1 y esta enzima, a su vez, se piensa que es capaz aumentar factores neurotróficos como el BDNF (factor neurotrófico derivado del cerebro). Concretamente, en ratones con un fenotipo de envejecimiento acelerado (SAMP8), se produce un aumento de Sir y BDNF cuando los ratones son alimentados en restricción calórica102.
ConclusionesSegún la bibliografía revisada, podríamos tratar al resveratrol como un componente básico del «elixir de la vida». Sin embargo, la biodisponibilidad parece limitar sus efectos. Con respecto a la longevidad, tiene 2 aspectos a su favor, por un lado es antioxidante y por otro incrementa la actividad sirt1 una enzima relacionada directamente con la restricción calórica y la longevidad. A su vez, tiene efectos favorables sobre el sistema cardiovascular, como el de la regulación del acúmulo de triglicéridos y la lipólisis, agregación plaquetaria, etc. Es anticancerígeno, antiinflamatorio, antialérgico, neuroprotector, promueve la osteogénesis, tiene beneficios sobre la fragilidad, etc. Es decir, los estudios describen numerosos efectos beneficiosos.
No obstante, la mayoría de estos estudios biológicos se han realizado in vitro. Cuando se intentan trasladar sus resultados a modelos animales, es difícil demostrar tales efectos. Ello se debe, a que la biodisponibilidad no está del todo clara en animales de experimentación, ya que las concentraciones eficaces son muy altas, del orden de micromolar. Si bien es cierto que la absorción es muy buena, con el paso hepático se producen numerosos metabolitos conjugados y el resveratrol libre que queda mayoritariamente se une a proteínas plasmáticas para su transporte. Los conjugados pueden ser, o eliminados, o en determinadas células desprender el resveratrol. Por lo tanto, aunque la absorción sea muy eficaz la efectividad del resveratrol se ve muy disminuida por su baja biodisponibilidad.
La evidencia de la eficacia del resveratrol en humanos ha sido aún más difícil de alcanzar y, de hecho, no hay estudios convincentes por el momento. Las discrepancias que se producen entre experimentos in vitro/in vivo se deben a la baja biodisponibilidad del resveratrol in vivo, en particular tras su administración oral103,104. Aclarar los aspectos de la estabilidad y farmacocinética de los metabolitos del resveratrol sería fundamental para entender y aplicar las propiedades terapéuticas del resveratrol.
El estudio de la captación de resveratrol, el destino celular, el metabolismo, la estabilidad de la molécula original y la de sus metabolitos necesitan una mayor investigación para comprender mejor su actividad biológica y serían cruciales para mejorar la eficiencia de sus propiedades53.