Analizar la distribución de los síntomas psicológicos y conductuales de la demencia (SPCD) en mayores con enfermedad de Alzheimer (EA) y deterioro cognitivo leve (DCL) y su utilidad en el diagnóstico diferencial de ambas entidades.
Material y métodosCiento setenta y nueve mayores de 64 años diagnosticados de DCL (n = 90) o EA (n = 89), estadio de la Global Deterioration Scale 4 o 5. Se determinaron los SPCD con la escala Neuropsychiatric Inventory. Se describe la prevalencia de los síntomas en cada grupo y se determina el riesgo que supone el presentar cada uno de los SPCD para que un paciente sea diagnosticado de EA en lugar de DCL.
ResultadosSesenta y siete pacientes con DCL (74,4%) y 82 con EA (92,1%) presentaron algún SPCD (p<0,01) siendo los más prevalentes la depresión y la apatía en ambos grupos. La media de SPCD fue de 2,1 en los DCL y de 3,2 en los EA y fueron más frecuentes en pacientes con mayores lesiones isquémicas de sustancia blanca (LISB) (p<0,05). La presencia de algún SPCD aumentó el riesgo de que los pacientes fueran diagnosticados de EA en lugar de DCL (odds ratio [OR] de 3,6; intervalo de confianza [IC] del 95%: 1,4–5,7; p<0,01) tras ajustar por edad, sexo, Mini-Mental State Examination y LISB. Los SPCD asociados independientemente al diagnóstico de EA fueron los delirios (OR de 4,9; IC del 95%: 1,3–18,6; p<0,05), la apatía (OR de 2,5; IC del 95%: 1,3–4,7; p<0,01), la desinhibición (OR de 3,1; IC del 95%: 1,5–6,4; p<0,01) y las conductas motoras sin finalidad (OR de 6,3; IC del 95%: 1,7–23,4; p<0,01).
ConclusionesLos SPCD son frecuentes en mayores con DCL y EA leve-moderada y pueden ayudar a diferenciar entre estas dos patologías.
To describe the neuropsychiatric symptoms (NPS) in elderly patients with either mild cognitive impairment (MCI) or Alzheimer's disease (AD) and their relevance in the differential diagnosis between the two entities.
Material and methodsA total of 179 subjects, aged more than 64 years old, with either MCI (n=90) or AD (n=89) and Global Deterioration Scale stage 4-5 were studied. NPS were assessed using the Neuropsychiatric Inventory scale. We identified the prevalence of the symptoms in each group and determined the risk conferred by each symptom to the differential diagnosis between the two entities.
ResultsSixty-seven patients with MCI (74.4%) and 82 with AD (92.1%) showed at least one NPS (p<0.01), the most prevalent being depression and apathy in both groups. The mean number of NPS was 2.1 in MCI and 3.2 in AD. NPS were more frequent in patients with more white matter ischemic lesions (WMIL) (p<0.05). The presence of at least one NPS increased the risk of being diagnosed with AD rather than MCI (odds ratio [OR] 3.6: 95% confidence interval [CI] 1.4–5.7; p<0.01) adjusted by age, sex, Mini-Mental State Examination and WMIL. The NPS independently associated with a diagnosis of AD were delusions (OR 4.9; 95% CI 1.3–18.6; p<0.05), apathy (OR 2.5; 95% CI 1.3–4.7 p<0.01), disinhibition (OR 3.1; 95% CI 1.5–6.4; p<0.01) and aberrant motor behavior (OR 6.3; 95% CI 1.7–23.4; p<0.01).
ConclusionsNPS are frequent in elderly individuals with MCI and mild-moderate AD and may help to differentiate between these two entities.
Los síntomas psicológicos y conductuales de la demencia (SPCD) son un conjunto heterogéneo de reacciones psicológicas, síntomas psiquiátricos y comportamientos anómalos debidos a la presencia de demencia. Se consideran SPCD la apatía, las alucinaciones, la agitación, la depresión, la ansiedad, la euforia, la irritabilidad, la desinhibición, los delirios, las conductas aberrantes o anómalas, los trastornos del sueño y las alteraciones de la conducta alimentaria1,2.
La importancia de los SPCD radica en que se asocian a mayor mortalidad, peor pronóstico, mayor institucionalización, mayor carga del cuidador y mayor consumo de recursos sanitarios y fármacos, originando en numerosas ocasiones más problemas que los propios déficits cognitivos3–5.
Se ha descrito que estos síntomas son muy frecuentes en pacientes con enfermedad de Alzheimer (EA), incluso en fases leves antecediendo a los propios síntomas cognitivos6, y son también comunes en pacientes con deterioro cognitivo leve (DCL) o con cognición normal7. Estudios en diferentes países y en diferentes ámbitos han encontrado una prevalencia entre el 35 y el 75% en pacientes con DCL6–14 y entre el 49 y el 89% en pacientes con demencia8,10,11,15–18.
Uno de los principales problemas ante los que se enfrenta el especialista en las clínicas de memoria es la dificultad para diferenciar entre el DCL y la EA. Esta diferenciación es muy relevante porque determina la instauración de tratamientos, la toma de decisiones sobre el paciente y la provisión de recursos sanitarios y sociales. Actualmente, el diagnóstico de la EA y del DCL se basa en criterios clínicos apoyados por la anamnesis, la exploración física y neurológica, la valoración funcional, los estudios analíticos y de neuroimagen, y por la valoración neuropsicológica. Sin embargo, y a pesar de la frecuente presencia de SPCD como se ha descrito, existen escasos estudios en los que se ha analizado su utilidad a la hora de diferenciar entre pacientes con EA y DCL13,19.
Por ello, nos propusimos describir la prevalencia de los SPCD en una cohorte de pacientes con DCL y EA en una clínica de memoria de Geriatría y analizar el riesgo que supone la presencia de dichos SPCD para el diagnóstico de EA frente a DCL.
Material y métodosDiseño, sujetos y ámbito de estudioEstudio observacional descriptivo analítico sobre 179 mayores de 64 años consecutivos diagnosticados de DCL según los criterios de Petersen, o de EA probable-posible según los criterios del NINCDS/ADRDA (National Institute of Neurological and Communicative Disorders and the Alzheimer's Disease and Related Disorders Association) en estadio GDS (Global Deterioration Scale) de Reisberg 4 o 5 y con MMSE (Mini-Mental State Examination) mayor a 12, atendidos en la unidad de memoria de la sección de Geriatría del Complejo Hospitalario Universitario de Albacete entre los años 2005 y 2006.
Diagnóstico de DCL y EALos pacientes fueron valorados inicialmente en las consultas externas de Geriatría, donde se realizó una anamnesis completa incluyendo el nivel educacional, la vida laboral, los antecedentes familiares, los factores de riesgo cardiovascular, las enfermedades previas y el tratamiento actual y previo. Se realizó una primera valoración funcional mediante los índices de Barthel y Lawton, cognitiva mediante el MMSE de Folstein y afectiva mediante el GDS (Geriatric Depression Scale) de Yesavage. A todos los pacientes se les realizó una exploración física y neurológica detallada. Se solicitó analítica completa con hemograma, bioquímica, hormonas tiroideas, orina y vitamina B12 y se realizó neuroimagen (resonancia magnética o tomografía computarizada).
Posteriormente, a todos los participantes se les realizó una valoración neuropsicológica a cargo de una neuropsicóloga. Se evaluaron las siguientes áreas con los siguientes test:
- 1)
Memoria verbal: memoria lógica I y memoria lógica II de la batería Wechsler.
- 2)
Memoria visual: reproducción visual I y II de la batería Wechsler.
- 3)
Lenguaje: test de denominación de Boston (30 láminas), FAS fonético y semántico.
- 4)
Atención y funciones ejecutivas: Trail Making Test (TMT) A y B (tiempo empleado en segundos), dígitos directos e inversos, test de claves de números, test de cambio de cartas, juicio temporal, test de Stroop y test de cancelación.
- 5)
Praxias: test de praxias de Luria y test de secuencias posturales de Luria.
- 6)
Depresión: GDS de Yesavage.
Posteriormente, y con todos los datos recogidos, se realizó una reunión de consenso en la que participaban dos geriatras expertos en demencias y una neuropsicóloga, para diagnosticar a los pacientes como DCL o EA. Para el diagnóstico de DCL se aplicaron criterios de Petersen y para los de EA los de la NINCDS/ADRDA.
Lesiones isquémicas de sustancia blancaLas lesiones isquémicas de sustancia blanca (LISB) se analizaron siguiendo las indicaciones de la escala ARWMC (Age Related White Matter Changes) de Wahlund20. Los pacientes se clasificaron en cuatro grupos tomando siempre la gradación del lugar anatómico donde las lesiones eran más severas: 0: ausencia de lesiones; 1: lesiones focales; 2: lesiones concluyentes; 3: afectación difusa de la sustancia blanca.
Valoración de los SPCDSe utilizó el Neuropsychiatric Inventory (NPI) validado en nuestro medio por Vilalta-Franch et al21, entrevista estructurada a un informador fiable que ha demostrado su validez en ámbitos culturales variados y situaciones clínicas distintas. Se recogió la presencia o ausencia de cada uno de los 10 síntomas que constituyen la escala inicial basándose en la pregunta inicial de prueba y en las preguntas de confirmación. No se incluyeron la alteración del sueño ni los trastornos alimentarios. Tampoco se evaluaron la frecuencia y la gravedad del síntoma ni el impacto sobre el cuidador, por prolongar excesivamente la duración de la administración del test, no aportando información sobre la prevalencia de los diferentes síntomas, que era el objetivo principal del trabajo. También se calculó el número de SPCD que presentaba cada paciente. Todos los NPI fueron administrados por una misma neuropsicóloga entrenada.
Análisis estadísticoEn primer lugar se realizó un análisis descriptivo de las características de la muestra. Posteriormente se analizó la relación cruda entre las variables sociodemográficas, neuropsicológicas y radiológicas con la presencia de SPCD empleando las pruebas de chi cuadrado y el test de la t de Student cuando convino. Se analizó la relación lineal existente entre el número de SPCD y el diagnóstico de DCL o EA mediante el estadístico de Mantel-Haenzel. Utilizando modelos de regresión logística se determinó el riesgo que supuso la presencia de algún SPCD o cualquiera de ellos para que un paciente fuera diagnosticado de EA en lugar de DCL, ajustado por edad, sexo, MMSE y LISB, describiendo la odds ratio (OR) con el cálculo del intervalo de confianza (IC) del 95%.
ResultadosEn la tabla 1 se recogen las características basales de nuestra muestra y en la tabla 2 los resultados de la valoración neuropsicológica. Los SPCD fueron más frecuentes en enfermos de Alzheimer que en aquellos diagnosticados de DCL (p<0,01) e igualmente los sujetos con EA presentaron un mayor número de síntomas que aquéllos con DCL (3,2 y 2,1 respectivamente; diferencia: 1,1; IC del 95%: 0,5 a 1,7; p<0,001).
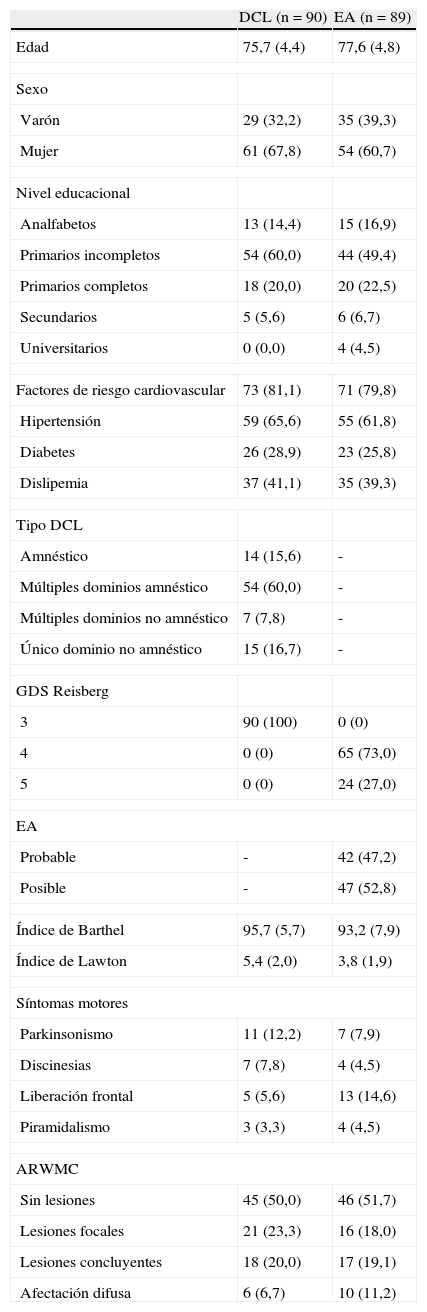
Características basales de la muestra*
| DCL (n = 90) | EA (n = 89) | |
| Edad | 75,7 (4,4) | 77,6 (4,8) |
| Sexo | ||
| Varón | 29 (32,2) | 35 (39,3) |
| Mujer | 61 (67,8) | 54 (60,7) |
| Nivel educacional | ||
| Analfabetos | 13 (14,4) | 15 (16,9) |
| Primarios incompletos | 54 (60,0) | 44 (49,4) |
| Primarios completos | 18 (20,0) | 20 (22,5) |
| Secundarios | 5 (5,6) | 6 (6,7) |
| Universitarios | 0 (0,0) | 4 (4,5) |
| Factores de riesgo cardiovascular | 73 (81,1) | 71 (79,8) |
| Hipertensión | 59 (65,6) | 55 (61,8) |
| Diabetes | 26 (28,9) | 23 (25,8) |
| Dislipemia | 37 (41,1) | 35 (39,3) |
| Tipo DCL | ||
| Amnéstico | 14 (15,6) | - |
| Múltiples dominios amnéstico | 54 (60,0) | - |
| Múltiples dominios no amnéstico | 7 (7,8) | - |
| Único dominio no amnéstico | 15 (16,7) | - |
| GDS Reisberg | ||
| 3 | 90 (100) | 0 (0) |
| 4 | 0 (0) | 65 (73,0) |
| 5 | 0 (0) | 24 (27,0) |
| EA | ||
| Probable | - | 42 (47,2) |
| Posible | - | 47 (52,8) |
| Índice de Barthel | 95,7 (5,7) | 93,2 (7,9) |
| Índice de Lawton | 5,4 (2,0) | 3,8 (1,9) |
| Síntomas motores | ||
| Parkinsonismo | 11 (12,2) | 7 (7,9) |
| Discinesias | 7 (7,8) | 4 (4,5) |
| Liberación frontal | 5 (5,6) | 13 (14,6) |
| Piramidalismo | 3 (3,3) | 4 (4,5) |
| ARWMC | ||
| Sin lesiones | 45 (50,0) | 46 (51,7) |
| Lesiones focales | 21 (23,3) | 16 (18,0) |
| Lesiones concluyentes | 18 (20,0) | 17 (19,1) |
| Afectación difusa | 6 (6,7) | 10 (11,2) |
ARWMC: Age Related White Matter Changes; DCL: deterioro cognitivo leve; EA:enfermedad de Alzheimer; GDS: Global Deterioration Scale.
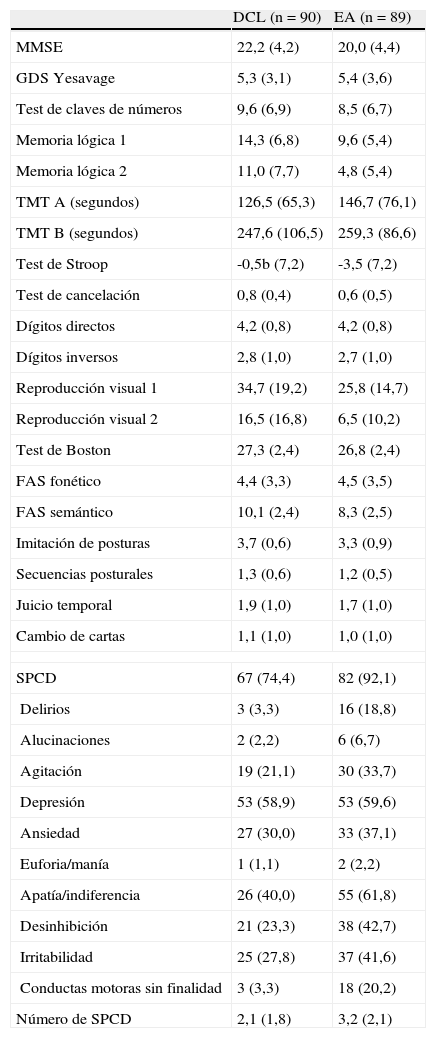
Resultados de la valoración neuropsicológica*
| DCL (n = 90) | EA (n = 89) | |
| MMSE | 22,2 (4,2) | 20,0 (4,4) |
| GDS Yesavage | 5,3 (3,1) | 5,4 (3,6) |
| Test de claves de números | 9,6 (6,9) | 8,5 (6,7) |
| Memoria lógica 1 | 14,3 (6,8) | 9,6 (5,4) |
| Memoria lógica 2 | 11,0 (7,7) | 4,8 (5,4) |
| TMT A (segundos) | 126,5 (65,3) | 146,7 (76,1) |
| TMT B (segundos) | 247,6 (106,5) | 259,3 (86,6) |
| Test de Stroop | -0,5b (7,2) | -3,5 (7,2) |
| Test de cancelación | 0,8 (0,4) | 0,6 (0,5) |
| Dígitos directos | 4,2 (0,8) | 4,2 (0,8) |
| Dígitos inversos | 2,8 (1,0) | 2,7 (1,0) |
| Reproducción visual 1 | 34,7 (19,2) | 25,8 (14,7) |
| Reproducción visual 2 | 16,5 (16,8) | 6,5 (10,2) |
| Test de Boston | 27,3 (2,4) | 26,8 (2,4) |
| FAS fonético | 4,4 (3,3) | 4,5 (3,5) |
| FAS semántico | 10,1 (2,4) | 8,3 (2,5) |
| Imitación de posturas | 3,7 (0,6) | 3,3 (0,9) |
| Secuencias posturales | 1,3 (0,6) | 1,2 (0,5) |
| Juicio temporal | 1,9 (1,0) | 1,7 (1,0) |
| Cambio de cartas | 1,1 (1,0) | 1,0 (1,0) |
| SPCD | 67 (74,4) | 82 (92,1) |
| Delirios | 3 (3,3) | 16 (18,8) |
| Alucinaciones | 2 (2,2) | 6 (6,7) |
| Agitación | 19 (21,1) | 30 (33,7) |
| Depresión | 53 (58,9) | 53 (59,6) |
| Ansiedad | 27 (30,0) | 33 (37,1) |
| Euforia/manía | 1 (1,1) | 2 (2,2) |
| Apatía/indiferencia | 26 (40,0) | 55 (61,8) |
| Desinhibición | 21 (23,3) | 38 (42,7) |
| Irritabilidad | 25 (27,8) | 37 (41,6) |
| Conductas motoras sin finalidad | 3 (3,3) | 18 (20,2) |
| Número de SPCD | 2,1 (1,8) | 3,2 (2,1) |
GDS: Geriatric Depression Scale; MMSE: Mini-Mental State Examination; SPCD: síntomas psicológicos y conductuales de la demencia; TMT: Trail Making Test.
El síntoma neuropsiquiátrico más prevalente en los pacientes con EA fue la apatía (61,8%), seguido de la depresión (59,6%), la desinhibición (42,7%) y la irritabilidad (41,6%). En aquellos con DCL, los más prevalentes fueron la depresión (58,9%), la apatía (40,0%), la ansiedad (30,0%) y la irritabilidad (27,8%).
Los síntomas neuropsiquiátricos no variaron según la edad, el sexo, el nivel educacional o los factores de riesgo cardiovascular de los participantes. Tampoco se apreciaron diferencias significativas en la presencia de SPCD entre los pacientes con EA probable o posible ni entre los diferentes subtipos de DCL, aunque en este último grupo el número de casos no permite establecer conclusiones fiables. No se apreciaron asociaciones entre ningún test cognitivo empleado y los SPCD. Sin embargo, fueron más prevalentes en sujetos con menor índice de Lawton (p<0,05) y mayor puntuación en el GDS de Reisberg (p<0,01) indicando una clara asociación entre severidad del deterioro y los síntomas. Los SPCD fueron más frecuentes en los casos con DCL que presentaban puntuaciones en la escala Wahlund de entre 2 y 3 que en aquellos con puntuaciones entre 0 y 1 (el 91,7 frente al 68,2%; p<0,05). Los pacientes con DCL y puntuaciones en la escala de Wahlund de entre 2 y 3 presentaron con mayor frecuencia depresión (el 79,2 frente al 51,5%; p<0,05) que aquellos con puntuaciones entre 0 y 1. Asimismo, los pacientes con EA y puntuaciones en la escala de Wahlund de entre 2 y 3 presentaron con mayor frecuencia conductas motoras sin finalidad (el 33,3 frente al 14,8%; p<0,05) que aquellos con puntuaciones entre 0 y 1. No se apreciaron otras asociaciones entre los diferentes SPCD y las LISB ni en pacientes con DCL ni con EA.
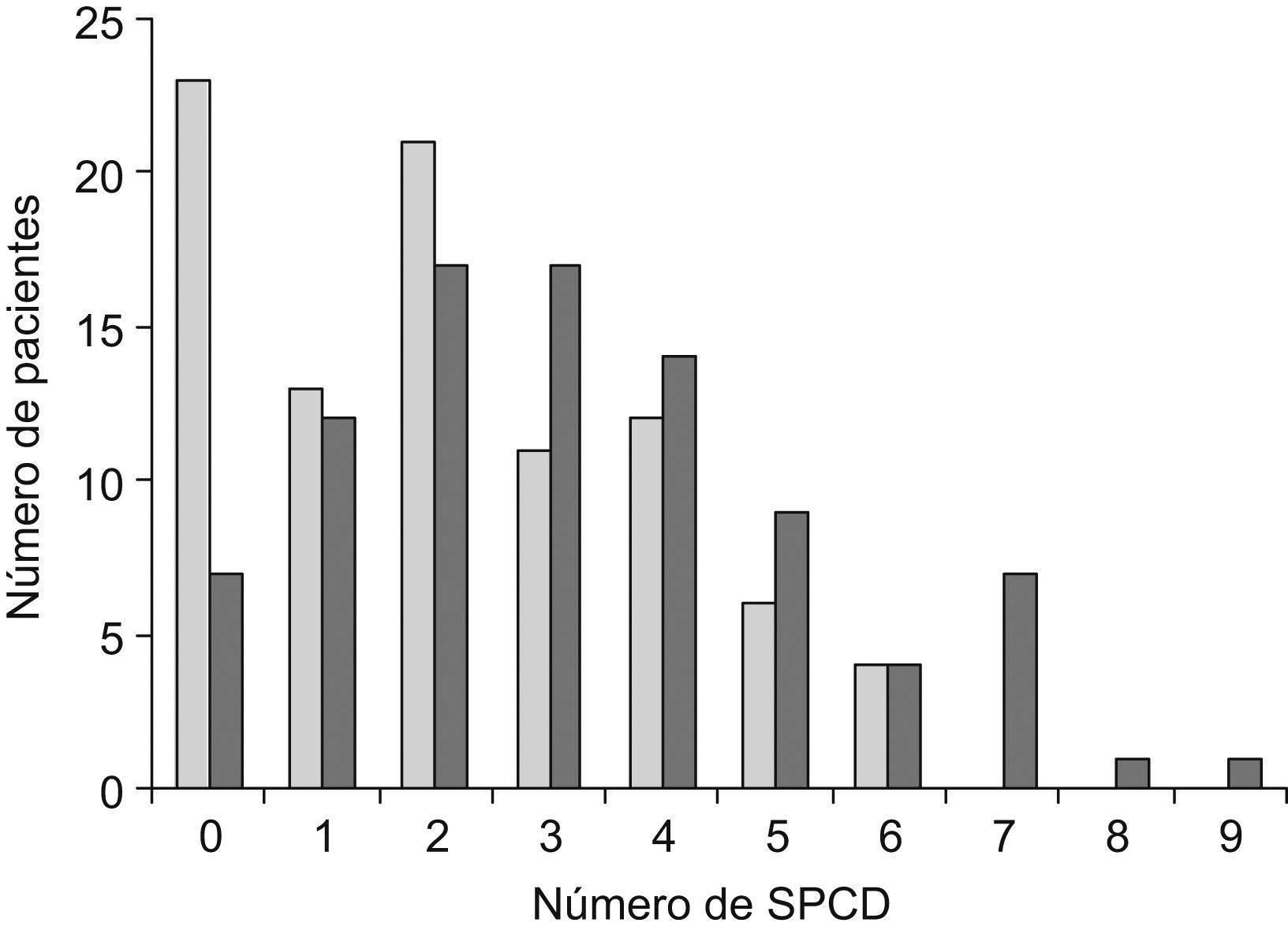
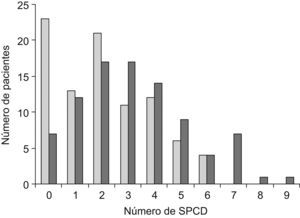
En la figura 1 se presenta el número de SPCD que presentaron los sujetos de cada grupo de estudio. El número de SPCD presentó una asociación lineal positiva con el diagnóstico de DCL o EA. Sólo el 7,9% de los pacientes sin SPCD fue diagnosticado de EA frente al 25,6% de los pacientes de DCL. Asimismo, todos los pacientes con más de 6 SPCD fueron diagnosticados de EA (p<0,001).
Número de síntomas psicológicos y conductuales de la demencia según el diagnóstico de deterioro cognitivo leve o enfermedad de Alzheimer. En barras claras se presentan los casos con deterioro cognitivo leve y en negras aquéllos con enfermedad de Alzheimer. SPCD: síntomas psicológicos y conductuales de la demencia.
La presencia de algún SPCD aumentó el riesgo de que los pacientes fueran diagnosticados de EA en lugar de DCL (OR de 3,6; IC del 95%: 1,4–1,7; p<0,01) ajustado por edad, sexo, MMSE y LISB. Los SPCD asociados independientemente con el diagnóstico de EA fueron los delirios (OR de 4,9; IC del 95%: 1,3–18,6; p<0,05), la apatía (OR de 2,5; IC del 95%: 1,3–4,7; p<0,01), la desinhibición (OR de 3,1; IC del 95%: 1,5–6,4; p<0,01) y las conductas motoras sin finalidad (OR de 6,3; IC del 95%: 1,7–23,4; p<0,01). La agitación rozó la significación estadística (OR de 2,1; IC del 95%: 1,0–4,3; p = 0,56), al igual que la irritabilidad (OR de 1,9; IC del 95%: 1,0–3,8; p = 0,60), pero no así el resto de SPCD.
DiscusiónLa primera conclusión de nuestro estudio es la elevada prevalencia de SPCD en ancianos con DCL y EA en una unidad geriátrica de memoria. El 74,4% de los pacientes con DCL y el 92,1% de aquellos con EA presentaron algún síntoma neuropsiquiátrico, mientras que el 36,7% de los DCL y el 59,6% de los EA presentaron tres o más. Estos datos están en consonancia con los descritos en trabajos previos.
Así, en una reciente revisión sistemática de la literatura médica, Apostolova et al encontraron una prevalencia entre el 35 y el 75% de SPCD en pacientes diagnosticados de DCL9, similar a las encontradas en pacientes con EA. Dos estudios en nuestro medio han descrito prevalencias en estos pacientes. En una consulta de Neurología del hospital La Fe de Valencia, el 62% de los pacientes con DCL presentó algún SPCD6, mientras que otro estudio en pacientes con EA realizado en 52 consultas especializadas de neurología, geriatría y psiquiatría encontró una prevalencia de SPCD del 66,7%18.
En nuestra muestra, los SPCD más frecuentemente detectados en pacientes con DCL fueron la depresión, la apatía y la ansiedad, al igual que en la revisión de Apostolova, donde los SPCD más frecuentes en estos pacientes fueron también la apatía, la ansiedad y la depresión9. En el estudio de Baquero los síntomas más frecuentes fueron la depresión, la irritabilidad y la ansiedad6 y en el estudio de Peters la depresión, la irritabilidad y la apatía15. En pacientes con EA los síntomas más prevalentes en nuestra muestra fueron la apatía, la depresión y la desinhibición, mientras que en el trabajo de López-Pousa fueron la apatía, la depresión y la ansiedad18 y en el de Peters fueron la apatía, la depresión y la irritabilidad15.
Solo dos estudios poblacionales han descrito prevalencias de SPCD en sujetos con DCL. En el Cardiovascular Health Study8 con una prevalencia global de SPCD del 43%, los síntomas más frecuentes fueron la depresión (20%), la apatía (15%) y la irritabilidad (15%), mientras que en el realizado en Olmsted County con una prevalencia global del 50%, los síntomas más frecuentes fueron la depresión (27%), la irritabilidad (19,4%) y la apatía (18,5%)7.
La prevalencia de los SPCD en pacientes con DCL o EA varía según el tipo de muestra (estudios poblacionales, ensayos clínicos o estudios descriptivos en consultas especializadas), los criterios diagnósticos de DCL y EA utilizados y las herramientas diagnósticas empleadas (NPI o escalas de síntomas específicos). En nuestro caso, al tratarse de una consulta especializada, las prevalencias fueron mayores. Tanto los criterios diagnósticos de DCL (Petersen) y de EA (NINCDS/ADRDA) así como la herramienta de valoración utilizada (NPI) en nuestra muestra se encuentran entre los más utilizados en estudios previos, por lo que no pensamos que pueda influir en nuestros resultados. En nuestro estudio no hallamos diferencias en la prevalencia de los SPCD según el subtipo de DCL, y en trabajos previos los resultados no son concluyentes22,23.
Se ha descrito que los SPCD son frecuentes a través de todo el espectro del deterioro cognitivo en pacientes referidos a consultas especializadas de memoria y que podrían preceder a los déficit cognitivos en personas sin deterioro cognitivo, con quejas subjetivas de memoria o con DCL15. En nuestra muestra los SPCD no presentaron correlación con ninguno de los test neuropsicológicos cognitivos empleados. Sin embargo, los pacientes con mayor número de SPCD presentaron una mayor dependencia en actividades instrumentales de la vida diaria (AIVD), indicando que provocan más deterioro funcional que cognitivo, como se ha descrito en trabajos previos15.
El diagnóstico diferencial entre DCL y EA es un problema frecuente e importante en clínicas de memoria. Por ello, recientemente se han desarrollado nuevos test y se han reevaluado test tradicionales que ayuden a diferenciar estas dos entidades. El MoCA24, el DemTect25, el Rey verbal learning test26, el ABCS27, el CAMcog28, el TMT A y B29 o el Cognitive Capacity Screening Examination30 se han utilizado con este fin con resultados modestos. Sin embargo, en ninguno de estos trabajos se han utilizado los SPCD para realizar el diagnóstico diferencial entre estas dos entidades. Algunos autores recomiendan que debe realizarse una evaluación integral de los pacientes, incluyendo medidas de capacidad intelectual basal, atención, funciones ejecutivas, memoria, lenguaje, capacidades visuoespaciales, ánimo, síntomas neuropsiquiátricos, comportamientos y AIVD para diferenciar adecuadamente entre sujetos con DCL y demencia19,31.
El principal resultado de nuestro trabajo es que la presencia de delirios, apatía, desinhibición y conductas motoras aberrantes ayuda a diferenciar pacientes con DCL de EA leve-moderada. Un reciente estudio poblacional identificó los SPCD que ayudan a diferenciar sujetos con DCL de aquellos sin deterioro cognitivo, siendo la apatía (OR 4,5), la agitación (OR de 3,6), la ansiedad (OR de 3,0), la irritabilidad (OR de 2,9) y la depresión (OR de 2,7) los que mejor lo hacían. Se ha descrito que los síntomas psicóticos, especialmente delirios y alucinaciones, así como la agitación psicomotriz, son más frecuentes en sujetos con EA leve que con DCL, sin que existan diferencias en el resto de los síntomas22,32.
Publicaciones recientes han sugerido que las lesiones isquémicas de sustancia blanca se asocian a un riesgo elevado de progresión desde una cognición normal al DCL y a la demencia33. En nuestra cohorte, las LISB no ayudaron a diferenciar entre sujetos con DCL y EA, pero no podemos asegurar que sirvan como marcadores de progresión del deterioro cognitivo, ya que el estudio no se diseñó con dicho fin. Sin embargo, las LISB fueron más severas en sujetos con DCL y depresión y en aquellos con EA y conductas motoras sin finalidad. Existe falta de consenso entre la asociación de los diferentes SPCD con las LISB en sujetos con deterioro cognitivo. Se han descrito asociaciones con depresión34,35, apatía34,36, anergia34, anhedonia34, conductas motoras aberrantes37 y síntomas psicóticos38, aunque otros estudios no han podido confirmarlas39. El papel de la enfermedad cerebrovascular en la patogénesis de la depresión y otros trastornos del ánimo en la edad adulta está bien descrito y la posibilidad de tener LISB es cuatro veces mayor en sujetos con depresión de inicio tardío que de inicio precoz40. Desconocemos la causa por la que las LISB sólo se asociaron a depresión en pacientes con DCL en nuestra muestra, aunque puede ser que aquellos con EA refieran menos los síntomas por su deterioro cognitivo o que estén interferidos por la apatía.
Las principales limitaciones del estudio incluyen que los sujetos de nuestra muestra tenían una edad elevada y un bajo nivel educacional, por lo que puede ser que nuestros hallazgos no sean aplicables a otras poblaciones. Asimismo, al realizarse en una clínica especializada, las prevalencias de SPCD no pueden extrapolarse a la población general. No se realizó una valoración cuantitativa de la severidad de cada uno de los síntomas con la herramienta NPI, que hubiera sido interesante para determinar puntos de corte diagnósticos de toda la escala en su conjunto y de los diferentes síntomas en particular. Por último, al tratarse de un estudio transversal no podemos conocer si tiene importancia el orden cronológico en la aparición de los síntomas neuropsiquiátricos en el diagnóstico de DCL o EA.
La aparición en ciernes de nuevas terapéuticas para fases leves de la EA, así como la necesidad de identificar correctamente a los pacientes para su inclusión en ensayos clínicos, hace tremendamente relevante la distinción entre sujetos con DCL y EA leve-moderada. Esta distinción es muy difícil incluso para el especialista entrenado cuando nos encontramos en la frontera de ambas entidades. Es por ello de gran importancia contar con todos los datos que ayuden a identificar correctamente a los sujetos. La identificación de los SPCD puede ser una aproximación diagnóstica útil en este campo aunque se precisan más estudios que refrenden este hallazgo.