Determinar la asociación entre tasa de filtración glomerular estimada (TFGe) y mortalidad en una cohorte retrospectiva de adultos mayores hospitalizados en una unidad geriátrica de agudos (UGA).
Materiales y métodosSe incluyó a 1.678 pacientes de 60 años o más, en Cali, Colombia, de 2012 a 2015, en seguimiento hasta 2016. El desenlace primario fue mortalidad. La función renal se estimó empleando la ecuación del Modification of Diet in Renal Disease Study (MDRD-4). Se agrupó la función renal según la TFGe (ml/min/1,73m2) así: levemente disminuida (≥60), moderadamente disminuida (30-59) y severamente disminuida (<30). Se hicieron análisis de sobrevida bivariados y regresión de Cox multivariado.
ResultadosEn el análisis univariado, los pacientes con TFGe severamente disminuida presentaron una mortalidad significativamente mayor que aquellos con TFGe superiores (p=0,046). En el grupo con MDRD severamente disminuida, la sobrevida fue menor en el grupo dependiente (índice de Barthel [IB]<60) que en el independiente (IB≥60) (prueba log rank p=0,001). En el análisis multivariado, hay un aumento significativo del riesgo de morir en ancianos con MDRD severamente disminuida (<30) comparado con MDRD levemente disminuida (≥60) (hazard ratio [HR] 1,44; intervalo confianza [IC] 95%: 1,02-2,05; p=0,039). También hubo aumento significativo del riesgo de morir en ancianos dependientes comparados con los independientes (HR 1,72; IC 95%: 1,26-2,34; p=0,000), los que tenían a la vez morbilidad alta (≥4) con albúmina baja (<3,2g/dl) comparados con aquellos con morbilidad baja (0-3) y albúmina alta (≥3,2) (HR 1,77; IC 95%: 1,18-2,65; p=0,005) y en aquellos con PCR alta (16-102mg/dl) comparados con aquellos con PCR baja (0-15) (HR 1,42; IC 95%: 1,01-2,01; p=0,043).
ConclusionesEl riesgo de mortalidad tiempo después de una hospitalización en una UGA es mayor en pacientes con TFGe<30. Las puntuaciones bajas en los índices del estado funcional, la comorbilidad alta, la hipoalbuminemia y los marcadores de inflamación son factores pronósticos adicionales a tener en cuenta. La mejoría en el estado funcional podría mejorar la sobrevida posterior a la hospitalización.
To determine the relationship between estimated glomerular filtration rate (eGFR) and mortality in a retrospective cohort of older adults admitted to an acute care for the elderly (ACE) unit.
Materials and methodsThe study included 1,678 patients aged 60 years and over admitted to an AEC, in Cali, Colombia, from 2012 to 2015, and followed- up until 2016. The primary outcome was mortality. Renal function (eGFR) was estimated using Modification of Diet in Renal Disease Study (MDRD-4) equation. The renal function was grouped according to the eGFR (ml/min/1.73m2) as follows: slightly decreased (≥60), moderately decreased (30-59), and severely decreased (<30). Bivariate survival and multivariate Cox regression analyses were performed.
ResultsIn the univariate analysis, patients with severely decreased eGFR had higher mortality than those with a higher eGFR (P=.046). In the group with severely decreased eGFR, survival was lower in the functionally dependent group (Barthel index [IB]<60) than in the independent group (IB≥60) (log rank test; P=.001). In the multivariate analysis, there was a significant increase in the risk of death in the elderly with severely decreased eGFR (<30) compared with slightly decreased eGFR (≥60) (hazard ratio [HR], 1.44; 95% confidence interval [CI]; 1.02-2.05, P=.039). There was also a significant increase in the risk of death in the dependent elderly compared to the independent ones [HR 1.72; 95% CI; 1.26-2.34, P=.000], those who had the high morbidity (≥4) with low albumin (<3.2g/dL) compared with those with low morbidity (0-3) and high albumin (≥3.2) [HR 1.77; 95% CI; 1.18-2.65, P=.005], and in those with a high (16-102mg/dL) C-reactive protein (CRP) compared with those with low CRP (0-15) [HR 1.42; 95% CI; 1.01-2.01, P=.043].
ConclusionsThe risk of mortality after hospital admission to an AEC unit is greater in patients with eGFR<30. Poor functional status performance, high comorbidity, low plasma albumin, and increased inflammation markers are additional prognostic factors to be taken into account. The improvement in the functional status could improve the survival after hospitalisation.
La enfermedad renal crónica (ERC) ha aumentado en los adultos mayores (AM) durante los últimos años, en quienes una peor tasa de filtración glomerular, así como albuminuria, se asocia a mayor riesgo de mortalidad1-3.
El aumento en la prevalencia y mortalidad de la ERC en los AM es debido a cambios funcionales y estructurales renales a causa del envejecimiento y del aumento de complicaciones asociadas a diabetes, hipertensión y otras enfermedades cardiovasculares de alta prevalencia en los AM3. Debido a la falta de reconocimiento de las primeras etapas de la ERC, y a pesar de la magnitud de los recursos destinados para el tratamiento de la ERC y las mejoras sustanciales en la calidad de las terapias como la diálisis, estos pacientes continúan experimentando alta mortalidad, morbilidad, discapacidad y reducción en la calidad de vida4,5.
Una tasa de filtración glomerular estimada (TFGe) baja se ha encontrado asociada con puntajes bajos en escalas de valoración funcional en las actividades básicas de la vida diaria6. La TFGe reducida es un importante factor de riesgo para mortalidad en AM, como se ha mostrado en algunas poblaciones de pacientes hospitalizados en unidades geriátricas de agudos (UGA)7. Pocos estudios han evaluado la asociación entre función renal y mortalidad posterior al egreso de la hospitalización en AM que estuvieron bajo un modelo de atención especializada de UGA.
Las UGA, a diferencia de las unidades de atención hospitalaria convencional, se basan en la rehabilitación y se enfocan en la condición funcional del AM frágil, donde la atención es brindada por un equipo interdisciplinario. Estas han sido diseñadas específicamente para prevenir el deterioro funcional y sus eventos adversos relacionados con la hospitalización por enfermedad aguda o crónica reagudizada8. Los resultados de metaanálisis demuestran que la atención en UGA tiene efectos benéficos sobre el cuidado general en la reducción de las caídas, el delirium, el declive funcional, la duración de la estancia hospitalaria y los costos de atención médica8.
A pesar de toda la información que existe con respecto a la ERC y el avance en las diferentes intervenciones que modifican la calidad de vida y pronóstico clínico, no hay suficiente información sobre la asociación entre la mortalidad y la TFGe en AM hospitalizados previamente en una UGA. El objetivo del estudio fue determinar la asociación entre TFGe y mortalidad en una cohorte de ancianos hospitalizados en una UGA entre enero de 2012 y septiembre de 2015, con un seguimiento que se extendió hasta junio de 2016.
Materiales y métodosDiseño del estudio y recolección de la informaciónEstudio observacional de cohorte retrospectiva, que incluyó a 1.678 AM hospitalizados previamente en una UGA desde enero del 2012 hasta septiembre del 2015, con seguimiento hasta junio del 2016. El protocolo del estudio lo aprobó el Comité de Ética y Científico de la Universidad Libre y de la Clínica Universitaria Rafael Uribe Uribe. Los pacientes o algún informante próximo se entrevistaron para obtener la información durante la hospitalización y seguimiento telefónico al mes posterior del alta.
Para ingresar a la UGA, los pacientes debían cumplir, además de edad mayor de 60 años, al menos uno de los siguientes criterios: consumo de 8 o más fármacos, evento cerebrovascular en etapas subagudas, enfermedades incapacitantes o condición funcional previa de dependencia severa o total, readmisiones hospitalarias frecuentes (2 o más al mes), condiciones mentales previas (delirium al ingreso o demencia de base), presencia de múltiples síndromes geriátricos (fragilidad, úlceras por presión, caídas), índice de masa corporal menor de 20kg/m2, red de apoyo social insuficiente, procedencia de instituciones geriátricas o pacientes mayores de 80 años con enfermedad médica aguda. Después de obtener el consentimiento informado de cada paciente, el cuestionario fue completado al momento del ingreso hospitalario por un médico del equipo interdisciplinario con entrenamiento para recolectar la información estandarizada de escalas de valoración geriátrica integral (VGI). De los 2.050 pacientes atendidos en la UGA, 372 fueron excluidos por datos incompletos de creatinina o con diagnóstico de sepsis, desnutrición, sarcopenia, o úlceras por presión, quedando una población final de 1.678 AM. Se usó el Mini-Examen Nutricional (<17 puntos) para detectar desnutrición y el perímetro de pantorrilla (<31cm) para detectar la sarcopenia (datos no mostrados).
Variables de estudioDesenlaceMortalidad posterior al alta hospitalaria. La información de mortalidad fue suministrada por la Secretaría de Salud Departamental del Valle del Cauca mediante los certificados de defunción hasta junio del año 2016.
Variable independiente principalLa creatinina plasmática se determinó a través del método de medida enzimática (creatininasa) realizado en el laboratorio de la institución, el cual presenta una especificidad analítica superior al de Jaffé, por ser menos sensible a las interferencias por pseudocromógenos9. La medición de creatinina se realizó una vez el paciente se encontraba en condiciones clínicas estables, dentro de 2 días antes de su alta hospitalaria. La función renal se estimó empleando la ecuación derivada del estudio de Levey et al.10 (MDRD-4 [Modification of Diet in Renal Disease Study equation] o MDRD-IDMS). Los participantes se agruparon en 3 estadios según la TFGe (ml/min/1,73m2) de la siguiente forma: levemente disminuido (o leve, >60), moderadamente disminuido (o moderado, 30-59) y severamente disminuido (o severo, <30).
CovariablesSe incluyeron en los análisis la edad, el sexo y las variables conocidas que pudieran afectar el desenlace. Valores de laboratorio se incluyeron y se usaron como variables numéricas; la proteína C reactiva (PCR) se dividió también en tertiles (0-15, 16-102, ≥103). Para la valoración del estado funcional se utilizó el índice de Barthel (IB) que evalúa 10 actividades básicas de la vida diaria asignándole un valor predeterminado para la autonomía/independencia al ingreso11. La puntuación varía de 0 a 100, siendo 0 la máxima dependencia y 100 la independencia total. El IB se usó como variable numérica y categórica (<60 o dependiente vs. ≥60 o independiente).
El estado cognitivo se evaluó con la escala del examen mínimo mental (Mini-Mental State Examination [MMSE])12. Los participantes se agruparon, según el puntaje, como normal (≥24), leve (19 a 23), moderado (14 a 18) y severo (<14).
Para la morbilidad se usó el índice de Charlson, que es la suma de las enfermedades activas del paciente, y se usó como variable numérica y categórica. Para esta última se determinó el punto de corte la mediana del índice en esta población y se estableció la morbilidad como 0-3 y ≥413. En algunos análisis, esta variable se unió a categorías basadas en la mediana de la albúmina como punto de corte así: morbilidad ≥4 y albúmina <3,2 (n=264), morbilidad 0-3 y albúmina <3,2 (n=350), morbilidad ≥4 y albúmina ≥3,2 (n=390), morbilidad 0-3 y albúmina ≥3,2 (n=674).
Análisis estadísticoSe usaron estadísticas descriptivas (porcentajes, promedios±desviación estándar [DE]) para describir la distribución de la población y las variables del estudio (categóricas o numéricas, respectivamente). Para los análisis bivariados se usaron los test de Chi-cuadrado (o Fisher según el caso) y el análisis de varianza, según el caso.
Para estimar el riesgo de morir a través del tiempo de seguimiento, se usaron los análisis de sobrevida. Primero, se estimó la probabilidad de supervivencia anual por el método de Kaplan-Meier; el test log rank se usó para determinar su significación estadística. Esto se hizo de acuerdo con las categorías de los estadios de la ecuación MDRD y las otras variables. Segundo, para el análisis multivariado, se empleó el modelo de regresión de Cox (procedimiento PHREG en SAS) para predecir el riesgo de morir durante el seguimiento respecto a las variables principales del estudio; así se determinaron los hazard ratios (HR) con los intervalos de confianza (IC) del 95%. Los análisis se realizaron mediante el paquete estadístico SAS (versión 9.4 para Windows, SAS Institute, Cary, Carolina del Norte, EE.UU.). El nivel de significación estadística se fijó en p<0,05.
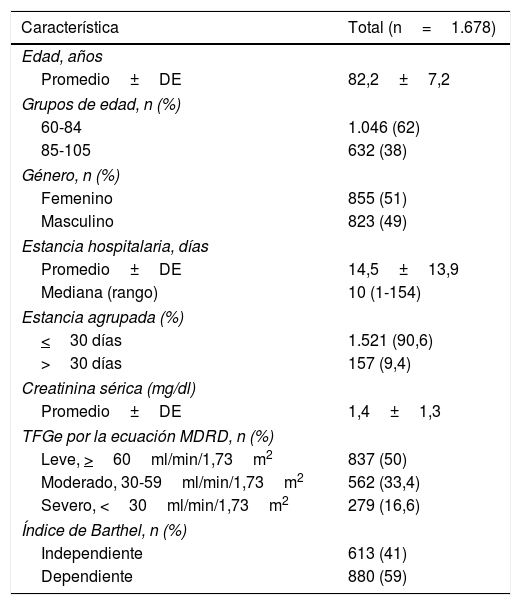
ResultadosCumplieron los criterios de selección 1.678 pacientes, con promedios de edad de 82,2±7,2 años, estancia hospitalaria de 14,5±13,9 días, y creatinina sérica de 1,4±1,3mg/dl. Según la TFGe, el 50% eran ≥60ml/min/1,73m2, el 33,4% 59-30ml/min/1,73m2 y el 16,6% <30ml/min/1,73m2. Con respecto al IB, el 59% se catalogó como dependiente (<60) al ingreso (tabla 1).
Características sociodemográficas y clínicas de la población del estudio
| Característica | Total (n=1.678) |
|---|---|
| Edad, años | |
| Promedio±DE | 82,2±7,2 |
| Grupos de edad, n (%) | |
| 60-84 | 1.046 (62) |
| 85-105 | 632 (38) |
| Género, n (%) | |
| Femenino | 855 (51) |
| Masculino | 823 (49) |
| Estancia hospitalaria, días | |
| Promedio±DE | 14,5±13,9 |
| Mediana (rango) | 10 (1-154) |
| Estancia agrupada (%) | |
| <30 días | 1.521 (90,6) |
| >30 días | 157 (9,4) |
| Creatinina sérica (mg/dl) | |
| Promedio±DE | 1,4±1,3 |
| TFGe por la ecuación MDRD, n (%) | |
| Leve, >60ml/min/1,73m2 | 837 (50) |
| Moderado, 30-59ml/min/1,73m2 | 562 (33,4) |
| Severo, <30ml/min/1,73m2 | 279 (16,6) |
| Índice de Barthel, n (%) | |
| Independiente | 613 (41) |
| Dependiente | 880 (59) |
DE: desviación estándar; MDRD: Modification of Diet in Renal Disease Study equation; TFGe: tasa de filtración glomerular estimada (ml/min/1,73m2).
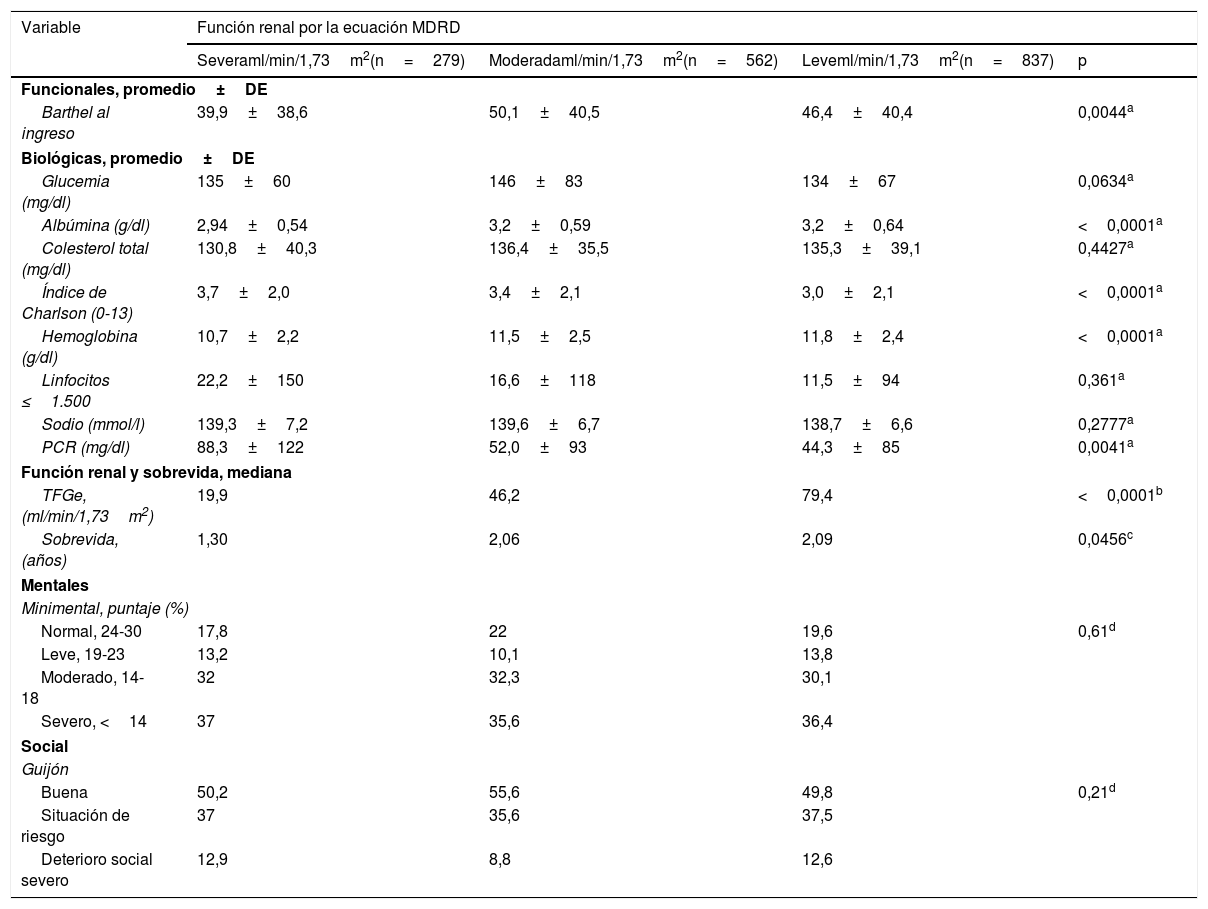
En el análisis univariado de variables predictoras, con respecto a la TFGe calculada por la ecuación MDRD, se encontró una asociación estadísticamente significativa para el IB al ingreso (p=0,0044) y el índice de Charlson (p<0,0001). La albúmina fue más baja en el grupo de TFGe<30ml/min/1,73m2 (2,94±0,54) con p<0,0001, así como la hemoglobina (10,7±2,2) con p<0,0001. La PCR (p=0,0041) fue más alta en el grupo de TFGe<30ml/min/1,73m2 (88,3±122) en comparación con los otros grupos. No se encontraron diferencias entre los grupos en relación con el nivel de glucemia ni en relación con el sodio (tabla 2).
Variables funcionales, mentales y biológicas según función renal por la ecuación MDRD
| Variable | Función renal por la ecuación MDRD | |||
|---|---|---|---|---|
| Severaml/min/1,73m2(n=279) | Moderadaml/min/1,73m2(n=562) | Leveml/min/1,73m2(n=837) | p | |
| Funcionales, promedio±DE | ||||
| Barthel al ingreso | 39,9±38,6 | 50,1±40,5 | 46,4±40,4 | 0,0044a |
| Biológicas, promedio±DE | ||||
| Glucemia (mg/dl) | 135±60 | 146±83 | 134±67 | 0,0634a |
| Albúmina (g/dl) | 2,94±0,54 | 3,2±0,59 | 3,2±0,64 | <0,0001a |
| Colesterol total (mg/dl) | 130,8±40,3 | 136,4±35,5 | 135,3±39,1 | 0,4427a |
| Índice de Charlson (0-13) | 3,7±2,0 | 3,4±2,1 | 3,0±2,1 | <0,0001a |
| Hemoglobina (g/dl) | 10,7±2,2 | 11,5±2,5 | 11,8±2,4 | <0,0001a |
| Linfocitos ≤1.500 | 22,2±150 | 16,6±118 | 11,5±94 | 0,361a |
| Sodio (mmol/l) | 139,3±7,2 | 139,6±6,7 | 138,7±6,6 | 0,2777a |
| PCR (mg/dl) | 88,3±122 | 52,0±93 | 44,3±85 | 0,0041a |
| Función renal y sobrevida, mediana | ||||
| TFGe, (ml/min/1,73m2) | 19,9 | 46,2 | 79,4 | <0,0001b |
| Sobrevida, (años) | 1,30 | 2,06 | 2,09 | 0,0456c |
| Mentales | ||||
| Minimental, puntaje (%) | ||||
| Normal, 24-30 | 17,8 | 22 | 19,6 | 0,61d |
| Leve, 19-23 | 13,2 | 10,1 | 13,8 | |
| Moderado, 14-18 | 32 | 32,3 | 30,1 | |
| Severo, <14 | 37 | 35,6 | 36,4 | |
| Social | ||||
| Guijón | ||||
| Buena | 50,2 | 55,6 | 49,8 | 0,21d |
| Situación de riesgo | 37 | 35,6 | 37,5 | |
| Deterioro social severo | 12,9 | 8,8 | 12,6 | |
DE: desviación estándar; MDRD: Modification of Diet in Renal Disease Study equation; PCR: proteína C reactiva; TFGe: tasa de filtración glomerular estimada (ml/min/1,73m2).
El tiempo total de análisis de pacientes en riesgo desde el inicio del estudio fue de 306,56 años para los 1.678 individuos. Con base en este tiempo se estimó que la tasa de mortalidad fue de 75,35 casos por 100 pacientes al año, con un IC del 95% que va de 66,2 a 85,7 casos de muertes por 100 pacientes al año. La tasa de supervivencia actuarial fue del 0,85, 0,65, 0,27 y 0,04 al año, 2, 3 y 4 años, respectivamente.
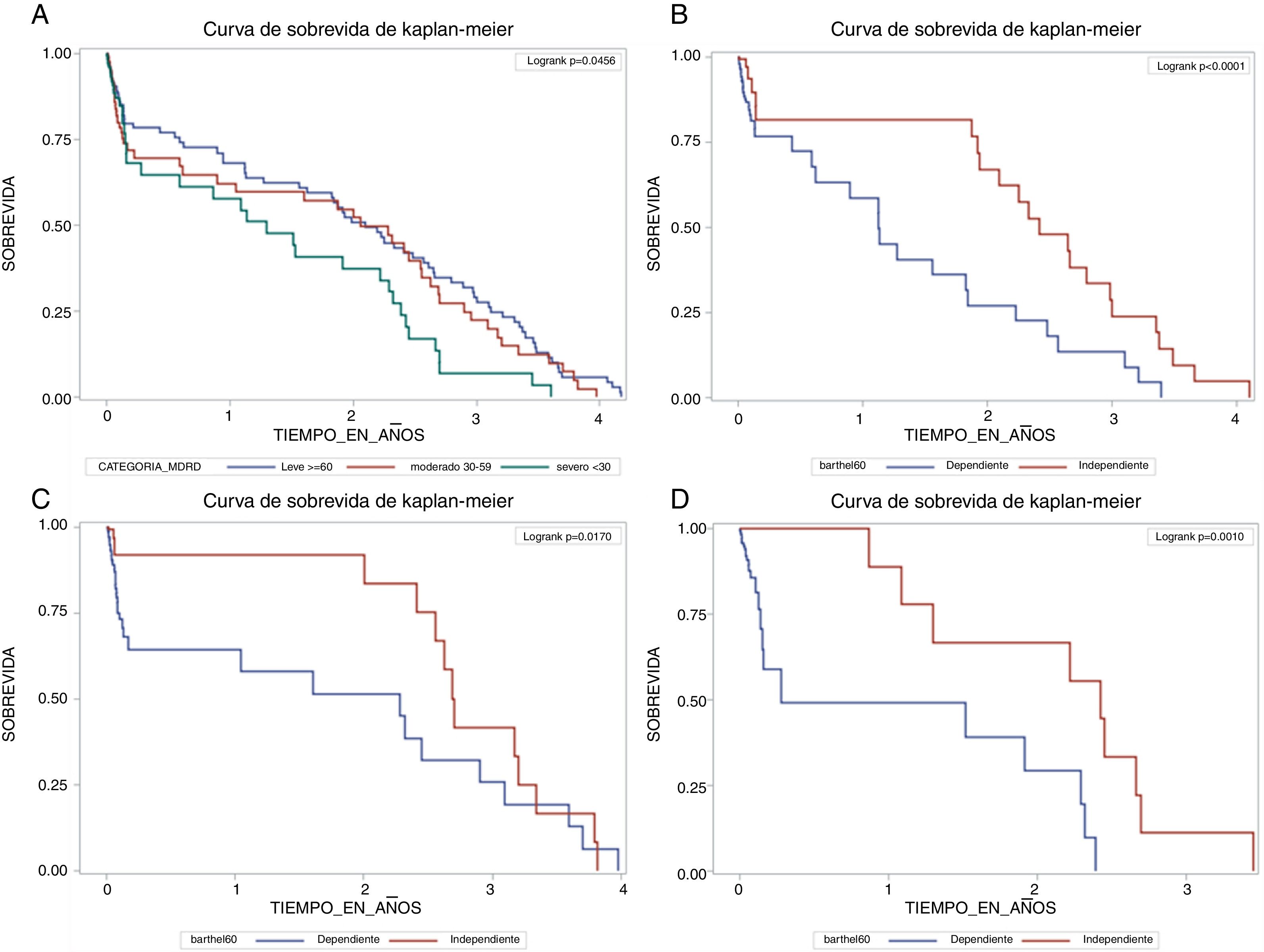
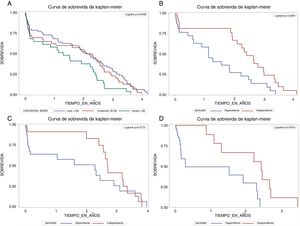
En la figura 1, en el panel A, en la población total (n=1.678) se compararon las curvas de sobrevida estimadas por categoría de la ecuación MDRD así: TFGe≥60ml/min/1,73m2, 30-59ml/min/1,73m2 y <30ml/min/1,73m2, en la que se observa que los pacientes con TFGe severamente comprometida fallecieron más rápido que el resto de los grupos (p=0,0456). Luego se hicieron las estimaciones de Kaplan-Meier para la sobrevida según la función renal estratificada por estado funcional y por el subgrupo de población en cada estadio: leve, moderado y severo. Hubo diferencias significativas comparando un IB independiente (≥60) con un IB dependiente (<60) en pacientes con estadio TFGe≥60ml/min/1,73m2 (panel B, n=837, p<0,0001), estadio TFGe 30-59ml/min/1,73m2 (panel C, n=562, p=0,0170), y estadio TFGe<30ml/min/1,73m2 (panel C, n=279, p=0,0010). No hubo diferencias por sexo (hombres vs. mujeres: estadio TFGe≥60ml/min/1,73m2, p=0,64; estadio TFGe 30-59ml/min/1,73m2, p=0,54; estadio TFGe<30ml/min/1,73m2, p=0,19), ni por edad (≤84 vs. ≥85: estadio TFGe≥60ml/min/1,73m2, p=0,99; estadio TFGe 30-59ml/min/1,73m2, p=0,64; estadio TFGe<30ml/min/1,73m2, p=0,56) ni por comorbilidad (0-3 vs. ≥4: estadio TFGe≥60ml/min/1,73m2, p=0,34; estadio TFGe 30-59ml/min/1,73m2, p=0,64; estadio TFGe<30ml/min/1,73m2, p=0,18) (no se muestran las gráficas para estos análisis).
Curvas de Kaplan-Meier para sobrevida según función renal y estado funcional de acuerdo con cada estadio de función renal.
En el panel A (población total; n=1.678) se comparan las curvas de sobrevida por categoría de la ecuación MDRD (puntos de corte para estadios TFGe dados en ml/min/1,73m2) así: estadio leve (≥60), moderado (30 a 59) y severo (<30). En los paneles B (estadio leve ≥60; n=837), C (moderado 30-59; n=562), y D (severo <30; n=279), se comparan por estado funcional según IB independiente (≥60) con un IB dependiente (<60).
IB: índice de Barthel; MDRD: Modification of Diet in Renal Disease Study equation; TFGe: tasa de filtración glomerular estimada.
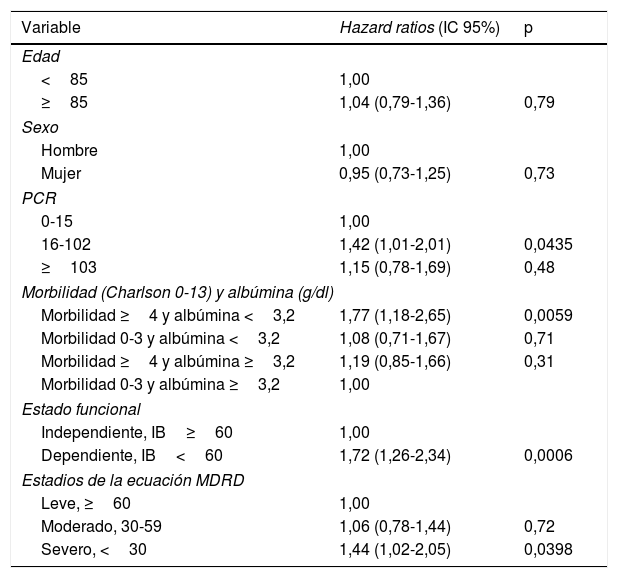
En la tabla 3 se detallan los resultados del análisis multivariado usando la regresión de Cox. Se ajustan las categorías de la ecuación MDRD por edad, género, estado funcional, comorbilidad en categorías combinada con la albúmina, y los tertiles de la PCR. Existe un aumento significativo del riesgo de morir en los pacientes con la ecuación MDRD en estadio TFGe<30ml/min/1,73m2 comparado con los de estadio TFGe≥60ml/min/1,73m2 (HR 1,44; p=0,0398). No se encontró diferencia significativa de riesgo de mortalidad en los pacientes con la ecuación MDRD en estadio TFGe 30-59ml/min/1,73m2 comparado con los de estadio TFGe≥60ml/min/1,73m2. También existe un riesgo aumentado de morir para los pacientes con un IB<60 comparado con los de IB≥60 (HR 1,72; p<0,0006) y para los pacientes con morbilidad alta (≥4) a la vez que con albúmina baja (<3,2) comparados con los de morbilidad baja (0-3) y albúmina alta (≥3,2) (HR 1,77; p=0,0059). Además, hubo un riesgo aumentado de morir para los pacientes con PCR intermedia alta (16-102) comparados con los de PCR baja (0-15) (HR 1,42; p=0,0435).
Modelo multivariadoa de Cox, proportional hazard ratios para la ecuación MDRD prediciendo riesgo de mortalidad a través del tiempo
| Variable | Hazard ratios (IC 95%) | p |
|---|---|---|
| Edad | ||
| <85 | 1,00 | |
| ≥85 | 1,04 (0,79-1,36) | 0,79 |
| Sexo | ||
| Hombre | 1,00 | |
| Mujer | 0,95 (0,73-1,25) | 0,73 |
| PCR | ||
| 0-15 | 1,00 | |
| 16-102 | 1,42 (1,01-2,01) | 0,0435 |
| ≥103 | 1,15 (0,78-1,69) | 0,48 |
| Morbilidad (Charlson 0-13) y albúmina (g/dl) | ||
| Morbilidad ≥4 y albúmina <3,2 | 1,77 (1,18-2,65) | 0,0059 |
| Morbilidad 0-3 y albúmina <3,2 | 1,08 (0,71-1,67) | 0,71 |
| Morbilidad ≥4 y albúmina ≥3,2 | 1,19 (0,85-1,66) | 0,31 |
| Morbilidad 0-3 y albúmina ≥3,2 | 1,00 | |
| Estado funcional | ||
| Independiente, IB≥60 | 1,00 | |
| Dependiente, IB<60 | 1,72 (1,26-2,34) | 0,0006 |
| Estadios de la ecuación MDRD | ||
| Leve, ≥60 | 1,00 | |
| Moderado, 30-59 | 1,06 (0,78-1,44) | 0,72 |
| Severo, <30 | 1,44 (1,02-2,05) | 0,0398 |
IB: índice de Barthel; IC: intervalo de confianza; MDRD: Modification of Diet in Renal Disease Study equation; PCR: proteína C reactiva.
Una TFGe disminuida es un factor de riesgo de mortalidad, pero su presencia posterior a una hospitalización en una UGA no ha sido evaluada. Por cada disminución de 15ml en la TFGe por debajo del umbral de 60ml/min/m2 en AM, aparte de predecir mortalidad14, es un importante determinante de limitación funcional15. En este estudio hemos demostrado que el riesgo de mortalidad tiempo después de una hospitalización en una UGA es 1,4 veces mayor en pacientes con TFGe baja (<30ml/min/1,73m2),y que la sobrevida es menor en personas que tienen a la vez dependencia funcional.
La mortalidad estandarizada por edad debido a la ERC aumentó en el mundo en un 36,9%, de 11,6 muertes por cada 100.000 habitantes en 1990 a 15,8 muertes por cada 100.000 habitantes en 20131. El riesgo para la mortalidad (hazard ratios) en las categorías más avanzadas de ERC fue de 2,18 (IC 95%: 1,14-4,15) en China (2007-2013), y en los Estados Unidos (2005-2011) fue de 1,66 (1,18-2,32) en ausencia de albuminuria; mientras que fue de 2,30 (1,13-4,68) y 3,04 (2,33-3,96) en presencia de albuminuria, respectivamente2.
En nuestro estudio, la tasa de mortalidad por cada 100 pacientes al año, en el primer año de seguimiento fue del 15%, muy similar a las tasas reportadas en otros estudios de pacientes mayores con ERC, como era de esperarse; sin embargo, no existen estudios con valores reportados con más de 4 años de seguimiento7,16. En un estudio que incluyó a 539 octogenarios, la ecuación MDRD (como referencia punto de corte <60ml/min/1,73m2) fue similar a la ecuación Chronic Kidney Disease Epidemiology Collaboration-creatinine (CKD-EPIcreat) en predecir eventos adversos cardiovasculares u hospitalización; fue inferior a la ecuación CKD-EPIcyst (cystatin) y a la ecuación CKD-EPIcreatcyst (creatinine-cystatin); pero fue superior a la ecuación Berlin Initiative Study (BIS) para predecir mortalidad durante un periodo de 3 años17. Cuando se usó el punto de corte de <30ml/min/1,73m2, todas las ecuaciones predijeron en forma similar la mortalidad18. En otro estudio que incluyó a 439 personas de 65 años o más durante un año, en análisis ajustados, los pacientes con una TFGe<30ml/min/1,73m2, al usar la ecuación CKD-EPI, mostraron la asociación más consistente con la mortalidad (HR 2,60; IC 95%: 1,20-5,66), seguida por la ecuación MDRD (HR 2,07; IC 95%: 1,01-4,30), y fue no significativa usando la ecuación Cockroft-Gault (CG-BSA) ajustado por superficie corporal (HR 2,68; IC 95%: 0,92-7,55)7. En general, se ha observado que las ecuaciones usadas para determinar la ERC no son intercambiables, y algunas pueden sobreestimar los estadios severos de la TFGe (p.ej., la ecuación BIS1 o la ecuación CG-BSA); estas diferencias pueden afectar también la estimación de la mortalidad, que también varía de acuerdo con la ecuación usada7,17,18. Desde el punto de vista clínico, se ha recomendado usar la ecuación CKD-EPI en vez de la ecuación MDRD, aunque tiende a clasificar más AM con ERC pero disminuye los falsos positivos19,20. En este estudio, nosotros escogimos la ecuación MDRD debido a que ha sido usada en grupos diversos de poblaciones (p.ej., varias razas)21 así como en poblaciones que incluyen un buen número de AM (en contraste, la ecuación CKD-EPI se ha usado más en poblaciones <65 años)22.
La tasa de mortalidad por distintas causas no fue mayor en hombres que en mujeres. Estos hallazgos son contrarios a datos recientes de diferentes estudios en AM, en donde los hombres con igual edad cronológica y deterioro biológico tenían un mayor riesgo en comparación con las mujeres23. Estos resultados demuestran que la TFGe puede proporcionar información útil para predecir mortalidad en una población de AM hospitalizados previamente en una UGA.
Por otra parte, la interacción entre ERC y dependencia funcional medida por el IB permitió identificar grupos de personas con un riesgo extremadamente elevado de mortalidad en el grupo de pacientes con puntuaciones más bajas del IB y TFGe<30ml/min/1,73m2. Tal interacción podría encontrar una explicación en los mecanismos patogénicos comunes con la fragilidad y el daño renal, como la inflamación crónica. Se sabe, además, que la vía inflamatoria afecta la masa muscular y la fuerza, al igual que otras funciones biológicas claves como la eritropoyesis24. No obstante, la funcionalidad marcó un punto estadísticamente significativo en todos los grupos de TFGe, lo que demuestra su importancia al momento del egreso hospitalario y como predictor independiente de mortalidad24,25. Estos hallazgos tienen implicaciones clínicas relevantes al mejorar la estratificación pronóstica, al asociar la TFGe y la funcionalidad medida por el IB, en pacientes AM dados de alta en una UGA. Este punto resalta la importancia de las UGA, que tienen como objetivo mantener y preservar la funcionalidad de los pacientes independientemente de la causa de su hospitalización, entendiéndose que este cuidado interdisciplinario preserva e impacta directamente la mortalidad, por lo menos en los pacientes con ERC.
En nuestro estudio encontramos anemia e hipoalbuminemia en las personas que tenían una TFGe severamente comprometida, hallazgo esperable en los resultados y que coincide con la evidencia investigativa mundial7,17,26-29. Del mismo modo, se encontraron niveles elevados de PCR en la población, lo cual apoya la teoría del proceso inflamatorio crónico de la enfermedad27. Nuestros hallazgos, en donde la hipoalbuminemia junto con la comorbilidad y el nivel elevado de la PCR fueron factores independientes de riesgo de muerte, coinciden con otros estudios en la literatura24,26. Esto sugiere que los procesos inflamatorios, además de estar involucrados en la fisiopatología de la ERC, se deben tener en cuenta como factores pronósticos adicionales a considerarse en el futuro.
Este estudio tiene algunas limitaciones; debido a que la población objeto incluía AM hospitalizados en una UGA, es posible que los resultados no sean aplicables a otros entornos. Igualmente los pacientes fueron reclutados en un solo hospital, lo cual disminuye la validez externa.
Estudios recientes llevados a cabo en poblaciones jóvenes mostraron que el riesgo de mortalidad asociado con un nivel de TFGe aumenta en personas con proteinuria30. No se recogió ningún dato sobre la proteinuria en esta población, por lo que no se logró explorar el papel aditivo de esta condición en la supervivencia. A su vez, la base de datos careció de una medición directa de TFGe u otros marcadores de la función renal, como la cistatina C que puede dar diferentes resultados.
A pesar de lo anterior, este estudio también tiene fortalezas; dentro de estas se destacan la edad promedio de 82,2±7 años y la amplia gama de factores de confusión para los cuales se ha corregido la relación de supervivencia con la TFG, como por ejemplo, el retiro de pacientes con sepsis, desnutrición o sarcopenia que pueden afectar los niveles de creatinina.
En conclusión, una TFGe<30ml/min/1,73m2 se asocia a un riesgo mayor de mortalidad tiempo después de una hospitalización en una UGA. El estado funcional pobre, la comorbilidad alta junto con albúmina baja y los marcadores de inflamación (PCR) son factores pronósticos independientes adicionales a tener en cuenta. Es necesario desarrollar escalas de mortalidad pronósticas en este tipo de pacientes que incluyan la función renal junto con los otros factores encontrados y de esta manera ofrecer una rehabilitación más intensiva. Así, la mejoría en el estado funcional podría mejorar la sobrevida posterior a la hospitalización.
Conflicto de interesesNinguno.
Un preliminar de este trabajo ganó el Premio al Tercer Mejor Trabajo de Investigación. XII Congreso de la Asociación Colombiana de Gerontología y Geriatría, celebrado en Bogotá del 19 al 21 de mayo de 2016.