En las personas mayores, la gripe estacional es un importantísimo problema de salud pública por su morbimortalidad y los costes económicos y sociales que conlleva. El objetivo de esta revisión es describir la magnitud y la trascendencia de la gripe estacional en este grupo de población y su prevención mediante la vacunación. Para ello se realiza una exposición actualizada sobre la composición de la vacuna, su pauta y vía de administración, la seguridad vacunal y la evaluación de la inmunogenicidad y efectividad de la vacunación. Entre los diferentes países y organismos oficiales existe variabilidad en las recomendaciones sobre la edad a partir de la cual se debe establecer la vacunación antigripal en las personas mayores. Para mejorar la cobertura vacunal frente a la gripe en España es necesario implantar nuevas estrategias de vacunación antigripal.
Seasonal flu is a very serious public health problem in the elderly due to its morbidity and mortality and financial and social costs arising from this. The aim of this review is to describe the magnitude and importance of seasonal flu in this population group, and its prevention by means of vaccination. For this reason, an updated account of the composition of the vaccine, its dosage and administration route, vaccine safety and the evaluation of the immunogenicity and effectiveness of vaccination. There is variation between different countries and official organisations on the age at which flu vaccination must be established in the elderly. New flu vaccination strategies need to be introduced, to further improve flu vaccination cover in Spain.
La gripe está causada por Orthomyxovirus de los tipos A y B, que presentan con el tiempo modificaciones de intensidad variable en su estructura antigénica. La infección por un determinado subtipo o variedad confiere escasa o nula protección frente a otros subtipos o variedades del virus. Estas características explican la epidemiología de la enfermedad, que se manifiesta en forma de gripe estacional (interpandémica) y de pandemias gripales1.
La gripe estacional cursa en forma de brotes epidémicos de intensidad variable que duran 5-7 semanas durante los meses fríos (entre diciembre y marzo en el hemisferio norte y entre abril y septiembre en el hemisferio sur). Estos brotes se deben a cambios menores de los virus gripales A y/o B (modificaciones cada 1 o 2 años de los antígenos por mutaciones puntuales en su genoma).
Las pandemias son debidas a variaciones mayores (cambios totales cada 10 o más años en sus antígenos de superficie por intercambio génico entre virus animales y humanos) de los virus del tipo A2. Durante el siglo xx han ocurrido tres grandes pandemias: 1918-1919 (H1N1),1957-1958 (H2N2) y 1968-1969 (H3N2). En junio de 2009, la OMS declaró la situación de pandemia de gripe A H1N13. La gripe pandémica causó la práctica totalidad de casos de gripe en 2009 y desplazó prácticamente al resto de cepas gripales. En 2010, la actividad del virus está siendo mínima durante el periodo estival en el hemisferio norte. Durante el invierno del hemisferio sur, la actividad se mantiene baja, coexistiendo con el virus de la gripe estacional pese a que existe transmisión activa en algunas zonas de la India, Nueva Zelanda y Australia. La OMS mantiene un seguimiento del nivel de actividad de la gripe pandémica para valorar la posible transición a un patrón estacional4.
Desde la aparición de la gripe aviar (H5N1) en 2003, las autoridades sanitarias han priorizado el diseño de estrategias preventivas y asistenciales para intentar controlar la aparición de una pandemia y minimizar su impacto. Pero no podemos olvidar que la gripe estacional sigue siendo un importantísimo problema de salud pública por su morbimortalidad y los costes económicos y sociales que conlleva5, por lo que el objetivo de esta revisión es describir la magnitud y la trascendencia de la gripe estacional en las personas mayores y su prevención mediante la vacunación.
Magnitud y transcendencia de la gripeComo promedio, cada año la gripe afecta al 10-20% de la población, pudiendo llegar hasta el 50% en comunidades cerradas2. Según el Centro Nacional de Epidemiología (Sistema de Enfermedades de Declaración Obligatoria), en España se alcanzan tasas anuales de 300-500 casos/100.000 habitantes (2-3 millones de casos notificados), aunque durante la temporada gripal 2008-2009 la incidencia fue moderada, notificándose 218,31 casos gripe por 100.000 habitantes6.
Los brotes de gripe estacional incrementan la demanda asistencial, aumentando espectacularmente las visitas ambulatorias y los ingresos hospitalarios7. En Estados Unidos el número de hospitalizaciones asociadas con la gripe varía considerablemente según la magnitud de la epidemia, oscilando aproximadamente entre 16.000 hospitalizaciones en las temporadas de baja incidencia de gripe a 220.000 en las temporadas de alta incidencia2. Las tasas de hospitalización asociadas a la gripe son máximas en el grupo de edad de 65 o más años, seguido por el de 50-64 años donde la prevalencia de personas con factores de riesgo es ya muy elevada (en torno al 40%), lo que explica este incremento de las hospitalizaciones8.
La diferente expresividad clínica de la gripe está relacionada con la exposición anterior, salvaje o vacunal, a antígenos del virus influenza. El virus gripal puede causar neumonía intersticial en sujetos sin factores de riesgo identificados. De modo excepcional se han descrito casos de encefalitis y síndrome de Guillain-Barré (SGB).
La mayor mortalidad y la complicaciones graves ocurren en las personas de 60-65 años o más de edad, así como en pacientes de cualquier edad con enfermedades crónicas de tipo respiratorio, cardiaco, metabólico o renal, especialmente aquellas que cursan con inmunosupresión asociada a la propia enfermedad o a la terapéutica administrada9. La mortalidad se produce, sobre todo, por complicaciones bacterianas (principalmente neumocócicas) y por descompensaciones de la enfermedad de base2.
Se estima que entre 1.500 y 3.000 personas fallecen cada año en España por esta enfermedad. Más del 90% de las muertes por gripe ocurren en mayores de 60 años. En Estados Unidos, las tasas estimadas de mortalidad asociadas con la gripe se sitúan entre 30 y 150 muertes por 100.000 personas de 65 o más años, según la intensidad de la actividad gripal. En este país se estima que cada año se producen más de 20.000 muertes debidas a la gripe, aunque en algunas temporadas epidémicas éstas podrían llegar a 60.00010.
El impacto sanitario y económico de la gripe en costes directos (sanitarios) e indirectos (derivados de las pérdidas de productividad) es considerable. De promedio, cada caso de gripe ocasiona 5-6 días de actividad limitada, 3-4 días de restricción de actividad en cama y alrededor de 3 días de absentismo laboral2. En 1987, un estudio estimó que el coste anual de los brotes epidémicos habituales de gripe en los Estados Unidos era de 3.000 millones de dólares; un 20-30% fueron costes directos11. En España, durante la temporada gripal 1999-2000, la gripe representó un coste total de aproximadamente 1.036,9 millones de euros (47,2% en hospitalizaciones) y los casos de mayores de 65 años de edad fueron los que presentaron un coste más elevado12.
Composición de las vacunas antigripalesLas vacunas antigripales utilizadas para la inmunización de las personas mayores son las vacunas inactivadas:
- –
Vacunas con virus enteros inactivados: suspensiones purificadas de viriones completos.
- –
Vacunas con virus fraccionados: viriones fraccionados por la acción de detergentes.
- –
Vacunas con antígenos de superficie o vacunas de subunidades (hemaglutinina y neuraminidasa) de la envoltura viral.
- –
Vacunas adyuvadas: la respuesta inmunitaria a los antígenos vacunales se ve favorecida por la presencia de moléculas como el MF59.
- –
Vacunas de virosomas: vacunas en las que los antígenos son transportados por virosomas, vesículas de pequeño tamaño formadas por compuestos fosfolipídicos y que remedan al virión, de modo que se favorece la respuesta inmunitaria pero con menor reactogenidad que en las vacunas de virus enteros.
Recientemente (diciembre de 2009) ha sido autorizada por la Food and Drug Admistration (FDA) una nueva formulación de vacuna inactivada trivalente frente a la gripe para uso en individuos por encima de 65 o más años (Fluzone High-dose®). Cada dosis de esta formulación, que estará disponible en EE. UU. para su administración en la campaña 2010-2011, contiene cuatro veces la cantidad antígeno de hemaglutinina del virus de la influenza (180μg, 60μg de cada cepa) en comparación con las dosis estándar (45μg, 15μg de cada cepa). Tras la autorización de la vacuna, se inició un estudio para valorar su eficacia, el cual se encuentra pendiente la finalización; no obstante, los datos disponibles en la actualidad orientan hacia una mayor respuesta inmunitaria en los mayores de 65 años, si bien la incidencia de reacciones locales y sistémicas está aumentada, aunque, por lo general, éstas son leves y de carácter autolimitado13.
Las vacunas atenuadas intranasales frente a la gripe, elaboradas a partir de cepas adaptadas al frío, no están autorizadas para su administración en adultos a partir de los 50 años de edad.
Anualmente, la OMS realiza recomendaciones sobre la composición de las vacunas antigripales a emplear en la campaña de vacunación, basándose en la información obtenida a través de la red de vigilancia epidemiológica, desplegada en más de 80 países, acerca de la prevalencia de aislamientos de cepas concretas que circulan en todo el mundo. Las vacunas recomendadas desde hace 30 años incluyen productos inmunizantes de los virus gripales A (subtipos H1N1 y H3N2) y B. La composición recomendada para la temporada 2010-2011 en el hemisferio norte es la siguiente: A/California/7/2009 (H1N1)-like, A/Perth/16/2009 (H3N2)-like y B/Brisbane/60/2008-like. En comparación con la campaña anterior 2009-2010, se han modificado las cepas virales A (H1N1) y A(H3N2) incluidas en la vacuna. La cepa A/California/7/2009 (H1N1)-like es la misma que se utilizó en la vacuna monovalente frente a la gripe pandémica14.
Recientemente, ha sido publicado un ensayo clínico multicéntrico en el que participaron 152 individuos mayores de 60 años y que ha evaluado la seguridad y la inmunogenicidad de la vacuna pandémica H1N1, administrada de forma aislada o simultánea a la vacuna antigripal estacional utilizada en la campaña 2009-2010. Los autores concluyen que la vacuna pandémica actual es segura e inmunogénica en las personas mayores, pudiendo ser coadministrada con seguridad con la vacuna de la gripe estacional15.
Pautas y vías de administraciónSe recomienda la administración anual de una dosis de vacuna antigripal en campaña de inmunización (meses de octubre y noviembre en el hemisferio norte, y marzo y abril en el hemisferio sur), si bien debe administrarse con posterioridad si por cualquier circunstancia la vacunación no se ha practicado en ese momento. Fuera de campaña, deben recibir la vacuna los viajeros incluidos en grupos de riesgo que no hayan sido vacunados en el otoño anterior y que realicen viajes a los trópicos en cualquier época del año o al hemisferio sur entre abril y septiembre.
La vía de administración en adultos es la intramuscular en el deltoides. El hecho de que la respuesta inmunitaria de las personas mayores a las vacunas utilizadas en la actualidad sea inferior a la obtenida en adultos jóvenes ha propiciado la búsqueda de formulaciones más inmunógenas. En este sentido, varios estudios experimentales han evaluado la vía intradérmica como alternativa a la vacunación intramuscular en este colectivo observando respuestas inmunitarias significativamente superiores, si bien la frecuencia de aparición de reacciones locales podría verse aumentada16,17. La Comisión Europea autorizó a principios de 2009 la comercialización de la primera vacuna antigripal administrada mediante microinyección intradérmica (Intanza®/IDflu®) para su uso en población adulta.
La administración reciente o futura de inmunoglobulinas o productos que las contengan no interfiere con la respuesta a la vacunación. Las terapias inmunosupresoras no contraindican la vacunación, si bien pueden disminuir la efectividad de la vacuna. La vacuna antigripal puede administrarse de forma simultánea a otras vacunas inactivadas o atenuadas, siempre en áreas anatómicas diferentes
La vacuna debe conservarse entre +2°C y +8°C. No admite congelación.
Seguridad vacunalAdemás de las contraindicaciones y precauciones generales de las vacunas (reacción anafiláctica a dosis previas, hipersensibilidad a algún componente de la vacuna, rango de edad fuera de lo establecido), las vacunas antigripales inactivadas están contraindicadas en pacientes con anafilaxia a las proteínas del huevo. Se desaconseja la vacunación antigripal en personas con antecedente de SGB en las 6 semanas siguientes a una vacunación antigripal previa, salvo que el riesgo de infección gripal y sus complicaciones se estime muy elevado. En caso de enfermedad aguda grave, puede ser prudente retrasar la vacunación hasta la recuperación del paciente.
Los efectos adversos de las vacunas antigripales inactivadas son, por lo general, poco importantes. Consisten fundamentalmente en reacciones locales (dolor, inflamación, eritema o induración en la zona de inoculación) autolimitadas (1-2 días de duración) que aparecen en un 5% de los vacunados y se presentan con menor frecuencia con la vacuna de virus fraccionados. La fiebre u otras reacciones sistémicas, como escalofríos, malestar, dolor de cabeza y mialgias, son poco importantes y ocurren más en niños y en vacunados por primera vez. Las reacciones alérgicas de tipo urticaria, angioedema, asma o anafilaxia son muy poco frecuentes. Se deben a hipersensibilidad a los componentes de la vacuna, en especial a las proteínas del huevo. En las cepas de vacunas que contienen hemaglutinina porcina se han descrito aisladamente casos de SGB. Aunque resulta muy difícil establecer asociaciones causales con una entidad con un incidencia anual de 10-20 casos por millón de adultos, se ha sugerido que la vacunación antigripal podría, a lo sumo, suponer un riesgo adicional de SGB de 1 caso por millón de vacunados. Tras la vacunación pueden producirse falsos positivos en la serología del virus de la inmunodeficiencia humana y el virus linfotrópico humano tipo 1, que vuelven a negativizarse en torno a los 75 días, así como del virus de la hepatitis C, que puede persistir un mayor periodo.
Inmunogenicidad en personas mayoresLa estrategia de vacunación antigripal más aceptada en el mundo occidental es la priorización de inmunización anual de grupos de riesgo, fundamentalmente de los individuos de 65 o más años, dada la mayor morbimortalidad causada por la gripe o sus complicaciones en este grupo poblacional. Aunque la vacunación continúa siendo el método más eficaz de prevención frente a la gripe y sus complicaciones, las vacunas utilizadas en la actualidad parecen conferir mayor protección a individuos jóvenes que a las personas mayores. Sólo una evaluación precisa de la eficacia y la efectividad de las vacunas antigripales en las personas mayores permitirá conocer lo acertado de su priorización en las campañas de vacunación antigripal y, por tanto, la toma racional de decisiones entre estrategias alternativas de inmunización18. En esa necesaria evaluación son de gran utilidad los estudios de metaanálisis, ya que la toma de decisiones en estrategias de vacunación no puede hacerse sobre el resultado de estudios aislados.
En un metaanálisis realizado por Gross et al19 en 1995, en el que se incluyeron 20 estudios observacionales de cohortes realizados en personas mayores, las estimaciones de la efectividad vacunal fueron del 56% (IC del 95%, 39-68%) para prevenir la enfermedad respiratoria, del 53% (IC del 95%, 35-66%) para prevenir la neumonía, del 50% (IC del 95%, 28-65%) para prevenir la hospitalización y del 68% (IC del 95%, 56-76%) para prevenir la muerte. Sin embargo, esta revisión se realizó hace ya 15 años, por lo que sus conclusiones pudiendo verse afectadas por la falta de inclusión de estudios recientes18,20.
Otro metaanálisis realizado por Vu et al21 en 2002, que incluía 15 estudios (sólo uno de los cuales era de diseño experimental), ha evaluado la efectividad de la vacunación antigripal en las personas de 65 años o más que viven en la comunidad. La vacuna frente a la gripe redujo la incidencia de las enfermedades similares a la gripe (ESG) en un 35% (IC del 95%, 19-47%), la hospitalización por neumonía y gripe en el 33% (IC del 95%, 27-38%), la mortalidad por neumonía y gripe en un 47% (IC del 95%, 25-62%) y la mortalidad por todas las causas en un 50% (IC del 95%, 45-56%). Esta revisión tiene varios defectos metodológicos que pueden afectar a sus conclusiones, como la exclusión de estudios con denominadores menores de 30 y la agrupación de estudios con diseños diferentes. Por otra parte, el número de estudios incluido es limitado20.
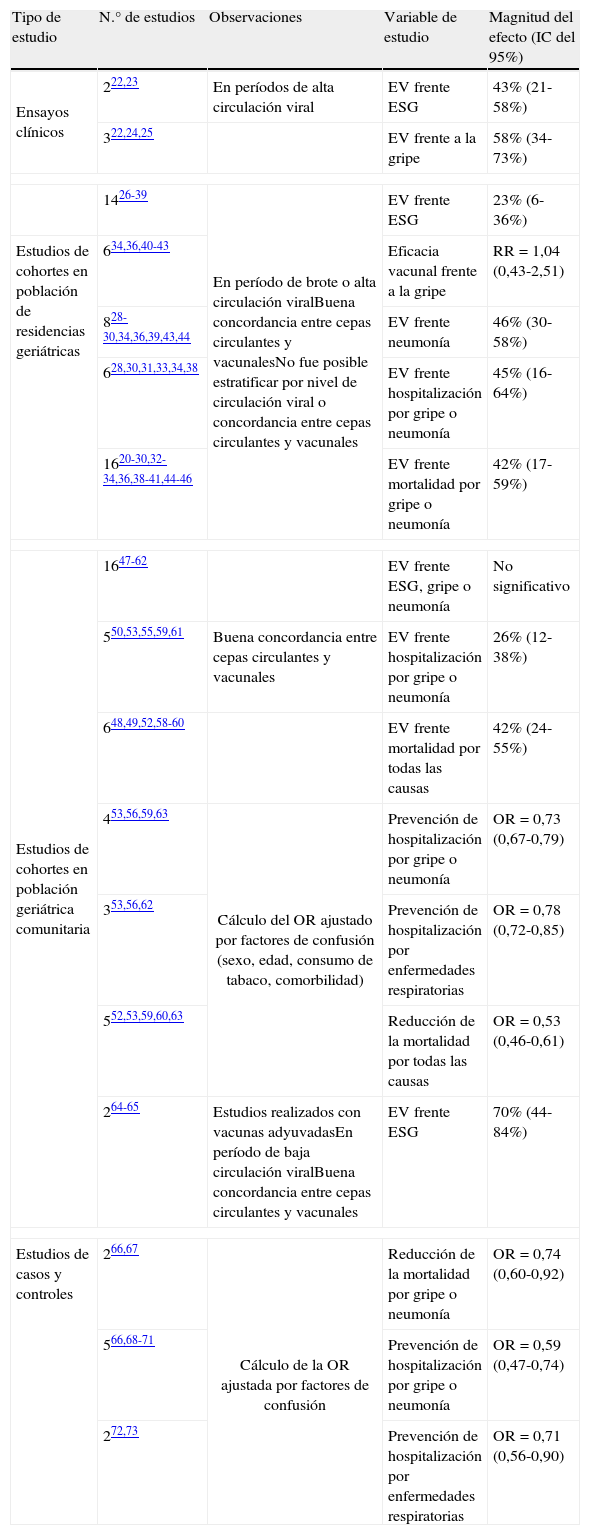
El más reciente metaanálisis, publicado en 2010, incluye estudios realizados durante más de 40 años de vacunación de gripe en pacientes de 65 años o más18. Se incluyeron estudios experimentales, cuasiexperimentales, de cohortes y de casos y controles con el objetivo de evaluar la efectividad de las vacunas antigripales frente a la gripe, las ESG, los ingresos hospitalarios, las complicaciones y la mortalidad en población geriátrica. Se consideró cualquier vacuna administrada de forma independiente, en cualquier dosis o cronograma de administración, comparada con placebo o con ninguna intervención. Los 68 estudios incluidos fueron divididos en subconjuntos según el contexto de administración de la vacuna (población comunitaria o de residencias geriátricas), nivel de circulación viral y concordancia entre las cepas virales incluidas en la vacuna y las circulantes. En la tabla 122–73 se muestran los resultados más relevantes de dicho metanálisis.
Efectividad de la vacuna antigripal en población geriátrica.
| Tipo de estudio | N.° de estudios | Observaciones | Variable de estudio | Magnitud del efecto (IC del 95%) |
| Ensayos clínicos | 222,23 | En períodos de alta circulación viral | EV frente ESG | 43% (21-58%) |
| 322,24,25 | EV frente a la gripe | 58% (34-73%) | ||
| 1426-39 | En período de brote o alta circulación viralBuena concordancia entre cepas circulantes y vacunalesNo fue posible estratificar por nivel de circulación viral o concordancia entre cepas circulantes y vacunales | EV frente ESG | 23% (6-36%) | |
| Estudios de cohortes en población de residencias geriátricas | 634,36,40-43 | Eficacia vacunal frente a la gripe | RR=1,04 (0,43-2,51) | |
| 828-30,34,36,39,43,44 | EV frente neumonía | 46% (30-58%) | ||
| 628,30,31,33,34,38 | EV frente hospitalización por gripe o neumonía | 45% (16-64%) | ||
| 1620-30,32-34,36,38-41,44-46 | EV frente mortalidad por gripe o neumonía | 42% (17-59%) | ||
| Estudios de cohortes en población geriátrica comunitaria | 1647-62 | EV frente ESG, gripe o neumonía | No significativo | |
| 550,53,55,59,61 | Buena concordancia entre cepas circulantes y vacunales | EV frente hospitalización por gripe o neumonía | 26% (12-38%) | |
| 648,49,52,58-60 | EV frente mortalidad por todas las causas | 42% (24-55%) | ||
| 453,56,59,63 | Cálculo del OR ajustado por factores de confusión (sexo, edad, consumo de tabaco, comorbilidad) | Prevención de hospitalización por gripe o neumonía | OR=0,73 (0,67-0,79) | |
| 353,56,62 | Prevención de hospitalización por enfermedades respiratorias | OR=0,78 (0,72-0,85) | ||
| 552,53,59,60,63 | Reducción de la mortalidad por todas las causas | OR=0,53 (0,46-0,61) | ||
| 264-65 | Estudios realizados con vacunas adyuvadasEn período de baja circulación viralBuena concordancia entre cepas circulantes y vacunales | EV frente ESG | 70% (44-84%) | |
| Estudios de casos y controles | 266,67 | Cálculo de la OR ajustada por factores de confusión | Reducción de la mortalidad por gripe o neumonía | OR=0,74 (0,60-0,92) |
| 566,68-71 | Prevención de hospitalización por gripe o neumonía | OR=0,59 (0,47-0,74) | ||
| 272,73 | Prevención de hospitalización por enfermedades respiratorias | OR=0,71 (0,56-0,90) | ||
EV: efectividad vacunal; ESG: enfermedades similares a la gripe.
Tomado de Jefferson et al18, 2010.
Los autores concluyen que la efectividad de las vacunas trivalentes antigripales en las personas mayores estimada basándose en las evidencias disponibles es modesta, situándose en niveles inferiores a los habitualmente considerados en la priorizaron de estrategias de vacunación. Sin embargo, los resultados de este metaanálisis se basan fundamentalmente en estudios no experimentales, lo que dificulta establecer conclusiones en cuanto a la efectividad vacunal en este grupo de población. La evaluación de la efectividad basada en ensayos clínicos controlados podría contribuir a resolver esta incertidumbre18.
Entre las limitaciones en la evaluación de la inmunogenicidad de la vacuna antigripal en población geriátrica se encuentran los posibles sesgos de selección cometidos en los estudios de cohortes, dado que las personas mayores más frágiles o con limitaciones funcionales tienen mayor probabilidad de no recibir la vacuna (sesgo de fragilidad). Otras limitaciones serían la falta de concordancia entre las cepas vacunales y las circulantes, la variabilidad en la severidad de la infección y la inexactitud en la asignación de los códigos diagnósticos que impide una medición adecuada de la fragilidad o gravedad de la enfermedad, ambas factores de riesgo de muerte por gripe74.
Recomendaciones de vacunación de organismos oficialesEn Europa existe variabilidad en cuanto a la edad a partir de la cual se establece la vacunación antigripal en los mayores. Así, la vacunación anual se recomienda a partir de los 50 años en Austria; por encima de los 60 años en Alemania, Grecia, Islandia y España, y de los 65 en Bélgica, Dinamarca, Finlandia, Francia, Irlanda, Italia, Holanda, Noruega, Portugal, Suecia, Suiza y el Reino Unido. Además, las políticas de financiación de la vacunación antigripal de este grupo etario varían ampliamente de unos a otros países, desde la asunción total del coste de la vacunación por el paciente en Austria, la financiación completa en Francia y España, la financiación pública de la vacuna pero no de los servicios clínicos en Suiza, hasta la incentivación a los facultativos para fomentar la vacunación antigripal en el Reino Unido. Con el objetivo de establecer, armonizar y reforzar las políticas europeas de inmunización en los mayores, las dos sociedades europeas de Geriatría y Gerontología, la European Union Geriatric Medicine Society y la International Association of Gerontology and Geriatrics-European Region han desarrollado un documento de consenso que aboga por la vacunación rutinaria de los mayores, estableciendo recomendaciones concretas para las vacunas universalmente indicadas en este grupo poblacional. En el caso de la gripe, establece la recomendación de vacunar anualmente a los individuos a partir de los 60 años de edad. El momento del ingreso de la persona mayor en una residencia geriátrica es una buena oportunidad para evaluar y actualizar su historia de vacunación, teniendo en cuenta la importancia que la inmunidad de grupo puede alcanzar en la prevención de enfermedades como la gripe en estos colectivos cerrados75.
En EE. UU., el Advisory Committee on Immunization Practices (ACIP) ha recomendado en anteriores campañas la vacunación antigripal de los adultos a partir de los 50 años de edad, así como de sus contactos domiciliarios o cuidadores76,77. Las recomendaciones del ACIP para la campaña 2010-2011, publicadas en agosto de 2010, amplían la indicación de vacunación sistemática anual frente al virus de la influenza a toda la población adulta, al incluir a los individuos entre 19 y 49 años de edad. Así, teniendo en cuenta las recomendaciones ya existentes para otros grupos etarios, la vacunación antigripal anual se recomienda en EE. UU. a todos los individuos por encima de los 6 meses de edad14.
Canadá y Australia recomiendan la vacunación del la población a partir de los 65 años78,79.
En España se ha publicado recientemente el calendario de vacunaciones sistemáticas del adolescente y adulto recomendado por la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene. Este documento recoge la indicación de vacunación anual a partir de los 60 años de edad, así como la recomendación de incorporar de forma progresiva la vacunación antigripal en el grupo de edad de 50 a 64 años, comenzado por el de 60-64 años80. Esta recomendación, basada en la elevada prevalencia en este grupo de edad de individuos con patologías de base (entorno al 40% en nuestro país), se ha implantado en la actualidad en las comunidades autónomas de Cataluña y Madrid, y sólo a partir de los 60 años. Se recomienda la utilización de vacunas de inmunogenicidad incrementada (vacuna adyuvada con MF 59) para las personas de 65 años o más, con el objetivo de mejorar la inmunogenicidad en este colectivo81. Se recomienda asimismo la vacunación antigripal al personal de centros geriátricos y a cuidadores domiciliarios de este colectivo82.
Estrategias para la ampliación de cobertura vacunalSegún datos del National Health Interview Survey, la cobertura vacunal en personas mayores de 64 años alcanzada en EE. UU. durante la campaña de vacunación antigripal 2007-2008 fue del 66,3% (IC del 95%, 64,2-68,3%), disminuyendo al 38,4% (IC del 95%, 36,4-40,4) en las personas de 50-64 años. Estas coberturas se hayan lejos del objetivo fijado por el servicio de salud estadounidense para el año 2010, que pretende alcanzar coberturas superiores al 90% en personas mayores de 65 años y en población de residencias geriátricas76. En España, la situación es similar. Las coberturas de vacunación antigripal alcanzadas en 2006 en individuos de 65 años o más fue del 66,8%, disminuyendo al 26,6% entre los de menor edad pertenecientes a grupos de riesgo83. Para mejorar las coberturas de vacunación se requieren nuevas estrategias de captación de la población diana (tabla 2)84.
Estrategias de vacunación antigripal para mejorar la cobertura vacunal.
| Lugar/grupo | Estrategia |
| Centros de salud | – Vacunación oportunista: ofrecimiento de la vacuna a la población de riesgo que entre en contacto con atención primaria antes de la temporada gripal |
| – Informar y sensibilizar a la población diana sobre la necesidad de vacunarse | |
| – Divulgación de la campaña en medios de comunicación (radio, periódico), carteles, hojas informativas desde el área de cita previa y consultas | |
| – Educación sanitaria individualizada de la población desde las consultas médicas y de enfermería para vencer las barreras, miedos y falsas concepciones sobre la vacunación | |
| – Realización de recordatorios postales (carta personalizada) o telefónicos a la población de riesgo mediante informatización de los sistemas de información y registro | |
| – Recaptación de aquellos pacientes que no acuden a las citas de vacunación | |
| – Mejorar la accesibilidad a los puntos de vacunación: | |
| – Planificar programas de vacunación en lugares no tradicionales. | |
| – Flexibilidad de horarios y citas y eliminación de barreras burocráticas | |
| Hospitales | Vacunación antes del alta hospitalaria de los pacientes pertenecientes a grupos de alto riesgo o que han requerido hospitalización por problemas relacionados con un mayor riesgo de complicaciones al presentar gripe |
| Atención domiciliaria | – Administración de la vacuna en el domicilio de la población de riesgo |
| – Indicación de vacunación a los cuidadores y convivientes de estos pacientes | |
| Centros proveedores de servicios a población de riesgo | – Ofertar la vacunación a los individuos de riesgo desde antes del inicio de la temporada de gripe (colaboración intersectorial con los servicios sanitarios de centros sociales, recreativos, residencias, centros de hemodiálisis, centros para crónicos, etc., ya sean públicos o privados) |
| Personal sanitario | – Ofrecimiento de la vacunación en su puesto de trabajo (búsqueda activa) |
| – Realización de campañas de educación del personal sanitario acerca de los beneficios de la vacuna sobre su salud y la de los pacientes | |
No obstante, ninguna estrategia implantada obtendrá éxito si no existe un adecuado conocimiento del personal sanitario sobre los aspectos prácticos de la vacunación. Las contraindicaciones absolutas para la vacunación antigripal son muy escasas e infrecuentes en la práctica. El desconocimiento o la mala interpretación de las contraindicaciones reales de vacunación y el mantenimiento de las falsas contraindicaciones (existencia de enfermedad crónica, infección febril menor o diarrea moderada, toma de antimicrobianos, etc.) por gran parte de los profesionales sanitarios pueden retrasar o impedir la vacunación, dando lugar a oportunidades perdidas de vacunación y, por tanto, a la disminución de las coberturas vacunales, con el riesgo consiguiente para el individuo mal inmunizado y su comunidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.