La gripe es un importante problema de salud pública, particularmente en las personas susceptibles de presentar complicaciones asociadas, personas mayores, niños menores de 2 años, enfermos crónicos, inmunocomprometidos y embarazadas. Pero, además, la gripe tiene un gran impacto sanitario con un aumento de la demanda asistencial y un espectacular aumento de las visitas ambulatorias, sobrecargando los servicios de urgencias y hospitalarios. Durante los brotes epidémicos, las tasas de hospitalización de las personas mayores de 65 años son máximas y la mortalidad notificada por gripe en la temporada 2017/2018 ha sido de 960 defunciones. La vacunación antigripal estacional es el método con una mayor relación coste-efectividad de prevención primaria de la gripe, reduciendo las enfermedades respiratorias relacionadas, el número de visitas a las consultas médicas, el número de hospitalizaciones y muertes en personas de alto riesgo y el absentismo laboral en adultos. En los últimos años la gripe B ha recibido escasa atención en la literatura científica y, sin embargo, en períodos interepidémicos, la gripe B puede ser una de las principales causas de epidemias de gripe estacional, causando una considerable morbimortalidad y un aumento de costes. La vacuna tetravalente, a diferencia de la trivalente, obtiene una protección inmunológica frente al segundo linaje de la gripe B y, de acuerdo con una revisión crítica de la literatura científica, proporciona una protección más amplia sin afectar a la inmunogenicidad de las otras 3 cepas vacunales comunes a las vacunas trivalente y tetravalente. La vacuna tetravalente es coste-efectiva al disminuir el número de casos de gripe y siempre es una intervención rentable, con un importante ahorro de coste para el sistema de salud y para la sociedad, disminuyendo las tasas de hospitalización y de mortalidad asociadas a las complicaciones de la gripe.
Información suplementaria: Este artículo forma parte del suplemento titulado «Vacunación frente a la gripe estacional en las personas mayores. Evaluación de la vacuna tetravalente», patrocinado por Sanofi-Aventis, S.A.
Influenza is a significant health problem, particularly in those persons susceptible to having associated complications, older people, children less than 2 years, patients with chronic diseases, immunocompromised patients, and pregnant women. But influenza also has a large impact on the health system, with an increase in the healthcare demand and a spectacular increase in outpatient visits, overloading the emergency and hospital services. During epidemic outbreaks, the hospital admission rates of people over 65 years are at a maximum, and the mortality notified for the 2017/2018 influenza season was 960 deaths. The seasonal anti-influenza vaccine is the method with a better cost-effective ratio of primary prevention of influenza, reducing associated respiratory diseases, the number of hospital admissions, and deaths in high risk individuals, as well as work absenteeism in adults. In the last few years, influenza B has received little attention in the scientific literature, although in the periods between epidemics influenza B can be one of the main causes of seasonal epidemics, causing considerable morbidity and mortality and an increase in costs. The quadrivalent vaccine has a second-line immunological protection against influenza B, and according to a critical review of the scientific literature, it provides wider protection without affecting immunogenicity of the other three vaccine strains common to the trivalent and tetravalent vaccine. The quadrivalent vaccine is cost-effective in reducing the number of influenza cases, and is always a worthwhile intervention, with a significant cost saving for the health system and for society, by reducing the hospital admission rates and mortality associated with the complications of influenza.
Supplement information: This article is part of a supplement entitled ‘Seasonal flu vaccination for older people: Evaluation of the quadrivalent vaccine’ which is sponsored by Sanofi-Aventis, S.A.
Las epidemias de gripe estacionales presentan una tasa de ataque anual que oscila entre el 5-10% en adultos y entre el 20-30% en niños, pudiendo llegar hasta el 50% en comunidades cerradas1.
En España, según el Sistema de Vigilancia de la Gripe (Instituto de Salud Carlos III), durante las últimas 8 temporadas analizadas se han alcanzado tasas anuales de incidencia acumulada que oscilan entre los 2.781,24 casos/100.000 habitantes (temporada 2009-2010) y los 1.649,96 casos/100.000 habitantes (temporada 2016-2017). En la última temporada analizada (2016-17), la tasa de incidencia acumulada de gripe en la población mayor de 64 años fue de 942,10 casos/100.000 habitantes2.
TrascendenciaLa carga de la enfermedad mide el impacto de un problema de salud, por lo que, desde una perspectiva de salud pública, es un factor importante para establecer prioridades.
La gripe es un importante problema de salud pública, particularmente en las personas más susceptibles de presentar complicaciones asociadas a la gripe (personas mayores, niños menores de 2 años, enfermos crónicos, inmunocomprometidos y embarazadas), en quienes la carga sanitaria (morbimortalidad), social y económica (incremento en los costes directos e indirectos por consultas médicas, ingresos hospitalarios, días de pérdida de productividad, años de vida perdidos, etc.) es muy significativa3.
El estudio BCoDE4(Burden of Communicable Diseases in Europe) del European Centre for Disease Prevention and Control (ECDC) que estima el impacto de 30 enfermedades infecciosas en Europa sitúa a la gripe en primer lugar con 81,8 años de vida ajustados por discapacidad (AVAD)/100.000 habitantes (IC 95%: 76,9-86,5).
- a)
Morbilidad. Las tasas de hospitalización asociadas con la gripe son máximas en el grupo etario por encima de 65 años, seguido por el grupo de 50-64 años, donde la prevalencia de personas con factores de riesgo es ya muy elevada (en torno al 40%), lo que explica el incremento en las hospitalizaciones5.
En España, desde el inicio de la temporada 2017-2018 y hasta la semana epidemiológica 20 (14-20 de mayo) de 2018, se han notificado 5.863 casos graves hospitalizados confirmados de gripe (CGHCG) en 17 comunidades autónomas. En 3.213 de los pacientes (55%) se identificó el virus B; en 2.648 (44,9%), el virus A, y en 2 casos, el C (0,1%). De los virus tipo A subtipados (1.082), 678 (63%) son A/H3N2 y 404 (37%) son A/H1N1. El mayor número de CGHCG se registra en el grupo de 64 años (66%), seguido del grupo de 45 a 64 años (20%). El 88% de los pacientes con información disponible presentaban factores de riesgo de complicaciones de gripe. En los adultos, los factores de riesgo más prevalentes son la enfermedad cardiovascular crónica (45%), la diabetes (31%) y la enfermedad pulmonar crónica (30%). El 73% de los pacientes desarrollaron neumonía y 1.258 casos ingresaron en UCI (22% de los que se disponía de información). De los 4.497 pacientes pertenecientes a grupos recomendados de vacunación, el 53% no habían recibido la vacuna antigripal de esta temporada6.
- b)
Mortalidad. El estudio Global Seasonal Influenza-associated Mortality Collaborator Network, que analizó datos de 47 países entre 1999-2015, estima que a nivel mundial ocurren anualmente entre 291.243 y 645.832 muertes asociadas con la gripe estacional (4-8,8/100.000 individuos), siendo las personas de 75 años o más quienes presentaron las tasas de mortalidad más altas (51,3-99,4/100.000 individuos)7.
La media estimada anual de exceso de mortalidad asociada a la gripe fue de 0,1 a 6,4/100.000 individuos en menores de 65 años; de 2,9 a 44/100.000 en entre 65 y 74 años, y de 17,9 a 223,5/100.000 en mayores de 75 años. Los Centros para el Control y la Prevención de Enfermedades (CDC) han estimado que la mortalidad asociada a la gripe podría ser 15 veces mayor que la registrada. La mortalidad se produce, sobre todo, por complicaciones bacterianas (principalmente neumocócicas) y por descompensaciones de la enfermedad de base8.
En España, desde el inicio de la temporada 2017-18 y hasta la semana 20 (14-20 de mayo) de 2018, se han notificado 961 defunciones en 16 comunidades autónomas; el 52%, en hombres. De ellas, 572 (60%) están asociadas a virus B y 387 (40%) a virus A (196 A no subtipado, 134 A/H3N2 y 59 A/H1N1). La mediana de edad era de 82 años (rango: 71-88 años). El 84% de los casos eran mayores de 64 años y el 13% pertenecía al grupo de 45-64 años. El 98% presentaba factores de riesgo. El 53% de los casos desarrolló una neumonía y el 29% había ingresado en UCI. De los 838 casos pertenecientes a grupos recomendados de vacunación, el 48% no había sido vacunado. Durante la temporada 2017-18, el Sistema de Monitorización de la Mortalidad diaria (MoMo) en España identificó un exceso de mortalidad desde la semana 52/2017 hasta la semana 8/2018, con un máximo en la semana 1/2018. El exceso se concentró fundamentalmente en los mayores de 64 años, y coincidió tanto con la fase de ascenso de la epidemia gripal como con una ola de frío registrada en España durante esas semanas2.
- c)
Coste. El coste total estimado directo e indirecto de una epidemia de gripe en países desarrollados puede llegar a ser de 56,7 millones de euros por millón de personas. En 2005, para el total de los 25 países de la Unión Europea, el coste de las visitas por gripe a médicos de atención primaria se estimó en 267,2 millones de euros y el coste de la atención hospitalaria, en 11.500 millones de euros9. En el año 2006, el coste directo de la gripe en España se estimó en 986 millones de dólares y el coste indirecto, en 550 millones de dólares10.
Estudios realizados en Estados Unidos, Francia y Alemania han estimado que los costes indirectos pueden ser 5-10 veces más altos que los directos y oscilan entre 10 y 15.000 millones de dólares por año. En Europa, la gripe es responsable de aproximadamente el 10% de las bajas laborales. En promedio, cada caso de gripe originaría entre 1,30 y 4,9 días de absentismo laboral11.
Evolución antigénica y circulación global del virus influenzaLos virus influenza pertenecen a la familia Ortomyxoviridae virus con ARN monocatenario segmentado y espículas de hemaglutinina y neuraminidasa que incluye géneros de virus de animales y humanos12.
Se dividen en 3 tipos: A, B y C. La gran mayoría de la enfermedad humana es causada por los tipos A y B, que son genéticamente y estructuralmente similares, pero difieren en biología, marco evolutivo y epidemiológico13.
Variantes antigénicas mayores y menoresLos virus de la gripe mantienen su virulencia en la población humana gracias a su poder de evolución y su extraordinaria variabilidad antigénica en forma de variantes mayores y menores14,15.
- a)
Variantes mayores o saltos antigénicos: solo ocurren en los virus de la gripe A y son responsables de la gripe pandémica. Estas variaciones se deben a la emergencia en la población de un subtipo nuevo de virus de la gripe A con un tipo nuevo y distinto de hemaglutinina al difundido hasta entonces entre la población, frente al cual no hay inmunidad. Pueden producirse por reordenamiento genético entre 2 cepas de subtipos diferentes que infectan a un mismo huésped o mediante el salto de especie desde un huésped animal al hombre. Si el nuevo subtipo es capaz de infectar y transmitirse entre humanos de manera mantenida, eficaz y constante, origina una pandemia. El subtipo A emergente resultante de la pandemia puede reemplazar o cocircular con menos frecuencia con el subtipo A anterior5,16.
- b)
Variantes menores o cambios antigénicos (deriva antigénica): ocurren en todos los tipos/subtipos de virus de la gripe, aunque con patrones específicos según el tipo/subtipo. Consiste en la acumulación de mutaciones puntuales en determinadas regiones antigénicas de las glucoproteínas de superficie. Las mutaciones ocurren como consecuencia de errores de la RNA-polimerasa viral y la presión inmune permite seleccionar aquellos virus que escapan a los anticuerpos neutralizantes, inducidos por infecciones previas o por la vacunación. En los períodos interpandémicos cada variante antigénica reemplaza a su predecesora, de tal forma que la cocirculación de diferentes variantes de un determinado subtipo ocurre durante períodos relativamente cortos17,18.
Las cepas del virus influenza A infectan a humanos y miles de otros mamíferos y, por lo tanto, son susceptibles de presentar variantes mayores.
El tipo A incluye distintos subtipos que responden a las combinaciones de los 17 tipos de hemaglutinina y los 10 tipos de neuraminidasa descubiertos (H1N1, H2N2, H3N2, H5N1, H7N1, etc.). El subtipo A/H3N2 experimenta cambios antigénicos con más frecuencia que el A/H1N15.
Desde el descubrimiento de los virus de la gripe A en 1933, solo 3 subtipos (H1N1, H2N2 y H3N2) han tenido una circulación sostenida y constante en población humana, ocasionando pandemias que coincidían con su emergencia (fig. 1)19. Los virus H1N1 responsables de la pandemia de la gripe española de 1918 eran de origen fundamentalmente aviar. La pandemia de gripe asiática por el subtipo H2N2 se produjo en 1957 por un recombinante aviar y tuvo un período muy breve de estacionalización, ya que en 1968 fue sustituido por el subtipo H3N2, responsable de la gripe de Hong Kong, originado también por reordenamiento genético con genes de la HA de origen aviar. Sus variantes menores continúan actualmente circulando y causando epidemias anuales. En 1977 apareció en la antigua Unión Soviética un subtipo H1N1 (A/USSR/90/77) no pandémico con genes distintos al de la pandemia de 1918. Este virus cocirculó en las epidemias estacionales con las variantes menores del subtipo H3N2 de 1968. La aparición en 2009 del virus pandémico de origen porcino H1N1, responsable de pandemia de gripe A, eliminó por completo la circulación humana de aquel subtipo H1N1 ruso20-22.
Evolución del virus influenza y del desarrollo de vacunas frente a la gripe.
Fuente: adaptado de Ray et al.19.
Los virus influenza B causan epidemias estacionales cada 2-4 años. Aunque ocasionalmente pueden infectar a las focas, no tienen un reservorio en especies animales por lo que no presentan variantes mayores23.
Al igual que los virus A, nuevas cepas variantes B emergen continuamente debido a la deriva antigénica, pero se caracterizan por una velocidad de mutación más lenta que los virus A/H3N2, como lo demuestra una tasa más baja de sustitución de nucleótidos: de 0,14×10−3 a 3,32×10−3 sustituciones/sitio/año para influenza B frente a 2,68×10−3 a 12,50×10−3 para influenza A/H3N223,24.
Los virus de la influenza B han evolucionado en 2 linajes antigénicamente distintos basados en la divergencia en HA1 dominio del gen de la hemaglutinina viral y designados como Victoria (B/Victoria/2/87) y Yamagata (B/Yamagata/16/88). Estos 2 linajes han circulado globalmente desde 1985 y han cocirculado desde 2001 en la población humana (fig. 1)19,22.
- ∘
Hasta 1985, un único linaje de influenza B estaba presente en todo el mundo, que fue el precursor del linaje de Yamagata23,25,26.
- ∘
En 1975, el linaje Victoria se había desarrollado en China a partir de un linaje menor de virus B, aunque no estuvo aislado fuera del país hasta 198523,27.
- ∘
Tras la detección mundial de cepas de tipo Victoria en 1985, el linaje Victoria dominó la circulación mundial desde 1987 hasta 1989, seguido por el dominio de Yamagata en la década de 1990 y el subsecuente resurgimiento del linaje Victoria en 2001-200228,29.
- ∘
Desde entonces los datos de vigilancia epidemiológica muestran una cocirculación generalizada de estos 2 linajes B dentro de la misma temporada de influenza, con una incidencia relativa de cada subtipo y linaje que varía ampliamente según la estación y la región geográfica, de modo que la carga anual de la gripe difiere impredeciblemente de un año a otro, variando potencialmente de un grupo de edad a otro, y de un área geográfica a otra30.
- ∘
El patrón de predominio variable de los 2 linajes B probablemente esté determinado por la inmunidad específica frente a linaje B en la población, con un linaje que predomina hasta que la inmunidad acumulada frente a ese linaje resulta en una mayor susceptibilidad relativa frente al otro linaje y en una mayor diseminación del mismo23.
La vacunación antigripal anual es la estrategia más efectiva para prevenir la aparición de la enfermedad y limitar su difusión entre colectivos con riesgo de complicaciones.
En España, fue introducida a principios de la década de los 80. Las autoridades sanitarias la recomiendan especialmente en aquellas personas que tienen un mayor riesgo de presentar complicaciones. Además, también se recomienda a personas que pueden transmitir la enfermedad a otras con alto riesgo de complicaciones y aquellas que, por su ocupación, proporcionan servicios esenciales a la comunidad31.
El Ministerio de Sanidad recomienda la vacunación sistemática a partir de los 65 años, aunque varias comunidades autónomas ya han implantado la vacunación sistemática a partir de los 60 años al recomendarse un adelanto progresivo de la edad de vacunación sistemática, comenzando por el grupo de edad de 60-64 años, para llegar en unos años a vacunar a todos los adultos de 50-64 años (quienes presentan una prevalencia de enfermedades crónicas de base del 40%)32,33.
En España, en personas de 65 o más años, la cobertura de vacunación antigripal en la temporada 2016-2017 ha sido del 55,5%, una cifra inferior a la de la anterior campaña (56,1%), que confirma la tendencia descendente desde la temporada 2009-2010, en la cual se alcanzó un 65,7% de cobertura y lejos de la temporada 2005-2006, en que se alcanzó un 70,1%2. Estos datos están muy por debajo del 75% establecido por la Organización Mundial de la Salud (OMS).
Durante la temporada 2017-18, hasta la semana 20 (14-20 de mayo) de 20186, el 53% de los casos graves hospitalizados con gripe confirmada por laboratorio, susceptibles de ser vacunados, no habían recibido la vacuna antigripal de la temporada. Esta cifra es superior a la temporada 2016-2017 (48%) e inferior a la temporada 2015-16 (65%)2. Debido a la magnitud y trascendencia de la gripe y sus complicaciones descritas en el apartado anterior de «Magnitud y trascendencia de la gripe estacional», es fundamental la concienciación de la población y de los profesionales sanitarios sobre los beneficios de la vacunación para mejorar las coberturas vacunales, en especial entre el personal de servicios sanitarios (cobertura en España en torno al 30%)34.
La vacunación frente a la gripe está asociada con una reducción de las enfermedades respiratorias relacionadas, del número de visitas a las consultas médicas, del número de hospitalizaciones y muertes en personas de alto riesgo, y de absentismo laboral en adultos35,36.
La efectividad vacunal global se estima en el 65% (35-85%), variando según el grupo de edad. La vacuna antigripal ofrece una protección del 30-74% en jóvenes y adultos sanos y del 42-72% en los mayores de 59 años, dependiendo de las temporadas y de la concordancia entre cepas vacunales y circulantes37,38. Esta reducción de la respuesta inmune en los adultos mayores se debe principalmente a la inmunosenescencia39,40.
Adaptación a la epidemiología del virus influenza B: nueva estrategia de vacunaciónUno de los aspectos fundamentales, no directamente relacionados con la vacuna, que influyen sobre la efectividad vacunal, está en relación con el virus: su transmisibilidad, su virulencia y su comportamiento epidemiológico. Por ello desde el desarrollo de las primeras vacunas monovalentes frente a la gripe A/H1N1 hace más de 75 años, las vacunas antigripales siempre han requerido adaptación en respuesta a cambios para proporcionar protección contra los virus de influenza circulantes predominantes22,41,42 (fig. 1):
- ∘
Tras el aislamiento de la gripe B por primera vez en 1940, se desarrollaron vacunas bivalentes (A/H1N1, B) que se utilizaron desde 1944 en personal militar y desde 1945 ampliamente en población civil. La vacuna contra el subtipo de influenza A se modificó en 1958 y en 1969 en respuesta a los cambios de la gripe A que desencadenaron pandemias graves.
- ∘
Las vacunas trivalentes estacionales de influenza que contienen 2 virus tipo A de influenza y un virus B se produjeron por primera vez en 1978, después de la reaparición y la cocirculación de A/H1N1 con virus A/H3N2. Desde entonces, la vacuna trivalente que incluye 2 subtipos de influenza A (A/H1N1 y A/H3N2) y solo un linaje de influenza B (B/Victoria o B/Yamagata) ha sido la principal estrategia de prevención frente a la gripe estacional.
Las razones epidemiológicas descritas en el apartado anterior de «Evolución antigénica y circulación global del virus influenza» plantearon que las vacunas trivalentes frente a la gripe estacional podrían mejorar su protección mediante la inclusión de ambos linajes B42-46. Estas razones B deben considerarse igual de válidas que las que determinaron en 1977 el paso de la vacuna bivalente frente a la gripe (A/H3N2 y B) a la nueva vacuna trivalente (A/H3N2, A/H1N1 y B), al comprobar la falta de protección cruzada entre los 2 subtipos de la gripe A22.
En consecuencia, en 2007, en los Estados Unidos la FDA47 propuso agregar una segunda cepa de linaje B a las vacunas frente a la gripe, y la OMS, en febrero de 201248, para la temporada 2012-2013 en el hemisferio norte, realizó la recomendación de introducir una nueva cepa gripal B del linaje alternativo y convertir la vacuna antigripal trivalente en una de tipo tetravalente, lo que suponía una nueva era en la estrategia de vacunación antigripal.
Estados Unidos fue el primer país en autorizar y disponer para la temporada 2013-14 de vacunas tetravalentes frente a la gripe49, y desde entonces muchos países incluyen las vacunas tetravalentes en sus recomendaciones y programas de vacunación antigripal: Hong Kong (2013)50, Alemania (2013)51, Reino Unido (2013)52, Canadá (2014)53, Italia (2014)54, Francia (2014)55, Brasil (2014)56, Australia (2015)57, Bélgica (2015)58, Países Bajos (2009)59,60.
En España, en 2014, estuvo disponible la primera vacuna tetravalente inactivada.
ObjetivoMediante una revisión crítica de la evidencia disponible en la literatura, los objetivos de este informe son:
- •
Analizar las razones que justifican mejorar la protección de la vacuna trivalente convencional (sin adyuvantes ni aumento de la dosis de antígeno) mediante una nueva estrategia de vacunación que incluya ambos linajes de tipo B.
- •
Evaluar la inmunogenicidad, reactogenicidad y el impacto económico-sanitario de la vacuna tetravalente (inactivada de virus fraccionados) en el adulto respecto a la vacuna trivalente convencional.
Ello contribuirá a la toma racional de decisiones entre estrategias alternativas de inmunización, como la de utilizar una determinada vacuna en las campañas de inmunización antigripal.
Necesidad de utilizar vacunas tetravalentesLa gripe B representa una proporción significativa de la carga general de la gripeGran parte de la literatura científica publicada sobre la epidemiología de la gripe se había centrado exclusivamente en la gripe A, cuyos subtipos han sido responsables de las pandemias30.
Por el contrario, la gripe B, en comparación con la gripe A, ha recibido escasa atención de la literatura científica, por lo que existe una limitada evidencia sobre la epidemiología global y sobre la carga de la gripe B, especialmente fuera de Europa y Estados Unidos31.
Sin embargo, durante períodos interpandémicos, la gripe B puede representar una proporción considerable del total de casos y ser una de las principales causas de epidemias de gripe estacional cada 2-4 años, causando una considerable morbimortalidad y aumento de costes30.
Magnitud de la gripe BLa proporción de casos de gripe B sobre el total de casos de gripe varía cada temporada y en cada área geográfica30,43,44.
Varios estudios han informado sobre la frecuencia de la gripe B en una sola temporada, o durante temporadas consecutivas en un solo país:
- -
En Estados Unidos, durante las temporadas de 1976-77 a 1998-99 y de 2001-2002 a 2010-2011 (excluida la pandemia 2009-2010), la gripe B supuso un 25% de las pruebas de laboratorio positivas (rango: 0,1-85,9%)44.
- -
Europa, durante las mismas temporadas, presentó datos similares, con un promedio del 23% (rango: 1-60%)30,46,60-63. A continuación se especifica la proporción de casos de gripe B indicada en algunos estudios:
- ∘
Holanda (1992 a 2007): 0-82% (promedio del 29%).
- ∘
Reino Unido (1999 a 2013): 2-65%.
- ∘
Alemania (2000-2013): 0-70%.
- ∘
España (2005-2013): 1,4-80,4%.
- -
En Australia desde 2002 a 2011: la gripe B ocasionó el 0,8-63,3% de los casos46.
- -
En la región Asia-Pacífico desde 1995-2010: la proporción de casos de gripe B fue muy diferente en Taiwán (6,4-62,9%) y en Corea (0-16,4%)30.
Pero existen pocos estudios que hayan analizado la epidemiología global de la gripe B. Un estudio realizó un análisis global pero limitándose a las regiones templadas de ambos hemisferios64. Sin embargo, es muy importante evaluar la epidemiología de la gripe en los trópicos, ya que es donde vive aproximadamente el 40% de la población mundial y la gripe presenta una actividad bastante diferente de otras regiones del mundo (los países de los trópicos pueden experimentar 2 picos anuales, y las epidemias no son tan cortas e intensas como en los hemisferios norte y sur)65. Estas diferencias pueden tener implicaciones importantes en la toma de decisiones efectivas y basadas en la evidencia sobre la composición y el período de administración de las vacunas antigripales66,67.
Por ello, el Global Influenza B Study (GIBS)68 analizó la epidemiología de la gripe B en 26 países (5 del hemisferio sur, 7 del hemisferio norte y 14 del cinturón intertropical) incluyéndose en el análisis 935.673 casos de gripe durante las temporadas 2000-2013, en que la gripe B fue dominante o cocirculó (>20% de las detecciones totales). El porcentaje medio de gripe B fue de 22±6% (rango intercuartílico: 8,3- 37,7%) sin diferencias estadísticamente significativas a lo largo de las estaciones. La gripe B rara vez representó más del 50% de los casos de gripe (una vez cada 7 temporadas). Aunque las diferencias no fueron estadísticamente significativas, hay cierta evidencia de variabilidad geográfica en la ocurrencia de gripe B en todo el mundo, siendo más común en los trópicos (mediana del 24,3%) y menos común en el hemisferio sur (17,8%).
La incidencia específica de la edad de la gripe asociada con las cepas B es tan ampliamente variable de temporada en temporada como la incidencia de la influenza en sí misma. Pero aunque la gripe B causa enfermedad en todos los grupos de edad, su incidencia, en comparación con la gripe A, parece ser más alta entre los niños mayores y los adultos jóvenes69,70.
Como lo corrobora el Global Influenza B Study68, a nivel mundial, donde se halló una proporción significativa más alta de casos de gripe B en el grupo de edad de 5-17 años, y de gripe A en el grupo de edad de 18-64 años en países de los hemisferios sur y norte (excepto Sudáfrica, Brasil, Turquía y Ucrania) y en algunos países del cinturón intertropical (Madagascar, Indonesia, Singapur, Costa Rica, Nicaragua, Guatemala y Vietnam).
Diferentes artículos destacan que en algunas epidemias anuales una gran parte del impacto sanitario de la gripe B (complicaciones, hospitalización, exceso de mortalidad) ocurre en adultos mayores70-77.
En el Reino Unido, un estudio de modelización de la enfermedad respiratoria viral en pacientes hospitalizados objetivó que la carga de la enfermedad de la gripe B era 100 veces mayor en el grupo de mayores de 65 años que en el grupo de 18-64 años, mientras que para la gripe A el aumento correspondiente entre jóvenes y ancianos era aproximadamente solo 50 veces mayor78.
Trascendencia sanitaria de la gripe BClínicamente, la gripe B es indistinguible de la gripe causada por el tipo A, presentando la misma duración, clínica, gravedad, complicaciones e, incluso, tasas de hospitalización. Sin embargo, existe la convicción general de que el virus A es responsable de casos de gripe más graves que el virus B70,71,79-83.
La tasa de hospitalizaciones y algunas manifestaciones clínicas de la gripe, como la miositis y la leucopenia, parecen ser más frecuentes en los niños infectados con gripe B que con el tipo A74,83-87.
Los resultados obtenidos en estudios realizados en diferentes áreas geográficas muestran que la gripe B causa una proporción significativa del total de la carga de morbimortalidad de la gripe. Algunos de los estudios más representativos son:
- ∘
En Estados Unidos:
- •
De 1976 a 1999: el 16% de la mortalidad atribuible a la gripe fue asociada a la gripe B (menor porcentaje que por A/H3N2, pero más elevado que por A/H1N1)73.
- •
De 1997 a 2009: el 29% (1-95%) de la mortalidad atribuible a la gripe A fue asociada a la gripe B. En 4 de 12 estaciones, se alcanzó un 51-95% de mortalidad atribuible a la gripe B88,89.
- •
Desde 1979 a 2001: la tasa de hospitalización durante las temporadas predominantes por gripe B fue de 81,4/100.000, resultado que se acercó al observado en temporadas predominantes de A/H3N2 (99/100.000) y que fue superior al obtenido en las temporadas predominantes de A/H1N1 (55,9/100.000)90.
- •
De 2001 a 2011: la proporción de visitas al médico general por gripe B fue del 43% (en 5-17 años de edad), 50% (en <65 años) y 26% (en >65 años)91.
- ∘
En el Reino Unido:
- •
De 2001 a 2011: la proporción relativa de visitas de médicos de cabecera por gripe B fue del 24%92.
- •
De 1996 a 2008: 2.456 muertes atribuibles a gripe B/año en 5/12 temporadas de gripe B ≥40%93.
- ∘
En Hong Kong:
- •
De 2000 a 2010: el promedio anual de ingresos hospitalarios (todas las edades) por gripe B fue del 24% (rango: 10,5-33%)94.
- ∘
En Canadá:
- •
De 2010 a 2012: la gripe B causó un 7,7-54% de los ingresos hospitalarios por gripe95.
- •
De 2007 a 2009: del total de adultos ingresados en la UCI por gripe, un 37-45,7% era por gripe B96.
Debido a que las nuevas cepas variantes de cada tipo/subtipo evolucionan continuamente por la elevada capacidad del virus de la gripe de sufrir variaciones antigénicas, la composición de las vacunas debe revisarse cada año. Por ello es imprescindible una adecuada vigilancia virológica y epidemiológica que permita detectar y caracterizar precozmente los virus de la gripe circulantes y evaluar su capacidad de difusión en la población para asegurar la correspondencia entre los virus que tienen más probabilidades de circular en la próxima temporada y la cepa presente en la vacuna97,98.
- ∘
A nivel mundial: el Programa de Vigilancia de Gripe de la OMS recoge y analiza la información epidemiológica y virológica de los diferentes países y áreas del mundo proporcionada por la Red Mundial de Vigilancia de la Gripe (creada en 1952) para realizar las recomendaciones sobre la composición anual de la vacuna99. Este proceso se lleva cabo desde 1971, y en 1998 se aumentó su frecuencia de una a 2 veces por año, para proporcionar recomendaciones por separado para cada hemisferio100 (en febrero en el hemisferio norte y en septiembre en el hemisferio sur).
- ∘
Estas recomendaciones se emiten aproximadamente 9 meses antes de que la vacuna se administre a la población, para permitir disponer de suficiente tiempo para la fabricación y distribución de la vacuna. El Sistema Mundial de Vigilancia y Respuesta ante la Influenza (GISRS)101 de la OMS ha realizado importantes esfuerzos para mejorar este proceso de evaluación.
- ∘
En Europa: el Centro Europeo para el Control de Enfermedades (ECDC) coordina desde 2008 la Red de Vigilancia Europea de Gripe (European Influenza Surveillance Network [EISN]). La mayoría de los países europeos están integrados en la EISN aportando información epidemiológica y virológica útil para la vigilancia de la gripe estacional o pandémica en Europa. La EISN agrupa también a numerosos laboratorios integrados en la Red Europea de Laboratorios de Referencia para la Gripe Humana (ERLI-Net).
- ∘
En los Estados Unidos: las predicciones son hechas por el Comité Asesor de Vacunas y Productos Biológicos Relacionados (VRBPAC) de la FDA usando datos e información de vigilancia global de los Centros para el Control y la Prevención de Enfermedades (CDC).
- ∘
En España: El Sistema de Vigilancia de la Gripe en España (SVGE)98 engloba diferentes fuentes y sistemas de información, que ofrecen una visión amplia del comportamiento de la enfermedad y de los virus gripales circulantes en el conjunto del Estado español y en cada comunidad autónoma. El Sistema de Vigilancia de la Gripe en España está integrado en la EISN.
Sin embargo, a pesar de los Sistemas de Vigilancia y especialmente durante los últimos 15 años, la predicción de la cepa B predominante a incluir en la vacuna ha resultado muy dificil43,44,102 debido a las razones ya indicadas en el anterior apartado de «Trascendencia»:
- a)
La circulación del virus B es muy variable e impredecible incluso de una región geográfica a otra, por lo que cada año uno de los 2 linajes B puede prevalecer sobre el otro.
- b)
Además, los 2 linajes B pueden circulan conjuntamente en la misma temporada gripal.
- c)
Aunque los virus de la gripe B evolucionan con relativa lentitud, la inmunidad de la población puede provocar un cambio rápido en el linaje dominante B, incluso durante el tiempo entre la selección del virus vacunal y el inicio de la temporada de gripe.
La dificultad en la predicción ocasiona un nivel variable de similitud o diferencia entre la cepa B circulante y la cepa B incluida en las vacunas que se conoce como discordancia antigénica (mismatch), la cual es el principal responsable de la disminución de eficacia de la vacuna43,44, como se expondrá en el apartado posterior de «Disminución de la eficacia/efectividad de la vacuna trivalente».
Esta discordancia antigénica se ha referenciado en la literatura científica, como lo muestran los siguientes ejemplos:
- a)
A nivel mundial:
Los datos analizados (período 2000-2013) por el Global Influenza B Study70 en 26 países indican que la discordancia antigénica entre la cepa vacunal y el linaje circulante predominante se produjo en un 25% de las 79 temporadas en las que la gripe B representó ≥10% de los casos totales de gripe: 11 de 36 estaciones en el hemisferio norte (31%), 6 de 22 estaciones en el hemisferio sur (27%) y 2 de 21 estaciones en el cinturón intertropical (10%).
- b)
En España:
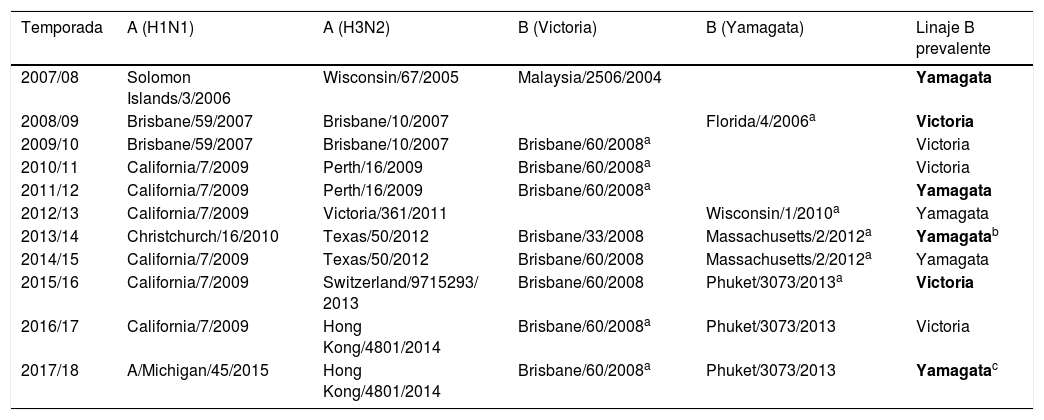
En 5 de las últimas 10 temporadas hasta 2016-2017 ha existido discordancia entre las cepas de gripe contenidas en la vacuna y las circulantes prevalentes61,103 (tabla 1). Existían informes preliminares de que en la temporada 2017/2018 también se ha producido discordancia104. Según el informe epidemiológico semanal (semana 20 de 2018: 14-20 de mayo) del Sistema de Vigilancia de la Gripe en España, en lo que respecta a virus B se han caracterizado 512 virus, 66 de ellos del linaje Victoria y 506 virus del linaje Yamagata. Once de los virus Victoria pertenecen al grupo B/Brisbane/60/2008 y, por lo tanto, son concordantes con el virus vacunal. Sin embargo, 55 de los 66 virus B del linaje Victoria (83%) presentan una deleción en los aminoácidos 162 y 163 de la hemaglutinina, principal característica de los virus del nuevo grupo representado por B/Norway/2409/2017. Según datos del Centro Colaborador de la OMS, este grupo de virus serían antigénicamente diferentes al resto de los virus del linaje Victoria, y por tanto, discordantes con la cepa vacunal de la temporada 2017-18105.
- c)
Otros países también han mostrado discordancia en un porcentaje importante de temporadas:
Composición recomendada por la OMS para las vacunas trivalente y tetravalente de los últimas 10 temporadas y cepa/linaje de B predominante en España en dicha temporada
| Temporada | A (H1N1) | A (H3N2) | B (Victoria) | B (Yamagata) | Linaje B prevalente |
|---|---|---|---|---|---|
| 2007/08 | Solomon Islands/3/2006 | Wisconsin/67/2005 | Malaysia/2506/2004 | Yamagata | |
| 2008/09 | Brisbane/59/2007 | Brisbane/10/2007 | Florida/4/2006a | Victoria | |
| 2009/10 | Brisbane/59/2007 | Brisbane/10/2007 | Brisbane/60/2008a | Victoria | |
| 2010/11 | California/7/2009 | Perth/16/2009 | Brisbane/60/2008a | Victoria | |
| 2011/12 | California/7/2009 | Perth/16/2009 | Brisbane/60/2008a | Yamagata | |
| 2012/13 | California/7/2009 | Victoria/361/2011 | Wisconsin/1/2010a | Yamagata | |
| 2013/14 | Christchurch/16/2010 | Texas/50/2012 | Brisbane/33/2008 | Massachusetts/2/2012a | Yamagatab |
| 2014/15 | California/7/2009 | Texas/50/2012 | Brisbane/60/2008 | Massachusetts/2/2012a | Yamagata |
| 2015/16 | California/7/2009 | Switzerland/9715293/ 2013 | Brisbane/60/2008 | Phuket/3073/2013a | Victoria |
| 2016/17 | California/7/2009 | Hong Kong/4801/2014 | Brisbane/60/2008a | Phuket/3073/2013 | Victoria |
| 2017/18 | A/Michigan/45/2015 | Hong Kong/4801/2014 | Brisbane/60/2008a | Phuket/3073/2013 | Yamagatac |
En negrita, la discordancia.
Estados Unidos (desde 1999-2000 a 2013-2014, 50%)106,107, Canadá (2001-2002 a 2012-2013, 50%)108, Australia (2001-2014, 33%)109, Europa (desde 2003-2004 hasta 2010-2011, 50%)43, Finlandia (1999-2012, 32,3%)110, Reino Unido (2001-2009, 50%)111, Brasil (2002-2013, 41,6%)68, Taiwán (2002-3 a 2011-2012, 50%)112, Hong Kong (2000-2010, 40%)113.
Limitada o ausente protección cruzada entre los 2 linajes BEl nivel de protección cruzada entre los 2 linajes B no es bien conocido, pero se estima que es limitado o ausente (la vacunación frente a uno de los linajes no comporta una protección adecuada frente al linaje heterólogo), debido a la gran diferencia antigénica entre los 2 linajes de influenza B. Además, con el tiempo, la distancia genética entre estas 2 líneas filogenéticas aumenta, lo que hace más y más aleatoria la posibilidad de inmunidad cruzada17,43,44.
Este hecho supone una gran limitación de las vacunas trivalentes convencionales siempre que el virus B circulante no coincida con el linaje elegido para la vacuna, ya sea porque la predicción del linaje era incorrecta o porque ambos linajes circulaban conjuntamente en un grado significativo.
La evidencia sobre la protección cruzada entre ambos linajes B aún no es bien conocida y además existe mucha variabilidad respecto a lo que se considera protección cruzada, lo que hace más difícil su estimación o predicción.
Existen estudios que han objetivado una reactividad cruzada significativa entre los 2 linajes B con la vacuna trivalente. Sin embargo, las variaciones en la reactividad cruzada, además de por la variabilidad antigénica de las cepas, puede explicarse por una inmunidad preexistente (por una vacunación o una infección natural previas)114-118.
Disminución de la eficacia/efectividad de la vacuna trivalenteLa consecuencia de lo expuesto en los apartados anteriores es que la eficacia/efectividad de la vacuna trivalente convencional puede verse afectada (reducción de la inmunogenicidad frente a las cepas circulantes) siempre que el linaje B circulante no coincida con el elegido para la vacuna (por una predicción incorrecta o porque ambos linajes circulaban conjuntamente en un grado significativo) debido a la limitada o ausente reactividad cruzada.
Como demuestra la literatura, el alcance de la protección cruzada puede variar, pero, en general, las diferencias entre la vacuna y los linajes circulantes dominantes deben evitarse por el riesgo de protección subóptima. Como ejemplos de esta disminución de la eficacia/ efectividad se reseñan los siguientes estudios:
- ∘
En Taiwán (2011-2012), la eficacia fue −66% (IC 95%: −132 a −18%) para la gripe B cuando la vacuna trivalente contenía una cepa de linaje B/Victoria, mientras que la predominante era una cepa B/Yamagata112.
- ∘
En Estados Unidos (2000-2010) hubo una reducción de la eficacia en las 6 temporadas en las que existió discordancia119,120.
- ∘
Dos metaanálisis de ensayos controlados aleatorizados encontraron que la eficacia relativa de las vacunas trivalentes frente a la gripe B confirmada por laboratorio es menor cuando la vacuna y las cepas de linaje B circulantes dominantes difieren (71% frente a 49% para adultos no ancianos116) y 77% (IC 95%: 18-94%) frente a 52% (IC 95%: 19-72%) en población general117.
También se han referido en la literatura resultados contradictorios:
- ∘
En 2015-2016, en Dinamarca la eficacia no fue significativa frente a la gripe B, cuando el linaje dominante circulante era Victoria, pero el de la vacuna era Yamagata (discordancia del 88%)121. Sin embargo, en el Reino Unido, durante la misma temporada, la eficacia sí fue significativa122.
- ∘
En 2011-2012, en Estados Unidos, la eficacia frente a la cepa B no incluida en la vacuna fue significativa e incluso superior que la cepa vacunal123, mientras que en Canadá fue significativa frente a la cepa B vacunal, pero no lo fue frente a la cepa B no incluida en la vacuna124.
- ∘
En 2012-2013, tanto en los Estados Unidos125 como en Canadá126, la eficacia fue similar y significativa frente a las cepas B vacunal y no vacunal.
Es necesario subrayar que una disminución de la efectividad de la vacuna antigripal para prevenir la infección confirmada de gripe puede tener un elevado impacto en salud pública, sobre todo en los grupos de riesgo, de presentar complicaciones asociadas a la gripe. Las consecuencias de ese impacto dependen, además de las respuestas de reactividad cruzada inducidas por la vacunación, de otros factores, como la virulencia de la cepa, la dinámica de la transmisión y la experiencia previa de la población con la cepa de deriva61,68,127.
Inmunogenicidad y seguridad de las vacunas tetravalentes inactivadas (virus fraccionados)InmunogenicidadLa inmunogenicidad indica la respuesta inmune que se produce tras la administración de un antígeno. Los estudios de inmunogenicidad son necesarios para la autorización de una vacuna y deben proporcionar información cualitativa y cuantitativa de la respuesta inmune (humoral y mediada por células) de acuerdo con las propiedades específicas de esa vacuna128.
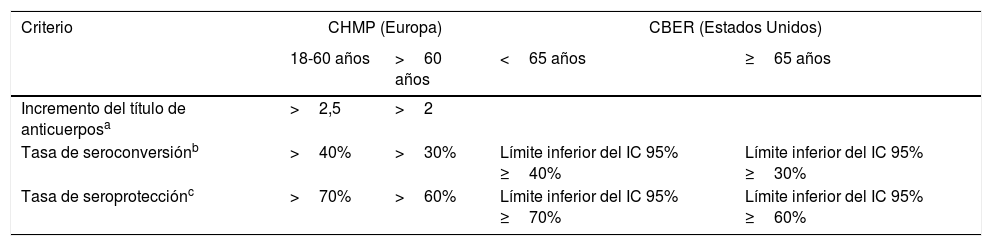
Criterios de inmunogenicidadLa evaluación de la inmunogenicidad de la vacunación antigripal se realiza mediante ensayos clínicos que miden la respuesta inmune frente a las cepas vacunales, para comprobar si se cumplen los requerimientos del Committee for Medicinal Products for Human Use (CHMP) en Europa129 o del Center for Biologics Evaluation and Research (CBER) en Estados Unidos130 indicados en la tabla 2. En adultos, con el método de inhibición de la hemaglutinación (IH), debe cumplirse al menos uno de los criterios para cada cepa vacunal.
Criterios de inmunogenicidad para vacunas antigripales. CHMP y CBER
| Criterio | CHMP (Europa) | CBER (Estados Unidos) | ||
|---|---|---|---|---|
| 18-60 años | >60 años | <65 años | ≥65 años | |
| Incremento del título de anticuerposa | >2,5 | >2 | ||
| Tasa de seroconversiónb | >40% | >30% | Límite inferior del IC 95% ≥40% | Límite inferior del IC 95% ≥30% |
| Tasa de seroprotecciónc | >70% | >60% | Límite inferior del IC 95% ≥70% | Límite inferior del IC 95% ≥60% |
CBER: Center for Biologics Evaluation and Research; CHMP: Committee for Medicinal Products for Human Use; IC: intervalo de confianza; IH: inhibición de la hemaglutinación.
GMT ratio: cociente de la media geométrica del título individual (títulos de anticuerpos pos/prevacunación).
El CBER ha establecido los criterios de no inferioridad en la inmunogenicidad de una nueva vacuna (tetravalente) frente a la que se compara (trivalente):
- a.
Límite superior del IC 95% de GMT ratio (trivalente/tetravalente) ≤1,5, y
- b.
Diferencia en la tasa de seroconversión (trivalente- tetravalente): límite superior del IC 95% ≤10%.
Aunque no se ha establecido una correlación entre los niveles específicos del título de anticuerpos de IH tras la vacunación con las vacunas antigripales inactivadas y la protección frente a la enfermedad gripal, se han utilizado los títulos de anticuerpos de IH como una medida de la actividad vacunal. En general se ha aceptado que la tasa de seroprotección se correlaciona con una eficacia o protección clínica (reducción del riesgo) del 50% frente a la infección por gripe en población susceptible131,132. Esta asociación estadísticamente significativa entre el título de anticuerpos de IH y la protección clínica frente a la gripe A o B se comprobó mediante un metaanálisis133 (que incluye 15 estudios) publicado en 2010, así como en posteriores modelos predictivos134,135.
Pero en la actualidad, la evidencia demuestra que sigue existiendo la necesidad de una mejor validación de la correlación de protección clínica frente a la gripe ya que esta potencialmente puede variar según las características individuales y poblacionales, los grupos específicos de edad y los tipos de vacunas, por lo que durante los estudios de eficacia se deberían investigar estos parámetros al menos en subconjuntos de población136.
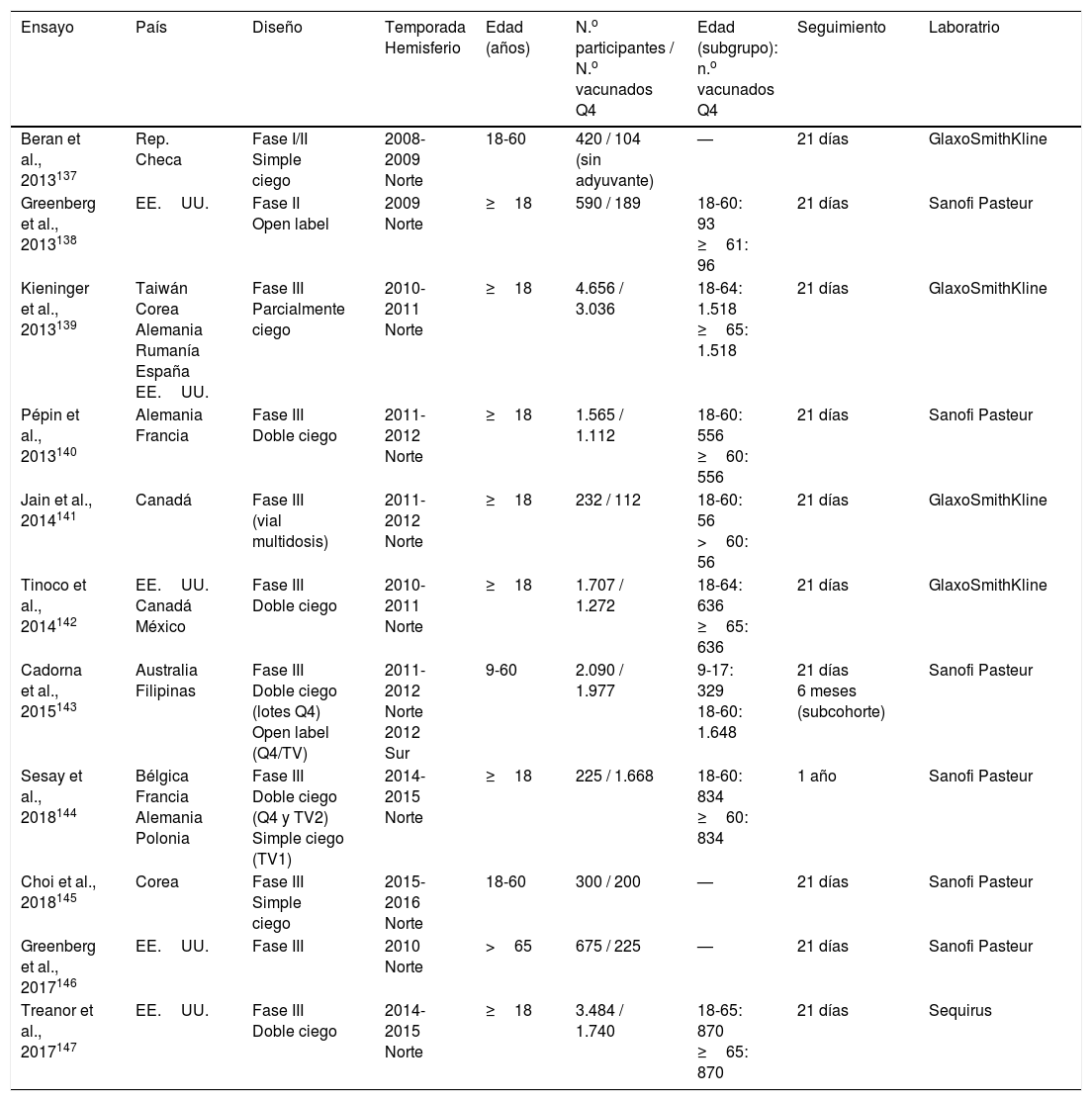
Resultados de los estudios sobre inmunogenicidadLos diferentes ensayos clínicos de fases I/II137,138 y de fase III139-147 (tabla 3) realizados en adultos concluyen que:
- -
La vacuna inactivada tetravalente (virus fraccionados) cumplió con los criterios del CHMP129 y CBER130 para las 4 cepas vacunales demostrando, respecto a la vacuna trivalente y en todos los grupos de edad, un nivel de inmunogenicidad (seroprotección y seroconversión) comparable o superior (significación estadística) para las 3 cepas compartidas y un nivel de inmunogenicidad superior frente a la cepa B adicional no incluida en la vacuna trivalente.
- -
Por ello, en comparación con la vacuna trivalente, la inclusión de una segunda cepa adicional del linaje B proporciona una protección más amplia frente a la cepa B sin afectar a la inmunogenicidad de las otras 3 cepas vacunales comunes a ambas vacunas.
Estudios de inmunogenicidad y reactogenicidad de las vacunas antigripales inactivadas (virus fraccionados) tetravalentes
| Ensayo | País | Diseño | Temporada Hemisferio | Edad (años) | N.o participantes / N.o vacunados Q4 | Edad (subgrupo): n.o vacunados Q4 | Seguimiento | Laboratrio |
|---|---|---|---|---|---|---|---|---|
| Beran et al., 2013137 | Rep. Checa | Fase I/II Simple ciego | 2008-2009 Norte | 18-60 | 420 / 104 (sin adyuvante) | — | 21 días | GlaxoSmithKline |
| Greenberg et al., 2013138 | EE.UU. | Fase II Open label | 2009 Norte | ≥18 | 590 / 189 | 18-60: 93 ≥61: 96 | 21 días | Sanofi Pasteur |
| Kieninger et al., 2013139 | Taiwán Corea Alemania Rumanía España EE.UU. | Fase III Parcialmente ciego | 2010-2011 Norte | ≥18 | 4.656 / 3.036 | 18-64: 1.518 ≥65: 1.518 | 21 días | GlaxoSmithKline |
| Pépin et al., 2013140 | Alemania Francia | Fase III Doble ciego | 2011-2012 Norte | ≥18 | 1.565 / 1.112 | 18-60: 556 ≥60: 556 | 21 días | Sanofi Pasteur |
| Jain et al., 2014141 | Canadá | Fase III (vial multidosis) | 2011-2012 Norte | ≥18 | 232 / 112 | 18-60: 56 >60: 56 | 21 días | GlaxoSmithKline |
| Tinoco et al., 2014142 | EE.UU. Canadá México | Fase III Doble ciego | 2010-2011 Norte | ≥18 | 1.707 / 1.272 | 18-64: 636 ≥65: 636 | 21 días | GlaxoSmithKline |
| Cadorna et al., 2015143 | Australia Filipinas | Fase III Doble ciego (lotes Q4) Open label (Q4/TV) | 2011-2012 Norte 2012 Sur | 9-60 | 2.090 / 1.977 | 9-17: 329 18-60: 1.648 | 21 días 6 meses (subcohorte) | Sanofi Pasteur |
| Sesay et al., 2018144 | Bélgica Francia Alemania Polonia | Fase III Doble ciego (Q4 y TV2) Simple ciego (TV1) | 2014-2015 Norte | ≥18 | 225 / 1.668 | 18-60: 834 ≥60: 834 | 1 año | Sanofi Pasteur |
| Choi et al., 2018145 | Corea | Fase III Simple ciego | 2015-2016 Norte | 18-60 | 300 / 200 | — | 21 días | Sanofi Pasteur |
| Greenberg et al., 2017146 | EE.UU. | Fase III | 2010 Norte | >65 | 675 / 225 | — | 21 días | Sanofi Pasteur |
| Treanor et al., 2017147 | EE.UU. | Fase III Doble ciego | 2014-2015 Norte | ≥18 | 3.484 / 1.740 | 18-65: 870 ≥65: 870 | 21 días | Sequirus |
Q4: vacuna tetravalente.
Es preciso tener en cuenta las siguientes consideraciones148-154:
- -
Los resultados obtenidos se refieren solo a estudios que han utilizado vacunas trivalentes no adyuvadas o sin altas dosis de antígeno y vacunas tetravalentes inactivadas de virus fraccionados, por lo que dichos resultados no pueden aplicarse a otras formulaciones de vacunas.
- -
Aunque la no inferioridad en la inmunogenicidad fue significativa en todos los grupos de edad, en varios estudios las personas mayores mostraron una menor respuesta que los adultos más jóvenes138-140,142,147. Este resultado se atribuye a la disminución de la capacidad de respuesta del sistema inmunitario relacionado con la edad (inmunosenescencia)155,156.
- -
Un estudio pivotal144 evaluó la respuesta en sujetos que presentaban condiciones clínicas crónicas de elevado riesgo para desarrollar complicaciones por gripe obteniéndose una buena protección frente a las 4 cepas, por lo que la inmunogenicidad de la vacuna tetravalente no se vio afectada por la presencia de dichas condiciones clínicas.
- -
En general, las respuestas de anticuerpos se evaluaron a los 21 días después de la vacunación en todos los estudios. Solamente 2 ensayos evaluaron a más largo plazo la persistencia de la inmunogenicidad:
- ∘
Un ensayo139 analizó la respuesta a los 6 meses y observó que los títulos de IH fueron menores a los 6 meses que a los 21 días, aunque se mantuvieron más altos que los niveles iniciales. La inmunogenicidad para los linajes B fue mayor que para la gripe A.
- ∘
Otro ensayo144 objetivó que las tasas de seroprotección se mantuvieron más altas que las basales un año después de la vacunación (≥98% en adultos más jóvenes y ≥90% en adultos mayores) para todas las cepas vacunales, aunque los títulos de anticuerpos IH disminuyeron gradualmente después del día 21 posvacunación y fueron de 2 a 3 veces más bajos en los meses 6 y 12 que en el día 21.
La seguridad indica la probabilidad de la vacuna de causar efectos adversos. La seguridad de una vacuna se evalúa mediante ensayos clínicos previos a la autorización de comercialización que se complementan con estudios poscomercialización y sistemas de farmacovigilancia. El objetivo principal de la evaluación de la seguridad de los fármacos es garantizar que su relación beneficio-riesgo es favorable.
Ensayos clínicos previos a la autorizaciónLas vacunas tetravalentes contienen un 25% más de antígeno (15μg adicionales) que la vacuna trivalente, por lo tanto, se evaluó en el programa de ensayos clínicos el posible aumento de riesgo en el perfil de reactogenicidad que podría suponer la utilización de la vacuna tetravalente en comparación con la trivalente.
Los ensayos mostraron que la vacuna tetravalente presentó un perfil de seguridad aceptable, similar al de la vacuna trivalente. Las reacciones adversas locales y sistémicas fueron similares para ambas vacunas y en su mayoría leves/moderadas y transitorias (resolución en menos de 3-5 días). Las reacciones más frecuentes fueron dolor en el sitio de inyección, cefalea, malestar general y mialgia. No se registraron eventos adversos graves o muertes relacionadas con la vacuna137-147.
Vigilancia poscomercializaciónEl análisis de las notificaciones realizadas al Vaccine Adverse Event Reporting System (VAERS) en los Estados Unidos desde el 1-7-2013 al 31-5-2015 mostró que el perfil de seguridad poscomercialización de la vacuna tetravalente fue similar al de la vacuna trivalente, siendo consistente con los resultados obtenidos en los ensayos precomercialización157. Durante ese período el VAERS recibió 1.265 notificaciones en personas mayores de 18 años de los cuales 199 (11%) ocurrieron en ≥65 años quienes presentaron reacciones de características similares a las de los adultos de 18-64 años, siendo las reacciones adversas más frecuentes: dolor en las extremidades (19%), eritema en el lugar de la inyección (17%), fiebre y dolor en el sitio de inyección (15%).
También se obtuvo un perfil de seguridad poscomercialización similar en ambas vacunas en un estudio158 realizado en 2015 en Australia occidental sobre 1.685 empleados del sistema de salud, aunque los que recibieron la vacuna tetravalente mostraron dolor e inflamación local en el sitio de inyección en una proporción levemente mayor (6,9% frente a 4,2%, p=0,02).
Evaluación del impacto sanitario y económico que tendría la utilización de vacunas tetravalentesAl obtenerse una protección inmunológica frente al segundo linaje de la gripe B, la utilización de vacunas tetravalentes mejora la prevención frente a la gripe siempre que el virus B circulante no coincida con el linaje B elegido para la vacuna trivalente, ya sea porque la predicción del linaje era incorrecta o porque ambos linajes circulen conjuntamente de manera significativa.
Sin embargo, uno de los criterios fundamentales a tener en cuenta en la decisión de utilizar o priorizar el uso de las vacunas tetravalentes en lugar de las trivalentes en los programas de inmunización es la evaluación coste-efectividad159. Dicha evaluación se basa en modelos matemáticos que pretenden estimar el impacto potencial (sobre la incidencia y morbimortalidad de la enfermedad) en relación con los costes sanitarios y sociales que tendría la nueva estrategia de vacunación tetravalente respecto a la trivalente.
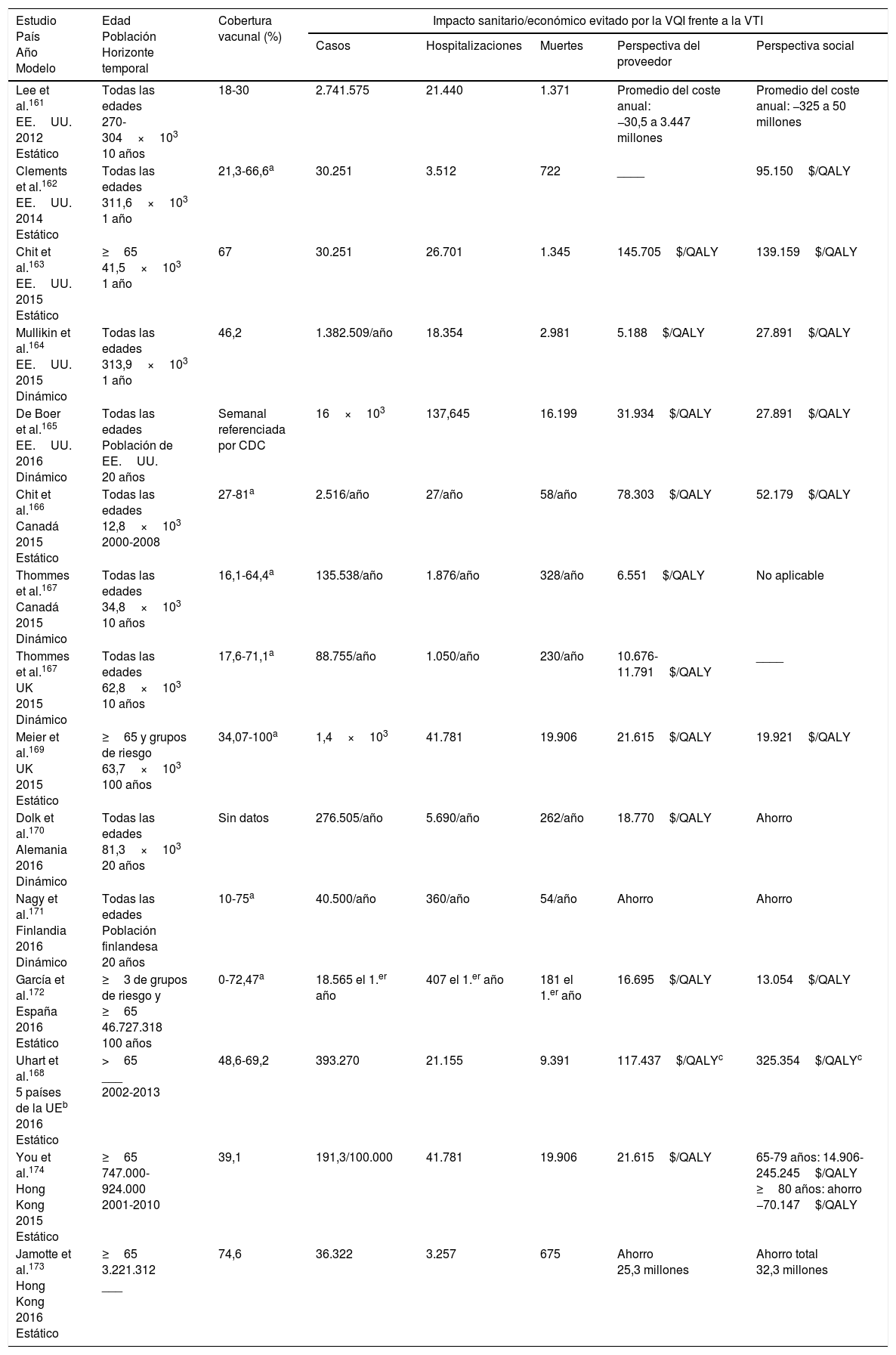
Resultados de los estudios de coste-efectividadEn 2017 se publicaron 2 revisiones sistemáticas19,160 de la literatura de los principales estudios realizados en diferentes países sobre el coste-efectividad de la vacuna tetravalente frente a la trivalente (no adyuvada o sin altas dosis de antígeno) utilizando modelos dinámicos o estáticos. Los resultados de dichos estudios127,161-174 se resumen en la tabla 4.
Coste efectividad de la vacuna antigripal tetravalente inactivada frente a la vacuna antigripal trivalente. Revisión de la literatura
| Estudio País Año Modelo | Edad Población Horizonte temporal | Cobertura vacunal (%) | Impacto sanitario/económico evitado por la VQI frente a la VTI | ||||
|---|---|---|---|---|---|---|---|
| Casos | Hospitalizaciones | Muertes | Perspectiva del proveedor | Perspectiva social | |||
| Lee et al.161 EE.UU. 2012 Estático | Todas las edades 270-304×103 10 años | 18-30 | 2.741.575 | 21.440 | 1.371 | Promedio del coste anual: −30,5 a 3.447 millones | Promedio del coste anual: −325 a 50 millones |
| Clements et al.162 EE.UU. 2014 Estático | Todas las edades 311,6×103 1 año | 21,3-66,6a | 30.251 | 3.512 | 722 | ____ | 95.150$/QALY |
| Chit et al.163 EE.UU. 2015 Estático | ≥65 41,5×103 1 año | 67 | 30.251 | 26.701 | 1.345 | 145.705$/QALY | 139.159$/QALY |
| Mullikin et al.164 EE.UU. 2015 Dinámico | Todas las edades 313,9×103 1 año | 46,2 | 1.382.509/año | 18.354 | 2.981 | 5.188$/QALY | 27.891$/QALY |
| De Boer et al.165 EE.UU. 2016 Dinámico | Todas las edades Población de EE.UU. 20 años | Semanal referenciada por CDC | 16×103 | 137,645 | 16.199 | 31.934$/QALY | 27.891$/QALY |
| Chit et al.166 Canadá 2015 Estático | Todas las edades 12,8×103 2000-2008 | 27-81a | 2.516/año | 27/año | 58/año | 78.303$/QALY | 52.179$/QALY |
| Thommes et al.167 Canadá 2015 Dinámico | Todas las edades 34,8×103 10 años | 16,1-64,4a | 135.538/año | 1.876/año | 328/año | 6.551$/QALY | No aplicable |
| Thommes et al.167 UK 2015 Dinámico | Todas las edades 62,8×103 10 años | 17,6-71,1a | 88.755/año | 1.050/año | 230/año | 10.676-11.791$/QALY | ____ |
| Meier et al.169 UK 2015 Estático | ≥65 y grupos de riesgo 63,7×103 100 años | 34,07-100a | 1,4×103 | 41.781 | 19.906 | 21.615$/QALY | 19.921$/QALY |
| Dolk et al.170 Alemania 2016 Dinámico | Todas las edades 81,3×103 20 años | Sin datos | 276.505/año | 5.690/año | 262/año | 18.770$/QALY | Ahorro |
| Nagy et al.171 Finlandia 2016 Dinámico | Todas las edades Población finlandesa 20 años | 10-75a | 40.500/año | 360/año | 54/año | Ahorro | Ahorro |
| García et al.172 España 2016 Estático | ≥3 de grupos de riesgo y ≥65 46.727.318 100 años | 0-72,47a | 18.565 el 1.er año | 407 el 1.er año | 181 el 1.er año | 16.695$/QALY | 13.054$/QALY |
| Uhart et al.168 5 países de la UEb 2016 Estático | >65 ___ 2002-2013 | 48,6-69,2 | 393.270 | 21.155 | 9.391 | 117.437$/QALYc | 325.354$/QALYc |
| You et al.174 Hong Kong 2015 Estático | ≥65 747.000-924.000 2001-2010 | 39,1 | 191,3/100.000 | 41.781 | 19.906 | 21.615$/QALY | 65-79 años: 14.906-245.245$/QALY ≥80 años: ahorro −70.147$/QALY |
| Jamotte et al.173 Hong Kong 2016 Estático | ≥65 3.221.312 ___ | 74,6 | 36.322 | 3.257 | 675 | Ahorro 25,3 millones | Ahorro total 32,3 millones |
QALY: quality-adjusted life years; VQI: vacuna antigripal tetravalente inactivada; VTI: vacuna antigripal trivalente.
La evidencia publicada indica que utilizar la vacuna tetravalente inactivada (virus fraccionados) en lugar de la vacuna trivalente es una intervención coste-efectiva:
- ∘
El impacto sobre el número total de casos de gripe (tipos A y B) osciló entre una reducción del 0,15% en los Estados Unidos usando un modelo estático162 al 6,47% en los Estados Unidos utilizando un modelo dinámico164. Estudios que presentan resultados para la gripe B encontraron reducciones de un 29,2% de casos en los Estados Unidos usando un modelo dinámico165 y de un 14,7% en Hong Kong utilizando un modelo estático174.
- ∘
El impacto de la vacuna tetravalente sobre morbimortalidad relacionada asociada a la gripe varió considerablemente en todos los estudios. En general, con los modelos dinámicos se obtuvieron mayores reducciones de la morbilidad que con los modelos estáticos. Se estimó un impacto más elevado sobre la mortalidad que sobre la morbilidad.
- ∘
La vacuna tetravalente inactivada (virus fraccionados) podría considerarse como una intervención rentable al suponer un importante ahorro de costes para el sistema de salud y para la sociedad (gracias a los casos y complicaciones evitadas), compensando parcial o totalmente el mayor precio de la vacuna tetravalente en comparación con la trivalente.
- a.
Desde la perspectiva del proveedor, 3 estudios (Finlandia171, Australia173 y la Unión Europea168) obtuvieron ahorro de costes en la intervención con tetravalente. Sin embargo, estos estudios asumieron paridad en el precio de la vacuna171,173 o excluyeron los costes de la vacunación en su análisis. El cociente coste-efectividad incremental (ICER) más elevado (145.705 dólares estadounidenses/quality-adjusted life years [QALY]) se estimó en un estudio realizado en Estados Unidos usando un modelo estático163.
- b.
Desde una perspectiva social, 3 estudios objetivaron ahorro de costes (un modelo estático en Estados Unidos161 y 2 modelos dinámicos en Alemania170 y Estados Unidos164). El ICER más alto se obtuvo en un estudio realizado en Hong Kong174, estimando que en una temporada con una buena coincidencia antigénica y un precio de vacuna incremental de 10 dólares estadounidenses, el ICER podría aumentar a 254.245 dólares estadounidenses por QALY obtenido.
- c.
Todos los estudios de coste-utilidad concluyeron que la vacunación con vacuna tetravalente sería al menos rentable en comparación con la trivalente, cuando se consideraron umbrales oficiales o hipotéticos, mostrando que una intervención es rentable si el ICER está por debajo de 3 veces el producto interno bruto per cápita de un país175.
- ∘
En la Unión Europea, un modelo estático publicado en 2016168 y realizado en 5 países (Francia, Alemania, Italia, España y el Reino Unido), de manera retrospectiva durante 2002-2013 (excluyendo la temporada 2009), estimó que la sustitución de la vacuna trivalente por la tetravalente habría evitado 1.034.727 casos de gripe adicionales (327,9/100.000 habitantes), 453.000 consultas a médicos generales (143,9/100.000), 672.000 días de trabajo perdidos (213,1/100.000), 24.453 hospitalizaciones (7,7/100.000) y 9.799 muertes (3,1/100.000). Si se extrapolan esos resultados a los 27 países de la Unión Europea, se habrían evitado 1.624.533 casos de gripe, 37.317 hospitalizaciones y 14.866 muertes. La mayoría de las hospitalizaciones y casi todas las muertes evitadas habrían sido en grupos de alto riesgo o en personas mayores.
- ∘
La carga económica total evitada en los 5 países con el uso de la vacuna tetravalente fue de 87,2 millones de euros desde la perspectiva de un tercer pagador (13,539 millones en consultas a médicos generales y 73,583 millones en hospitalizaciones) y 241,4 millones de euros desde una perspectiva social (14,741 millones en consultas a médicos generales, 76,630 millones en hospitalizaciones y 149,996 millones en días de trabajo perdidos).
- ∘
En España, un modelo estático publicado en 2016172 estimó que reemplazar la vacuna trivalente por la tetravalente en individuos de riesgo (≥3 años de edad) y en ≥65 años era una intervención coste-efectiva. En el primer año de aplicación se evitarían 18.565 casos de gripe; 2.577 complicaciones relacionadas con la gripe; 407 hospitalizaciones, y 181 muertes; con un coste incremental de 11.203.359 de euros debido a que el coste incremental de la vacuna (17,7 millones de euros) fue compensado parcialmente por el ahorro de costes de absentismo laboral (3,7 millones); complicaciones de la gripe (2,2 millones) y gripe no complicada (0,4 millones). El ICER fue de 8.748€/años de vida ajustados por calidad (AVAC).
Estos resultados ponen de manifiesto la oportunidad perdida, que supone el no utilizar las vacunas tetravalentes, de reducir la incidencia de casos, la morbimortalidad asociada a la gripe estacional y sus costes asociados176.
Factores clave en la estimación del coste-efectividadAunque en los estudios realizados las conclusiones sobre el coste-efectividad de la intervención fueron en general similares, existe heterogeneidad en los resultados entre los diferentes estudios. Ello se debe a una serie de factores, ya descritos por Quinn et al. en 2014177, que actúan como parámetros clave en la estimación del potencial impacto y el coste-efectividad de la vacunación antigripal tetravalente determinando que el impacto real sea muy variable y difícil de cuantificar.
Dichos factores o parámetros clave son: el tipo de modelo utilizado, la población diana objetivo del programa de vacunación, la concordancia antigénica y el nivel de circulación de gripe B no incluido en la vacuna trivalente, la propia variabilidad de cada cepa, la inmunidad preexistente debido a una infección previa, el nivel de protección cruzada de la vacuna trivalente frente a la cepa B no incluida en la vacuna, la cobertura vacunal alcanzada, la diferencia de precio entre la vacuna trivalente y la tetravalente, y la utilización de datos específicos por subtipo viral y edad para estimar la carga y los costes de la enfermedad160.
Cada temporada, la mayoría de estos factores pueden variar y por tanto también lo harán los beneficios y el impacto de la vacuna tetravalente. Por este motivo se recomienda evaluar dicho impacto utilizando datos de múltiples temporadas de gripe, que en promedio reflejarán mejor la variabilidad de dichos factores de un año a otro.
Tipo de modelo utilizadoLos modelos estáticos son más conservadores (no cuantifican la inmunidad colectiva, el impacto indirecto de la vacunación sobre la población no vacunada), por lo que en comparación con los modelos dinámicos predicen un menor impacto y ofrecen peores resultados de coste-efectividad. Por ello es recomendable utilizar modelos dinámicos aunque requieran incorporar más datos o información que los modelos estáticos178.
Población diana objetivo del programa de vacunaciónLos resultados de coste efectividad pueden estar muy influidos por el grupo objetivo del programa de vacunación. El impacto adicional de los modelos dinámicos sobre los estáticos será mayor en los países con programas de vacunación antigripal universal en comparación con los países que restringen la vacunación a las personas mayores o a grupos de riesgo. Además, cuando desde una perspectiva social se considera el ahorro de costes debido a los días de trabajo perdidos, pueden obtenerse mejores resultados en cuanto a coste-efectividad. Por otro lado, las tasas de complicaciones por gripe son más altas entre las personas mayores179,180.
Nivel de circulación del virus B en el área geográfica estudiada y coincidencia antigénicaLos resultados de los estudios coste-efectividad, incluido el ICER, tienden a ser muy sensibles al nivel de circulación del virus de la gripe B y de su concordancia antigénica con la cepa seleccionada en la vacuna:
- ∘
En temporadas con una coincidencia antigénica adecuada entre la cepa vacunal y la circulante y sin cocirculación de ambos linajes B, es probable que el impacto de la vacuna tetravalente frente a la trivalente no sea significativo. Esto se evidenció en algunos estudios que analizaron el impacto retrospectivamente durante el período 2001-2010, lo que demuestra una amplia variación en los resultados de coste-efectividad entre las diferentes temporadas161,174.
- ∘
La incidencia de la gripe B varía según los países y las regiones geográficas68. Por lo tanto, los estudios coste-efectividad que analizan el impacto retrospectivo de la vacuna tetravalente deben utilizar datos específicos del área geográfica analizada.
La existencia del efecto potencial atribuible a la protección cruzada en los análisis puede llevar a infraestimaciones sobre el impacto de la vacuna tetravalente de manera significativa. La mayoría de los estudios incluyeron protección cruzada en sus análisis basándose en las revisiones sistemáticas de Tricco et al.116 y Diaz Granados et al.117. Sin embargo, de todos es conocido que la estimación puede ser inexacta por la posibilidad de presentar sesgos de múltiples orígenes, como podría ser la existencia de inmunidad preexistente (por una vacunación o una infección natural previas), por lo que, en este parámetro, se recomienda realizar análisis de sensibilidad.
Respecto a la duración de la inmunidad adquirida por infección previa, se espera que esté influida por la disminución natural de la inmunidad en el individuo y por la deriva de los virus de la gripe a lo largo del tiempo181. Sin embargo, la evidencia sobre este aspecto es escasa.
Diferentes estudios de modelado dinámico han establecido o asumido una duración de la inmunidad adquirida natural para la gripe B más prolongada que para la gripe A (6 años para la gripe A y 12 para la B en el estudio de Vynnycky et al.182 y 3,5 años frente a 7 en el estudio de Eichner et al.183).
Respecto a la duración de la inmunidad inducida por la vacuna, un estudio181 mostró que la protección frente a la gripe B era más prolongada que frente a la gripe A/H3N2, posiblemente debido a una deriva antigénica más rápida de A/H3N2.
Precio de la vacunaEl precio de la vacuna debe tenerse en cuenta al interpretar los resultados de coste-efectividad, como por ejemplo en los estudios que asumen una paridad de precios entre ambas vacunas que casi automáticamente dará como resultado un ahorro de costes.
Asumir la paridad de precios en ausencia de un precio oficial de la vacuna tetravalente y simplemente mostrar el beneficio de salud neto esperado de la tetravalente respecto a la trivalente evita obtener conclusiones equivocadas. Los resultados podrían actualizarse cuando esté disponible el precio de la vacuna. Además, los costes pueden estar sobrestimados debido a que hay que tener en cuenta que en los programas de salud pública masivos con un gran volumen de compras, como son las campañas de vacunación antigripal, las vacunas pueden obtenerse a precios relativamente más bajos con descuentos sobre el precio de partida160.
Estimaciones específicas del uso de recursos y costes por subtipo y edad de la cargaEl uso de estimaciones de resultados que no están especificadas por el subtipo de influenza estacional podría considerarse no óptimo porque, aunque la mayoría de los estudios utilizaron estimaciones iguales de uso de recursos y costes en todos los subtipos de gripe, la realidad es que estas estimaciones pueden diferir entre los subtipos virales A y B en todos los grupos de edad160.
ConclusionesCada temporada, la gripe B representa una proporción significativa de la carga general de la gripe- ∘
Debido a la evolución antigénica y epidemiológica del virus influenza B, existe una cocirculación generalizada de los 2 linajes B desde la temporada 2001-2002. La circulación del virus B es muy variable (porcentaje medio del 22±6% del total de gripe) e impredecible cada temporada, incluso de una región geográfica a otra, por lo que cada año uno de los 2 linajes B puede prevalecer sobre el otro o circular ambos conjuntamente de manera significativa.
- ∘
La gripe B, clínicamente, es indistinguible de la gripe A (duración, signos y síntomas, gravedad y complicaciones) aunque exista la convicción general de que el virus influenza A es responsable de casos de gripe más graves que el virus influenza B.
- ∘
La gripe B causa una proporción significativa del total de la carga sanitaria, social y económica de la gripe.
- ∘
La eficacia/efectividad de la vacuna trivalente convencional puede verse disminuida siempre que el linaje B circulante no coincida con el elegido para la vacuna trivalente (como ha ocurrido en un 25-50% de las temporadas):
- ∘
Por una predicción incorrecta (debido a la dificultad de los Sistemas de Vigilancia para predecir qué linaje B circulará cada temporada);
- ∘
porque ambos linajes circulan conjuntamente en un grado significativo.
- ∘
La reducción de la inmunogenicidad frente a las cepas circulantes se debe a que la gran diferencia antigénica entre los 2 linajes B condiciona un nivel de protección cruzada limitado o ausente (la vacunación frente a uno de los linajes no conlleva una protección adecuada frente al linaje heterólogo).
- ∘
Una disminución en la eficacia/efectividad de la vacuna antigripal para prevenir la infección confirmada de gripe puede tener un elevado impacto en salud pública, sobre todo en los grupos de riesgo de presentar complicaciones por gripe.
- -
Cumple los criterios del CHMP (Europa) y CBER (Estados Unidos) para las 4 cepas vacunales demostrando, en todos los grupos de edad, un nivel de inmunogenicidad (seroprotección y seroconversión) comparable o superior (significación estadística) para las 3 cepas compartidas y un nivel de inmunogenicidad superior frente a la cepa B adicional no incluida en la vacuna trivalente.
- -
Proporciona una protección más amplia frente a la cepa B sin afectar a la inmunogenicidad de las otras 3 cepas vacunales comunes a ambas vacunas y sin comprometer la seguridad (perfil de seguridad aceptable en los estudios pre y poscomercialización, similar al de la vacuna trivalente).
- -
Es una intervención coste-efectiva al disminuir el número total de casos de gripe, así como las tasas de hospitalización y de mortalidad asociadas. Sin embargo, los diferentes estudios de coste-efectividad disponibles muestran gran variabilidad en el impacto causado por la enfermedad.
- -
Es una intervención rentable al suponer un importante ahorro de costes para el sistema de salud y para la sociedad (gracias a los casos y complicaciones evitadas), compensando parcial o totalmente el mayor precio de la vacuna tetravalente en comparación con la trivalente.
Estas ventajas evidencian la oportunidad perdida para reducir el impacto sanitario, económico y social asociado a la gripe estacional en adultos que supondría no utilizar la vacunación tetravalente inactivada en lugar de la trivalente convencional, por lo que se recomienda priorizar la elección de una estrategia de vacunación tetravalente en la campaña anual de vacunación antigripal.
Nota del suplementoEste suplemento ha sido patrocinado por Sanofi-Aventis, S.A.
A efectos de trasparencia, le informamos de que Sanofi-Aventis, S.A. ha colaborado en la financiación de la presente publicación. Su contenido refleja las opiniones, criterios, conclusiones y/o hallazgos propios de los autores, los cuales pueden no coincidir necesariamente con los de Sanofi-Aventis, S.A. Sanofi-Aventis, S.A. recomienda siempre la utilización de sus productos de acuerdo con la ficha técnica aprobada por las autoridades sanitarias.
Elsevier y sus asociados no asumen responsabilidad alguna por cualquier lesión y/o daño sufridos por personas o bienes en cuestiones de responsabilidad de productos, negligencia o cualquier otra, ni por uso o aplicación de métodos, productos, instrucciones o ideas contenidos en el presente material. Dados los rápidos avances que se producen en las ciencias médicas, en particular, debe realizarse una verificación independiente de los diagnósticos y las posologías de los fármacos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.