La mayor especificidad de la medición de magnitud de riesgo relativo de osteoporosis y fractura ósea en la mujer se obtiene cuando se toman como referencia límites autóctonos de densidad mineral ósea (DMO), obtenidos de población normal, lo cual no está suficientemente establecido en países de la región latinoamericana.
ObjetivosCaracterizar cambios de la masa ósea según densitometría y riesgo relativo de osteoporosis en una población femenina seleccionada (sana, mayor de 49 años de edad, en plena actividad laboral) utilizando como referencia límites de márgenes de riesgo de la DMO en población autóctona.
Materiales y métodosSegún encuesta transversal en la región occidental de Cuba, se estudió a 307 mujeres sanas, de 50 a 59 años, desde 1998 a 2007, mediante densitometría de rayos X de doble haz (DEXA Lunar) a vértebras lumbares (antero-posterior), cuello de fémur, triángulo de Ward, trocánter y cuerpo total. Se obtuvo densidad ósea (g/cm2), expresada también en cociente según estatura para cada sitio anatómico (g/cm) y se calculó declinación (%) y frecuencia de riesgo relativo de fractura. Se realizaron distribuciones en percentiles y se calcularon medias y desviación estándar, según origen étnico. Se evaluaron diferencias según tiempo de amenorrea, origen étnico, cocientes según estatura, así como resultados tomando como referencia criterios de la Organización Mundial de la Salud (márgenes de seguridad ≤ 1 desviación estándar y riesgo ≤ 2,5 desviaciones estándar) de una población cubana joven y de otras poblaciones de referencia mediante análisis de varianza (ANOVA) y prueba de la t de Student para muestras independientes. Los datos fueron procesados por SPSS, versión 11.5 para Windows.
ResultadosEl cociente fémur/estatura de mujer promedio con menos de 5 años de amenorrea presentó declinación del —7,7% cuando se comparó con el pico de masa ósea de población joven. La frecuencia de mujeres con riesgo de fractura aumentó para vértebras y cuello de fémur cuando se utilizaron las referencias de población cubana. Según margen de riesgo, la población de 50 a 59 años no diferenciada por origen étnico tuvo riesgo relativo de fractura para cuello de fémur (4,4%), vértebra lumbar (8,1%) y cuerpo total (7,7%). Al aplicar la referencia cubana de cuerpo total, el riesgo fue similar a los criterios de la DEXA Lunar.
ConclusionesSe observó prevalencia de riesgo de osteoporosis y cifras de declinación de masa ósea en el grupo estudiado. Se comprobó mayor especificidad en los sitios anatómicos cuando se normalizó según estatura, utilizando referencias según criterios de márgenes de riesgo de población autóctona.
The highest specificity in the measurement of the magnitude of relative risk of osteoporosis and bone fracture among women is obtained when autochthonous ranges of bone mineral density (BMD), obtained from a normal population, are taken as reference values. These ranges are not sufficiently well established in Latin America.
ObjectivesTo characterize changes in bone mass according to absorptiometry measurements and the relative risk of osteoporosis in a selected female population (healthy, working women aged more than 49 years old) using BMD risk margins in an autochthonous population as reference values.
Materials and methodsWe performed a cross-sectional survey in the western region of Cuba in 307 healthy women, aged 50 to 59 years old, from 1998 to 2007. BMD was measured with a dual-energy X-ray absorptiometry densitometer (DEXA Lunar) in the lumbar spine (anterior-posterior), femoral neck, Ward triangle, trochanter and whole body. Bone density (g/cm2) was obtained and was also expressed as a quotient according to height for each skeletal site (g/m). The percent decrease in bone mass and the frequency of women at relative risk of fracture were calculated. Distributions in percentiles were determined and means and standard deviation were calculated according to ethnic origin. Differences in BMD according to length of amenorrhea, ethnic origin, quotients according to height, and results taking the World Health Organization criteria as reference (safety margins ≤1 standard deviation and risk ≤ 2.5 standard deviation) were evaluated in a young Cuban population and in other reference populations by means of analysis of variance (ANOVA) and Student’s t test for independent samples. Data were processed by SPSS, version 11.5 for Windows.
ResultsIn the average woman with less than 5 years of amenorrhea, the femur / height quotient, showed a decrease of 7.7 % when compared with peak bone mass in the young population. The frequency of women at risk of fracture increased for fractures of the lumbar spine and femoral neck when the Cuban population was used as reference. According to the risk margin (g/cm2), in the population aged between 50 and 59 years, not differentiated by ethnic origin, the relative risk of fracture of the femoral neck was 4.4 %, that for fracture of the lumbar vertebra was 8.1 % and that for whole-body fracture was 7.7 %. When the Cuban reference was applied for whole body fracture, the presence of risks was similar to the DEXA Lunar criteria.
ConclusionsThe prevalence of risk of osteoporosis and decline in bone mass were determined in the study group. Our results provide further evidence of the highest specificity in skeletal sites when measurements are adjusted by height, using the criteria of risk margins in the autochthonous population as a reference.
Debido al crecimiento de la población cubana mayor de 50 años, la frecuencia de la osteoporosis se plantea para nuestro sistema de salud como un problema prioritario para su prevención, diagnóstico precoz y tratamiento oportuno1–3.
Desde los primeros trabajos sobre osteoporosis en la mujer y posteriormente con el surgimiento de la aplicación de la densitometría para estos fines, casi todas las publicaciones hasta el año 2000 se han limitado a la mujer y fundamentalmente a la osteoporosis posmenopáusica4–10.
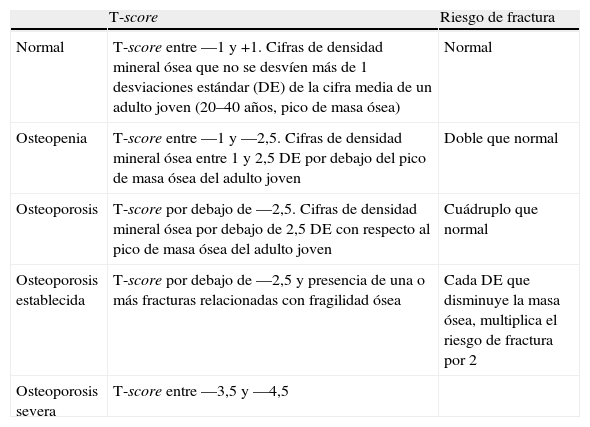
La Organización Mundial de la Salud (OMS) ha establecido como margen de seguridad para osteoporosis y fracturas el intervalo ≤ 1 desviación estándar (DE) para los valores de densidad mineral ósea (DMO) de un sitio anatómico determinado (p. ej., vértebras lumbares, cuello de fémur) y como margen de riesgo, el intervalo ≤ 2,5 DE. Estos criterios de la OMS se emplean internacionalmente en el cribado de la osteoporosis4 (anexo 1).
Considerada como la gran pandemia de los inicios de este siglo, la osteoporosis y su consecuente riesgo de fracturas se presenta de modo diverso entre los distintos países11–16. El Informe Anual de Osteoporosis de la oficina del Cirujano General en Estados Unidos señala que esta enfermedad afecta al 55% de la población mayor de 50 años de edad de ese país y que el 17% de la población femenina de ese grupo de edad padece de una pérdida de hueso en cadera superior a 2,5 DE por debajo del promedio de la población joven de referencia cuando se utilizan como criterio los valores de DMO (g/cm2) de la Encuesta Nacional de Salud y Nutrición (NHANES)13.
En Cuba, en 2007, del total de egresos ocurridos en una muestra probabilística de 35 hospitales, las fracturas de fémur y extremidades representaron una tasa de 1,6. Debe considerarse la existencia del subdiagnóstico de la osteoporosis en nuestro medio; para citar un ejemplo, en la ciudad de La Habana sólo se informa y se registra como osteoporosis al 3,2% de la población3.
Se ha considerado como un potente predictor de fracturas óseas la DMO medida por densitometría de rayos X de doble haz, conocida también como absorciometría dual de rayos X (DEXA o DXA). Cada disminución de una unidad de desviación estándar se ha asociado con un incremento de 2,6 del riesgo relativo de fractura de cadera15.
Si se recuerda el antecedente de que en una población como la cubana se ha estimado el predominio de la población mestiza y que menos del 40% es de origen europeo16,17.
Los antecedentes de mestizaje y multirraciales, así como los cambios sociales de los últimos 40 años ocurridos en la sociedad cubana y su influencia en el desarrollo del perfil antropológico, conducen a tener en cuenta esos factores en las investigaciones sobre el comportamiento del desarrollo físico y en particular de la masa ósea de la mujer menopáusica de la población cubana.
En estudios realizados anteriormente en Cuba19–22, se constató el poder predictivo de la etnia y la estatura de la mujer sobre el comportamiento de la masa ósea. Sin embargo, resultaba necesario evaluar una muestra mayor y de procedencia geográfica más extensa para sustentar los resultados de esos estudios.
El objetivo de la presente investigación fue evaluar el riesgo relativo de osteoporosis y el consecuente efecto en la evaluación nutricional en una población femenina seleccionada (sana, mayor de 49 años de edad y en plena actividad laboral), mediante la caracterización cuantitativa de los cambios de la masa ósea, utilizando como referencia los límites de márgenes de seguridad y riesgo de una población autóctona.
Materiales y métodosTipo de estudio y muestra. Se realizó un estudio transversal de la prevalencia de riesgo relativo de osteoporosis y las cifras de declinación de la densidad de la masa ósea en dos sitios anatómicos de una muestra seleccionada de población femenina en actividad laboral, a la que se examinó según la encuesta periódica de salud en centros de trabajo y hospitales de las provincias de la región occidental de Cuba (ciudad de La Habana, Habana, Matanzas y Pinar del Río). La muestra estuvo constituida por 307 mujeres sanas, con edades de 50–59 años, reclutadas durante 1998–2007 y consideradas según su origen étnico como afrocubanas (negras), afroeuropoides (mestizas) y europoides (blancas), de acuerdo con los criterios del Programa Biológico Internacional y la experiencia de algunos trabajos antropológicos cubanos23–25. Se consideró menopáusica a aquella con más de 49 años de edad y más de 6 meses de amenorrea. Se conformaron dos grupos, constituidos por mujeres con menos de 5 años de amenorrea (n = 201) y con más de 5 (n = 106).
Criterios de inclusión. Mujeres sanas, de 50 a 59 años, cuyas historias clínicas demostraron que estaban exentas de lo establecido en los criterios de exclusión.
Criterios de exclusión. Quedaron excluidas las mujeres cuyas historias clínicas refirieron alguna de estas entidades: hábito de fumar, insuficiencia renal crónica, trastornos endocrinos, hepáticos o enfermedades metabólicas, menopausia precoz, histerectomía u ooforectomía antes de los 50 años, nefrolitiasis, uso de medicamentos del tipo de los corticoides, anticonvulsivos, heparina, terapia hormonal de reemplazo y/o ingestión de suplementos minerales.
Consideraciones bioéticas. Se obtuvo el consentimiento informado de las participantes. La investigación fue aprobada por el Comité de Ética de la institución (Centro de Investigaciones Médico Quirúrgicas).
MétodosSe determinó la DMO en g/cm2 de vértebras lumbares (L1-L4) en vista anteroposterior y cuello de fémur para el total de la muestra, mediante densitometría de rayos X de doble haz (DEXA Lunar), con un densitómetro DPX-IQ, versión 4.6 b (DEXA Lunar, Estados Unidos), calibrado diariamente (phantom DEXA Lunar). En una submuestra aleatoria de 250 mujeres se realizó la medición de DMO de cuerpo total.
Se emplearon el T-score y el Z-score para las evaluaciones (anexo 1)5,6,16.
T-score: la DMO de la paciente comparada con la de una población de mujeres jóvenes (pico de masa ósea); un score superior a —1 DE se considera normal; entre —1 y 2,5 DE se clasifica como osteopenia (baja masa ósea); por debajo de —2,5 DE se define como osteoporosis. Se emplea para medir el riesgo de fracturas.
Z-score: la DMO de la paciente comparada con la de una población de mujeres de iguales grupo de edad y talla. Si este score resulta muy alto o muy bajo, se requieren otras investigaciones médicas.
Se compararon estos scores obtenidos con las referencias de la población femenina norteamericana6,10,11,13, el criterio de riesgo de osteopenia y osteoporosis (≤ 1 y ≤ 2,5 DE) de la referencia hispana de la DEXA Lunar5,6, mexicana26, canadiense27, con los límites críticos de la OMS4 y también con las medias de masa ósea para cuello de fémur y de vértebras lumbares de una población cubana joven, de 20 a 29 años (considerado como pico de masa ósea), y del grupo de 20 a 39 años de edad (por conveniencia para realizar análisis comparativo con población hispana de la DEXA), obtenidas en previas investigaciones19–21. Los coeficientes de variación para vértebras, cuello de fémur y cuerpo total fueron del 0,8, el 1 y el 0,8% respectivamente.
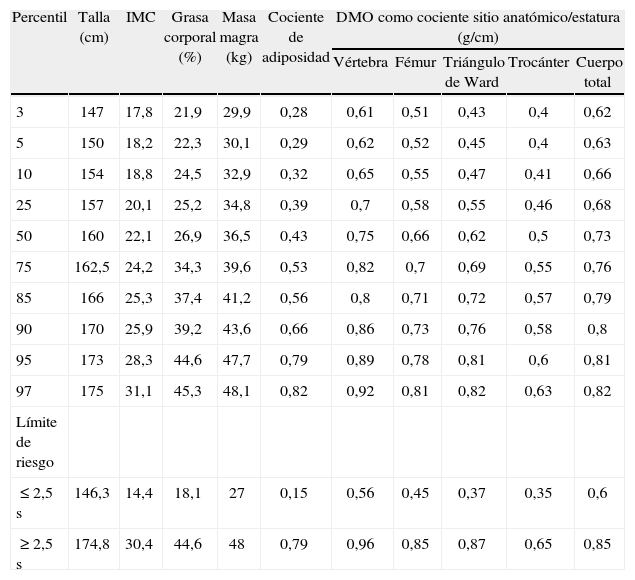
Procesamiento de los datosSe consideraron las medias de DMO y sus límites de distribución para 1 y 2,5 de cada sitio anatómico, correspondientes a una subpoblación habanera seleccionada de 20 a 29 años como la referencia autóctona de márgenes de seguridad (≤ 1 DE) y de riesgo (≤ 2,5 DE)22, para identificar el riesgo probable de osteoporosis y de fractura de la población mayor de 49 años estudiada, según etnia, tiempo de amenorrea y edades (tabla 1).
Composición corporal y densidad mineral ósea. Distribución en percentiles. Población femenina de 20–29 años residente en La Habana, Cuba
| Percentil | Talla (cm) | IMC | Grasa corporal (%) | Masa magra (kg) | Cociente de adiposidad | DMO como cociente sitio anatómico/estatura (g/cm) | ||||
| Vértebra | Fémur | Triángulo de Ward | Trocánter | Cuerpo total | ||||||
| 3 | 147 | 17,8 | 21,9 | 29,9 | 0,28 | 0,61 | 0,51 | 0,43 | 0,4 | 0,62 |
| 5 | 150 | 18,2 | 22,3 | 30,1 | 0,29 | 0,62 | 0,52 | 0,45 | 0,4 | 0,63 |
| 10 | 154 | 18,8 | 24,5 | 32,9 | 0,32 | 0,65 | 0,55 | 0,47 | 0,41 | 0,66 |
| 25 | 157 | 20,1 | 25,2 | 34,8 | 0,39 | 0,7 | 0,58 | 0,55 | 0,46 | 0,68 |
| 50 | 160 | 22,1 | 26,9 | 36,5 | 0,43 | 0,75 | 0,66 | 0,62 | 0,5 | 0,73 |
| 75 | 162,5 | 24,2 | 34,3 | 39,6 | 0,53 | 0,82 | 0,7 | 0,69 | 0,55 | 0,76 |
| 85 | 166 | 25,3 | 37,4 | 41,2 | 0,56 | 0,8 | 0,71 | 0,72 | 0,57 | 0,79 |
| 90 | 170 | 25,9 | 39,2 | 43,6 | 0,66 | 0,86 | 0,73 | 0,76 | 0,58 | 0,8 |
| 95 | 173 | 28,3 | 44,6 | 47,7 | 0,79 | 0,89 | 0,78 | 0,81 | 0,6 | 0,81 |
| 97 | 175 | 31,1 | 45,3 | 48,1 | 0,82 | 0,92 | 0,81 | 0,82 | 0,63 | 0,82 |
| Límite de riesgo | ||||||||||
| ≤ 2,5 s | 146,3 | 14,4 | 18,1 | 27 | 0,15 | 0,56 | 0,45 | 0,37 | 0,35 | 0,6 |
| ≥ 2,5 s | 174,8 | 30,4 | 44,6 | 48 | 0,79 | 0,96 | 0,85 | 0,87 | 0,65 | 0,85 |
DMO: densidad mineral ósea; IMC: índice de masa corporal.
Tomada de Santos-Hernández22.
Para evitar la influencia del tamaño corporal en las variables de DMO se utilizaron los cocientes por la estatura para expresar la DMO de las vértebras lumbares 1–4, cuello de fémur y cuerpo total, en g/cm.
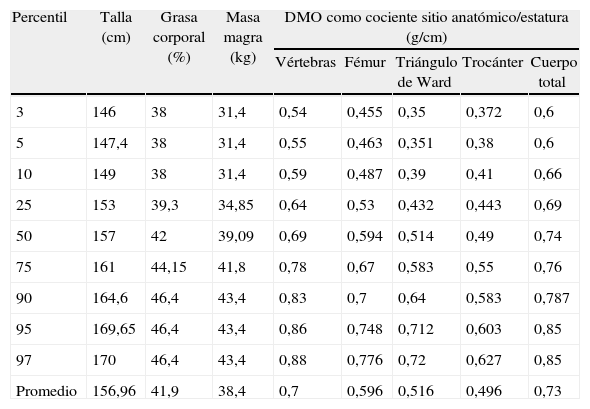
En la tabla 2 se presenta la distribución en percentiles de la composición corporal de la población femenina sana de 50 a 59 años con menos de 5 años de amenorrea, que pertenece a la población empleada en esta investigación22.
Composición corporal y densidad mineral ósea (DMO). Población femenina promedio de 50–59 años y menos de 5 años de amenorrea (n = 201). Cuba, 2007
| Percentil | Talla (cm) | Grasa corporal (%) | Masa magra (kg) | DMO como cociente sitio anatómico/estatura (g/cm) | ||||
| Vértebras | Fémur | Triángulo de Ward | Trocánter | Cuerpo total | ||||
| 3 | 146 | 38 | 31,4 | 0,54 | 0,455 | 0,35 | 0,372 | 0,6 |
| 5 | 147,4 | 38 | 31,4 | 0,55 | 0,463 | 0,351 | 0,38 | 0,6 |
| 10 | 149 | 38 | 31,4 | 0,59 | 0,487 | 0,39 | 0,41 | 0,66 |
| 25 | 153 | 39,3 | 34,85 | 0,64 | 0,53 | 0,432 | 0,443 | 0,69 |
| 50 | 157 | 42 | 39,09 | 0,69 | 0,594 | 0,514 | 0,49 | 0,74 |
| 75 | 161 | 44,15 | 41,8 | 0,78 | 0,67 | 0,583 | 0,55 | 0,76 |
| 90 | 164,6 | 46,4 | 43,4 | 0,83 | 0,7 | 0,64 | 0,583 | 0,787 |
| 95 | 169,65 | 46,4 | 43,4 | 0,86 | 0,748 | 0,712 | 0,603 | 0,85 |
| 97 | 170 | 46,4 | 43,4 | 0,88 | 0,776 | 0,72 | 0,627 | 0,85 |
| Promedio | 156,96 | 41,9 | 38,4 | 0,7 | 0,596 | 0,516 | 0,496 | 0,73 |
Tomada de Santos-Hernández22.
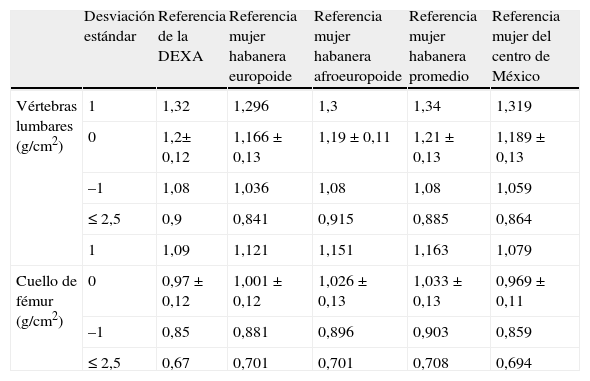
Los resultados se presentaron en percentiles, promedios y medidas de distribución: desviación estándar, análisis de varianza (ANOVA) y prueba de la t de Student para muestras independientes para determinar las diferencias de acuerdo con la edad, el tiempo de amenorrea y el origen étnico, relacionándolas con los límites críticos de la OMS4 (tabla 3).
| Desviación estándar | Referencia de la DEXA | Referencia mujer habanera europoide | Referencia mujer habanera afroeuropoide | Referencia mujer habanera promedio | Referencia mujer del centro de México | |
| Vértebras lumbares (g/cm2) | 1 | 1,32 | 1,296 | 1,3 | 1,34 | 1,319 |
| 0 | 1,2± 0,12 | 1,166 ± 0,13 | 1,19 ± 0,11 | 1,21 ± 0,13 | 1,189 ± 0,13 | |
| –1 | 1,08 | 1,036 | 1,08 | 1,08 | 1,059 | |
| ≤ 2,5 | 0,9 | 0,841 | 0,915 | 0,885 | 0,864 | |
| 1 | 1,09 | 1,121 | 1,151 | 1,163 | 1,079 | |
| Cuello de fémur (g/cm2) | 0 | 0,97 ± 0,12 | 1,001 ± 0,12 | 1,026 ± 0,13 | 1,033 ± 0,13 | 0,969 ± 0,11 |
| –1 | 0,85 | 0,881 | 0,896 | 0,903 | 0,859 | |
| ≤ 2,5 | 0,67 | 0,701 | 0,701 | 0,708 | 0,694 |
También se consideró la población de referencia del software de DEXA Lunar para europoides, hispanas, mestizas (negroides-europoides) y negras5,6, así como los criterios más recientes de la Sociedad Internacional de Densitometría Clínica16.
Las mujeres de origen asiático no fueron incluidas en el análisis comparativo, por tratarse de un escaso número (sólo 21), en su totalidad de carácter mestizo (asiáticas-europeas y negroides-asiáticas).
Se expresó la prueba de la t de Student según las diferencias en coeficientes estandarizados del valor beta y del valor t, significativa para la probabilidad p < 0,05 y altamente significativa para p < 0,01.
Las cifras de declinación ósea expresadas en porcentaje fueron obtenidas al comparar la diferencia de los valores de densidad ósea de cada sitio anatómico, normalizados según el cociente de estatura, comparados con la población autóctona de 20 a 29 años de edad para cada grupo étnico y el promedio. Todos los análisis estadísticos fueron realizados por el sistema SPSS/PC versión 11.5.
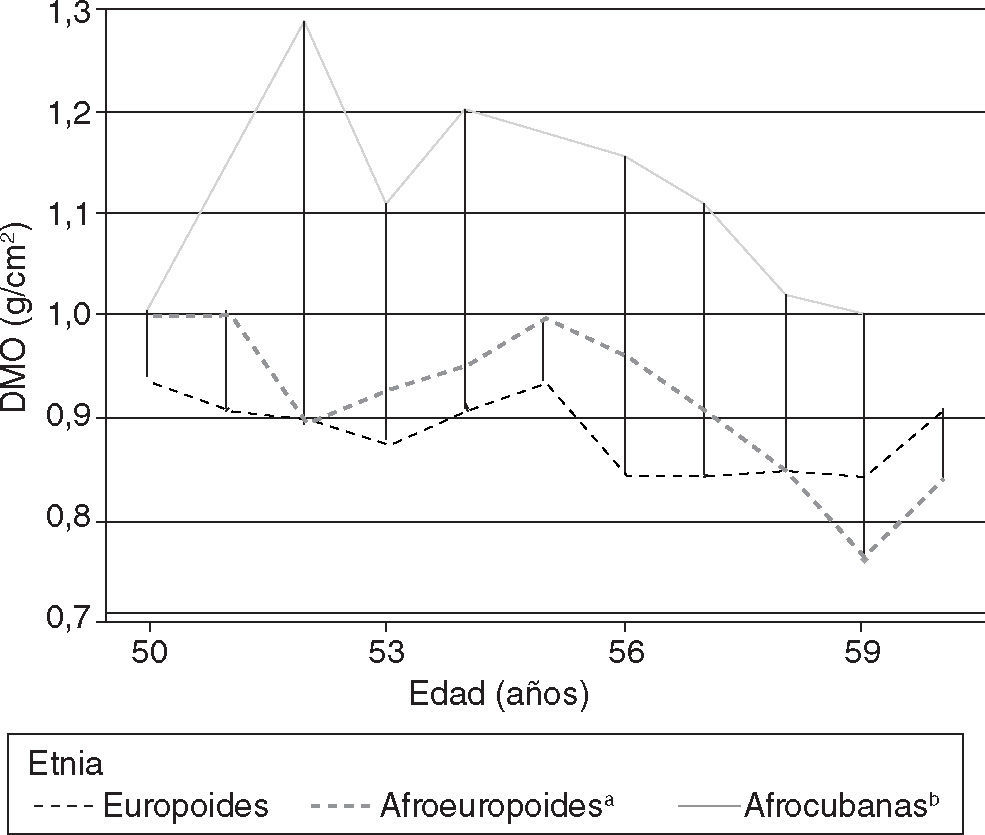
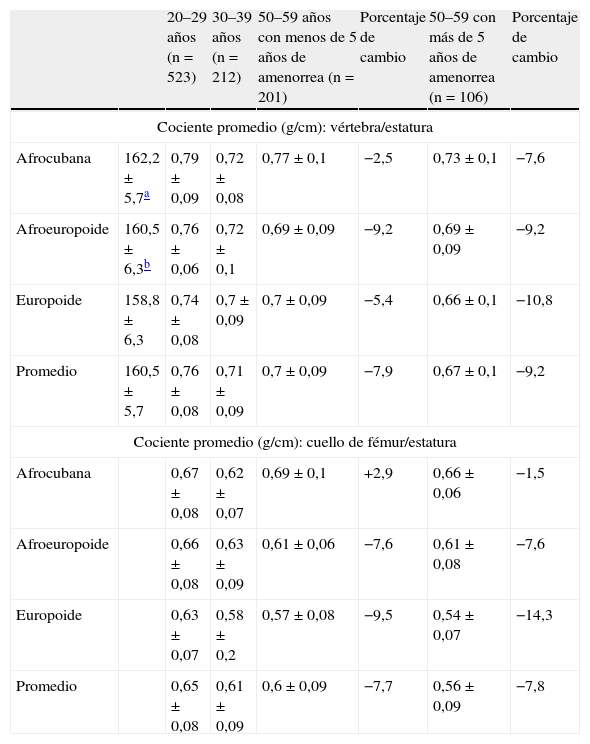
ResultadosEn la tabla 4 se destacan las diferencias encontradas para la estatura entre los tres grupos de este trabajo, que fueron significativas según la prueba de la t de Student (p < 0,05) entre las negroides-europoides y las europoides y altamente significativas entre europoides y negroides cubanas (p < 0,001).
Densidad mineral ósea (en términos de cociente por estatura, g/cm) en mujeres del occidente de Cuba, sanas. Cambios (%) según sitio anatómico, edad, origen étnico y tiempo de amenorrea, Cuba, 2007
| 20–29 años (n = 523) | 30–39 años (n = 212) | 50–59 años con menos de 5 años de amenorrea (n = 201) | Porcentaje de cambio | 50–59 con más de 5 años de amenorrea (n = 106) | Porcentaje de cambio | ||
| Cociente promedio (g/cm): vértebra/estatura | |||||||
| Afrocubana | 162,2 ± 5,7a | 0,79 ± 0,09 | 0,72 ± 0,08 | 0,77 ± 0,1 | −2,5 | 0,73 ± 0,1 | −7,6 |
| Afroeuropoide | 160,5 ± 6,3b | 0,76 ± 0,06 | 0,72 ± 0,1 | 0,69 ± 0,09 | −9,2 | 0,69 ± 0,09 | −9,2 |
| Europoide | 158,8 ± 6,3 | 0,74 ± 0,08 | 0,7 ± 0,09 | 0,7 ± 0,09 | −5,4 | 0,66 ± 0,1 | −10,8 |
| Promedio | 160,5 ± 5,7 | 0,76 ± 0,08 | 0,71 ± 0,09 | 0,7 ± 0,09 | −7,9 | 0,67 ± 0,1 | −9,2 |
| Cociente promedio (g/cm): cuello de fémur/estatura | |||||||
| Afrocubana | 0,67 ± 0,08 | 0,62 ± 0,07 | 0,69 ± 0,1 | +2,9 | 0,66 ± 0,06 | −1,5 | |
| Afroeuropoide | 0,66 ± 0,08 | 0,63 ± 0,09 | 0,61 ± 0,06 | −7,6 | 0,61 ± 0,08 | −7,6 | |
| Europoide | 0,63 ± 0,07 | 0,58 ± 0,2 | 0,57 ± 0,08 | −9,5 | 0,54 ± 0,07 | −14,3 | |
| Promedio | 0,65 ± 0,08 | 0,61 ± 0,09 | 0,6 ± 0,09 | −7,7 | 0,56 ± 0,09 | −7,8 | |
Tomada de Santos Hernández22.
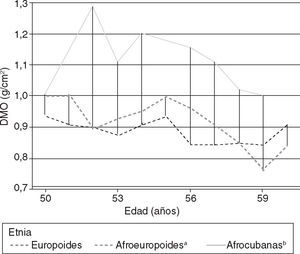
Todas las mujeres de 50 a 59 años de más de 5 años de amenorrea presentaron valores importantes de porcentaje de cambio o declinación de la DMO (expresada según el cociente por estatura) para las vértebras, al compararlas con la población autóctona joven. En el caso del cuello de fémur, se observó un comportamiento similar, excepto para la negroide cubana, donde resultó interesante observar sólo una reducción del 1,5%. Para ambos sitios anatómicos, la europoide mostró las mayores cifras de cambio, con una pérdida por encima del 10% (tabla 4).
En el caso del grupo de igual edad, pero con menos de 5 años de amenorrea, también se observaron valores de cambio de DMO con relación al grupo control; nuevamente, las europoides presentaron los valores mayores.
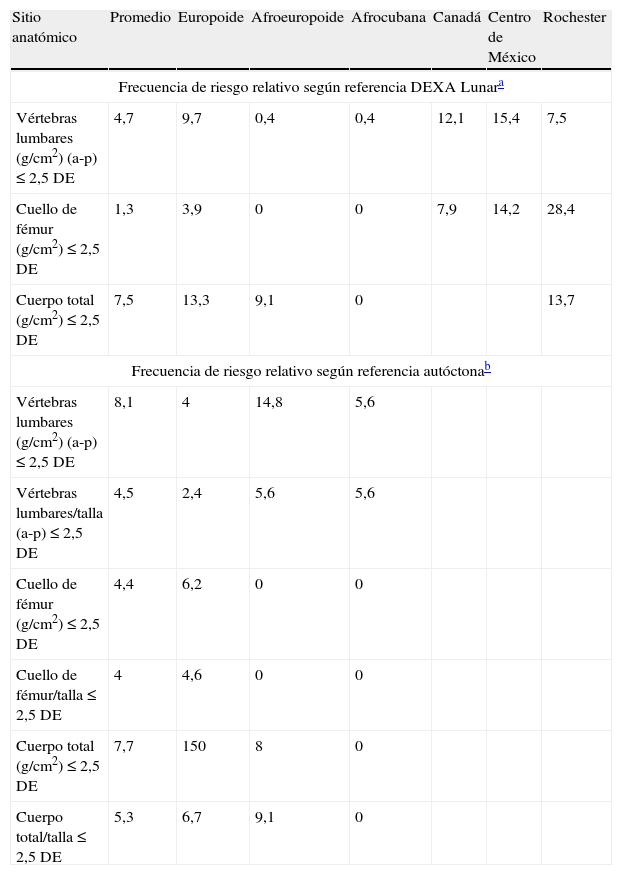
La tabla 5 muestra las frecuencias de riesgo relativo de osteoporosis y fracturas para la población estudiada. Se destaca la mayor frecuencia de riesgo para vértebras lumbares en el caso de las mujeres afroeuropoides, mientras que para las europoides el mayor riesgo fue para el cuello de fémur cuando se consideró como referencia el margen de riesgo de osteoporosis y fracturas (≤ 2,5 DE) de la población autóctona de igual edad.
Riesgo relativo de osteopenia y osteoporosis. Frecuencia (%) según margen de riesgo. Mujeres de 50 a 59 años (n = 307). Análisis comparativo según etnia y algunas poblaciones de referencias. Provincias occidentales de Cuba, 2007
| Sitio anatómico | Promedio | Europoide | Afroeuropoide | Afrocubana | Canadá | Centro de México | Rochester |
| Frecuencia de riesgo relativo según referencia DEXA Lunara | |||||||
| Vértebras lumbares (g/cm2) (a-p) ≤ 2,5 DE | 4,7 | 9,7 | 0,4 | 0,4 | 12,1 | 15,4 | 7,5 |
| Cuello de fémur (g/cm2) ≤ 2,5 DE | 1,3 | 3,9 | 0 | 0 | 7,9 | 14,2 | 28,4 |
| Cuerpo total (g/cm2) ≤ 2,5 DE | 7,5 | 13,3 | 9,1 | 0 | 13,7 | ||
| Frecuencia de riesgo relativo según referencia autóctonab | |||||||
| Vértebras lumbares (g/cm2) (a-p) ≤ 2,5 DE | 8,1 | 4 | 14,8 | 5,6 | |||
| Vértebras lumbares/talla (a-p) ≤ 2,5 DE | 4,5 | 2,4 | 5,6 | 5,6 | |||
| Cuello de fémur (g/cm2) ≤ 2,5 DE | 4,4 | 6,2 | 0 | 0 | |||
| Cuello de fémur/talla ≤ 2,5 DE | 4 | 4,6 | 0 | 0 | |||
| Cuerpo total (g/cm2) ≤ 2,5 DE | 7,7 | 150 | 8 | 0 | |||
| Cuerpo total/talla ≤ 2,5 DE | 5,3 | 6,7 | 9,1 | 0 | |||
DE: desviación estándar.
La negroide cubana presentó los valores menores para las vértebras, y ninguna frecuencia de riesgo para el cuello de fémur.
Se comprueba la diferencia que ocurre en el análisis cuando se toman valores de referencia distintos. Al considerar el margen de riesgo de osteoporosis y fracturas (≤ 2,5 DE) de la población autóctona de igual edad, el 4,4% de las mujeres promedio representantes del grupo de mujeres menopáusicas estudiadas tenían la DMO del cuello de fémur por debajo de ese sitio de corte evaluativo; sin embargo, esa frecuencia de riesgo relativo de osteoporosis y fractura ósea aparentemente disminuyó al 1,3% al realizar la evaluación según la referencia hispana de DEXA Lunar.
Lo contrario ocurrió para la negroide cubana, que presentó una altísima frecuencia de riesgo para las vértebras lumbares al compararla con la población autóctona y una frecuencia casi nula (0,4%) según la referencia hispana de DEXA Lunar; esto señala la importancia del grupo étnico en este tipo de análisis. Para el caso de la DMO de cuerpo total no se observaron diferencias importantes cuando se emplearon ambas poblaciones de referencia, excepto para el caso de la mujer europoide, cuya frecuencia de riesgo fue mayor (15%) en comparación con la población autóctona.
En la misma tabla 5 se observa la importancia de tener en cuenta la estatura para el análisis de riesgo. Cuando se empleó la DMO expresada como el cociente referido a la estatura (g/cm) y se utilizó como criterio de evaluación la referencia autóctona según origen étnico, la frecuencia probable para riesgo de osteoporosis y fractura del cuello de fémur para la población femenina europoide se redujo al 4,6%, del 6,2% que se obtuvo cuando no se incluyó la estatura; sin embargo, en las mujeres negroide-europoides y negroides cubanas no se observó ninguna diferencia.
DiscusiónHace 20 años la osteoporosis sólo podía diagnosticarse por la presencia de fracturas óseas. En 1994 un panel de expertos de la OMS recomendó el uso de un umbral de T-score —2,5 DE por debajo de la media de densidad ósea del adulto joven y desde entonces este criterio se ha convertido en el umbral aceptado en la práctica de la clínica nutricional4,13–16.
El límite de riesgo para la cifra de densidad ósea obtenido en la población de nuestra investigación estuvo por encima de la referencia establecida por la OMS para el límite crítico de riesgo de fractura para la mujer posmenopáusica hispana (0,67 g/cm2), lo cual ha reafirmado la desventaja de hacer el análisis sin realizar ajustes por estatura y considerando una población caucásica de referencia (tabla 3).
Cuando se compara el riesgo de fractura de vértebra con el de la población mexicana, sin utilizar criterio de normalización por estatura, la mujer mexicana-norteña evaluada según tecnología DEXA tiene un riesgo incrementado (30,3%), respecto a las investigadas en el contexto cubano, en tanto que las del centro de ese país presentan una situación comparable a la de nuestra mujer negroide-europoide o mestiza (tabla 4).
Cuando se utilizó la normalización según cociente para la estatura, se pudo apreciar que al tener en consideración los cambios de la estatura según transcurre la edad (considerados por nosotros en publicaciones anteriores19–21,28 como factores predictores importantes de los cambios de la masa ósea), se pudo demostrar que estas diferencias de la densidad ósea tenían un comportamiento singular vinculado al origen étnico, que algunos autores habían adjudicado solamente a las diferencias de tamaño corporal y no a las características antropológicas en sí mismas28,29 (tabla 4 y fig. 1).
Cuando se comparó este grupo con el de las mujeres de más de 5 años de amenorrea, se observó que estas últimas presentaban en general valores mayores de cambio, como era de esperarse. Sin embargo, fue interesante el hallazgo de que la negroide cubana de más de 5 años de amenorrea tuvo valores de cambio menores que su homóloga de menos de 5 años para el caso del cuello de fémur. También resultó llamativo el hecho de que las afroeuropoides de mayor o menor tiempo de amenorrea no mostraron variación en sus valores de cambio de DMO para vértebras y cuello de fémur.
Aparentemente, la mujer promedio de nuestra investigación es el resultado del aporte de cada una de las variantes étnicas de la población estudiada, por lo que de estos resultados se infiere que para estudios específicos de riesgo de osteoporosis y fracturas sería conveniente realizar los análisis teniendo en cuenta la etnia (tabla 4).
Merece destacarse lo observado para la negroide cubana, que presentó una altísima frecuencia de riesgo para las vértebras lumbares al compararla con la población autóctona y una frecuencia casi nula (0,4%) según la referencia hispana de DEXA Lunar; esto señala la importancia del grupo étnico en este tipo de análisis. Para el caso de la DMO de cuerpo total no se observaron diferencias importantes cuando se emplearon ambas poblaciones de referencia, excepto para el caso de la mujer europoide, cuya frecuencia de riesgo fue mayor (15%) en comparación con la población autóctona (tabla 5).
En las mediciones de densitometría de cuerpos totales (g/cm2) del promedio de esta población, la frecuencia de mujeres con criterio de riesgo de osteoporosis fue muy similar, tanto si se usaban como referencia los criterios de la DEXA Lunar para este parámetro en sus mujeres promedio (7,5%) o los criterios de márgenes de seguridad y riesgo de nuestra población sana joven (7,7%).
Cuando se analizó la densidad de cuerpo total de nuestra europoide según el límite utilizado por la referencia de la DEXA Lunar5,6,16, la frecuencia por debajo del límite de riesgo fue del 13,3%, muy similar a la información publicada por Melton et al10 con una población de Rochester. Cuando se aplicaron los criterios autóctonos de margen de riesgo a las evaluaciones realizadas en cuerpos totales, se encontró que el 15% estaba por debajo de ese sitio de corte.
Si se considera que en el estudio de esta población femenina se disponía del material evaluado de la densidad de los cuerpos totales (reconocido por muchos autores como la medida de referencia)4–8,16,19–21, podría aceptarse que sin dudas hubo una gran ventaja adicional para este análisis, por la mayor precisión que implica la valoración del esqueleto entero y que obvia el solapamiento encontrado con las medidas regionales.
En atención al alto coste y la factibilidad de los estudios de densitometría DEXA de cuerpo total para la evaluación de la composición corporal de sujetos especificados, debe estudiarse la medición priorizada de sitios anatómicos como las vértebras, el cuello del fémur, el triángulo de Ward y el trocánter del fémur, que han dado evidencias en nuestra población de una especificidad aceptable19–22.
Si se utiliza la recomendación de DMO (0,67 g/cm2) del Comité de Expertos de la OMS4 para la evaluación del riesgo de fractura de cuello de fémur y su aplicación al estudio de la osteoporosis posmenopáusica (de acuerdo con los sitios de corte identificados en nuestra población), significaría que el límite de riesgo de esta población estaría por debajo de 0,708 g/cm2 (déficit de más de 2,5 DE por debajo del promedio de la población autóctona)19–21.
El I Congreso Iberoamericano de Antropología redimensionó esta necesidad de precisiones metodológicas en el estudio de la etnia, y recomendó el análisis que considera minuciosamente el examen antropométrico sobre la base del ancho de la nariz, la altura de la órbita, la presencia de prognatismo del maxilar superior y el diámetro prostio-basio para clasificar a los sujetos con estos objetivos de investigación y que han podido validarse con diversos marcadores bioquímicos24,25.
La mujer caucásica en Estados Unidos parece tener una incidencia 2 veces mayor que la informada en población hispana4,10–15, según algunos autores que incluyen en estos criterios a los inmigrantes de México, América Central y del Sur30–33. Algunos autores informan una prevalencia inferior (—5,5%) de fractura de vértebra en mujeres posmenopáusicas chinas9 al descrito por métodos similares en la investigación de mujeres de Rochester10.
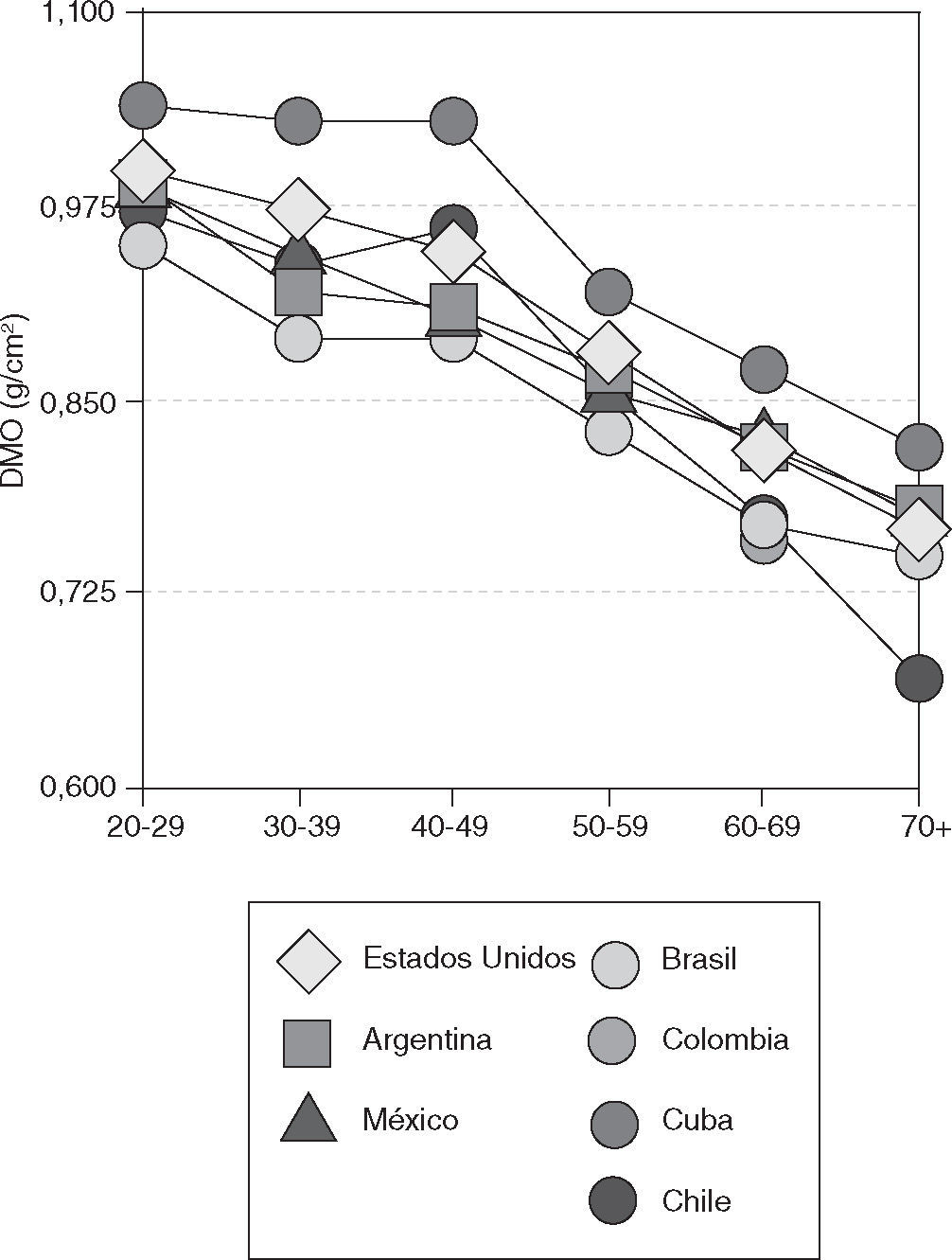
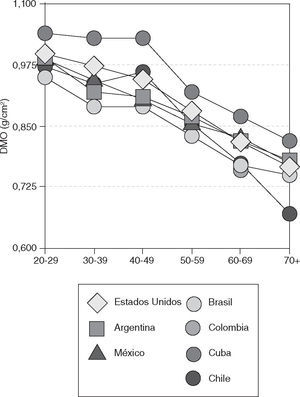
La información epidemiológica sobre este aspecto en Latinoamérica es escasa. Existen algunos pocos estudios en Argentina, Brasil, Chile y Venezuela32. Sobre este aspecto se reconoce la gran heterogeneidad y variación producida por los mestizajes frecuentes entre algunas poblaciones latinoamericanas24,25,30–33.
La investigación de Clark et al32 nos permite realizar un análisis comparativo de las respectivas densidades de cuello de fémur entre poblaciones medidas con la misma tecnología de densitometria DEXA-Lunar. En el caso de los datos de Chile, medidos por un equipo Norland, se hace ajuste al convertirlos por un factor de 0,043630 (fig. 2).
Ha sido difícil comparar la prevalencia de fracturas óseas en diversas regiones de Latinoamérica porque los estudios difieren en sus técnicas, criterios de selección de la muestra y definiciones empleadas para clasificar el origen étnico y diagnosticar la fractura. En el análisis multifactorial de la etiopatogenia de la pérdida de masa ósea, también se debe tener presente que países como Brasil y el área del Caribe tienen una considerable proporción de población de origen africano, mientras que en países de Centroamérica se encuentra un mestizaje entre indígenas y europeos de origen hispano, que han sido comentados como población “matzo” o mestiza10,14,30–32 diferente de la anterior.
La mayor especificidad encontrada al aplicar los criterios de márgenes de riesgo autóctonos se reveló con una diferencia para la vértebra lumbar desde una frecuencia de riesgo relativo del 4,7% (cuando se aplicó el criterio de la DEXA Lunar en g/cm2) hasta el 8,1%, cuando se utilizaron nuestras referencias de población joven sana en la mujer cubana promedio.
Esta mayor precisión se demostró en el cuello de fémur, considerado como sitio idóneo en ausencia de mediciones de cuerpos totales10,14,16, con un aparente incremento del riesgo relativo desde el 1,3 al 4,4%, al utilizar las referencias locales22.
Las diferencias señaladas pueden interpretarse como el resultado de la interacción genética ambiental experimentada por estas poblaciones, que se expresa en la edad en que se alcanza el máximo de desarrollo de esas características de la densidad ósea, la declinación con la interactuación de la edad, el tiempo de amenorrea y el estilo de vida, así como el papel importante que ha desempeñado la dieta10,14,19–21,24–26,28–33.
Cuando la alimentación de la población es abundante en proteínas de origen animal y escasa en frutas y vegetales, se ha especulado que puede producirse una relación aproximada de que por cada 10 g per cápita adicionales de proteína animal se incremente la tasa de riesgo de 20 fracturas de cadera/100.000 personas/año34–36.
Países como China, con una tasa baja anual de incidencia de fracturas de cadera de 2,9/100.000 habitantes, pese a una reconocida baja densidad ósea, que se ha interpretado como una característica propia del origen étnico asiático9, presentan una dieta promedio donde la relación de proteínas vegetales/animales es de 4,8, que lo ubica en la posición más alta de la escala que citan Frassetto y Sebastian36.
Según estos criterios de interactuación de factores nutricionales con la frecuencia de fractura de cadera, la población cubana se puede situar en riesgo intermedio21, de acuerdo con estudios dietéticos realizados35,36, Cuba mantenía cifras de relación de consumo per cápita para las proteínas vegetales/animales de una tasa de 1,15 como promedio anual, con algunas variaciones estacionales de aproximadamente 1,2 en la ingestión dietética de la primavera y 1,1 durante la etapa invernal37,38.
El estudio realizado en familias caucásicas por Tang et al ha contribuido a identificar la unión de sitios que determinan la influencia genética integrada de la masa magra y sitios anatómicos específicos de la masa ósea. Este hallazgo fundamenta un análisis integrado en la evaluación nutricional de la composición corporal, que tenga en cuenta este tipo de mecanismos en las causas, cuando se trata de identificar y analizar la frecuencia de riesgo del exceso de adiposidad y de pérdida de masa ósea39,40.
La posibilidad de contar con valores locales de referencia de indicadores de densidad ósea y composición corporal como la masa magra, la masa ósea y la masa grasa, derivados de la población autóctona mediante tecnologías de avanzada que se distinguen por la exactitud instrumental, como el DEXA, permitiría mejorar (léase sensibilidad y especificidad) los criterios diagnósticos biofísicos de la osteoporosis en la población cubana22,28.
Sin embargo, debe reconocerse que entre las limitaciones potenciales para la representatividad de esta población, los ya descritos criterios de inclusión no permiten considerarla como una muestra probabilística a los efectos de un problema multifactorial como el que se aborda en este artículo.
La aplicación de criterios de evaluación autóctonos ha adquirido una importancia relevante para el diagnóstico en la práctica de la clínica nutricional, al constituirse en una estrategia para el perfeccionamiento de los sistemas clínicos de diagnóstico, por cuanto permite una adecuada identificación de los límites de distribución de los indicadores de interés para una población cubana sana, de forma tal que considere las posibles adaptaciones de estudios y técnicas de este perfil tecnológico a las realidades locales.
ConclusionesSe estudia y se caracterizan los cambios de la masa mineral ósea según densitometría, así como la frecuencia del riesgo relativo de osteoporosis en una población femenina seleccionada sana, mayor de 49 años de edad, en plena actividad laboral, obtenida en las provincias occidentales de Cuba; se utilizó como criterio de evaluación la Referencia Autóctona de Márgenes de Seguridad y de Riesgo22 de la densidad ósea.
| T-score | Riesgo de fractura | |
| Normal | T-score entre —1 y +1. Cifras de densidad mineral ósea que no se desvíen más de 1 desviaciones estándar (DE) de la cifra media de un adulto joven (20–40 años, pico de masa ósea) | Normal |
| Osteopenia | T-score entre —1 y —2,5. Cifras de densidad mineral ósea entre 1 y 2,5 DE por debajo del pico de masa ósea del adulto joven | Doble que normal |
| Osteoporosis | T-score por debajo de —2,5. Cifras de densidad mineral ósea por debajo de 2,5 DE con respecto al pico de masa ósea del adulto joven | Cuádruplo que normal |
| Osteoporosis establecida | T-score por debajo de —2,5 y presencia de una o más fracturas relacionadas con fragilidad ósea | Cada DE que disminuye la masa ósea, multiplica el riesgo de fractura por 2 |
| Osteoporosis severa | T-score entre —3,5 y —4,5 |