Resultados
Con fecha 17 de julio de 2002 se habían registrado 1.786 pacientes en BIOBADASER, procedentes de 72 centros (anexo 1), con un total de 1.843 ciclos de tratamientos (57 pacientes han estado en tratamiento con más de un agente biológico en momentos distintos de su evolución).
Descripción de los pacientes registrados
El 72% de los pacientes registrados son mujeres (n = 1.286). La edad media es de 52 ± 15 años, siendo la proporción de niños (menores de 16 años) del 1,7% (n = 30). En la tabla 1 se exponen los diagnósticos de los pacientes que recibieron terapias biológicas y han sido registrados en BIOBADASER.
Descripción de los ciclos de tratamiento registrados
Los dos agentes biológicos registrados hasta el momento son etanercept e infliximab. El 86,5% de los 1.843 tratamientos registrados corresponden a infliximab (n = 1.594).
Supervivencia del fármaco
Se han registrado 288 interrupciones del tratamiento (15,6%), en la mayoría de las ocasiones como resultado de un acontecimiento adverso (n = 166; 57,6%), seguido de ineficacia (n = 78; 27,7%). En 44 casos (15,3%) el motivo de interrupción fue distinto de los previos, incluyendo: decisión del paciente (25), mejoría (4) y embarazo (3). En 57 ocasiones, como ya se ha mencionado, la interrupción se siguió del inicio de tratamiento con otro agente biológico.
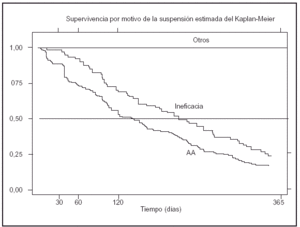
La figura 1 muestra la curva de supervivencia de las terapias biológicas registradas en BIOBADASER. La supervivencia del fármaco a 1 y 6 meses y 1 y 2 años es, respectivamente, de: 0,98 (0,98-0,99), 0,91 (0,89-0,92), 0,85 (0,84-0,87) y 0,81 (0,78-0,83). Hasta 10 pacientes han estado en tratamiento con etanercept o infliximab por más de 2 años y medio, y uno durante más de 3 años. La duración del tratamiento no se asocia con el sexo (log-rank p = 0,546) ni con el tipo de fármaco (infliximab o etanercept) (log-rank p = 0,959); sin embargo sí está condicionada por el motivo de suspensión del fármaco (log-rank p = 0,075) (fig. 2).
Figura 1. Curva de supervivencia de las terapias biológicas en BIOBADASER.
Figura 2. Supervivencia del fármaco por motivo de su suspensión.
Descripción de los acontecimientos adversos
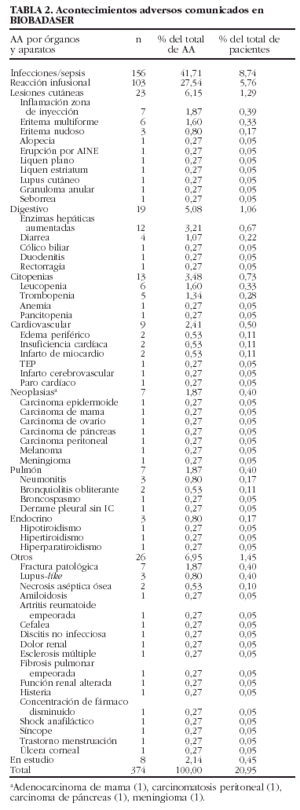
Se comunicaron 374 acontecimientos adversos en 299 pacientes (en 40 pacientes se comunicaron 2 acontecimientos, en nueve 3 acontecimientos, en uno 4 acontecimientos y en tres 5 o más acontecimientos). El tipo de acontecimiento adverso más frecuente fue la infección (n = 156; 42%), seguido de las reacciones infusionales (n = 103; 27,5%) y los trastornos cutáneos (n = 23; 6%). La tabla 2 muestra un listado de todos los acontecimientos notificados. Ninguno de los tipos generales de acontecimientos está asociado estadísticamente con el tipo de fármaco empleado.
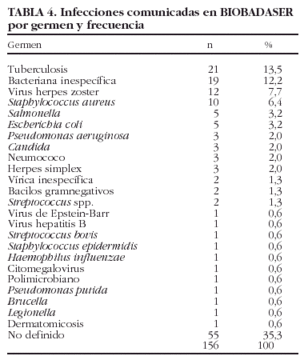
En las tablas 3 y 4 se exponen las localizaciones y gérmenes implicados en las infecciones, respectivamente.
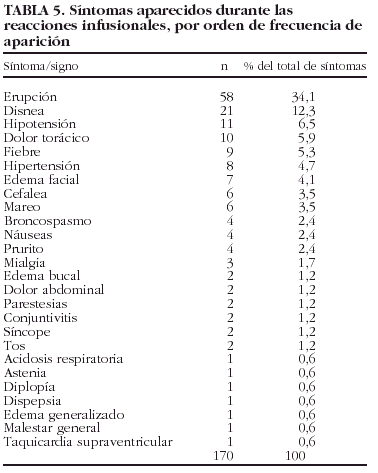
La tabla 5 muestra los 170 tipos de síntomas y signos aparecidos en las 103 reacciones infusionales con infliximab. La mediana del tiempo de aparición de la reacción respecto de la infusión fue de 0 h, con un rango entre 0 y 240 h (P25-75 = 0-0).
En total se han registrado 20 fallecimientos de pacientes. Los fallecidos bajo terapia con infliximab fueron 18, cuyas causas de muerte fueron: 13 casos por infección: una tuberculosis diseminada, 3 sepsis (Pseudomonas, Staphylococcus aureus y una no identificada), 4 neumonías (por gérmenes no identificados) y 2 abscesos (uno cerebral y uno hepático) y un caso de endocarditis por S. epidermidis; en tres casos la causa de fallecimiento fue el fallo pulmonar: una bronquiolitis obliterante en el seno de una artritis reumatoide (AR), una neumonitis intersticial aguda en un caso de esclerosis sistémica y uno por progresión de fibrosis pulmonar en paciente con AR; en un caso adicional la muerte sobrevino por fallo hepático secundario a isoniacida pautada por infección tuberculosa y en 3 ocasiones la causa de la muerte no pudo ser identificada. Dos pacientes fallecieron estando en tratamiento con etanercept, uno por neumonía causada por Pseudomonas y otro por sepsis de origen intestinal.
En cuanto a los tratamientos concomitantes y comorbilidad de los pacientes que presentaron acontecimientos adversos, las tablas 6 y 7 muestran, respectivamente, los fármacos que utilizaban al menos dos pacientes y la comorbilidad que presentaron los pacientes con acontecimientos adversos.
Comité Científico de BIOBADASER*
Sociedad Española de Reumatología Madrid. España
*Comité científico de BIOBADASER:
Juan Gómez-Reino Carnota, Reumatología, Hospital Universitario de Santiago, Santiago de Compostela; Loreto Carmona, Reumatología, Hospital Clínico San Carlos, Madrid. Dolores Montero, División de Farmacoepidemiología y Farmacovigilancia, Agencia Española del Medicamento, Madrid; Emilio Martín Mola, Reumatología, Hospital la Paz, Madrid; Jordi Carbonell Abelló, Reumatología, Hospitales del Mar y de la Esperanza, Barcelona; Vicente Rodríguez Valverde, Reumatología, Hospital Marqués de Valdecilla, Santander; Eliseo Pascual Gómez, Reumatología, Hospital General de Alicante, Alicante; Jesús Tornero Molina, Reumatología, Hospital General de Guadalajara, Guadalajara; Manuel Figueroa Pedrosa, Reumatología, Hospital Ntra. Sra. de Aranzazu, San Sebastián; Rafael Cáliz Cáliz, Reumatología, Hospital Virgen de la Nieves, Granada; Juan Mulero Mendoza, Reumatología, Hospital Puerta de Hierro, Madrid; Armando Laffón Roca, Reumatología, Hospital de la Princesa, Madrid; José Luis Marenco de la Fuente, Reumatología, Hospital de Valme, Sevilla; Luis Carreño Pérez, Reumatología, Hospital Gregorio Marañón, Madrid; Xavier Tena Marsa, Reumatología, Hospital Germans Trias i Pujol, Barcelona; Jose M.ª Álvaro-Gracia, Reumatología, Hospital de la Princesa, Madrid.
BIOBADASER se realiza en colaboración con la División de Farmacoepidemiología y Farmacovigilancia de la Agencia Española del Medicamento.