Introducción
La evaluación de la artritis reumatoide (AR) ha sufrido un importante cambio a lo largo de las dos últimas décadas con el desarrollo de instrumentos que han permitido la cuantificación de los efectos clínicos de las intervenciones1. Estos instrumentos han sido diseñados fundamentalmente pero no exclusivamente para su utilización en ensayos clínicos aleatorizados2-4. Tras una fase inicial en la que el gran número de medidas de desenlace utilizadas y su falta de estandarización han hecho difíciles las comparaciones, se ha establecido el conjunto de instrumentos que se debe emplear en los ensayos clínicos aleatorizados5-9. Además, también se ha propuesto el conjunto de variables que deberían ser incluidas en los estudios observacionales10-12. Ello ha supuesto un tránsito de una reumatología «cualitativa» a una reumatología «cuantitativa», en la que la actividad de la enfermedad y sus repercusiones han dejado de ser una apreciación intuitiva para pasar a ser un fenómeno medible13.
Aunque este tipo de medidas de desenlace se ha convertido en habitual e incuestionable dentro de la investigación clínica, su implantación en la práctica diaria es muy escasa. Y ello a pesar de que la medición cuantitativa de aspectos relacionados con la enfermedad puede ofrecer varias ventajas en la consulta general como: a) proporcionar información objetiva sobre la gravedad de la enfermedad; b) clasificar al paciente dentro del espectro continuo de la enfermedad, y c) tener importantes connotaciones sobre las decisiones que deben tomar el médico, el paciente y terceras partes. Los motivos por los que no se ha generalizado el uso de tales instrumentos son fáciles de comprender, tanto en nuestro medio como en otros países14,15. Sin embargo, en la actualidad hay en España un interés creciente por sustituir el sistema clásico de evaluación de la actividad de la enfermedad que es insuficiente, poco reproducible y no cuantitativo, por otro modelo que sea capaz de plasmar el impacto de la enfermedad y el efecto del tratamiento1. Así, el Comité de Expertos de la Sociedad Española de Reumatología ha recomendado incluir entre los parámetros para evaluar la respuesta a la terapia con inhibidores del TNF y otros fármacos inductores de remisión, el recuento del American College of Rheumatology (ACR), la evaluación del dolor y de la actividad de la enfermedad médico y paciente mediante una escala analógica visual, y la evaluación de la capacidad funcional mediante el Health Assessement Questionnaire modificado16.
El estudio sobre la variabilidad en el manejo de la AR (emAR) ha supuesto una oportunidad para conocer algunas características de los pacientes con AR atendidos en servicios de atención especializada del territorio nacional, así como la posibilidad de describir y cuantificar los recursos dedicados a ello. En este artículo se describen los datos obtenidos sobre el seguimiento de los pacientes con AR en nuestro país y se analizan las hipotéticas barreras que impedirían la generalización del uso de este tipo de medidas de desenlace en la evaluación de estos enfermos.
Material y métodos
Selección de la población de estudio
Los métodos y características de la población estudiada en el estudio emAR se han descrito en detalle en otras publicaciones17,18. En resumen, la unidad de estudio fueron las historias clínicas (HC) de individuos mayores de 16 años con diagnóstico de AR que hubieran sido atendidos en servicios de atención especializada de todo el territorio nacional. Se recogieron todos los datos producidos en los dos años previos a la fecha de revisión de la HC (realizada durante 1999-2000, dependiendo de los centros), en cuestionarios estandarizados diseñados específicamente por el equipo investigador. Además, la persona designada en cada centro para realizar el estudio (habitualmente un médico) recibió un extenso cuaderno con las instrucciones y definiciones necesarias para asegurar la homogeneidad en la recogida de datos.
Se realizó un muestreo estratificado por comunidades autónomas (CCAA) y bietápico por centros hospitalarios y pacientes. Para una precisión del 5%, un error alfa de un 5% y un efecto diseño de 3, se consideró una muestra mínima de 1.085 HC que, asumiendo un 15% de HC no localizables y un 15% de incompletas, implicó la aleatorización de 1.550 HC en todo el territorio nacional. La asignación de HC a cada comunidad autónoma fue proporcional a su población, con una asignación mínima de 25 HC en las CCAA con menor número de habitantes. Para llevar a cabo la selección se obtuvo un listado de centros hospitalarios a partir del Catálogo Nacional de Hospitales de 1996. Se excluyeron los centros en los que no existían las especialidades de medicina interna o reumatología. Se realizó una selección aleatoria de los centros dentro de cada comunidad autónoma, de forma que su probabilidad de elección fuera proporcional al número de camas (variable subrogada de la población atendida). Se solicitó a los centros que remitieran un listado de todos los pacientes con AR que hubieran sido atendidos en dicho centro durante los años 1997 y 1998. El hospital que rechazaba participar era sustituido por el siguiente de la lista de aleatorización dentro de cada comunidad autónoma.
Una vez obtenidos los listados de una misma comunidad autónoma, se realizó un muestreo sistemático con el que se obtuvo la población de estudio para cada comunidad autónoma. Las HC que tras la revisión no correspondían a pacientes con AR fueron sustituidas dentro de cada centro por la siguiente HC dentro de la lista de aleatorización. Las HC no localizables o incompletas no fueron sustituidas. El tamaño muestral final fue de 1.379 HC resumidas. No hubo diferencias significativas en el número de HC no localizadas o incompletas entre CCAA.
Variables analizadas
Se analizó la forma de seguimiento clínico de los pacientes, incluyendo una estimación semicuantitativa del número de visitas (nunca, ocasionalmente, habitualmente o siempre) en las que se había utilizado alguno de los siguientes criterios: a) duración de la rigidez matutina; b) evaluación articular mediante elementos descriptivos de las articulaciones inflamadas, dolorosas, afectadas y dañadas o deformadas, o recuentos articulares formales (recuento del ACR19, índice articular de Ritchie20, recuento de 28 articulaciones21 u otro tipo de recuento articular); c) valoración del dolor (adjetiva, escala analógica visual o escala de Lickert); d) valoración de la actividad de la enfermedad por el médico y el paciente (mediante escalas adjetivas igual/mejor/peor o ninguna/leve/moderada/severa o escala analógica visual); e) valoración de la capacidad funcional mediante instrumentos cuantitativos (fuerza de la mano, tiempo de marcha en 15 metros), descriptivos (clase funcional del ACR22, clase funcional de Steinbrocker23) o cuestionarios de funcionalidad (Health Assessment Questionnaire24,25, Arthritis Impact Measurement Scales26,27, entre otros), y f) cuestionarios de calidad de vida (Medical Outcome Survey Short Form-36 o 1228, Nottingham Impact Profile29 y Sickness Impact Profile30, entre otros). En los pacientes que eran evaluados cada 6 meses con medidas contrastadas (número de articulaciones dolorosas y tumefactas, escalas analógicas visuales, HAQ, etc.) con visitas intermedias en las que no se realizaban estas medidas, se consideró que se las recogía habitualmente.
Como parte del protocolo de estudio, se recogieron además las siguientes variables: a) variables sociodemográficas (fecha de nacimiento, sexo, estado civil, nivel de educación, profesión, situación laboral y lugar de residencia); b) características de la enfermedad (fecha de inicio, factor reumatoide, clase funcional de Steinbrocker, valores máximo y mínimo de velocidad de sedimentación globular [VSG] y proteína C reactiva [PCR], número máximo y mínimo de articulaciones inflamadas a lo largo del período de estudio, comorbilidad, manifestaciones extraarticulares); c) características del médico responsable (edad, sexo, especialidad, vía de formación, cargo asistencial y actividades profesionales pública y privada), y d) características generales del centro y del servicio (localización, nivel del centro, población atendida, distribución de la población [rural y urbana], número de camas, especialidad del servicio, ámbito de asistencia a pacientes con AR [sólo en el hospital, sólo en centros de especialidades o en ambos], número de médicos de plantilla, formación de residentes y número de residentes por año, número de ingresos anuales, número de consultas [primeras y sucesivas], demora de consultas, sistema de monitorización de fármacos [en el hospital, en atención primaria o compartido], existencia de consultas específicas [consultas monográficas de AR, consultas multidisciplinarias, consulta de enfermería, consulta telefónica], y realización de ensayos clínicos o investigación clínica en AR u otras enfermedades).
Introducción de los datos en soporte magnético y control de calidad
Todos los cuestionarios fueron revisados por un miembro del equipo investigador (V.V.G.), e introducidos, por dicho investigador o un administrativo especialmente entrenado, en una base de datos relacional creada a tal efecto. Los datos fueron exportados a una hoja de cálculo (JMP®, SAS Institute Inc., Cary, NC, EE.UU.) para su análisis estadístico. Para asegurar la calidad de los datos se siguieron las siguientes estrategias: se elaboró un cuaderno de instrucciones que contenía todas las definiciones para cada una de las preguntas del cuestionario; se realizó un estudio piloto en dos centros con la participación de seis revisores de HC y un total de 185 HC revisadas, que no detectó errores importantes en el cuaderno de recogida de datos; la base de datos fue depurada mediante un protocolo de monitorización para la detección de inconsistencias o campos con valores perdidos sin que se detectaran errores sistemáticos en la introducción de datos y menos del 2,5% de errores aleatorios, que fueron corregidos.
Análisis estadístico
Se consideraron variables dependientes las variables principales relacionadas con el seguimiento clínico y como variables independientes las relacionadas con las características del paciente, de la enfermedad, del servicio/hospital y del médico. Para el análisis descriptivo se utilizó la media (± desviación estándar) o la mediana (desviación intercuartil, percentiles 25-75) para las variables continuas, según se ajustaran a una distribución normal o no, y el porcentaje para las variables cualitativas. Se analizaron las asociaciones univariantes mediante regresión logística utilizando como variable dependiente el uso de diferentes instrumentos de seguimiento, mostrándose los resultados como odds ratio (OR) con el correspondiente intervalo de confianza (IC) del 95% asociado.
Resultados
Instrumentos básicos de seguimiento
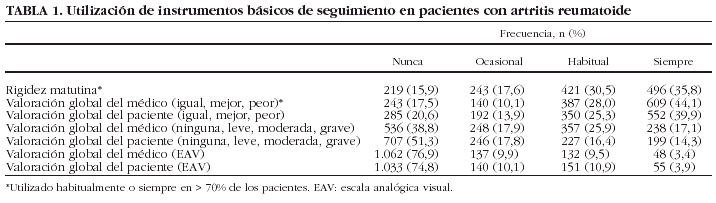
La valoración de la rigidez matutina y la valoración subjetiva del médico en una escala adjetiva, constaban habitualmente o siempre en más del 70% de las visitas clínicas (tabla 1). El uso de otro tipo de escalas fue mucho menos frecuente, de forma que hasta en un tercio de las HC, apenas había referencias (nunca u ocasionalmente) de la valoración subjetiva del paciente de su enfermedad.
La utilización de escalas analógicas visuales (EAV) fue muy infrecuente. La evaluación de la actividad de la enfermedad por parte del médico y del paciente mediante una EAV, fue menos frecuente en los servicios que sólo atendían a los pacientes en el hospital que con la atención en el hospital y ambulatorio de especialidades (OR = 0,53; IC del 95%, 0,4-0,69; p = 0,00001). Por el contrario, fue más probable en los servicios con médicos residentes (OR = 2,4; IC del 95%, 1,87-3,19; p = 0,00001). Ninguna otra variable se correlacionó significativamente con la utilización de este tipo de medición de actividad de la enfermedad.
Recuentos articulares
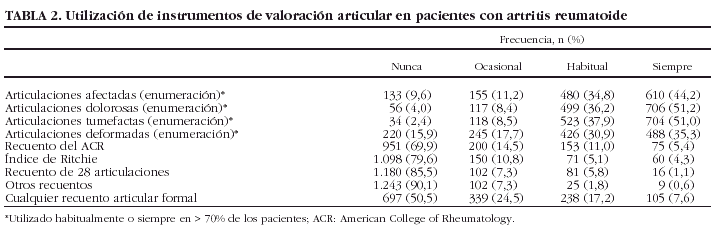
La tabla 2 muestra la frecuencia con la que se utilizaron las diferentes formas de describir la afección articular. En más del 70% de las HC revisadas había una enumeración simple de las articulaciones afectadas, dolorosas, inflamadas o deformadas. Ningún tipo de recuento formal fue utilizado siempre u ocasionalmente en un porcentaje significativo de pacientes (en conjunto sólo el 22,8% de los pacientes tenía recuentos articulares en todas o la mayor parte de las visitas). Sin embargo, casi la mitad de los pacientes (49,5%) tenía al menos un recuento formal de articulaciones dolorosas y tumefactas durante los 2 años de seguimiento. El recuento más utilizado fue el índice completo del ACR, seguido del índice de Ritchie y del recuento de 28 articulaciones de Fuchs.
Ninguna de las características demográficas del paciente ni de la enfermedad se correlacionó significativamente con una mayor probabilidad de recuentos articulares durante el seguimiento. En cuanto al tratamiento empleado, fue más probable que los pacientes tratados con fármacos modificadores de la enfermedad (FME) hubieran tenido al menos un recuento formal a lo largo del seguimiento (OR = 1,66; IC del 95%, 1,08-2,6; p = 0,02) que los que no habían tomado ninguno. No se observaron diferencias respecto al uso de AINE, corticoides o combinaciones de FME.
Con respecto a las características del servicio o el hospital, hubo una proporción significativamente menor de pacientes con al menos un recuento formal entre los que fueron atendidos sólo en el hospital en comparación con aquellos atendidos en el ambulatorio y en el hospital (OR = 0,65; IC del 95%, 0,51-0,8; p = 0,0001). Por el contrario, la probabilidad de que los enfermos tuvieran un recuento articular aumentó en los servicios que disponían de consulta de enfermería (OR = 1,43; IC del 95%, 1,15-1,47; p = 0,001) y en los que se realizaban ensayos clínicos en AR (OR = 1,31; IC del 95%, 1,05-1,63; p = 0,01). Ninguna de las características del médico responsable se correlacionó con la existencia de recuentos articulares.
Valoración del dolor
La valoración subjetiva del dolor mediante una escala adjetiva, quedó reflejada en la HC con escasa frecuencia (tabla 3). Sólo en un 11,8% de los pacientes se utilizó una EAV habitualmente o siempre a lo largo del estudio (un 21,1% tenía al menos una valoración del dolor mediante EAV), siendo éste el instrumento utilizado con más frecuencia. El uso de escalas de tipo Lickert fue anecdótico.
La utilización de una EAV de dolor fue menos frecuente en los pacientes tratados con corticoides que en los que no lo fueron (OR = 0,62; IC del 95%, 0,47-0,62; p = 0,0008); por el contrario, fue más probable en pacientes tratados con FME (OR = 1,84; IC del 95%, 1,02-3,6; p = 0,05) que en los que recibían tratamiento combinado con dos o más FME. Ninguna de las características demográficas del paciente ni de la enfermedad se correlacionó significativamente con una mayor probabilidad de valoración del dolor mediante EAV.
Respecto a las características del médico, hubo una tendencia significativa a que la utilización de EAV disminuyera con la edad del médico responsable (coeficiente ± EE, 0,04 ± 0,01 por año de edad; p = 0,001) y aumentara en los pacientes cuyo médico responsable era varón (OR = 1,98; IC del 95%, 1,37-2,92; p = 0,0004). La proporción de pacientes con al menos una evaluación del dolor mediante EAV fue significativamente menor entre los que fueron atendidos sólo en el hospital en comparación con los atendidos en el ambulatorio y en el hospital (OR = 0,30; IC del 95%, 0,22-0,41; p = 0,0001). Por el contrario, la probabilidad de tener al menos una EAV de dolor era mayor en los servicios con médicos residentes (OR = 3,39; IC del 95%, 2,52-4,63; p = 0,0001), consulta monográfica de AR (OR = 4,41; IC del 95%, 3,36-5,78; p = 0,0001), ensayos clínicos en AR (OR = 5,52; IC del 95%, 3,49-9,24; p = 0,0001) y consulta de enfermería (OR = 3,56; IC del 95%, 2,72-4,68; p = 0,0001). Hubo también una tendencia a utilizar este tipo de determinación con mayor frecuencia en los servicios con un programa de atención compartida de pacientes con AR con atención primaria.
Valoración del estado funcional y el estado general de salud
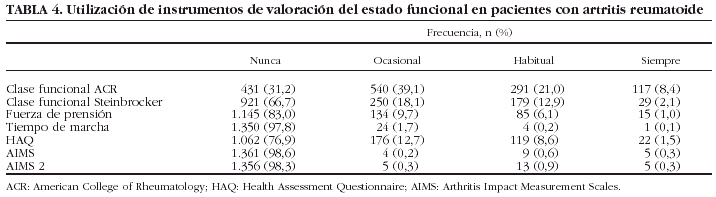
Ninguno de los instrumentos de valoración del estado funcional y del estado general de salud era utilizado habitualmente en la práctica clínica diaria (tabla 4). La clasificación funcional del ACR fue el instrumento de valoración funcional más utilizado (al menos una vez durante el seguimiento en el 68,4% de los pacientes), seguido de la clasificación funcional de Steinbrocker (33,1%) y el cuestionario HAQ en sus dos versiones (23%). El uso de otros instrumentos como el Arthritis Impact Measurement Scales (AIMS) en cualquiera de sus dos versiones, Medical Outcome Survey Short-Form36 (SF-36) y 12 (SF-12), Nottingham Health Profile (NHP) y Sickness Impact Profile (SIP), entre otros, osciló entre el 0 y el 1,5%.
Se analizaron los factores relacionados con la existencia de al menos una valoración mediante el cuestionario HAQ. La utilización de este instrumento fue más probable en los servicios de reumatología (OR = 3,36; IC del 95%, 1,98-6,18; p = 0,00001) y en los pacientes tratados con FME (OR = 2,02; IC del 95%, 1,12-3,9; p = 0,02) o combinaciones de FME (OR = 1,36; IC del 95%, 1,03-1,79; p = 0,02). Fue también más frecuente en los servicios con médicos residentes (OR = 1,6; IC del 95%, 1,23-2,09; p = 0,0004), consulta monográfica de AR (OR = 5,56; IC del 95%, 4,25-7,29; p = 0,00001), consulta de enfermería (OR = 6,76; IC del 95%, 5,08-9,09; p = 0,00001) y ensayos clínicos en AR (OR = 2,32; IC del 95%, 1,64-3,35; p = 0,00001). Ninguna otra variable se asoció significativamente con una frecuencia de uso mayor o menor del HAQ.
Criterios objetivos de mejoría
Con el objetivo de explorar la posible aplicación de los criterios de mejoría del ACR31,32 o del Disease Activity Score (DAS)33,34, se analizó la proporción de pacientes de la muestra que tenían al menos un recuento articular formal, una valoración del dolor mediante EAV, una valoración general del paciente mediante EAV y una valoración del estado funcional mediante el HAQ (asumiendo que todos ellos tenían al menos una valoración de un reactante de fase aguda como la VSG o la PCR en el momento de la valoración). Con estas premisas, sólo hubiera sido posible aplicar los criterios del ACR en 20 pacientes (1,45% del total) y sólo hubiera sido posible calcular un DAS en 154 (11,1% del total).
Discusión
Nuestros resultados ponen de manifiesto un escaso uso de herramientas cuantitativas en la evaluación y seguimiento de los pacientes con AR en la práctica clínica diaria de nuestro país. Y ello a pesar de que estos instrumentos ya forman parte de una cultura asumida en el ámbito de la reumatología para la publicación de estudios, conceder autorización de nuevos fármacos, evaluar el impacto de modalidades terapéuticas no farmacológicas, la evaluación económica de la enfermedad o su impacto en el individuo a largo plazo13,35,36. De hecho, la aplicación de estas mediciones ha tenido mucho que ver en el cambio de consideración de la AR de una enfermedad «de buen pronóstico en la mayoría de los pacientes»37 a una enfermedad «en muchos casos crónica y progresiva que resulta en incapacidad funcional y a veces la muerte»38.
Nuestros resultados demuestran, sin embargo, que la mayor parte de los pacientes son seguidos de una forma «tradicional», mediante escalas adjetivas en el mejor de los casos, y con una presencia muy baja de instrumentos cuantitativos. La rigidez matutina sigue siendo el parámetro más utilizado en nuestro país, al menos el que más veces queda reflejado en la HC del paciente, a pesar de haber sido excluido del conjunto mínimo de datos del ACR y el EULAR. Es probable que su presencia como criterio diagnóstico y de remisión de la enfermedad, la facilidad con la que se obtiene este dato y su aceptable correlación con otros parámetros clínicos y analíticos, perpetúen su uso. La valoración del dolor o del estado global de la enfermedad (médico y paciente) mediante EAV, del estado funcional mediante un cuestionario estandarizado o del número de articulaciones dolorosas y tumefactas mediante un recuento formal, no llegó al 25% de la muestra en el mejor de los casos, aun considerando su medición sólo una vez a lo largo del seguimiento. En conjunto, la proporción de pacientes que podía haber sido evaluada según los criterios de mejoría del ACR o el EULAR puede considerarse anecdótica. Estas cifras describen un panorama muy alejado de las recomendaciones del Grupo de Expertos de la SER para evaluar la AR en su consenso sobre la terapia con inhibidores del TNF y otros fármacos inductores de remisión16.
La disponibilidad de consulta de enfermería, consulta monográfica de AR, ensayos clínicos en esta enfermedad y la formación de médicos residentes se asociaron con una mayor utilización de estos instrumentos de medición en nuestro estudio. Parece razonable pensar que los centros en los que se utilizaban estas herramientas cuantitativas disponen de una mayor infraestructura o aprovechan la realización de investigación clínica o ensayos clínicos en AR para incorporarlos a la práctica diaria. Sólo un hecho de estas características explicaría que los recuentos articulares más frecuentes fueran precisamente los más complejos. Sin embargo, la disponibilidad de este tipo de recursos no refleja meramente una mayor infraestructura, sino también una actitud distinta hacia el seguimiento de los enfermos con AR.
La resistencia a usar estos instrumentos cuantitativos en el seguimiento de pacientes con AR en la práctica diaria tiene probablemente un origen multifactorial. En primer lugar, podría haber dudas sobre la validez, la fiabilidad y la reproducibilidad de estos instrumentos en nuestro medio. Sin embargo, en la actualidad, la mayoría de las mediciones recomendadas cuenta ya con versiones lo suficientemente validadas y contrastadas en nuestro país, como para no considerarlo un impedimento mayor39-42.
En segundo lugar, los propios médicos pueden desconfiar de la utilidad de estas determinaciones en la práctica clínica diaria. No hay ningún estudio que haya demostrado los beneficios de este tipo de seguimiento desde el punto de vista de la toma de decisiones, la calidad en el manejo, la utilización de recursos sociosanitarios o el desenlace en pacientes individuales. Gran parte de la información que se obtiene con estos instrumentos se puede obtener mediante una entrevista convencional con el paciente. Sin embargo, sabemos que reflejan medidas de desenlace importantes para el paciente que, en ocasiones, son difíciles de poner de manifiesto de otra manera durante una visita clínica convencional43,44. Por ejemplo, muchos pacientes con AR de larga evolución terminan adaptándose a su situación de modo que, incluso para ellos, su incapacidad funcional puede pasar inadvertida. Un cuestionario puede poner de manifiesto áreas específicas en las que el paciente esté teniendo dificultades, aunque él no sea consciente de ello. Además, este tipo de instrumentos puede permitir la clasificación del paciente dentro de un espectro continuo de la enfermedad con importantes repercusiones sobre las decisiones referidas a su tratamiento16,45.
Existen muchos ensayos clínicos de calidad cuyos resultados no tienen una aplicación inmediata en la práctica diaria. Se ha sugerido que ello es así porque los médicos tienen dificultades para asimilar la información incluida en los ensayos clínicos plagados de instrumentos de valoración cuantitativa a pacientes concretos. Sin embargo, se ha demostrado que los médicos dan una misma interpretación a estas mediciones, ya procedan de la práctica clínica diaria o de los ensayos clínicos, es decir, interpretan la información derivada de los ensayos clínicos como si procediera de pacientes individuales46. La cuestión es, por tanto, si la «intuición» diaria es equivalente a la medición del estado de salud del paciente mediante un determinado instrumento ya sea genérico o específico de la enfermedad. Hace años que otras especialidades han desarrollado esquemas de manejo en enfermedades como la insuficiencia cardíaca, la enfermedad coronaria o los tumores, según criterios de clasificación con repercusiones importantes en el tratamiento y el desenlace de la enfermedad. En la actualidad contamos con mediciones que requieren poco tiempo, simples, fáciles de puntuar, válidas, fiables y sensibles al cambio. Probablemente ha llegado el momento en que los pacientes con AR puedan beneficiarse en la práctica diaria de esquemas de clasificación similares, basados en estos instrumentos de seguimiento.
En todo caso, es muy probable que todavía existan resistencias a utilizarlos en la práctica diaria. En un entorno de presión asistencial creciente, baja dotación de recursos y ausencia de incentivos, parece difícil incorporarse a esta nueva cultura de evaluación cuantitativa. Por otro lado, no existen estudios que hayan analizado cuál es el conjunto básico de determinaciones en el que debe basarse el seguimiento sistemático en consulta de los pacientes con AR. Podemos asumir que es el mismo que se aplica a los ensayos clínicos y estudios observacionales, pero es posible que puedan surgir nuevos instrumentos simplificados cuya aplicación en la clínica diaria sea menos costosa. Tampoco sabemos con qué periodicidad merece la pena realizar este tipo de evaluación «exhaustiva». No podemos esperar, sin embargo, a que todas estas preguntas tengan una clara respuesta para incorporarnos a esta nueva al menos en nuestro país en cuanto a su uso sistemático cultura de instrumentos cuantitativos.
Pero es indudable que para ello hace falta un cierto cambio en la organización asistencial. En primer lugar, el uso de estos instrumentos es una parte de la atención médica que prestamos a nuestros pacientes con AR, no un «extra». Gran parte de la información que recogemos mediante cuestionarios o preguntas preestablecidas forma parte de la visita clínica habitual; la cuestión es si elegimos una forma estructurada para hacerlo o seguimos haciéndolo «clásicamente». Si nuestra elección es hacerlo de forma estructurada, hay que desarrollar una estrategia para que incorporando todas o algunas mediciones a la rutina diaria siga habiendo tiempo para hablar con el paciente, sin duplicar la información. Se ha demostrado que es posible desarrollar estos nuevos esquemas de práctica médica47,48. Por ejemplo, haciendo que el propio paciente sea el que aporte la mayor cantidad de información posible de una forma estructurada (la sala de espera es un lugar óptimo para rellenar este tipo de cuestionarios)44,49,50. En segundo lugar, aprovechando todos los recursos personales a disposición de los pacientes incluyendo al personal no médico para incorporarlos a esta nueva cultura y que participen activamente en la obtención de esta información47. Enfermeras, auxiliares y personal administrativo deben formar parte del entramado asistencial dedicado al cuidado de los pacientes con AR y están en una posición ideal para administrar los cuestionarios y ayudar a su correcta cumplimentación (sobre todo en los pacientes con bajo nivel cultural), resolver dudas y poner de manifiesto problemas que pasan inadvertidos durante la visita médica. Por último, toda la información debería estar disponible en el momento de la visita médica, si lo que se pretende es que toda ella sirva para tomar decisiones fundamentadas. Es decir, esta información debe poder ser comparada con evaluaciones previas para que consiga su máximo valor. Las aplicaciones informáticas constituyen una herramienta insustituible para conseguir este objetivo51, pero al servicio de la práctica clínica, no al revés.
Con todas estas premisas, es asumible y sostenible en el tiempo una estrategia de seguimiento basada en la medición de parámetros cuantitativos. En todo caso, será necesario seguir realizando estudios que permitan identificar qué instrumentos se adaptan mejor a su uso en la práctica clínica diaria, desarrollar nuevos instrumentos cuando sea necesario y analizar cuándo y cómo es necesario disponer de esta información, para que los pacientes obtengan el máximo beneficio dentro del cuidado habitual de su enfermedad.
Agradecimientos
Los autores quieren agradecer a la Sociedad Española de Reumatología (SER) el patrocinio de este trabajo y a Novartis Farmacéutica, su financiación.
Apéndice 1. Grupo de Estudio emAR (por orden alfabético)
Dr. Aragón (Talavera de la Reina); Dr. Arboleya (Gijón); Dra. Aznar (Tudela); Dr. Baixauli Rubio (Valencia); Dr. Barbeito (Alcoy); Dr. Belmonte (Castelló); Dr. Beltrán (Zaragoza); Dr. Cabezas (Logroño); Dr. Carreño (Madrid); Dr. Casado (Badalona); Dr. Ciria (Barcelona); Dr. Corral (Salamanca); Dr. de Agustín (Barcelona); Dra. de Paco (Mataró); Dr. del Rincón (Cáceres); Dr. Doña (Huelva); Dr. Espadaler (Palma de Mallorca); Dr. Fernández Campillo (Orihuela); Dr. Fernández Domínguez (Orense); Dr. Fiter (Barcelona); Dr. Fraiz (Baracaldo); Dr. García Aparicio (Salamanca); Dr. García Meijide (Santiago de Compostela); Dr. Giménez Úbeda (Zaragoza); Dr. Giralt (Barcelona); Dr. González (Madrid); Dr. Gracia (Logroño); Dra. Grandal (Sevilla); Dra. Ibero (Elda); Dr. Inxausti (San Sebastián); Dra. Iovani (Elda); Dra. Jiménez Alfaro (Burgos); Dr. Jiménez Zorzo (Zaragoza); Dra. Larrosa (Girona); Dr. López Longo (Madrid); Dr. Macías (Cádiz); Dr. Manero (Zaragoza); Dr. Martín (Huelva); Dr. Mayol (Castelló); Dr. Monteagudo (Madrid); Dr. Navarro (Elche); Dra. Navío (Madrid); Dr. Ordás (Oviedo); Dr. Pascual (Málaga); Dr. Pecondón (Zaragoza); Dr. Peiró (Cuenca); Dr. Rodríguez de Castro (Mahón); Dr. Rodríguez Lozano (Las Palmas); Dr. Romero (Córdoba); Dr. Rosas (Las Palmas); Dr. Rosas (Villajoyosa); Dr. Sáiz (Torrelavega); Dr. Salazar (Badajoz); Dra. Sampedro (Toledo); Dra. Sandoval (Tudela); Dr. Santos (Toledo); Dr. Senén (Gijón); Dr. Tamarit (Valencia); Dr. Tovar (Elche); Dra. Ureña (Málaga); Dr. Vargas (Huelva); Dr. Zubeita (Toledo).