Introducción
La artrosis es una enfermedad articular muy compleja que afecta principalmente al cartílago articular, y secundariamente al hueso subcondral y a todas las estructuras articulares. La teoría fisiopatológica más generalizada defiende que en el cartílago articular se produce una pérdida del equilibrio entre los procesos anabólicos y catabólicos del condrocito, lo cual origina el desequilibrio entre la síntesis y degradación de la matriz extracelular y, como resultado final, una destrucción acelerada de dicha
matriz y una pérdida total de la integridad del cartílago1.
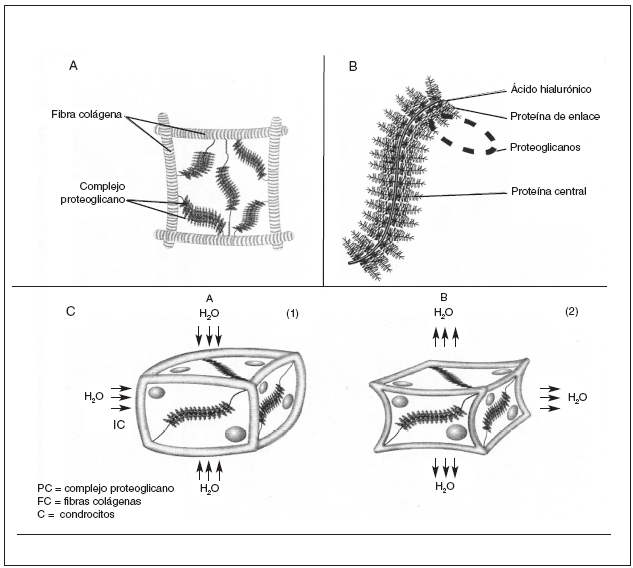
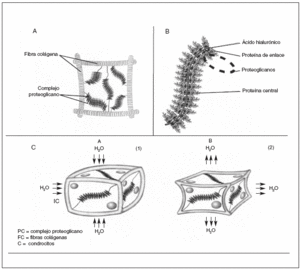
La matriz extracelular del cartílago articular está constituida por una fracción líquida y un armazón sólido de macromoléculas que proporciona al cartílago su forma y estabilidad. El agua contribuye casi al 80% del peso total del cartílago articular y su interacción con las macromoléculas de la matriz influye sustancialmente en las propiedades mecánicas del tejido. El armazón sólido del cartílago articular está constituido por fibras colágenas que constituyen el endoesqueleto del cartílago en cuya red se albergan agregados de proteoglicanos2 (fig. 1A).
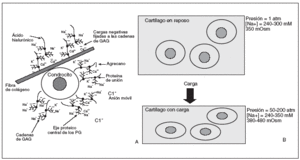
Figura 1. A) Unidad elemental del cartílago articular: agregados de proteoglicanos aniónicos que ocupan el espacio comprendido entre fibras de colágeno. B) Agregado de proteoglicanos formado por un filamento central de ácido hialurónico al que están unidas las proteínas de enlace y las cadenas de proteoglicanos. C) Comportamiento de una unidad del cartílago articular en reposo (1 ) y en un momento de carga (2).
Los proteoglicanos son macromoléculas constituidas por un eje central lineal de naturaleza proteica a las que están conectadas mediante enlaces covalentes cadenas de polisacáridos glucosaminoglicanos. Cada proteína central soporta de 50 a 100 cadenas de glucosaminoglicanos. Cada disacárido tiene al menos un grupo carboxilo o sulfato cargado negativamente, por lo que los glucosaminoglicanos constituyen largas filas de cargas negativas que repelen otras moléculas cargadas negativamente y atraen cationes3,4 (fig. 1B).
Composición iónica y de agua del cartílago articular: efecto de la carga en el medio iónico y osmótico del condrocito
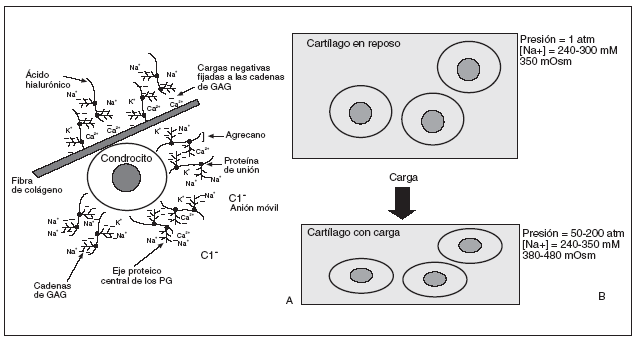
La presencia de los grupos aniónicos carboxilo y sulfato en los glucosaminoglicanos confiere a la matriz del cartílago una composición iónica y osmótica diferencial, dado que la alta densidad de cargas negativas en los proteoglicanos atrae cationes (principalmente Na+, K+ y Ca2+) y repele aniones (Cl, HCO2), por lo que la concentración de cationes libres en el cartílago es alta y la de aniones es baja en comparación con los fluidos extracelulares de otros tejidos5,6 (fig. 2A).
Figura 2. A) Medio iónico extracelular del cartílago articular: alta densidad de cationes. B) Efecto de la carga en el medio iónico y osmótico de los condrocitos. La fuerza mecánica deforma los condrocitos, elevando la presión hidrostática y aumentando la densidad de cargas fijadas, produciendo así un aumento significativo en la concentración local de cationes y la osmolaridad del tejido.
Durante la carga articular se producen cambios fisicoquímicos que alteran la composición iónica y osmótica de la matriz del cartílago, que a su vez alteran la composición intracelular de iones y su pH. La fuerza mecánica deforma los condrocitos, con la elevación la presión hidrostática y el aumento de la densidad de cargas fijadas, y así se produce un aumento significativo en la concentración local de cationes y la osmolaridad del tejido (fig. 2B).
Papel del agua y los iones en la biomecánica articular
La capacidad del cartílago para soportar las grandes presiones generadas durante la carga depende de la integridad del armazón colágeno, del entramado fibrilar tridimensional y del mantenimiento de la elevada concentración de proteoglicanos aniónicos que ocupan los espacios comprendidos entre las fibras colágenas.
La alta densidad de cargas negativas en los proteoglicanos atrae cationes y repele aniones; este movimiento de cationes a la matriz es seguido por el movimiento obligado de agua, así se crea el llamado efecto Donnan; los proteoglicanos, que no pueden salir de la red de colágeno, atraen hacia sí moléculas de agua, hinchándose y expandiendo la red de colágeno hasta el punto de conferir al cartílago su típica elasticidad, resistencia y capacidad de amortiguar los esfuerzos mecánicos4.
Cuando se ejerce una presión sobre el cartílago, su deformación ocurre de manera gradual, a medida que las moléculas de agua se desplazan del interior de los proteoglicanos hacia la superficie articular. Cuando la fuerza cesa, estas moléculas de agua vuelven a su localización inicial, atraídas por la fuerte carga negativa de lo proteoglicanos, restableciéndose la estructura del cartílago. Esta capacidad de amortiguación ejercida por los proteoglicanos, hace que las fuerzas lleguen parcialmente disipadas y enlentecidas a la red de colágeno, que es la responsable final de la estructura tridimensional del cartílago, en virtud de su enorme resistencia física a la tensión7 (fig. 1C).
Composición iónica y de agua del cartílago en la artrosis
En las fases iniciales de la artrosis se ha observado un aumento de la concentración del sodio extracelular, que alcanza cifras similares a las que se observan en el cartílago durante la carga articular. Igualmente, se produce un aumento del contenido de agua del cartílago8. En la fase avanzada de la enfermedad, se produce una disminución del contenido acuoso de la matriz del cartílago, así como de la concentración extracelular de sodio.
Mediante espectroscopia de absorción atómica se ha medido la concentración intracelular de Na, K y agua en condrocitos sanos y afectados de artrosis. En la artrosis precoz, el contenido intracelular de agua, Na+ y K+ se mantiene en concentraciones similares a las de los condrocitos sanos. Cuando la artrosis avanza, la concentración intracelular, principalmente de Na+, aumenta de forma significativa9.
Papel del agua y los iones en la fisiopatología de la artrosis
El condrocito dispone de todos los enzimas necesarios para la biosíntesis y degradación de las moléculas de la matriz a lo largo de la vida. Para ello, debe sentir los cambios en la composición de la matriz producidos por la degradación de macromoléculas, así como cambios en la demanda por el uso articular. El cartílago articular adulto está sujeto a un equilibrio entre los procesos anabólicos (síntesis de matriz extracelular) y catabólicos (degradación y pérdida de matriz), los mecanismos que controlan el balance entre ambas actividades, síntesis y degradación, permanecen poco conocidos, pero las citocinas parecen tener un importante papel.
La matriz actúa transmitiendo señales que resultan de fuerzas mecánicas de la superficie articular y los condrocitos responden a estas señales por alteración de la matriz, posiblemente a través de la expresión de citocinas. El mantenimiento de la composición normal del cartílago requiere un nivel mínimo de carga y moción de la articulación. Sin embargo, una carga y moción repetidas de la articulación de un nivel mayor de lo normal puede aumentar la actividad sintetizadora de los condrocitos, pero éstos tienen limitada su capacidad de expandir el volumen tisular en el adulto2. Los detalles de cómo los mecanismos de carga de las articulaciones, que deforman la matriz extracelular, influyen en la función de los condrocitos son aún desconocidos, pero la deformación de la matriz produce señales mecánicas, eléctricas y fisicoquímicas que pueden tener un papel en la estimulación de los condrocitos.
Desde la década de los noventa se sabe que los condrocitos son sensibles y responden adaptándose a cambios a corto plazo en su ambiente iónico y osmótico. A corto plazo, son capaces de regular la concentración intracelular de iones en un intento de devolver la concentración de iones a sus valores fisiológicos. A largo plazo, tales cambios pueden afectar al equilibrio entre la síntesis y degradación de la matriz, comprometiendo por tanto las propiedades mecánicas del tejido, lo que puede jugar un papel en la patogénesis de los estadios precoces de la patología articular. Se ha comprobado que la síntesis de la matriz extracelular por el condrocito es sensible a la concentración extracelular de Na+ y también se ha visto que cambios en el pH extracelular modifican la síntesis de macromoléculas de matriz10-14.
Estudios en cultivo de condrocitos han mostrado que si se aumenta el sodio al medio extracelular aumenta la producción de la citocina anabólica IGF y disminuye la de citocinas catabólicas IL-1 y TNF-*. También se ha visto que cuando se modifica el sodio extracelular en cultivo de condrocitos se producen cambios en los componentes de la matriz extracelular (proteoglicanos y colágeno): un aumento de la síntesis de proteoglicanos no agregados, biglicano y decorina y un aumento de la síntesis del colágeno tipo X15.
El transporte de agua e iones a través de la membrana plasmática es una propiedad fundamental de todas las células animales, incluyendo los condrocitos, pero en éstos, dado su peculiar ambiente iónico y osmótico, constituye un pilar clave para el funcionamiento del cartílago. El conocimiento del transporte de iones y las propiedades bioquímicas y moleculares de las proteínas transportadoras de membrana en los condrocitos es pobre comparado con el de otras células.
Transportadores de agua e iones en el cartílago articular
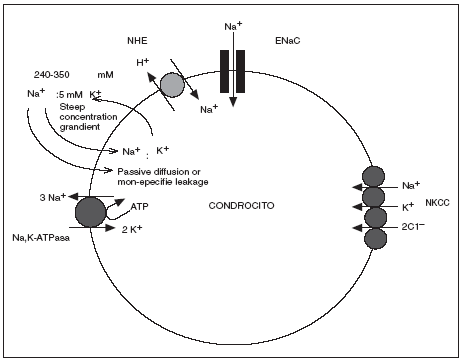
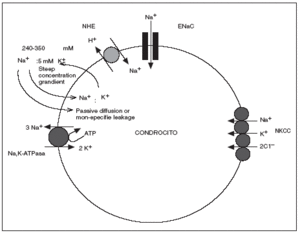
En los estudios realizados hasta ahora acerca del transporte de iones y regulación del pH en el cartílago articular humano sano, el Na+ parece tener al menos 4 mecanismos de transporte de membrana en los condrocitos; 3 mecanismos a favor de gradiente de concentración que no requieren energía directa para su función: el intercambiador Na+ x H+ (NHE), el cotransportador Na+/K+/2Cl y el canal epitelial de sodio (ENaC) y un mecanismo contra gradiente la bomba Na,K-ATPasa16,17 (fig. 3).
Figura 3. Transportadores de sodio identificados en el condrocito humano (adaptado de Mobasheri et al, 1998 y Trujillo et al 1999.
En el cartílago afectado de artrosis se ha observado una ausencia de expresión del canal epitelial de sodio en las regiones intermedias. El ENaC es el único sistema de transporte de sodio cuya expresión se ve alterada en la artrosis. Seguramente esta represión es inducida por la elevación intracelular del sodio consecutiva a la elevación de este catión en la matriz del cartílago. ¿Por qué selectivamente la represión de ENaC y no la de los otros transportadores? El condrocito es una célula de origen mesenquimal, apolar y, por consiguiente, sin un flujo vectorial transcelular de Na+. El Na+ no se transporta de un medio a otro, tan sólo se usa para la generación de gradientes que puedan servir a la célula para captar glucosa, aminoácidos, calcio, regular su pH y toda una serie de mecanismos necesarios para la vida. Posiblemente, como respuesta, la forma más fácil que tenga la célula de reducir la entrada de Na+, sin afectar ninguna de las entradas o salidas de otros solutos, sea la de anular la expresión final del canal que específicamente transporta sólo Na+, el ENaC. Esta diferencia de la artrosis puede ser una manifestación que indique una alteración primaria de esta enfermedad18.
El incremento de la concentración de sodio en la matriz del cartílago, seguramente debido a una disminución de la capacidad neutralizadora de cargas consecutiva a la variación estructural de los glucosaminoglicanos, conlleva una disminución del número de copias de subunidades de ENaC en la membrana plasmática con el fin de evitar la entrada indiscriminada de sodio a favor de gradiente.
En estudios preliminares en cultivos primarios de condrocitos humanos, se ha observado también que el aumento del sodio del medio extracelular induce una disminución de la expresión de las
3 subunidades de ENAC19.
El transporte de agua a través de la membrana plasmática celular se realiza mediante 2 caminos: por difusión simple (permeabilidad difusional de agua) y mediante canales de agua de membrana plasmática (aquaporinas [AQP]). Los estudios realizados hasta el momento muestran que AQP1 se expresa abundantemente en todo el espesor del cartílago humano in situ y que AQP3 se expresa débilmente en las áreas de superficie y medias. Sin embargo, la expresión de AQP1 se reduce significativamente en condrocitos aislados frescos. No hemos encontrado evidencia de presencia de AQP2 en condrocitos. No hubo diferencias de expresión de AQP1 entre el cartílago sano y el afectado de osteoartritis. La presencia de AQP1 hace suponer que juega un papel en el transporte de agua de los condrocitos dentro del cartílago, y su reducción o ausencia de expresión en condrocitos aislados sugiere que éstos carecen de los requerimientos fisiológicos para el transporte de agua mediado por AQP120,21.
En respuesta a este ambiente iónico alterado, los condrocitos modulan sus sistemas de transporte iónicos de membrana celular. Teniendo esto en cuenta, es posible que durante los estadios iniciales de la patología del cartílago, los condrocitos puedan ser capaces responder a los cambios iónicos y osmóticos mediante la adaptación de la densidad y patrón de distribución de las isoformas de los sistemas de transporte iónico de membrana. Sin embargo, a largo plazo, los cambios mantenidos y progresivos del ambiente iónico de la matriz pueden no ser tolerados por los condrocitos, siendo incapaces de iniciar mecanismos reparadores. El control de la homeostasis iónica intracelular y consecuentemente de la síntesis de matriz, puede ser una promesa para el futuro desarrollo de fármacos para el control y manejo de la artrosis. La modulación farmacológica de los transportadores plasmáticos de membrana puede prevenir la destrucción del cartílago en sujetos susceptibles.
El conocimiento del papel fisiopatológico de los sistemas de transporte en condrocitos puede llevar a futuras estrategias terapéuticas.