Introducción
La utilización de células para la reparación y/o sustitución de tejidos u órganos dañados es, hoy día, un campo emergente en la medicina reparativa. Hasta hace poco tiempo, esta disciplina se encargaba de la reparación y reestablecimiento de la función perdida debida a enfermedad, daño o pérdida de partes del cuerpo, y podía o no implicar un componente in vitro. No obstante, es de reseñar que todas estas aplicaciones implicaban un componente in vivo. El material utilizado como sustituto (prótesis vasculares, abdominales, óseas) era implantado en el paciente y debía integrarse con el tejido del receptor, con las respuestas que esto conlleva: de cuerpo extraño, de reconocimiento inmunológico y antigénica1. Cómo contribuyen estos fenómenos de remodelación a mejorar la estructura y función del órgano y/o tejido dañado o perdido, depende de una gran variedad de factores, incluyendo la composición del material implantado2, la presencia de un componente celular3 y los métodos de procesamiento.
Hoy día, la medicina reparativa abarca a muchas otras disciplinas: biología celular y molecular, cirugía, ingeniería y química, entre otras. La conjunción de todos estos campos hace posible que surja la denominada ingeniería de los tejidos vivos, una ciencia que se inició desde 2 perspectivas: la terapia celular y la ciencia de los biomateriales. La unión de estas 2 vertientes hace posible el diseño y, posteriormente, la construcción de sustitutos (constructos) con capacidad de reparar, regenerar o sustituir funcional y estructuralmente tejidos u órganos de pacientes que han perdido su funcionalidad total, o bien han resultado dañados mecánica o fisiológicamente. Así, se constituye una organización jerarquizada que controla desde el diseño del material hasta su implante y correcto funcionamiento en el individuo receptor.
Un tejido normal está constituido por un componente estructural y otro celular. Para que pueda llevar a cabo su función, ambos componentes están interrelacionados, de tal manera que uno le da soporte al otro. Existe una red vascular encargada de transportar hasta las células distintas señales externas (citocinas, factores de crecimiento, hormonas, etc.), de nutrir y oxigenar las células y, al mismo tiempo, de eliminar los desechos celulares. Éste es el modelo básico que la ingeniería de los tejidos ha de construir para conseguir sustitutos de uso clínico.
Los ingenieros biomédicos han empezado a desarrollar técnicas específicas para sintetizar tejidos funcionales. La gran barrera a salvar está en trasladar los resultados experimentales a la producción a gran escala de estos constructos, con materiales que sean apropiados en el campo de la medicina reparativa. Este último punto implica profundizar en la metodología necesaria que permita, por un lado, mantener la población celular viable en el biomaterial y, por otro, inducir su proliferación y diferenciación en el ambiente adecuado. Para ello, se han diseñado biorreactores, instrumentos capaces de inducir histogénesis bajo ciertas condiciones. Su uso a gran escala y sus esperanzadores resultados podrían producir tejidos tridimensionales y tejidos composites4, para la reparación y regeneración de órganos y tejidos dañados en medicina reparativa.
Actualmente, la ingeniería de los tejidos es una realidad en el campo de la experimentación animal, con pequeños logros en clínica humana. Los resultados son esperanzadores, si bien es necesario profundizar en los mecanismos de construcción de los tejidos para lograr réplicas que, tanto estructural como funcionalmente, sean capaces de sustituir órganos y tejidos no funcionales.
Actualmente, en clínica humana, el campo con mayor perspectiva real es la terapia celular. Esta ciencia se basa en la utilización terapéutica de productos celulares, entre los que destaca la trasferencia de células o tejidos, autólogos o heterólogos, a los tejidos u órganos dañados. La terapia celular más conocida es el trasplante de médula ósea para el tratamiento de tumores hematológicos5 y algunos tumores sólidos6. Si bien, son de destacar la utilización de mioblastos en reparación miocárdica, el tratamiento de úlceras dérmicas y grandes quemaduras con piel crecida in vitro7, el tratamiento de úlceras corneales y alteraciones de la membrana corneal con membrana amniótica8, la inmunoterapia9 y, recientemente, el tratamiento de fístulas en la enfermedad de Crohn mediante el uso de células madre procedentes de grasa subdérmica10. En la actualidad, los defectos locales que afectan al cartílago articular de la rodilla, se reparan con éxito en clínica mediante el implante autólogo de condrocitos11.
Terapia celular y cartílago
Las lesiones que afectan al cartílago, como la osteoartrosis, conllevan alteraciones, tanto de las características del componente celular como del estructural, dependiendo la sintomatología de la magnitud y localización de la lesión. Con métodos terapéuticos tradicionales (gimnasia terapéutica y toma de medicamentos antiinflamatorios) generalmente se logra una mejoría de los síntomas. En estadios avanzados de destrucción del cartílago articular hablamos de artrosis. La articulación en su totalidad está inflamada y no se deja flexionar ni enderezar totalmente. En este estadio también se presentan dolores en estado de reposo. El concepto terapéutico depende de la magnitud y localización de las lesiones del cartílago. Estamos, en todo caso, ante enfermedades emergentes y que además cada día veremos de una forma más frecuente en consultas y hospitales.
Hace 250 años, Hunter fue el primero en describir que el cartílago articular dañado no era capaz de repararse por sí mismo. El cartílago es un tejido avascular, lo que implica directamente que la respuesta inflamatoria normal, con hemorragia, formación de un tapón de fibrina, la síntesis de proteínas celulares y la migración de células mesenquimales está ausente, limitando los procesos de autorreparación normal12,13. Otros factores que influyen en el proceso reparativo son la edad, la profundidad y el daño de la lesión, que haya sido traumática o crónica, que esté asociada a inestabilidad, que exista una meniscectomía anterior, o la predisposición genética. La edad es un factor muy importante a tener en cuenta, dado que el número de células mesenquimales con capacidad de regenerar tejidos disminuye con la edad, así encontramos una de cada 10.000 células en recién nacidos, una de cada 400.000 en individuos de 50 años y, una de cada 2.000.000 en individuos octogenarios. La profundidad de la lesión también afecta al proceso reparativo, las lesiones superficiales no penetran en la superficie condral y no existe aporte sanguíneo (células inflamatorias y fibroblastos que generen nueva matriz, aunque no sea la idónea). Las lesiones producidas por traumatismos se reparan mejor que las áreas con defectos globales y/o degenerativos. La inestabilidad estructural y otras patologías asociadas a menudo se relacionan con fuerzas irregulares sobre las superficies articulares.
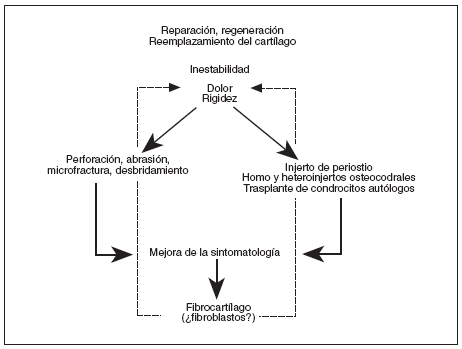
Los tratamientos actuales locales se han basado en la aplicación de distintas terapias (fig. 1), como el lavado de la articulación, la microfractura (que permite la salida de células madre hacia la zona de lesión), la abrasión (para crear nuevo cartílago) o el desbridamiento. Estas técnicas, si bien facilitan la reparación mejorando la función condral y la sintomatología, también favorecen la formación de fibrocartílago en lugar del cartílago normal, hialino. El fibrocartílago parece ser depositado por fibroblastos que llegan a la zona de lesión vía torrente sanguíneo tras el procedimiento quirúrgico. Otros tratamientos como el injerto de periostio; los autoinjertos, limitados por la viabilidad del tejido del propio paciente; los aloinjertos osteocondrales, que suelen degenerar con el tiempo, y el trasplante autólogo de condrocitos o progenitores condrogénicos vehiculizados o no en polímeros e hidrogeles, han mostrado prometedores resultados reduciendo el dolor y la disfunción del cartílago articular.
Figura 1. Etapas del desarrollo y tratamiento de las lesiones de cóndilo femoral de rodilla.
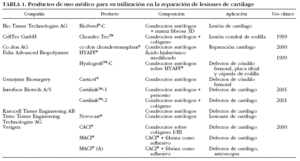
El implante de condrocitos autólogos es hoy una realidad como terapia celular en el tratamiento de defectos focales de cartílago en los cóndilos femorales de las rodillas11. De hecho, podemos encontrar una amplia gama de productos de uso médico, muchos en fase de ensayo clínico, cuya base terapéutica es el implante de condrocitos autólogos (tabla 1), solos o acompañados de distintas matrices. No obstante, esta técnica presenta en la actualidad algunos inconvenientes: la edad de los pacientes es crítica, dado que no pueden superar los 55 años; el proceso requiere 2 intervenciones quirúrgicas (obtención de cartílago e implante de condrocitos); la siembra y el cultivo de condrocitos autólogos es un proceso largo (3-4 semanas), y los pacientes con defectos primarios de cartílago no pueden incluirse en el programa de implante autólogo, pues carecen de células competentes. Estas limitaciones pueden solventarse mediante el uso de una fuente celular alternativa, como un modelo de células procedentes de cordones umbilicales que se puedan almacenar congeladas, metodología que puede proporcionar nuevas aplicaciones clínicas en terapia celular humana.
Terapias futuras
El reto actual estriba en la formación de estructuras cartilaginosas complejas. Experimentalmente, existen grupos que, mediante la utilización de moldes en biorreactores, han sido capaces de sintetizar oreja humana14, implantes nasoseptales y discos temporomandibulares15.
Dentro del campo de la reparación de cóndilos femorales de rodilla, la investigación básica está centrando sus esfuerzos en varias vías:
Diseño de constructos. Para ello utlizan como soporte para el crecimiento celular polímeros de ácido láctico, *-hidroxiácidos o copolímeros de los ácidos láctico y glicólico. La desventaja de estos polímeros estriba en que existe pérdida de unión celular con el paso del tiempo. Para solventar este problema, ya existen grupos trabajando en péptidos RGD16 que, unidos a los polímeros, favorecerían la adhesión celular, mejorando la calidad del constucto.
Utilización de factores de crecimiento (TGF-ß) para mejorar tanto la calidad como el tiempo de la reparación.
Síntesis de neocartílago sobre hueso cultivado como soporte y, una vez crecido, implantarlo en la zona lesionada.
Las alternativas terapéuticas indicadas, también llamadas «bioprótesis», podrían regenerar la cobertura cartilaginosa desgastada o desaparecida únicamente si se eliminan simultáneamente daños colaterales, tales como desgarres de menisco, inestabilidad articular o posiciones axiales erróneas. Vemos entonces, que la variabilidad terapéutica es muy grande y no siempre es la más adecuada. En el futuro, otros tratamientos basados fundamentalmente en la utilización de células indiferenciadas, como son las células madre adultas, tendrán un campo de aplicación importante para estos procesos al igual que algunas terapias génicas.